Introducción
El virus SARS-CoV-2 provocó la pandemia por coronavirus 2019 (COVID-19), adquiriendo dimensiones inusitadas para la humanidad. Se han reportado más de 580 millones de casos y más de 6 millones de fallecidos en el mundo. En Uruguay, hasta el momento de la presente publicación, ha habido más de un millón de casos y más de 7.000 fallecidos, lo que determina una letalidad de 0,7%, con valores cercanos a 1,5% a mediados de 2021. Por su parte, la tasa de mortalidad por COVID-19 se ubica en 165 fallecidos por 100.000 habitantes. El impacto de la pandemia en la región de América Latina y el Caribe fue muy significativo. Según datos de la Organización Mundial de la Salud (OMS), en esta región se han reportado 32% de los casos de muerte para una población que representa el 8,4% de la población mundial1.
La enfermedad provocada por SARS-CoV-2 repercutió fundamentalmente en la población adulta mayor con comorbilidades, y en pacientes de sexo masculino. Sin embargo, las mujeres jóvenes no han estado exentas de manifestaciones graves y potencialmente fatales. En consecuencia, la población de gestantes tampoco ha quedado por fuera del alcance de esta infección viral2,3.
Las mujeres embarazadas infectadas con el virus SARS-CoV-2 pueden ser asintomáticas o sintomáticas. Aquellas que son sintomáticas parecen tener un mayor riesgo de desarrollar secuelas de la enfermedad por COVID-19 en comparación con las mujeres en edad reproductiva no embarazadas. También pueden tener un mayor riesgo de desarrollar algunas complicaciones del embarazo en comparación con las personas embarazadas no infectadas o asintomáticas4,5.
En Uruguay no se dispone de un registro de prevalencia de COVID-19 en pacientes embarazadas. El aumento del número de casos globales registrado entre marzo y junio de 2021 se acompañó de un incremento paralelo de los casos de COVID-19 en pacientes embarazadas observados en la práctica clínica. Como consecuencia de ello, se observaron las manifestaciones maternas y fetales que el virus determina en la población obstétrica, y, de hecho, en el 2021 la infección por SARS-CoV-2 se constituyó como la principal causa de muerte materna en Uruguay6,7.
Esta situación no debe llamar la atención, puesto que el embarazo tiene algunas características que determinan un aumento del riesgo de complicaciones maternas por infecciones virales. Durante el embarazo aumenta el volumen minuto, la frecuencia respiratoria, el consumo de oxígeno, disminuye el volumen pulmonar y se desarrolla un estado de tolerancia inmunológica que permite a la madre alojar a un feto antigénicamente diferente sin complicaciones8,9. Los cambios en la fisiología y respuesta inmune en la gestante la predisponen a ciertas infecciones, especialmente las virales, y la hacen menos tolerante a la hipoxia. Esto conlleva un riesgo aumentado de presentaciones graves y mayor estadía hospitalaria en comparación con las mujeres no embarazadas, todo lo cual puede determinar complicaciones obstétricas y resultados perinatales adversos. El curso de la infección por SARS-CoV-2 parece ser más grave en las mujeres embarazadas. La infección, particularmente cuando es sintomática, se asocia con un mayor riesgo de algunas complicaciones del embarazo10,11,12,13,14.
La transmisión directa de persona a persona es el principal medio de transmisión del SARS-CoV-2, siendo la transmisión vertical una preocupación adicional en mujeres embarazadas. La transmisión sexual no ha sido reportada15,16.
La vacunación reduce el riesgo de desarrollar COVID-19 y la gravedad de las manifestaciones clínicas. La evidencia disponible respalda la seguridad de administrar las vacunas contra SARS-CoV-2 actualmente disponibles en pacientes obstétricas. Aunque las personas embarazadas y lactantes no se incluyeron en los grandes ensayos iniciales de la vacuna, los datos posteriores de las personas embarazadas vacunadas demostraron eficacia y seguridad antes, durante el embarazo, posparto y lactancia17-19.
El objetivo de este trabajo consiste en describir y analizar las características de las pacientes que presentaron infección a SARS-CoV-2 durante la gestación y los resultados maternos y fetales.
Material y método
Se diseñó un estudio retrospectivo y analítico de casos y controles. Se realizó un muestreo no probabilístico, tomando todas las pacientes embarazadas que ingresaron a una institución de asistencia médica colectiva entre el 1 de marzo y el 31 de julio de 2021. Se trató del período de máximo impacto sanitario en Uruguay, dado por los casos graves en relación con el total de casos. En Uruguay, en este período, circuló la variante de preocupación Gamma (P1) del virus SARS-CoV-2, de mayor transmisibilidad que la variante salvaje. Esta institución sanitaria cuenta con 200.000 usuarios y 360 nacimientos al año, pertenecientes a todos los quintiles de ingresos de la población uruguaya.
Se definió como “caso”: paciente embarazada que presenta infección por SARS-CoV-2 durante la gestación y que requiriera hospitalización, ya sea por la infección viral o por motivos obstétricos. A tales efectos se requirió que la paciente presentara una prueba de SARS-CoV-2 por reacción en cadena de la polimerasa (PCR) en las 24 horas previas al ingreso. Se definió “control”: paciente hospitalizada que no presentara pruebas positivas para COVID-19 al ingreso ni hubiera desarrollado la enfermedad durante la internación. A los efectos de tomar los controles se consideran pacientes con +/- 5 años y +/- 5 semanas de edad gestacional. Sin perjuicio de estas definiciones, se estableció que no podría haber casos menores de 35 años con controles mayores de esa edad, de igual modo, no se incluyeron controles de trimestre diferente al caso considerado. Para mejorar la potencia estadística del estudio se tomaron dos controles por cada caso.
La definición en trimestres de edad gestacional se estableció considerando desde la fecha de la última menstruación y estimando la edad gestacional por la primera ecografía. Primer trimestre: desde el inicio de la gestación hasta la semana 12 de edad gestacional, segundo trimestre desde la semana 13 a la 28 y tercer trimestre desde la semana 29 hasta el final.
Las variables consideradas fueron: edad materna, procedencia (capital o interior), vacuna anti-COVID (sí o no), número de dosis, tiempo transcurrido desde la última dosis de la vacunación, antecedentes personales a destacar: hábito tabáquico, consumo de sustancias de abuso, diabetes mellitus, hipertensión arterial, preeclampsia/eclampsia; gestas previas.
Del embarazo en curso se recabó la historia de complicaciones obstétricas desagregadas en las siguientes variables: amenaza de parto de pretérmino, diabetes gestacional, estado hipertensivo del embarazo, preeclampsia (severa o no severa), muerte fetal, restricción del crecimiento fetal (RCIU), desprendimiento prematuro de placenta (DPPNI). También se recabó la edad gestacional al momento de la finalización de la gestación y la oportunidad de finalización (urgencia respecto a “no urgencia”) y vía de finalización (parto o cesárea), así como si el nacimiento fue de pretérmino, considerando como tal a los nacimientos de menos de 37 semanas de edad gestacional.
Se recabaron los resultados/complicaciones neonatales desagregados en las siguientes variables: estado vital, peso del RN, Apgar al minuto y a los 5 minutos, requerimiento de cuidados especializados neonatales y número de días que requirieron estos cuidados. Se registró el tamizaje de COVID del RN y su resultado, así como la condición del RN al egreso. Para los casos, se consideraron las siguientes variables: edad gestacional al diagnóstico (en semanas), requerimiento de ingreso sanatorial, requerimiento de oxígeno, síntomas respiratorios, generales y requerimiento de intubación orotraqueal u otras medidas de soporte vital avanzado, así como requerimiento de ingreso a cuidados especializados maternos.
Las variables cuantitativas se presentan con medidas de tendencia central y dispersión; media y desvío estándar y mediana y percentiles 25 y 75, según su distribución. La normalidad se probó mediante test de hipótesis (Shapiro-Wilk) y gráficos. Las variables cualitativas se presentan mediante frecuencias absoluta y relativa. Las comparaciones entre grupos se realizaron mediante test de chi cuadrado o test de Fisher para los datos cualitativos y mediante test de t de Student, de Wilcoxon o U de Mann-Whitney, según la distribución y el caso, para los datos cuantitativos. Se consideró un nivel de significación estadística menor a 0,05. Se calculó el poder estadístico (1-ꞵ) de la muestra para aquellas comparaciones (proporciones y medias) en la que no fue rechazada la hipótesis nula. Los datos se procesaron en el software STATA 13.
El protocolo se ajustó en un todo a lo establecido por el decreto 158/019 sobre investigación en seres humanos20. De igual modo, se desarrolló conforme a las pautas éticas internacionales para la investigación relacionada con la salud con seres humanos elaboradas por el Consejo de Organizaciones Internacionales de las Ciencias Médicas (CIOMS), en colaboración con la OMS. Se prestó especial atención a la pauta 19 del CIOMS, que refiere a la investigación en embarazadas21. Los datos de las pacientes y de los RN fueron anonimizados. El protocolo fue aprobado por el Comité de Ética de la Asociación Española Primera de Socorros Mutuos, según resolución número 3971 del 14 de septiembre de 2021.
Resultados
Variables demográficas
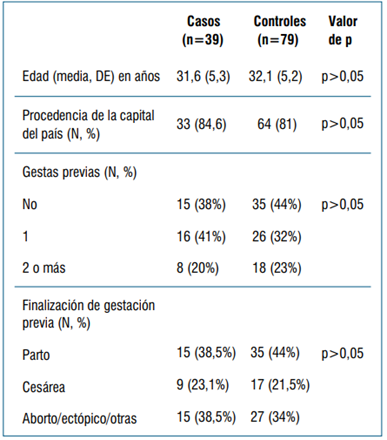
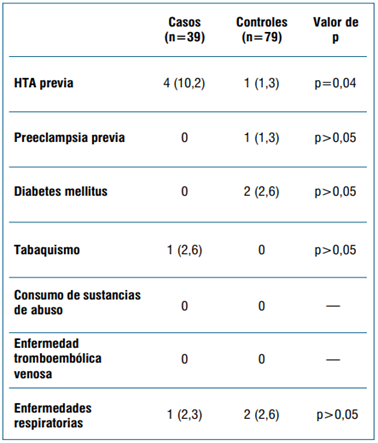
Se incluyeron 118 pacientes embarazadas, 39 casos y 79 controles. Las principales variables demográficas consideradas se muestran en la (tabla 1). Las morbilidades previas en cada grupo se muestran en la (tabla 2). El estado vacunal en cada grupo se muestra en la (tabla 3).
Tabla 3 Estado vacunal.
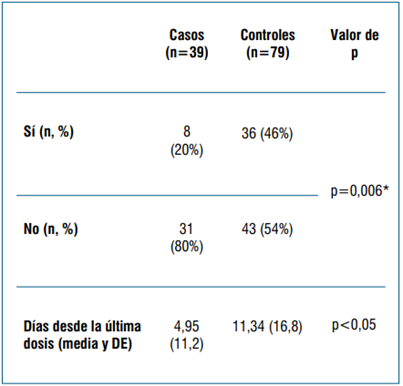
Situación vacunal de las pacientes consideradas. Nota: se considera “sí” al menos una dosis de la vacuna. Ser caso se asoció con una menor probabilidad de haber estado vacunado con un OR de 0,3 (IC 95%: 0,13 - 0,75). *El efecto se mantiene independientemente de si la paciente recibió una o dos dosis.
Embarazo actual
En relación con los casos, la media de edad gestacional al diagnóstico de COVID-19 fue de 31,7 (DE 6,3) semanas; 31 (79,5%) en el tercer trimestre, 8 (20,5%) en el segundo trimestre, ninguna de esta serie en el primer trimestre. El motivo de ingreso sanatorial fue por complicaciones derivadas de la infección por SARS-CoV-2 en 4 casos (10%) y por motivos obstétricos en los 35 restantes (89,7%); 2 pacientes (5%) requirieron ingreso a cuidados especializados, la estadía promedio fue de 72 horas. La saturación de oxígeno ventilando espontáneamente al aire mínima constatada fue de 92%, el rango de saturación fue de 92% - 99%, siendo la media 98% (DE 1,45). Ninguna paciente requirió intubación orotraqueal ni otras técnicas de soporte ventilatorio avanzado, no hubo fallecimientos.
Los síntomas más frecuentemente observados fueron rinorrea en 18 (46,2%), fiebre en 15 (38,5%), tos en 14 (36%) y odinofagia en 10 (25,6%) de los casos. Disnea, anosmia y ageusia se observaron con una frecuencia menor a 10%.
Complicaciones obstétricas
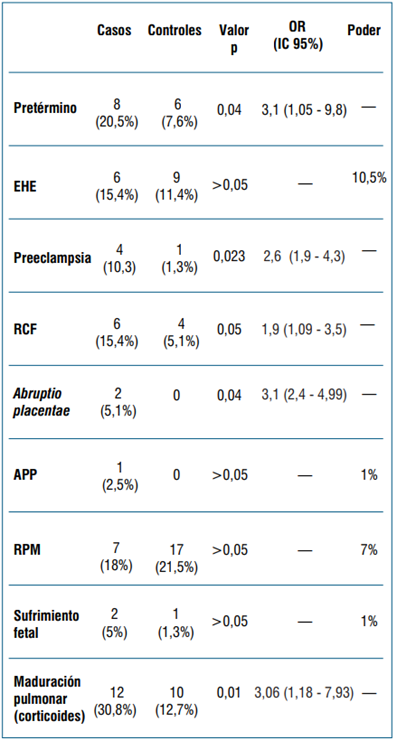
Consideradas globalmente, se observaron 21 (55,3%) dentro de los casos y 17 (44,7%) dentro de los controles, p<0,001, el OR calculado fue de 4,2 (IC 95%: 1,9 - 9,7). En el modelo de regresión el OR de complicaciones obstétricas, ajustado por hipertensión (HTA) previa, fue de 3,7 (IC 95%: 1,56 - 8,79). La media de edad gestacional a la que finalizó el embarazo en el grupo casos fue de 37,5 (DE 2,8) semanas respecto al grupo control que fue de 38,7 (DE 2,1) semanas, p=0,026. No hubo diferencias estadísticamente significativas en relación con preeclampsia severa entre ambos grupos (p>0,05). En 14 (36%) de los casos la vía de finalización del embarazo fue parto respecto a 36 (45,6%) en el grupo control; p>0,05. La oportunidad de finalización fue clasificada como “no urgente” en 29 (75%) de los casos y en 69 (87,3%) de los controles, los restantes fueron clasificadas como “urgentes”, p>0,05. La (tabla 4) muestra las complicaciones obstétricas desagregadas por cada variable considerada.
Resultados y complicaciones neonatales
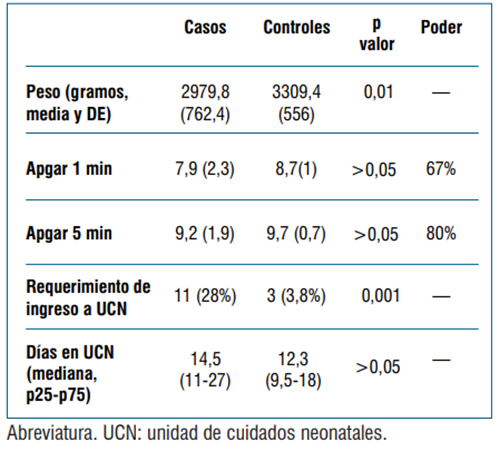
En relación con los RN, en ninguno de los grupos se identificó infección por SARS-CoV-2. Las complicaciones neonatales, consideradas globalmente, fueron más frecuentes en el grupo casos, donde hubo 12 (30,8%) respecto al grupo controles, con 3 (3,8%); OR 11,2 (IC 95%: 2,9 - 42,9). Ningún RN requirió soporte vital avanzado ni ventilación mecánica. En ninguno de los grupos hubo muertes neonatales, todos los RN presentaron evolución favorable. La (tabla 5) muestra las complicaciones neonatales desagregadas por cada variable considerada.
Discusión
Nuestros resultados confirman que la infección por SARS-CoV-2 no resultó inocua para la población obstétrica. En efecto, las pacientes portadoras de esta infección presentaron una mayor probabilidad de resultados obstétricos adversos y de complicaciones neonatales.
El presente estudio se enmarca en un escenario epidemiológico crítico. El conocimiento de los fenómenos en salud durante la pandemia exige una descripción de los contextos y especificidades epidemiológicas. El diseño metodológico adecuado permite describir la realidad con mayor precisión. En tal sentido, un estudio de casos y controles encuentra su lugar en este marco epidemiológico, al tiempo que el curso de la gestación permite observar desenlaces en períodos acotados de tiempo.
En nuestro trabajo se observa una razonable comparabilidad de las características demográficas y clínicas de los grupos de casos y controles, salvo en la prevalencia de HTA crónica -mayor en el grupo casos-, por lo que debió ser considerada posteriormente en el análisis. Este dato es comparable con la población obstétrica general22. En cambio, la prevalencia de HTA crónica resultó menor en el grupo control. Es posible que estuviera subestimada en comparación con el grupo control y con la población general. Esto podría explicarse por el hecho de que al haber ingresado por COVID, conllevara un control más estricto de los parámetros vitales. Cabe destacar que se trata de un grupo de pacientes con baja carga de morbilidades previas, lo cual puede estar relacionado con la evolución leve de la enfermedad COVID-19.
La presentación clínica de la infección a SARS-CoV-2 no difirió de la reportada en otros estudios para la población gestante, ni de la presentación clínica descrita para la población general23,24. La media de edad gestacional al momento de la infección fue de 31 semanas, la amplia mayoría fue ingresada por razones obstétricas, frente a un 10% ingresadas por complicaciones derivadas de la infección viral. Estas observaciones son comparables con reportes nacionales y de otros países. La frecuencia observada de COVID-19 grave fue baja respecto a otras series, a pesar de la proporción significativa de pacientes no inmunizadas25. El efecto más importante en el curso de la enfermedad de la población gestante se ha reportado para las pacientes sintomáticas y afectadas por la cepa Delta respecto a otras cepas26. Como se mencionó previamente, este estudio muestra el impacto de la ola de infección por SARS-CoV-2 en Uruguay durante el período en que predominó la cepa P1 del virus.
Nuestro estudio verifica el efecto protector de la vacunación en la población obstétrica17-19,27. En efecto, los casos tuvieron una frecuencia de inmunización significativamente menor. La inmunización se asoció a una reducción en la probabilidad de hospitalización con COVID-19 de las embarazadas de un 70%. Es de destacar que la campaña de inmunización para las pacientes embarazadas comenzó al inicio de mayo de 2021, es decir que el período de nuestro estudio abarca una etapa en la cual aún no se había generalizado para este grupo de riesgo.
La probabilidad de presentar resultados obstétricos adversos, considerados globalmente, fue el cuádruple en el grupo casos respecto al grupo control. Este resultado se mantiene aun corrigiendo por el efecto de la HTA que, como se menciona previamente, fue más frecuente en el grupo casos. El grupo casos de SARS-CoV-2 tuvo el triple de chance de presentar nacimientos de pretérmino. En efecto, la edad gestacional de finalización del embarazo fue aproximadamente una semana menor en este grupo. La frecuencia de estados hipertensivos del embarazo y de preeclampsia fue mayor en el grupo casos y se observó una tendencia no significativa a una mayor frecuencia de rotura prematura de membranas y sufrimiento fetal agudo en este grupo. En otras variables analizadas se observa mayor frecuencia en el grupo casos, pero el análisis no alcanza la significación estadística. A su vez, en estos casos el poder estadístico de la muestra no nos permite afirmar que la asociación no existe, por lo que nuestro estudio no tiene poder significativo para comprobar estas diferencias. La vía de finalización fue la cesárea en más de la mitad de los casos, lo cual está por encima de la media nacional de 44%, según datos de 201928. Es posible que la pandemia se comportara como un factor favorecedor para decidir la interrupción mediante cesárea. Al mismo tiempo, la interrupción por cesárea probablemente estuvo determinada por una mayor frecuencia de preeclampsia, restricción de crecimiento fetal y de abruptio placentae, como se observa en el grupo casos.
La probabilidad de resultados neonatales adversos fue mayor a diez veces en el grupo casos. El peso de los RN fue significativamente menor y la chance de requerir cuidados neonatales especializados fue significativamente mayor en el grupo casos. Es razonable atribuir esta observación a la edad gestacional de los RN, que es significativamente menor en el grupo casos respecto al grupo control. La evolución clínica fue favorable y no se observaron infecciones perinatales por SARS-CoV-2. En cualquier caso, cabe señalar que los RN no fueron pretérminos severos ni presentaron una media de peso por debajo de 2500 gramos, ni valores de Apgar que traduzcan depresión neonatal. Estas observaciones son concordantes con reportes nacionales y de otros países29,30. Cabe señalar que nuestras observaciones surgen en el marco de una unidad de cuidados neonatales de alta especialización, lo que seguramente contribuyó a que los desenlaces clínicos fueran favorables en este grupo de RN. No observamos transmisión perinatal de la infección por SARS-CoV-2, lo cual es coincidente con diversas series internacionales.
Las principales debilidades de nuestro estudio derivan del carácter retrospectivo realizado en un muestreo no probabilístico. De todos modos, los grupos fueron razonablemente comparables. Nuestro trabajo tiene como principal fortaleza haber recabado información del período de la pandemia asociado con alta contagiosidad y morbilidad relacionada con la infección por SARS-CoV-2. Abordamos un grupo de riesgo especialmente vulnerable, donde los estudios son dificultosos. Logramos comparar con embarazos de pacientes sin COVID y reforzamos la potencia con un doble número de controles.
En conclusión, el escenario pandémico dejó enseñanzas en el campo de la salud materno-fetal. Primero, se comprueba que la infección por virus SARS-CoV-2 determinó complicaciones maternas y fetales. Las complicaciones obstétricas fueron prematuridad, preeclampsia, restricción del crecimiento fetal y abruptio placentae, mientras que el requerimiento de cuidados especializados neonatales fue la característica distintiva de los resultados neonatales. Segundo, nuestro estudio comprueba el efecto protector de la vacunación en esta población. Finalmente, y no menos importante, comprobamos que aun en las circunstancias más adversas la investigación clínica puede ser desarrollada y arrojar información valiosa para la práctica asistencial.