Introducción
El dolor crónico no oncológico es una de las grandes preocupaciones médicas, sociales y laborales. Desde la Antigüedad es conocido el uso beneficioso de los cannabinoides sobre el dolor crónico, especialmente en el dolor neuropático1. Aunque en los últimos tiempos se han realizado estudios para conocer la fisiología del sistema endocannabinoide (SEC) y justificar la utilización terapéutica para el dolor crónico y otros síntomas, se necesita más investigación acerca del tema.
En Uruguay se reguló el uso de cannabis en el año 2013 con la aprobación de la Ley 19.172 (cultivo doméstico, clubes de cannabis, venta de flores de cannabis en farmacia y CM2). El uso de CM se reglamentó en febrero de 20153. En octubre de 2017 se autoriza y comienza la venta al público en farmacias de productos de CM elaborados en el país, en base a extractos de variedades no psicotrópicas (CBD al 2% con menos de 1% de tetrahidrocannabinol (THC) con número de registro en el Ministerio de Salud Pública (MSP) 45276)4. En junio de 2018 se aprobó CBD 5% con ≤1% de THC, con número de registro en el MSP 45380.
Desde septiembre de 2016 funciona en Montevideo una clínica de carácter privado (CEDU) para asesoramiento y tratamiento de diversas patologías con CM integrada por distintos profesionales de la salud, siendo el primer espacio de atención interdisciplinaria en este tema en nuestro país. A partir de esta experiencia de atención a la salud, entendiendo al paciente como un ser bio-psico-social, se observó que uno de los síntomas más frecuentes de consulta es el dolor crónico no oncológico.
Esta investigación retrospectiva se realizó desde 2016 a 2020. Al inicio, al no tener productos registrados en Uruguay, ingresan como medicación “de uso compasivo” y luego como cannabinoides no registrados en el país. Estos medicamentos no tienen número de registro en el MSP, ya que entran como excepción, y eran procedentes de Estados Unidos: Charlotte Web (CBD 5%) y de Alemania-Suiza: M1661 (CBD 5%) y M1771 (CBD 7,5%).
Otra forma de acceso al CM son las asociaciones de pacientes (Ley 19847 de diciembre de 2019)5, a través de las cuales se accede a una amplia gama de quimiotipos de cannabis. Estos productos de CM son testeados en laboratorios autorizados por el MSP, identificando composición de cannabinoides (THC, CBD) y presencia de contaminantes (metales pesados, virus, bacterias y hongos).
El dolor, según la International Association for the Study of Pain (IASP), es la “experiencia sensorial y emocional desagradable asociada con, o similar a la asociada, con daño tisular real o potencial”6.
El dolor crónico es aquel que persiste después de tres meses, sumando componentes nociceptivos, neuropáticos o inflamatorios asociando o generando sensibilización periférica.
Esta revisión está enfocada en el dolor crónico no oncológico y dentro de éste el dolor osteoarticular por artrosis, artritis reumatoidea, fibromialgia y dolor neuropático en pacientes que no han tenido respuesta al tratamiento estándar habitual. Entendiendo por tratamiento estándar habitual aquellos procedimientos que son reconocidos y se utilizan en la clínica de forma permanente como recursos terapéuticos de elección para el dolor, científicamente avalados frente a las distintas enfermedades existentes.
El efecto analgésico de los cannabinoides sigue siendo estudiado. El mecanismo de acción propuesto es que los cannabinoides bloquean e inhiben la transmisión del impulso doloroso en diferentes localizaciones, activando el receptor cannabinoide tipo 1 (RCB1) en cerebro, médula espinal y neuronas sensoriales periféricas7.
Los cannabinoides tienen un papel modulador de la información nociceptiva tanto a nivel central como periférico. A nivel central, cuando se activan los nociceptores, liberan endocannabinoides (EC) para regular la información que transmiten a la médula espinal, mediado por RCB1 en el sistema nervioso central (SNC)8.
En la periferia están mediados por RCB1 y receptores cannabinoides tipo 2 (RCB2); cuando se activan los nociceptores, activan la síntesis de EC y éstos son liberados en el espacio extracelular. A partir de allí se unen a células del sistema inmune y a los queratinocitos. Esto provoca la inhibición de las sustancias proinflamatorias y propionociceptivas. La unión a los queratinocitos aumenta la liberación de betaendorfinas y éstas se unen a la membrana del nociceptor contribuyendo a la disminución de la transmisión de la señal nociceptiva8.
A nivel medular disminuye la actividad neuronal por menor liberación de neurotransmisores (NT) y menor despolarización de las neuronas con la consiguiente reducción de la transmisión del mensaje nociceptivo9,10.
Los RC en las células gliales (microglía y astrocitos) modulan la sensibilidad central, inhiben la secreción de sustancias proinflamatorias y propionociceptivas gliales e inhiben la neuroinflamación medular.
A nivel supraespinal sus acciones son menos conocidas, pero su activación da efectos depresores con sedación y esto puede contribuir al efecto analgésico10.
La revisión hecha por expertos de las Academias de Ciencias, Ingeniería y Medicina de Estados Unidos respecto al CM y el peso de la evidencia con fines terapéuticos muestra que el cannabis es eficaz para el tratamiento del dolor crónico (es una de las 100 conclusiones de este informe)11.
En otra revisión sistemática sobre el uso del CM en dolor crónico no oncológico, se encuentra que la mejor respuesta se da en el dolor neuropático, dolor en personas con virus de inmunodeficiencia humana (VIH) y dolor crónico abdominal. Sin embargo, la recomendación es que los médicos valoren el beneficio en cada paciente12.
En 34 estudios se utilizaron tres extractos medicinales a base de cannabis para uso sublingual, en pacientes con dolor crónico, sobre todo neuropático, para explorar eficacia, tolerabilidad y dosis. Los extractos medicinales de CM fueron de tres tipos: THC, CBD y THC-CBD en una proporción 1 a 1, durante un período de 12 semanas. Los extractos de THC demostraron ser más efectivos en el control de los síntomas y los efectos colaterales fueron aceptables y similares a los observados con otros fármacos psicoactivos para el dolor crónico13.
En revisión sistemática específica del uso de cannabinoides para la reducción de opioides en pacientes con dolor crónico no oncológico se incluyeron nueve estudios con 7.222 participantes, los resultados fueron que hubo una reducción de 64% al 75% de la dosis de opioides cuando se usó en combinación con CM en 32% a 59% de estos pacientes. También se demostró disminución en las internaciones y en las consultas de emergencia en el último año en aquellos pacientes que recibieron CM asociados a opioides en esta patología. No se logró determinar la dosis óptima de CM para lograr esta reducción en el uso de opioides, por lo cual es necesario profundizar en las investigaciones al respecto14,15.
El objetivo general de este trabajo fue valorar el beneficio clínico de preparados de CM para dolor crónico no oncológico.
Los objetivos específicos fueron:
Material y método
Se trata de un estudio descriptivo, observacional, longitudinal, de una población que se atiende en un centro privado de salud. La población estudiada (438 pacientes) fue la que consultó en CEDU desde setiembre de 2016 a marzo de 2020 por dolor crónico no oncológico que no respondió al tratamiento estándar habitual y que comenzó el tratamiento con CM usando quimiotipos diferentes de cannabis predominando los de CBD al 5% y con menos de 0,3% de THC.
Es una cohorte histórica, con seguimiento variable en cada caso, con un análisis estadístico que compara el dolor en cada individuo en sus diferentes consultas.
Los criterios de inclusión fueron pacientes mayores de 18 años con dolor crónico no oncológico que no tuvieron respuesta a tratamientos estándar; los criterios de exclusión fueron hipersensibilidad a los cannabinoides, pacientes embarazadas o en lactancia, o en edad genital activa que no utilizaban un método anticonceptivo seguro (implantes o DIU); cardiopatía isquémica y arritmias sin control por cardiólogo, esquizofrenia sin control por psiquiatra y anticoagulación con warfarina sin control con tiempo de protrombina e INR en los últimos seis meses. Las variables estudiadas fueron patronímicas (edad, sexo, escolaridad, cobertura asistencial), clínico-asistenciales (tipo de patología que motivó la consulta, otras enfermedades acompañantes, medicación que estaban recibiendo, indicación de CM, quimiotipo indicado (proporción de CBD-THC), dosis indicada y efectividad con el uso de cannabis (medida según la escala numérica del dolor (NRS)16, número de controles y EA).
Las escalas de medición de las variables patronímicas fueron las siguientes.
Las variables clínico asistenciales fueron: tipo de patología que motivó la consulta (dolor crónico osteoarticular, dolor neuropático, fibromialgia y artritis reumatoidea); enfermedades acompañantes: gastrointestinales, cardiovasculares, psiquiátricas, oncológicas, respiratorias, diabetes, inmunológicas y sin enfermedades acompañantes; medicación que estaban recibiendo para el dolor crónico: opioides y derivados, AINES, corticoides y pregabalina.
Se indicó el tratamiento con CM de acuerdo a la sintomatología, comorbilidades y farmacoterapia del paciente utilizando productos full spectrum (extracto completo de la planta) que contienen predominantemente CBD al 5%. En los que provenían de asociaciones de pacientes se pudo indicar preparaciones con quimiotipos más específicos para su patología, tipo CBD3-THC1, THC1-CBD1, THC2-CBD1 (productos testeados en laboratorios autorizados por el MSP).
Algunos productos importados, como M1337 (CBD 5%) y M1661 (CBD 5%) se caracterizaban por diferentes terpenos en cada uno de ellos (betacariofileno y mirceno) y M1171 (CBD 7,5%) sin terpenos, todos con THC menor a 1%.
Dada la complejidad de la valoración del dolor y de acuerdo a la revisión comparativa, se optó por la NRS, que es de sencilla aplicación y comprensión del paciente. La escala va de 0 a 10, clasificando 0 sin dolor; 1 a 3: dolor leve; 4 a 7: dolor moderado, y 8 a 10: dolor severo16.
Se evaluaron los EA y la gravedad de éstos de acuerdo a pautas de CTCAE v5.017.
Todos los pacientes del estudio concurrieron a CEDU. El número de consultas de cada paciente varió entre 1 y 4.
En la primera consulta se realizó la valoración completa del paciente, se le informó acerca del SEC y se asesoró sobre el posible tratamiento, interacciones y EA del mismo. Se solicitó consentimiento informado en todos aquellos a quienes se indicó terapia a base de cannabinoides.
Los pacientes fueron citados para controles seriados (al mes, a los tres y a los seis meses en un cronograma estipulado) disponiendo en todo el proceso de contacto directo con el equipo médico (celular y correo electrónico) a efectos de comunicar o consultar ante cualquier duda (EA, circunstancias intercurrentes).
En los controles previstos se registraron las siguientes variables: beneficios observados en el alivio del dolor crónico mediante el grado de respuesta según escala numérica (sin disminución del dolor: sin respuesta; disminución del dolor de más de 2 puntos: respuesta leve a moderada, y con disminución de 3 puntos o más: muy buena respuesta) y presencia o no de EA.
Análisis estadístico
En el análisis estadístico de tipo descriptivo se utilizaron las medidas de tendencia central y de dispersión. Para las variables cuantitativas se utilizaron media, mediana y modo como medidas de tendencia central, y desvío estándar, varianza y rango como medidas de dispersión. Se emplearon, además, medidas posicionales para las distintas variables cuantitativas en estudio.
Para las variables categóricas se utilizaron frecuencias expresadas en porcentajes de las diferentes categorías de la variable en cuestión. Se realizaron cruces de variables para responder a los objetivos planteados con los test estadísticos correspondientes, previa verificación de las condiciones de aplicación de dichos test. Se tomó el nivel de dolor inicial en la escala numérica para cada paciente y se comparó con el nivel de dolor al mes, a los tres y a los seis meses, utilizando el test de t para muestras apareadas. El nivel de significación fue de α = 0,05.
Resultados
En el período en estudio (septiembre de 2016 a marzo de 2020) consultaron 2.038 pacientes en CEDU, de los cuales 648 lo hicieron por dolor crónico no oncológico, y de éstos, 210 consultaron por asesoramiento y 438 iniciaron el tratamiento con CM.
De estos 438 pacientes, 324 (74%) fueron mujeres y 114 (26%) hombres.
El rango de edad fue de 19 a 95 años (media 76 años). El promedio fue de 69 años. En la escolaridad más del 84% tenía nivel de enseñanza secundaria o terciaria (370 de 438).
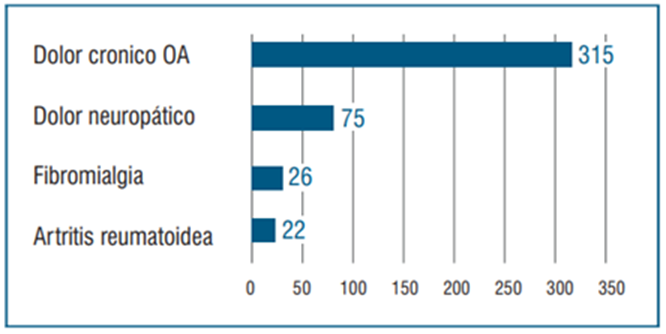
El tipo de dolor más frecuente en los 438 pacientes que iniciaron tratamiento fue dolor osteoarticular en 315 (71,9%), dolor neuropático en 75 (17,1%), fibromialgia en 26 (5,9%), y artritis reumatoidea en 22 (5,1%) (figura 1: tipo de dolor).
Al momento de la consulta el tratamiento estándar para el dolor se basó en AINES en 76%, opioides y derivados en 34,3%, pregabalina en 28% y corticoides en 6,6% de los pacientes.
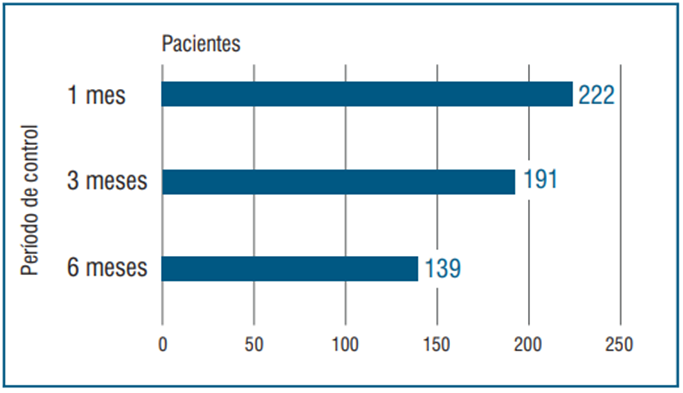
Los 438 pacientes que iniciaron tratamiento con cannabinoides concurrieron por lo menos a un control: 222 (50,7%) concurrieron al mes; 191 concurrieron a los tres meses (43,6%), y 139 a los seis meses (figura 2).
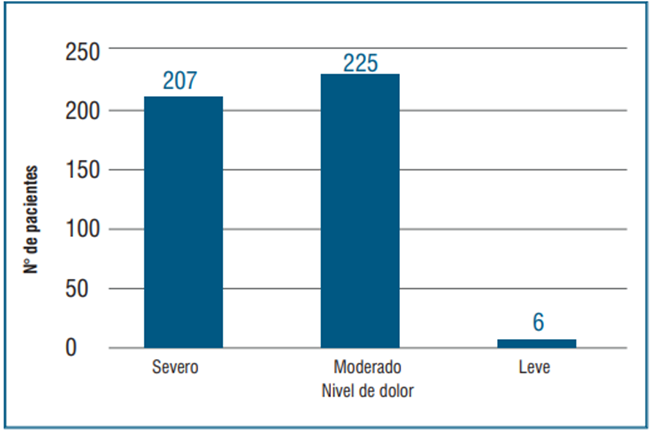
Al inicio del tratamiento el nivel de dolor fue severo en 207 pacientes (47,3%), moderado en 225 pacientes (51,4%) y leve en 6 pacientes (1,3%) (figura 3).
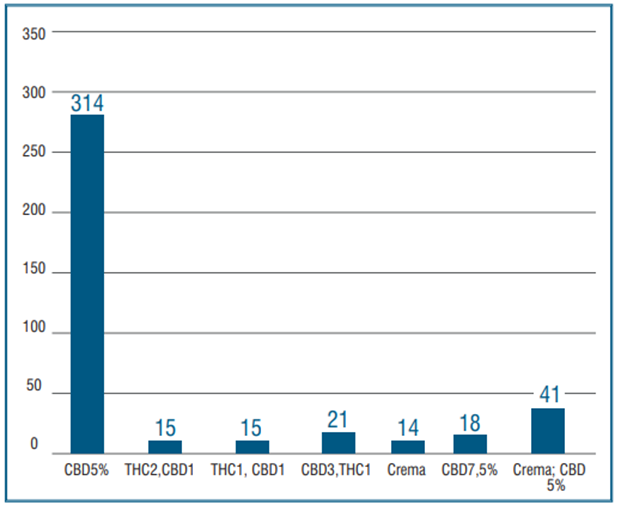
Al momento de iniciar el tratamiento la gran mayoría (71,7%) recibió CBD al 5% tipo full spectrum, los cuales fueron importados o nacionales. Dieciocho pacientes (4,1%) recibieron CBD al 7,5% con 0,9% de THC (producto importado). Sesenta y cinco (14,8%) utilizaron productos de las asociaciones de pacientes. Por otro lado, 41 pacientes (9,3%) concurrieron a CEDU ya utilizando aceites artesanales (no testeados). Se les asesoró en cuanto a los riesgos de su uso y entonces optaron por productos de las asociaciones, dados los altos costos de los productos regulados. En total, 106 pacientes usaron productos testeados de las asociaciones con diferentes quimiotipos: en 15 una fórmula con THC 2-CBD1; en otros 15 THC1-CBD1; en 21, CBD3-THC1; en 41 crema de cannabis y CBD al 5%, y en 14 solo crema de cannabis (figura 4).
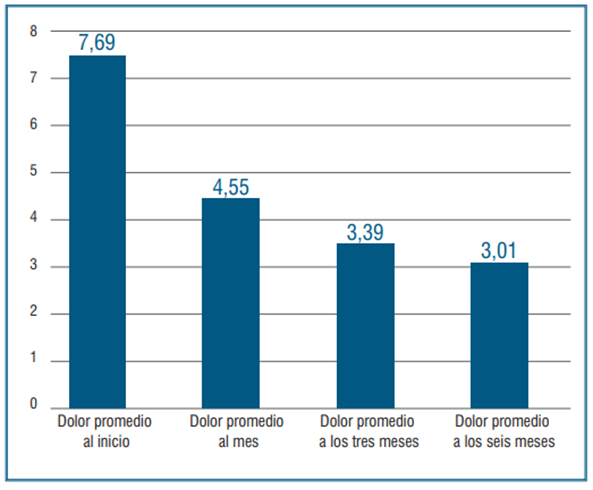
Los resultados de esta investigación revelan una respuesta estadísticamente significativa al mes y a los tres meses. El dolor promedio al inicio fue de 7,69 en la escala numérica, al mes de 4,55, a los tres meses de 3,39 y a los seis meses de 3,01. (figura 5). La caída del dolor entre el inicio y el mes fue de 3,14 (test de T para muestras apareadas, p < 0,0001); entre el inicio y los tres meses fue de 4,3 (test de T para muestras apareadas, p < 0,0001), y entre el mes y los seis meses fue de 1,4 (test de T para muestras apareadas, p < 0,0001). La variación del dolor entre tres y seis meses no fue estadísticamente significativa (0,339, test de T para muestras apareadas, p < 0,064).
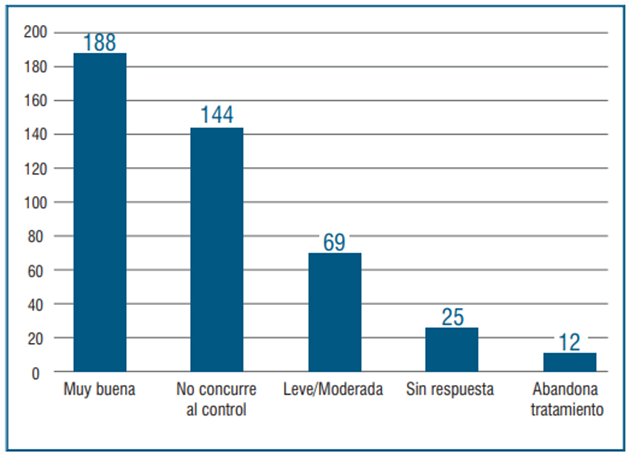
La respuesta al tratamiento a los tres meses fue muy buena en 188 pacientes (42,9%); leve a moderada en 69 (15,8%); sin respuesta en 25 pacientes (5,7%). No concurren al control 144 pacientes (32,9%) y 12 abandonan el tratamiento (2,7%) (figura 6).
Con respecto a la presencia de EA, 369 pacientes (84,2%) no presentaron y 69 (15,7%) tuvieron EA de entidad leve. De estos, solo tres abandonaron el tratamiento por somnolencia diurna, constipación e intolerancia digestiva. El EA más frecuente fue somnolencia diurna en 18 (26%), seguido de constipación en 12 (17%), sequedad de boca en 10 (15%), epigastralgia en 8 (12%), disminución del apetito 5 (7%) intolerancia al sabor en 5 (7%), mareos en 4 (6%), alteración del sueño en 4 (6%) e hipotensión postural en 3 pacientes (4%).
En cuanto al tratamiento estándar que venían recibiendo por el dolor, el uso de AINES disminuyó 23,2% y suspendió el 23%; opioides y derivados disminuyó 15,7% y suspendió el 8,3%; corticoides disminuyó en 3,2% y suspendió el 2%; pregabalina disminuyó 6% y suspendió el 3%.
Discusión
Esta investigación retrospectiva muestra que los cannabinoides pueden ser una opción válida para el tratamiento del dolor crónico no oncológico en pacientes que no tienen respuesta al tratamiento estándar, de la misma manera que lo encontrado en las revisiones bibliográficas acerca del tema.
Debilidades y fortalezas de la investigación
Este trabajo retrospectivo por sus características no ha podido tener en cuenta las diferencias en la respuesta al tratamiento con CM entre el sexo femenino y el masculino18. Tampoco se evaluó el uso de otras sustancias como el tabaco o el cannabis recreativo en la población estudiada. Los grupos de tratamiento recibieron diferentes quimiotipos, no teniendo éstos las mismas características de composición para poder ser comparados entre sí. No tenemos diferenciados los pacientes que concurrieron a cada control, por lo cual se eligió el grupo control de los tres meses para evaluar la mejoría del dolor, comparándolo con el nivel del dolor al inicio. Destacamos que si bien es un estudio descriptivo y no tiene un grupo comparador, a este grupo de pacientes les fue útil el tratamiento y los EA referidos fueron leves y en ningún caso graves.
En las investigaciones de CM y dolor crónico de la revisión bibliográfica, se encontró que los resultados se seleccionaron en base a las definiciones de la IMMPACT (iniciativa sobre métodos, medición y evaluación del dolor en ensayos clínicos). El beneficio moderado y sustancial se define como al menos un 30% de alivio del dolor sobre la línea de base (moderado), o al menos un 50% de alivio del dolor sobre la línea de base (sustancial)20,21. Este estudio mostró 44% de alivio del dolor sobre la línea de base.
Del punto de vista demográfico es una cohorte donde la mayoría son mujeres, con promedio de edad de 69 años, en concordancia con las características de nuestra población22, a diferencia de lo que se ve en otros países23.
En cuanto al tipo de dolor, la gran mayoría presentó dolor crónico osteoarticular y la respuesta al tratamiento con cannabinoides fue significativa. La bibliografía consultada muestra mayor evidencia en dolor neuropático, aunque últimamente se han publicado diversos estudios con cannabinoides que evalúan la eficacia analgésica en dolor crónico osteoarticular24-26.
Cannabinoides y opioides tienen acción sinérgica en el tratamiento del dolor, potenciando el efecto antinociceptivo mediado por receptores. Esto permite disminuir el uso de opioides y sus derivados, posibilitando reducir los EA de este grupo de fármacos14,15. Esta acción permite disminuir la polifarmacia, lo cual se confirma en este trabajo, que mostró una disminución o suspensión del uso de opioides y derivados en 24%.
En la bibliografía consultada no encontramos referencia a la disminución o suspensión del uso de AINES con el tratamiento con cannabinoides; sin embargo, los resultados de esta investigación muestran una importante disminución o suspensión del uso de AINES en un total de 46,2%.
En cuanto al tipo de tratamiento, usamos en todos los casos productos full spectrum, los cuales además del beneficio de los cannabinoides agregan el efecto de los terpenos27. Algunos de los terpenos, como el beta cariofileno (uno de los terpenos más predominantes en los extractos full spectrum) ejerce efecto sinérgico antiinflamatorio y analgésico a través de la prostaglandina E1 y la activación de RC. El beta cariofileno también inhibe la expresión proinflamatoria de citoquinas inducida por lipopolisacáridos (LPS) a través de la activación del receptor CB228.
En la revisión bibliográfica la mayoría de los trabajos de CM y dolor crónico han utilizado THC24. En Uruguay, hasta el momento, no hay THC regulado de uso medicinal, por lo cual la gran mayoría de los pacientes de este estudio han usado quimiotipos con CBD al 5%, excepto algunos provenientes de las asociaciones de pacientes en una proporción poco significativa.
La dosis recomendada para efecto analgésico con CBD de acuerdo a la revisión en el tema es de 5 a 40 mg/día (dosis media 15 mg)19 y esto coincide con la dosis que usamos en este estudio. En CM la dosis se ajusta en cada paciente de forma individual y es dosis ascendente progresiva de acuerdo a respuesta y tolerancia. Usando un proceso Delphi, veinte expertos mundiales en nueve países desarrollaron recomendaciones basadas en el consenso en cómo dosificar cannabis en pacientes con dolor crónico iniciando con una dosis de CBD de 5 mg dos veces por día29.
El proceso Delphi modificado es una herramienta útil para proporcionar recomendaciones basadas en el consenso sobre cuestiones clínicas importantes en las que se carece de datos de ensayos controlados aleatorios30.
Con respecto a los EA, los resultados de este estudio coinciden con la revisión bibliográfica donde no hay EA graves por uso de CM en pacientes con dolor crónico y los que se observan son leves o moderados (somnolencia, constipación, sequedad de boca, epigastralgia, astenia)31.
Dados los beneficios que presenta el CM en el tratamiento del dolor crónico, se destaca la necesidad de disponer en forma accesible de este tipo de medicamento para tratar a estos pacientes. A pesar de las limitaciones de no contar con estudios clínicos controlados (ECC) es necesario incorporar el CM al tratamiento del dolor en forma efectiva, integrándose al formulario terapéutico de medicamentos (FTM), mejorando de esta manera su accesibilidad.
Conclusiones
El dolor crónico no oncológico es una de las grandes preocupaciones médicas, sociales y laborales desde hace largo tiempo, de difícil tratamiento y mayor uso de polifarmacia con todos los riesgos que conlleva para la salud de la población usuaria.
El grupo estudiado estuvo constituido en su mayoría por mujeres de tercera edad, con estudios de nivel secundario o terciario.
El uso de CM para el dolor crónico no oncológico en esta investigación retrospectiva ha demostrado que puede ser una buena opción para su tratamiento, evidenciándose una respuesta significativa del descenso del nivel de dolor en los sucesivos controles (44% a los tres meses).
A su vez, encontramos una disminución de la polifarmacia relativamente significativa, con disminución o suspensión del uso de opioides o AINES, o ambos, contribuyendo así a disminuir algunos de los EA de estos medicamentos. Este descenso de la polifarmacia es plausible de incrementarse en la medida en que el paciente continúe con el seguimiento médico ajustando la dosis de cannabinoides.
Es de destacar que si bien es un estudio descriptivo y no tiene grupo comparador, a este grupo de pacientes le fue beneficioso el tratamiento y no refirieron EA graves.