Introducción
El surgimiento de la enfermedad por coronavirus 2019 (coronavirus disease 2019 o COVID-19) causada por el virus SARS-CoV-2 en Wuhan, China en diciembre de 2019, evolucionó rápidamente en una pandemia global con consecuencias graves del punto de vista sanitario y económico. Uruguay no fue ajeno a esta pandemia, presentó el mayor azote entre setiembre de 2020 y junio de 2021, que puso al sistema sanitario en máxima tensión y en particular a las áreas de cuidados críticos. En el momento actual, las autoridades sanitarias han reportado en Uruguay 1.035.046 casos de COVID-19 con 7.619 fallecidos (covid19uy.com, 27/3/23). De acuerdo a la información proporcionada por la Sociedad Uruguaya de Medicina Intensiva (SUMI), durante la primera ola comprendida entre 2/4/20 y 2/9/21 (período en el cual está comprendida la serie presentada en este trabajo) se reportaron 4.960 pacientes internados en medicina intensiva, falleciendo 2.829 (57%). Si bien el principal compromiso por este virus ha sido el pulmonar (en forma de neumonitis y síndrome de distrés respiratorio agudo - SDRA), se pudo observar el reporte creciente de otras disfunciones cómo la disfunción renal con implicancias pronósticas en término de morbimortalidad.
Objetivos
Objetivo general del estudio: determinar la incidencia del compromiso renal asociado al COVID-19 así como su implicancia pronóstica.
Los objetivos específicos del estudio fueron:
1) Determinar la incidencia de proteinuria, hematuria e injuria renal aguda (IRA) asociada a COVID-19 con sus diferentes subfenotipos.
2) Determinar la asociación de factores indirectos con el desarrollo de IRA.
3) Determinar la implicancia pronóstica en términos de morbimortalidad del compromiso renal y de los diferentes grados de soporte orgánico.
Materiales y métodos
Estudio prospectivo, observacional y analítico de una cohorte de pacientes con COVID-19 severa y crítica ingresados a la Unidad de Medicina Intensiva (UMI) del Hospital Español, ASSE, Montevideo, Uruguay. La UMI del Hospital Español, al constituirse en centro de referencia COVID-19, se expandió a una Unidad con 35 camas de cuidados críticos. El diagnóstico de COVID-19 fue confirmado mediante la determinación de positividad para virus SARS-CoV-2 por técnica de rt-PCR.
Los criterios de inclusión fueron los pacientes mayores de 18 años, con COVID-19 severa y crítica que completaron su evolución en UMI.
Los criterios de exclusión fueron los pacientes menores de 18 años, pacientes sin diagnóstico confirmado de COVID-19.
Definiciones empleadas
Se emplearon las definiciones de severidad de COVID-19 de la Organización Mundial de la Salud (OMS)1. COVID-19 crítica fue definida por la presencia de SDRA, sepsis, shock séptico u otra condición que pueda requerir de terapia de soporte vital como la ventilación mecánica invasiva (VMI) o vasopresores1. COVID-19 severa fue definida por la presencia de por lo menos uno de los siguientes criterios: saturación de O2 menor de 90% ventilando al aire, signos de trabajo respiratorio severo (empleo de musculatoria accesoria, habla entrecortada, frecuencia respiratoria mayor de 30 rpm)1.
Fueron empleadas las siguientes definiciones de IRA y sus diferentes subfenotipos:
- IRA asociada a COVID-19: IRA (diagnóstico en base a definición consenso KDIGO) desarrollada en el curso de COVID-19 severa o crítica2.
- IRA definida por criterios KDIGO: incremento de la creatininemia e0,3 mg/dL en un plazo hasta 48 horas o un incremento de la creatininemia e 1,5 veces el valor basal en un plazo conocido o presumido de hasta 7 días o una diuresis <0,5 ml/kg/h por 6 horas. Se definen tres estadíos de severidad basados en el grado de ascenso de la creatininemia y descenso del gasto urinario así como la necesidad de terapia de reemplazo renal (TRR)3.
- IRA transitoria: duración hasta 48 horas4.
- IRA persistente: duración entre 48 horas y 7 días4.
- Enfermedad renal aguda (ERA): disfunción renal de más de 7 días y hasta 90 días de duración4.
- Enfermedad renal crónica (ERC): disfunción renal de duración mayor de 90 días ya presente antes del ingreso sobre la que se puede agregar una IRA. Dentro de este grupo se discriminó a aquellos pacientes que recibían tratamiento de reemplazo renal crónico.
- IRA comunitaria: diagnosticada dentro de las primeras 24 horas de estadía en UMI.
- IRA nosocomial: diagnosticada luego de las primeras 24 horas de estadía en UMI.
- Recuperación de la función renal: retorno de la función renal a su nivel basal.
- Recidiva de IRA: nuevo episodio de IRA luego de una recuperación de la función renal.
Variables empleadas: cuantitativas (edad, scores de severidad APACHE II y SOFA, estadía en UMI, duración de VMI y TRR, creatininemia máxima, valores de PCR, linfocitos, LDH, ferritina, D-dímeros, natremia, potasemia, albuminemia, pH, PaCO2, SBE), cualitativas (género, estado al alta de UMI, proteinuria, hematuria, IRA, estadio 1, 2 y 3, IRA severa (estadios 2 y 3), IRA comunitaria, IRA nosocomial, IRA transitoria, IRA persistente, ERA, ERC, recidiva de IRA, función renal normal al alta de UMI, requerimiento de O2, oxigenoterapia de alto flujo (OAF), ventilación no invasiva (VNI), VMI, vasopresores, TRR, requerimiento de VMI+vasopresores, VMI+vasopresores+TRR, balance hídrico positivo, nefrotóxicos, sobreinfección nosocomial, vacunación, antecedentes personales relacionados con el desarrollo de COVID-19 y gérmenes de infecciones nosocomiales.
La proteinuria fue determinada mediante examen de orina y cualquier valor cuando fue reportado se consideró positivo.
Nefrotóxicos considerados: antiinflamatorios no esteroideos (AINE), inhibidores de la enzima conversora de angiotensina (IECA), antagonistas de los receptores de la angiotensina II (ARA II), agentes de contraste, antimicrobianos (aminoglucósidos, piperacilina tazobactam), nefrotóxicos endógenos (rabdomiólisis).
El cálculo del balance hídrico diario y acumulativo se realizó por el método de registro de ingresos y egresos hídricos con las limitantes conocidas del método referido y más aún en el contexto de pandemia.
Análisis estadístico: las variables descriptivas fueron expresadas en n (%), media (± DS) o mediana (Q1-Q3). Se realizó un análisis univariado y multivariado. La comparación de medias y medianas fue realizada con test t o ANOVA para muestras independientes y tests no paramétricos, respectivamente. La asociación de variables cualitativas fue determinada por test de Chi cuadrado. El análisis multivariado fue realizado mediante regresión logística binaria para IRA y mortalidad al alta de UMI. Los datos fueron procesados mediante el empleo de SPSS versión 26. Las diferencias estadísticas fueron consideradas significativas cuando el valor de p fue menor de 0,05.
Este estudio fue aprobado por el Comité de Ética de la Investigación del Hospital Español.
Resultados
Fueron considerados 233 pacientes con COVID-19 severa y crítica ingresados a la UMI del Hospital Español en el período comprendido entre setiembre de 2020 y mayo de 2021.
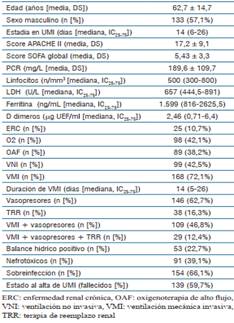
Las características generales de la población estudiada se presenten en la (tabla 1).
Los antecedentes personales que predominaron en la población estudiada fueron: hipertensión arterial (41%), diabetes (22%) y obesidad (15%).
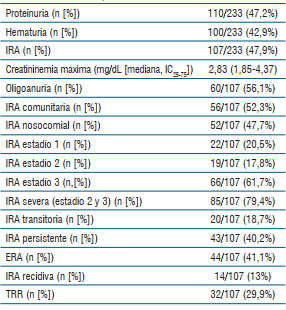
En la (tabla 2) se muestra las frecuencias de compromiso renal en forma de hematuria, proteinuria e IRA con sus diferentes subfenotipos.
La IRA asociada a COVID-19 se presentó en el 47,9% (107/233), la IRA severa (estadios KDIGO 2 y 3) en el 79,4% (85/107), la IRA nosocomial en el 47,7% (52/107), la ERA en el 41,1% (44/107) y el requerimiento de TRR en el 29,9% (32/107).
La mayor parte de los pacientes con IRA cumplieron con los criterios diagnósticos de la misma durante las primeras 24 h de evolución en UMI.
Se destaca que seis pacientes de la serie presentaban ERC en etapa de tratamiento con reemplazo renal crónico y una mortalidad de 83,3% (5/6).
La serie presentó tres pacientes con trasplante renal de los cuales uno presentó IRA y dos fallecieron (66,6%).
Se evidenció rabdomiólisis en dos pacientes.
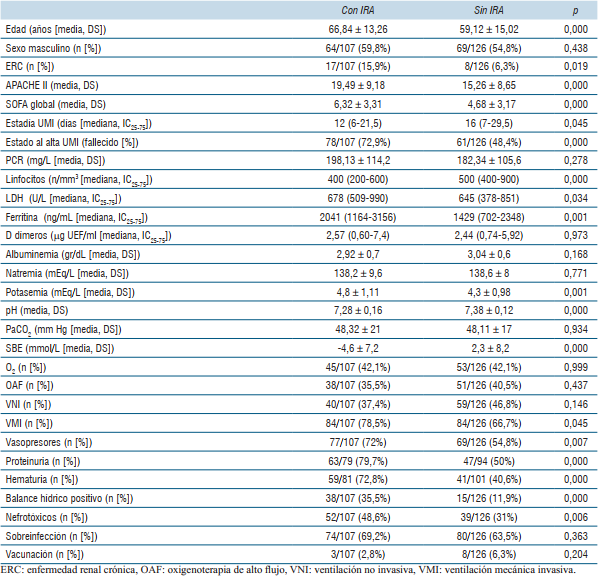
En la (tabla 3) se muestra las características de los pacientes que presentaron IRA asociada a COVID-19 y de los que no presentaron IRA. Se destaca la mortalidad al alta UMI de pacientes con IRA 78/107 (72,9%) versus sin IRA 61/126 (48,4%) (p= 0,000).
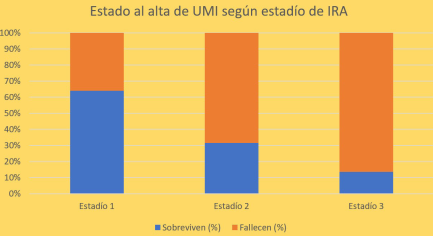
La (figura 1) muestra el estado al alta de los pacientes con IRA según el estadío KDIGO, mortalidad estadio 1: 36,4% (8/22), estado 2: 68,4% (13/19), estadio 3: 86,4% (57/64), p= 0,000.
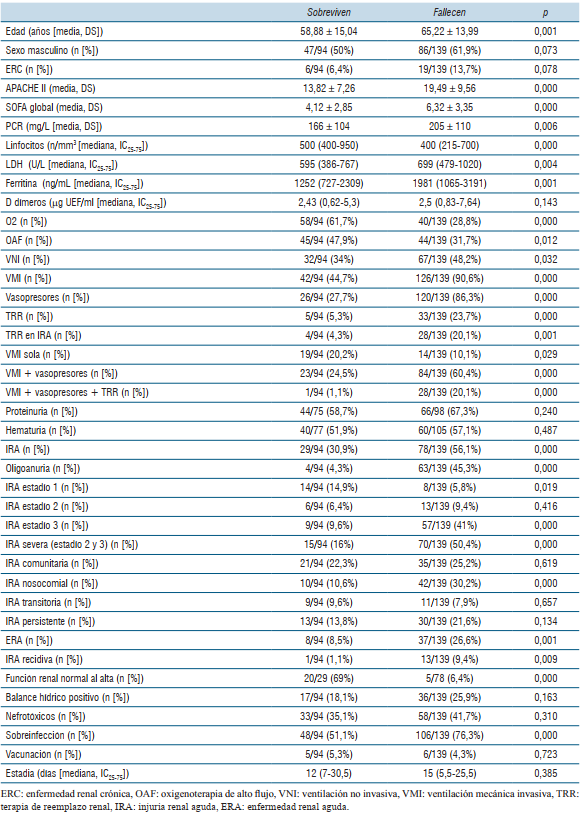
La (tabla 4) compara las diferentes características de todos los pacientes que sobreviven con todos los pacientes que fallecen durante la estadía en UMI.
Tabla 4: Características de todos los pacientes de la serie que sobreviven versus pacientes que fallecen
El análisis multivariado no mostró factores predictivos independientes de riesgo para el desarrollo de IRA.
El análisis multivariado mostró cómo factores predictivos independientes de riesgo de muerte al alta de UMI a la función renal normal al egreso (OR 0,055, IC 95%: 0,014-0,2213, p= 0,000), la edad (OR 1.040, IC 95%: 1.008-1.073, p= 0,015) y el empleo de vasopresores (OR 43,62, IC 95%: 4.905-387.924, p= 0,001). En el análisis multivariado, la IRA no pudo ser identificada como un factor predictivo independiente de riesgo para muerte al alta de UMI.
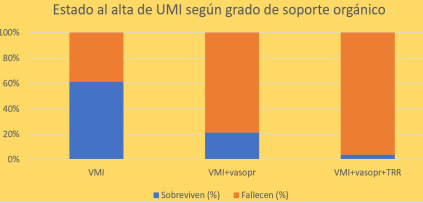
La (figura 2) muestra el estado al alta de los pacientes según el grado de soporte orgánico utilizado, mortalidad: VMI: 38,7% (12/31), VMI+vasopresores: 78,9% (86/109), VMI+vasopresores+TRR: 96,3% (26/27), p= 0,000.
La estadía en UMI (días _mediana, IC25-75_) según el grado de soporte orgánico fue la siguiente: VMI: 25 (12,5-36,25), VMI + vasopresores: 18 (6-27,5), VMI + vasopresores + TRR: 15 (6-31) (p= 0,063).
Discusión
En este trabajo analizamos una serie de 233 pacientes ingresados a la UMI del Hospital Español por COVID-19 severa y crítica. El compromiso renal fue frecuente tanto en forma de proteinuria (47,2%), hematuria (42,9%) o IRA (47,9%).
Se pudo determinar un predominio de IRA en estadíos más severos y su asociación con una mortalidad significativamente mayor. La normalización de la función renal se comportó como un factor predictivo protectivo de riesgo de muerte. La severidad de la IRA y el grado de soporte multiorgánico se asociaron con un aumento progresivo de la mortalidad.
Al comparar la mortalidad al alta de UMI según el grado de soporte orgánico, se pudo observar una mortalidad significativamente mayor y creciente con el grado progresivo de soporte (VMI 38,7%, VMI+vasopresores 78,9%, VMI+vasopresores+TRR 96,3%, p= 0,000).
Estos resultados son acordes con un estudio observacional, multicéntrico de evaluación del nivel de soporte orgánico y mortalidad de 20.608 pacientes adultos hospitalizados por COVID-19 donde la mortalidad fue de 8,2% en aquellos que no recibieron ninguno de los soportes orgánicos, de 40,8% en los que solo recibieron VMI, 53% en los que recibieron VMI y vasopresores, y 71,6% en los que recibieron VMI, vasopresores y TRR5.
La estadía en UMI en la serie de nuestro estudio fue progresivamente menor de acuerdo al grado de soporte orgánico. Aunque dicha diferencia no fue significativa, presentó una tendencia. La menor estadía con un mayor grado de soporte orgánico puede ser explicada por la mayor gravedad de éstos últimos que implicaría una mortalidad más precoz.
Se objetivó proteinuria en el 47,2% y la hematuria en el 42,9% siendo las mismas significativamente más frecuentes en los pacientes que desarrollaron IRA con respecto a los que no la desarrollaron. Éstos resultados son similares a los reportados en metaanálisis sobre compromiso renal en COVID-19 en donde la proteinuria se presentó entre el 52,09% y 57,2%5,6 y la hematuria en el 45,38%6.
La IRA fue evidenciada en el 47,9% de los pacientes y más de la mitad de los mismos, se presentaron en oligoanuria. La necesidad de TRR en los pacientes que desarrollaron IRA fue del 29,9%.
En diferentes series reportadas de pacientes críticos con COVID-19, la incidencia de IRA acorde a criterios KDIGO fue entre 30,6% y 86,5% 7-16, correspondiendo la mayoría a estadíos 2 y 38,17.
Los requerimientos de TRR reportados en pacientes con COVID-19 severa y crítica son entre el 8,6% y 20,6% 9,10,11,15,16 y este grupo de pacientes se asocia con una mortalidad significativamente mayor9. La incidencia de IRA que requiere de TRR en UMI ha disminuido en el tiempo de 26% al inicio de la pandemia a 14% en 202213. En los pacientes sobrevivientes que requirieron TRR, se continuó en un 8%-33% al alta hospitalaria13.
Un análisis temporoespacial del compromiso renal en el contexto de pacientes con COVID-19 consideró 17.134 pacientes de 30 estudios seleccionados18. La prevalencia de IRA en los pacientes enrolados antes del 1/3/20 fue significativamente menor que la de los pacientes enrolados en forma posterior (9% versus 36%)18. Los pacientes con COVID-19 severa y los no sobrevivientes presentaron un riesgo significativamente mayor de desarrollar IRA y de necesidad de TRR18. Muchas series reportadas posteriormente muestran una disminución en el tiempo de la incidencia y severidad de la IRA asociada a COVID-19 que puede estar relacionada a optimización del tratamiento, a un reconocimiento creciente de formas menos severa de IRA, a la virulencia de las diferentes cepas y a la vacunación13,19,20,21.
En otras series se han reportado factores de riesgo independiente para el desarrollo de IRA, como el requerimiento de vasopresores o la necesidad de ventilación mecánica invasiva17. Si bien en el análisis univariado se pudo determinar que la necesidad de vasopresores y ventilación mecánica invasiva se presentó en forma significativamente mayor en los pacientes que desarrollaron IRA, el análisis multivariado no pudo evidencia factores de riesgo independientes para su desarrollo.
La identificación de subfenotipos de IRA permite facilitar la investigación y el manejo clínico así como ajustar el pronóstico22. Diferentes criterios han sido utilizados para determinar subfenotipos entre los cuales se destaca: características clínicas (IRA oligoanúrica, IRA comunitaria y nosocomial), evolución temporal (IRA transitoria, persistente y recurrente), severidad (estadíos de IRA 1, 2 y 3, IRA severa) y presencia de biomarcadores22. Los subfenotipos de IRA se asocian a diferentes pronósticos y pueden ser utilizados para definir estrategias terapéuticas22.
La mayor parte de los pacientes con IRA cumplieron con los criterios diagnósticos de la misma durante las primeras 24 h de evolución en UMI. Otras series mostraron resultados similares reafirmando que la infección por COVID-19 presenta un rol importante en el desarrollo de IRA por mecanismos directos.
Dentro de los diferentes subfenotipos de IRA analizados en esta serie, se debe destacar la predominancia de la IRA de origen comunitario (52,3%), de la IRA severa (estadíos 2 y 3) (79,4%) y de la ERA (41,1%).
En otras series, la IRA comunitaria se presentó en 51%-72% y la nosocomial en el 28%-49% siendo similar la severidad de ambas pero la mortalidad asociada a IRA nosocomial fue significativamente mayor (61,3% vs 32,7%)13.
En esta serie, el 13% y el 23.4% de los pacientes con IRA presentaron en forma respectiva episodios de recidiva de IRA y función renal normal al alta de UMI.
En otras series y metaanálisis publicados, el 40.2% recuperan función renal al día 7 mientras que la mayoría presenta IRA persistente o ERA (entre 45.73% y 47%) 19,23. Al alta hospitalaria, la mayoría de los pacientes que sobreviven (74%-84%) recuperan la función renal. El riesgo de no recuperación de la función renal es significativamente mayor en pacientes que desarrollan IRA estadio 3 y/o ERA13.
Por otra parte los pacientes con IRA presentaron valores significativamente menores de recuento de linfocitos y mayores de LDH y ferritina. Los pacientes con IRA presentaron valores significativamente menores de pH y SBE así cómo valores mayores de potasemia.
Si consideramos los factores indirectos implicados en el desarrollo de IRA, se pudo observar la presencia significativamente mayor en los pacientes con IRA de VMI, empleo de vasopresores, presencia de balance hídrico positivo y de nefrotóxicos.
La presencia de sobreinfección y/o cultivos positivos no fue significativamente mayor en los pacientes que desarrollaron IRA. La sobreinfección y/o cultivos positivos fueron muy frecuentes en ésta serie de pacientes con COVID-19 severa y crítica en donde predominaron los bacilos gram negativos (BGN) multirresistentes (Klebsiella pneumoniae, Pseudomonas aeruginosa, Enterobacter sp) y hongos (Cándida sp, Aspergillus sp). Los pacientes fallecidos presentaron una proporción significativamente mayor de sobreinfección nosocomial/cultivos positivos (76,3% vs 51,1%).
Con respecto a la rabdomiólisis, fue detectada solo en dos pacientes mediante la determinación de niveles plasmáticos de CPK aunque este número seguramente no es el real porque no se realizó la determinación sistemática de CPK plasmática en todos los pacientes de la serie.
Una complicación que se ha observado en COVID-19 es la microangiopatía trombótica donde la presencia de plaquetopenia puede ser sugestiva de la misma. En esta serie no se observó una diferencia significativa en el desarrollo de IRA en aquellos pacientes que presentaron plaquetopenia. Dentro de los pacientes que presentaron plaquetopenia (recuento plaquetario menor de 100.000), ocho pacientes (30,8%) desarrollaron IRA, mientras que dentro de los que no presentaron plaquetopenia, 99 pacientes (47.8%) desarrollaron IRA (NS). Si consideramos al grupo de pacientes con IRA, 8 pacientes (7.5%) presentaron plaquetopenia comparado con los pacientes sin IRA que presentaron plaquetopenia en 18 pacientes (14,3%) (NS).
Al comparar a los pacientes con IRA con respecto al máximo estadío alcanzado de severidad alcanzado se pudo observar una diferencia significativa y progresiva (estadío 1 a 3) en los valores de scores de severidad APACHE II y SOFA así como de mortalidad al alta de UMI. En forma similar los valores de PCR fueron progresivamente mayores según el estadio alcanzado, lo que junto con los valores de LDH y ferritina referidos previamente destaca el potencial rol de la respuesta inflamatoria en el desarrollo de IRA. También se debe destacar una diferencia significativa y progresiva en los diferentes estadíos de los valores de potasemia, acidemia y de requerimientos de vasopresores y VMI.
La mortalidad al alta de UMI de los pacientes con IRA analizados en esta serie fue de 72,9%. La mortalidad al alta reportada de pacientes con IRA asociada a COVID-19 en pacientes críticos ha sido entre 35% y 60,5%8,12,14, requiriendo en un alto porcentaje VMI y vasopresores8,14,24. Incluso la IRA estadio 1 se asocia con un riesgo incrementado de muerte con un aumento de la misma al aumentar el grado de severidad.
En ésta serie, los pacientes que desarrollaron IRA presentaron valores significativamente mayor de edad, de presencia de ERC, de scores de severidad APACHE II, SOFA y de mortalidad al alta de UMI (72,9% vs 48,4%).
Al comparar los pacientes fallecidos con respecto a los sobrevivientes, los primeros presentaron valores significativamente mayores de edad, scores APACHE II y SOFA, PCR, LDH y ferritina, así como mayor linfopenia. Los pacientes no sobrevivientes presentaron un porcentaje significativamente mayor de requerimiento de VNI, VMI, vasopresores, TRR y grado de soporte orgánico. Los pacientes fallecidos a su vez presentaron una proporción significativamente mayor de IRA, IRA severa, oligoanuria, IRA nosocomial, ERA y recidiva de IRA. Los pacientes sobrevivientes presentaron un porcentaje significativamente mayor de función renal normal al alta con respecto a los fallecidos (69% vs 6,4%).
En varias de las series reportadas, la prevalencia de IRA y la necesidad de TRR, VMI y vasopresores fue significativamente mayor en los pacientes no sobrevivientes10,23.
En los metaanálisis publicados sobre compromiso renal en COVID-19, los pacientes que desarrollaron IRA presentaron un OR entre 9,03 y 13,52 para mortalidad6,25,26.
La IRA se comportó en algunas series como un predictor independiente de mortalidad (HR 1,66)10,19 mientras que en otras lo fueron el empleo de VMI y vasopresores24.
En esta serie el análisis multivariado para mortalidad no permitió evidenciar a la IRA como un factor de riesgo independiente para la primera. De acuerdo a los resultados obtenidos solo podemos afirmar que los pacientes con IRA presentaron una mortalidad significativamente mayor con respecto a los que no lo presentaron así como que la mortalidad aumentó en forma significativa al aumentar el número de soportes orgánico requeridos. La función renal normal al alta de UMI se comportó como un factor de riesgo independiente protectivo para muerte en UMI.
Si bien no fue uno de los objetivos de análisis de esta serie, la IRA desarrollada en COVID-19 se ha evidenciado con peor pronóstico con respecto a otras infecciones virales. En un estudio se comparó la incidencia y pronóstico de IRA en 3.402 pacientes hospitalizados con COVID-19 versus 3.680 pacientes hospitalizados con influenza27. La IRA fue más frecuente (40.9% vs 29.4%) y más severa en COVID-19, requiriendo éstos además más VM, vasopresores y mayor mortalidad27. La recuperación de la función renal fue menos común en los pacientes con IRA asociada a COVID-1927.
En esta serie de pacientes, solo el 4,72% (11/233) presentaron algún tipo de esquema de vacunación anti COVID-19 dado que recién se comenzó con la vacunación a finales del período en que se desarrolló el estudio. Por lo tanto no es posible poder obtener conclusiones con respecto a la vacunación y el desarrollo de IRA. En un estudio publicado recientemente sobre el perfil de seguridad de la vacuna BNT162b2 (Pfizer-BioNTech) en Israel, la vacunación mostró un efecto protectivo en contra del desarrollo del evento adverso IRA (RR 0,44)28. Por otra parte el estudio referido pudo evidenciar que la infección por SARS-CoV-2 se asocia con un riesgo incrementado de desarrollo de IRA (RR 14,83)28. Por lo tanto la escasa vacunación de esta serie también explicaría la alta incidencia de desarrollo de IRA así como la elevada mortalidad observada.
Limitaciones del estudio
Si bien éste es el primer estudio realizado en nuestro medio sobre el compromiso renal en pacientes con COVID-19 severa y crítica, el mismo presenta algunas limitaciones. Entre las mismas se destaca que se trata de una serie relativamente pequeña y de un solo centro de terapia intensiva así como la no determinación sistemática de algunas variables que fueron aclaradas en el texto.
Conclusiones
El compromiso renal en forma de proteinuria, hematuria e IRA fue frecuente en COVID-19 severa y crítica acorde con otras series reportadas. Se pudo determinar un predominio de IRA en estadíos más severos y su asociación con una mortalidad significativamente mayor. La normalización de la función renal se comportó como un factor predictivo protectivo de riesgo de muerte. La severidad de la IRA y el grado de soporte multiorgánico se asoció con un aumento progresivo de la mortalidad. La detección precoz de la IRA y el control de los factores etiológicos inespecíficos evitarían el avance de la misma a estadíos más severos asociados con peor pronóstico.