Introducción
Los prolactinomas están compuestos por una proliferación de células lactotropas, siendo los tumores de hipófisis más frecuentes (40%), presentando una relación mujeres/hombres de 10:11,2.
Habitualmente son esporádicos, y pueden asociarse a síndromes hereditarios como neoplasia endocrina múltiple tipo 1 (MEN 1) en un 30%2.
Según su tamaño se clasifican en microprolactinomas (menores a 1 cm) o macroprolactinomas (mayor o igual a 1 cm). Estos últimos se presentan con mayor frecuencia en los varones debido a la demora en la consulta, llevando a un diagnóstico más tardío1,2.
Generalmente las concentraciones de prolactina (PRL) producidas tienen correlación con el tamaño tumoral3.
Independientemente de la causa, la sintomatología se origina tanto por la hiperprolactinemia como al efecto de masa, especialmente en los macroprolactinomas2. La hiperprolactinemia interfiere con la secreción pulsátil de GnRH e inhibe la secreción de LH y FSH; por otra parte, la masa tumoral puede producir hipopituitarismo por efectos compresivos de las estructuras paraselares lo que puede favorecer el hipogonadismo hipogonadotrófico3.
Los prolactinomas son raros en la infancia o la adolescencia y a menudo se presentan con retraso en el desarrollo puberal e hipogonadismo o síntomas por efecto de masa1,3.
Caso clínico
Paciente de 27 años, de sexo masculino, con antecedentes personales de obesidad, gastrectomía atípica por lesión vegetante con anatomía patológica que informa carcinoma neuroendocrino bien diferenciado, realizada dos años previos a la consulta. Concurre derivado desde el Servicio de Urología por hipogonadismo en contexto de estudio por una pubertad detenida.
Refería escaso desarrollo de vello facial, disminución global de las fuerza y escaso desarrollo muscular. Concomitantemente disminución de la libido, anorgasmia y aneyaculación. Negaba anosmia e hiposmia, cefalea y alteraciones visuales. Negaba galactorrea, ginecomastia, episodios de hipotensión o mareos y síntomas de disfunción tiroidea.
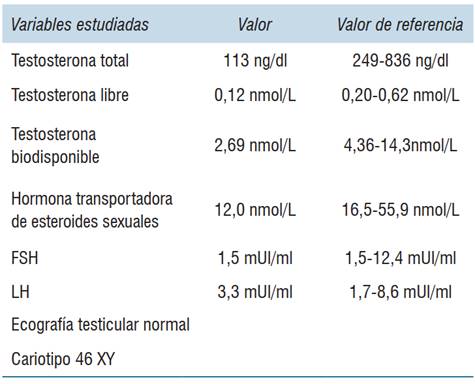
Al examen presenta una obesidad moderada con un IMC 35,4 kg/m2, normotenso, barba rala, resto del vello corporal de distribución androgénica normal. No ginecomastia. A nivel genital: vello púbico Tanner V; testículos en bolsa 8 ml (adultos ≥ 15 ml) y pene de 6 cm (adultos ≥ 9,3 cm), Tanner III. Examen neurológico normal, con campo visual por confrontación normal. Con planteo de hipogonadismo hipogonadotrófico se solicitó bioquímica que confirmó el planteo clínico (tabla 1).
Laboratorio
La paraclínica se muestra en la (tabla 1).
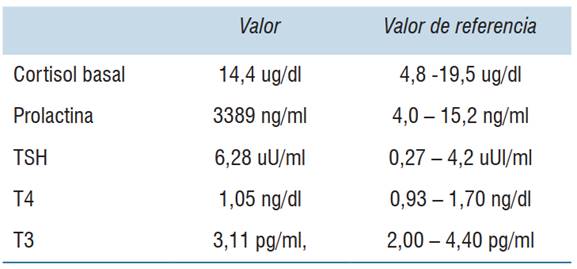
Se completa estudio de hipogonadismo hipogonadotrófico con la valoración del resto de los ejes hormonales (tabla 2) y resonancia nuclear magnética (RNM) de cráneo con enfoque selar (figura 1).
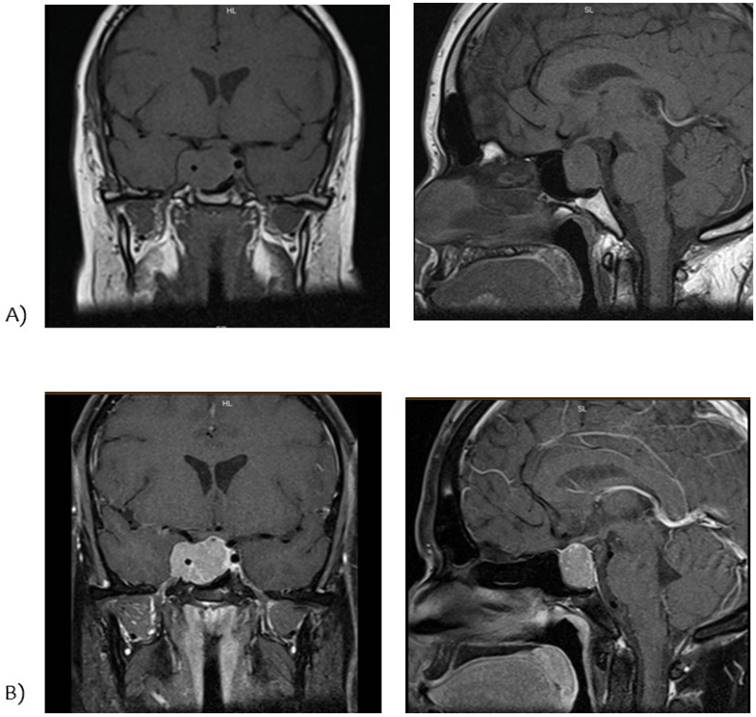
Figura 1: A) RNM de cráneo con enfoque selar conte coronal y sagital ponderada en T1. B) RNM de cráneo con enfoque selar conte coronal y sagital ponderada en T2.
Se solicitó calcemia: 9,9 mg/dl (VN: 8,2-10,2) y albuminemia: 4,6 g/dl; pendiente somatomedina C y valoración genética.
Imagenología
RNM: lesión focal con epicentro selar de aproximadamente 37 x 28 x 19 mm en sus diámetros L, T y AP; invade el seno esfenoidal y el seno cavernoso derecho, englobando a la arteria carótida cavernosa en la totalidad de su circunferencia. Se extiende hacia la región supraselar, comprimiendo levemente el quiasma óptico; y un componente supraselar lateralizado a derecha que engloba la arteria carótida supraclinoidea. El tallo hipofisario se encuentra comprimido superiormente y lateralizado a izquierda. Resto del estudio normal (figura 1).
Diagnóstico y tratamiento
Se diagnostica hipogonadismo hipogonadotrófico secundario a macroprolactinoma. Se inicia tratamiento médico con cabergolina 0,5 mg semanales.
Discusión
El término hipogonadismo describe la condición clínica que, como consecuencia de una alteración en cualquier punto del eje hipotálamo-hipófisis-gonadal (HHG), deriva en la producción insuficiente de testosterona y/o del número de espermatozoides por parte del testículo4,5.
De acuerdo al origen del defecto, se clasifica en hipogonadismo hipogonadotrófico (Hh) si el fallo es a nivel del eje hipotálamo-hipofisario, o hipogonadismo hipergonadotrófico cuando el fallo es de origen testicular4,5.
Una correcta evaluación permitirá orientar la naturaleza del proceso subyacente y la conveniencia de estudios complementarios4,5.
Para establecer el diagnóstico se deben determinar las concentraciones séricas de testosterona. Este se basa en concentraciones de testosterona total disminuidas (menos de 250-300 ng/dl) confirmadas en dos determinaciones realizadas en ayunas por la mañana (8:00-10:00 horas)6,7.
La determinación del nivel de LH y FSH permite establecer el origen, las concentraciones séricas normales o bajas establecen el diagnóstico de hipogonadismo hipogonadotrófico que nos conducirá a realizar un estudio completo a nivel central que incluya una RNM hipofisaria y un perfil hormonal hipofisario basal7.
La presencia de niveles elevados de prolactina (3.389 ng/dl) en este caso, orientaron a la presencia de un macroprolactinoma, etiología más frecuente dentro de las causas patológicas del área supraselar8.
El diagnóstico del prolactinoma requiere evidencia imagenológica de adenoma. La resonancia magnética con gadolinio es el mejor procedimiento de imagen para la mayoría de las masas selares y, por lo general, no es necesario realizar ningún otro estudio de imagen (figura 1)9.
Ante la existencia de una masa hipofisaria es obligatoria la evaluación de la función hormonal, ya que puede verse afectada por la compresión del tejido hipofisario sano o por la interrupción de la comunicación entre hipotálamo e hipófisis, lo que no fue evidenciado en nuestro paciente9.
Los prolactinomas generalmente son esporádicos, pero un 30% pueden asociarse a síndromes hereditarios como MEN1, que se deberá descartar con estudio genético dado el antecedente de tumor neuroendócrino a nivel gástrico2.
Las manifestaciones clínicas de los prolactinomas en la infancia o la adolescencia varían principalmente según el sexo, la edad de aparición, el tamaño del tumor y los niveles de PRL. A menudo se presentan con retraso en el desarrollo puberal e hipogonadismo o síntomas por efecto de masa1,3,10-14.
El hipogonadismo hipogonadotrópico adquirido se caracteriza por la aparición posnatal de trastornos que dañan o alteran la función de neuronas que secretan GnRH y/o células gonadotrofas pituitarias15. Se desarrolla principalmente durante o después de la pubertad, y puede ser el resultado de cualquier tipo de lesión hipofisaria o hipotalámica, incluidos los prolactinomas, como en este caso16.
Las manifestaciones clínicas dependen de la edad de aparición, gravedad y duración de la deficiencia de gonadotropina, y la existencia de otras deficiencias hormonales15.
Puede prevenir el inicio de la pubertad, aparecer durante el desarrollo puberal, aunque generalmente lo hacen después de la edad normal de desarrollo puberal15.
En nuestro caso determinó una pubertad detenida (PD) con un micropene.
Definimos pubertad detenida a aquella que no llega a completarse, transcurriendo más de 4-5 años entre su inicio y el desarrollo gonadal completo17.
El término micropene hace referencia a un falo de configuración normal, pero de longitud inferior a -2,5 DE para la edad y etnia correspondientes, que en un adulto corresponde a menos de 9,3 cm18-20.
Un Tanner III, como se observa al examen, se produce en general a una edad media de 12,6 años, (con un rango de entre los 10,7 y 14,9 años), momento en el que sospechamos se inició la alteración puberal en un paciente sin controles en salud durante su adolescencia21.
Otras manifestaciones en hombres adultos incluyen subfertilidad, disfunción reproductiva (disfunción eréctil y azoospermia no obstructiva) y características inespecíficas como reducción de vitalidad y bienestar, debilidad física, pérdida de minerales óseos, labilidad emocional y reducción de la libido16.
La disminución del volumen testicular y la masa muscular es inconsistente y sólo se produce cuando la deficiencia de gonadotropinas es duradera y grave15.
El tratamiento del hipogonadismo adquirido debe apuntar a la causa subyacente. Sin embargo, a veces persiste a pesar de la reducción o erradicación del tumor o infiltración causal, por lo que puede ser necesaria la terapia de reemplazo de andrógenos15.
En este paciente se inició tratamiento médico con agonistas dopaminérgicos, primera opción terapéutica de tratamiento de los prolactinomas. Los objetivos del tratamiento son:
a) disminuir las concentraciones de PRL y revertir la clínica;
b) reducir el tamaño tumoral;
c) restaurar la función gonadal y otros déficits hormonales hipofisarios y
d) prevenir la recurrencia y progresión tumoral.
La cabergolina es el agonista dopaminérgico (AD) de primera elección tanto por su mayor eficacia, normalización de niveles de PRL y reducción del tamaño tumoral, como por su mejor tolerabilidad. Al igual que el resto de los AD, conviene introducirla progresivamente para evitar la aparición de efectos secundarios. El tratamiento médico debe mantenerse hasta la normalización de las concentraciones de PRL (respuesta bioquímica) y la reducción del tamaño tumoral1,2,8,22.
Ocasionalmente puede ser necesario el tratamiento quirúrgico (cirugía transesfenoidal) y de forma excepcional radioterapia en caso de no respuesta al tratamiento médico1,2,8,22.
Conclusión
El abordaje diagnóstico de un paciente con hipogonadismo debe realizarse de una manera ordenada, secuencial y exhaustiva con el objetivo de descubrir la causa subyacente para realizar un correcta asistencia.
En este caso se abordó el diagnóstico de un paciente con hipogonadismo hipogonadotrópico secundario a un macroprolactinoma hipofisario, iniciado seguramente en la edad infantil y no pudiendo descartar la presencia de un MEN1 dada la asociación con un tumor neuroendócrino. Destacamos la importancia de los controles en salud durante la adolescencia, momento de gran relevancia para la detección de alteraciones en el desarrollo puberal que hubieran permitido realizar un diagnóstico precoz y tratamiento oportuno para disminuir las consecuencias de esta patología en este paciente.