Introducción
La púrpura trombótica trombocitopénica (PTT) es una microangiopatía trombótica caracterizada por anemia hemolítica y plaquetopenia, secundaria a la deficiencia adquirida en la actividad de la proteasa ADAMST131,2, y presenta una incidencia acumulada de tres casos por millón y por año3. En la literatura se menciona que hasta un 2% de los pacientes con PTT desarrolla pancreatitis aguda (PA), en tanto que la PTT secundaria a una PA es aún menos frecuente4.
Caso clínico
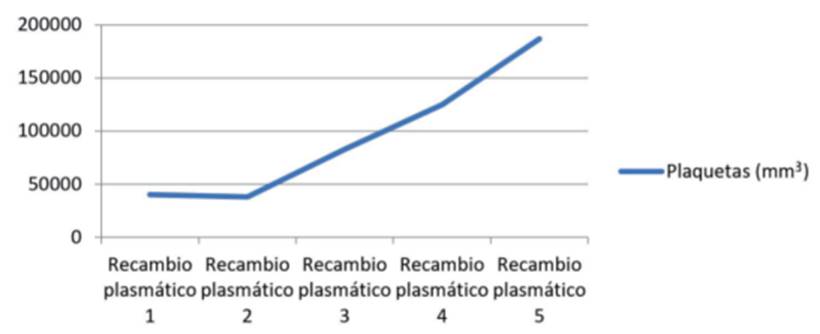
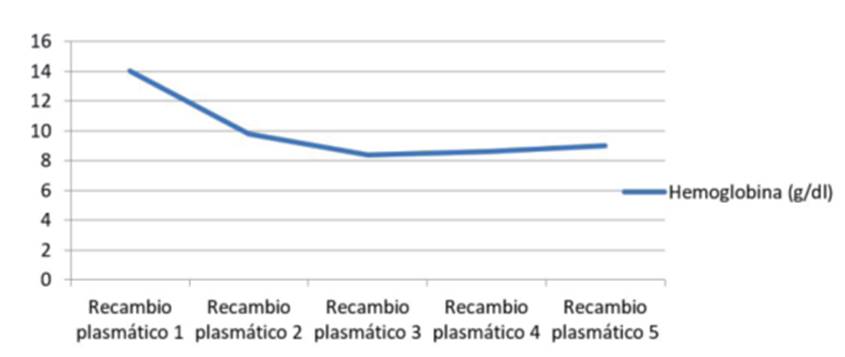
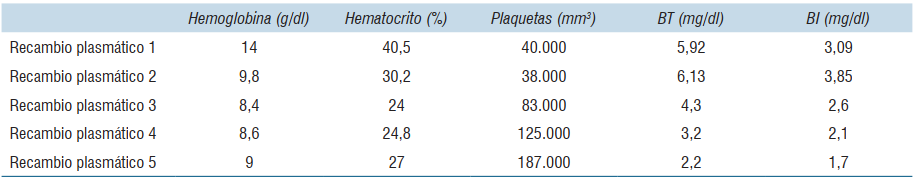
Paciente de sexo masculino de 29 años, sin antecedentes patológicos a destacar. Consulta por un cuadro de dolor epigástrico y vómitos de 5 días de evolución. Al examen físico se destaca paciente lúcido, ictericia universal de piel y mucosas, abdomen doloroso, distendido, sin elementos de irritación peritoneal. De los exámenes de laboratorio en el Servicio de Urgencia se destaca: hemoglobina (Hb): 14 g/dL, hematocrito (Hto): 40,5%, leucocitos; 10.300 mm3, plaquetas: 232.000 mm3, creatinina: 0,74 mg/dL, bilirrubina total (BT): 6,05 mg/dL, bilirrubina indirecta: 4,64 mg/dL, alanina-aminotransferasa: 187 U/l, aspartato-aminotransferasa 75 U/l, fosfatasa alcalina: 126 U/l, gammaglutamil transpeptidasa de 131 U/l, lactatodeshidrogenasa (LDH): 203 U/l, amilasa pancreática: 1469 U/l, triglicéridos: 138 mg/dl, proteína C reactiva (PCR): 14 mg/l y procalcitonina: 0,30 ng/ml. Tomografía (TC) de abdomen con contraste (figura 1) muestra un páncreas edematoso, con realce homogéneo sin áreas de necrosis. Líquido peripancreático que se extiende a las fascias pararrenales anteriores y a la curvatura gástrica; leve dilatación de la vía biliar intrahepática con un colédoco de 8 mm sin obstrucción. Ingresa a sala de cuidados moderados con diagnóstico de PA Balthazar C con un índice de severidad tomográfico (IST) de 2. A las 48 horas se constata paciente febril con 38,4oC axilar, destacándose de la analítica la presencia de anemia con Hb 9,8 g/dl y Hto 26,8%; plaquetopenia de 40.000/mm3, aumento de LDH: 1.611 U/l, ictericia con BT de 5,92 mg/dl a predominio de la bilirrubina indirecta: 3,09 mg/dl; injuria renal aguda con creatinina plasmática de 1,31 mg/dl. La lámina periférica destaca la presencia de 20% de esquistocitos. En este momento de la evolución se realiza diagnóstico de púrpura trombótica trombocitopénica (PTT), solicitándose su ingreso a la Unidad de Cuidados Intensivos (UCI) para valoración conjunta con intensivista, médico hematólogo y especialista en hemoterapia y medicina tranfusional, ante la necesidad de implementar una terapia de recambio plasmático. Al ingreso a UCI el paciente se mantiene con estabilidad hemodinámica y respiratoria. Al trastorno hepático y hematológico se asocia una injuria renal aguda KDIGO (Kidney Disease: Improving Global Outcomes) I, con máximo valor de creatinina de 1,5 mg/dl con diuresis conservada. Dosificación del complemento C3 de 98,3 mg/dl (rango normal de 91 a 190 mg/dl), hipocomplementemia C4 de 16,7 mg/dl (rango normal de 18 a 56 mg/dl), anticuerpos antinucleares negativos y anticuerpos antiácido desoxirribonucleico nativo negativos, inmunocomplejos circulantes negativos, y prueba de Coombs directa e indirecta negativas. Serología para virus hepatitis B, C, VDRL, enfermedad de Chagas y virus de la inmunodeficiencia humana negativos. Durante su estancia en UCI se realizaron 5 sesiones de recambio plasmático terapéutico y prednisona 1 mg/kg/día, con una franca mejoría del cuadro clínico con normalización de la función renal y del recuento plaquetario alcanzando un valor de 187,000 /mm3 (figura 2) y (figura 3), (tabla 1).
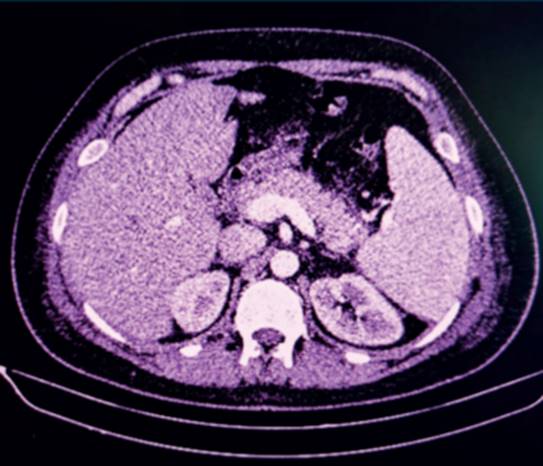
Figura 1: Tomografía de abdomen con contraste intravenoso. Páncreas aumentado de tamaño en toda su extensión sin áreas de necrosis. Alteración de la grasa peripancreática.
En suma, presentamos un paciente con PTT como complicación sistémica de una pancreatitis aguda Balthazar C, IST 2, lo que debe ser considerado como una verdadera emergencia médica que obliga a implementar una estrategia terapéutica específica multidisciplinaria, donde cobra especial jerarquía el recambio plasmático.
Discusión
La PTT es un síndrome caracterizado por anemia hemolítica y trombocitopenia, secundaria al déficit de la proteasa ADAMST13, lo cual determina la aparición de grandes multímeros plasmáticos del factor de von Willebrand y por lo tanto la agregación plaquetaria en la microcirculación lo cual es una reconocida causa de DOM. Dentro de los cuadros de PTT existe una forma inmune que está mediada por autoanticuerpos contra ADAMST13 denominada PTT inmune, que de forma característica debuta entre la cuarta y quinta década de la vida. Por otro lado, existe una forma hereditaria debida a la presencia de variantes patogénicas del gen que codifica la ADAMST13, es una forma muy poco frecuente, menos de 5%3. Es importante destacar que el PTT constituye una emergencia médica, con una elevada mortalidad de no implementarse el inicio inmediato de recambio plasmático. Dicha terapéutica se asocia a una tasa de sobrevida mayor al 90%1-4.
La PTT puede determinar lesión pancreática por trombosis microvascular e isquemia. Del mismo modo, la intensa respuesta inflamatoria determinada por la PA puede desencadenar episodios de PTT6, lo que puede deberse a la activación del complemento y liberación de multímeros del factor de von Willebrand a nivel endotelial con consumo de ADAMST13, lo que lleva a un déficit relativo del mismo7.
En la serie de casos y revisión de la literatura más grande reportada hasta el momento, con un total de 21 pacientes, en todos los casos la PA precedió la aparición de signos clínicos y de laboratorio de PTT con una mediana de 3 días, y en 17 pacientes se identificó una clara etiología de la PA predominando la causa alcohólica y litiásica en ese orden8. Recientemente se han publicado nuevos casos de PTT diagnosticada en la evolución de una PA7-10, en estos la evidencia clínica y de laboratorio de PTT apareció al día 4 del diagnóstico de PA, realizándose recambio plasmático terapéutico de forma precoz con buena evolución y remisión de la DOM9.
Con relación al cuadro clínico de la PTT en la PA, una característica distintiva es la naturaleza proteiforme de las formas de presentación. Son síntomas y signos frecuentes de esta asociación la presencia de hemorragias, infarto de miocardio, accidente cerebrovascular isquémico y convulsiones, entre otros11.
El presente caso clínico presentó un curso evolutivo bifásico: una primera fase caracterizada por la PA, y una segunda fase a partir del día 5 donde desarrolla la microangiopatía trombótica. El diagnóstico del PTT inmune se establece mediante la medición de la actividad de ADAMST13 <10% y la presencia de autoanticuerpos. Sin embargo, en la práctica clínica estos exámenes de laboratorio no están disponibles de forma inmediata, por lo que en presencia de una alta sospecha clínica (anemia hemolítica, LDH aumentada, trombocitopenia, esquistocitos en lámina periférica y prueba de Coombs negativa) el inicio inmediato de la técnica de recambio plasmático está formalmente indicado, de acuerdo con el score PLASMIC12.
En virtud de lo expuesto, el ingreso a UCI y el inicio precoz de recambio plasmático y de glucocorticoides son la piedra angular del tratamiento del PTT. Destacamos la importancia del abordaje multidisciplinaria de estos pacientes, en conjunto con intensivista, hematólogo y especialista en hemoterapia y medicina tranfusional13.
En el presente caso clínico se realizaron cinco sesiones de recambio plasmático, suspendiéndose el procedimiento al obtener un recuento plaquetario de 187.000/mm3, y presentando al alta de UCI un recuento de 217.000/mm3. La American Society of Apheresis (ASFA) recomienda discontinuar la plasmaféresis cuando se superan las 150.000/mm3 plaquetas durante al menos dos días consecutivos14, esta es la conducta más aceptada en nuestro medio. Sin embargo, otros autores recomiendan continuar con la técnica hasta obtener un recuento plaquetario normal durante al menos 72 horas. El recambio plasmático terapéutico, guiado por especialista en hemoterapia y medicina tranfusional, es una técnica que consiste en la extracción de plasma mediante aféresis y su reemplazo, de preferencia con plasma fresco congelado procedente de donante único. Se recomienda un volumen de recambio de aproximadamente 40 ml/kg14. Mediante la aplicación de esta técnica, es posible la eliminación de los autoanticuerpos que inhiben la actividad de la proteasa ADAMTS13, así como de los multímeros del factor de Von Willebrand con lo cual se evita el fenómeno de microtrombosis y la evolución a DOM11.
El inicio de terapia corticoidea en conjunto con el recambio plasmático es otro pilar en el tratamiento del PTT. Se cree que los corticoides reducen la producción de los autoanticuerpos contra la proteasa ADAMTS13 y se asocia a una reducción de las citoquinas inflamatorias16-18. Existe evidencia limitada con respecto a la dosis recomendada de glucocorticoides y su vía de administración, algunos autores la establecen en función de la severidad clínica19. En nuestro medio, solemos iniciar con prednisona a dosis de 1 mg/kg/día, como en nuestro caso clinico.
Por otra parte, existe evidencia que apoya el uso de rituximab, anticuerpo monoclonal, en la etapa aguda de la PTT adquirida sumado al recambio plasmático y corticoides20. Esta terapia se ha asociado con una menor tasa de recaídas y menor mortalidad en el seguimiento hasta 4 años comparado con pacientes que recibieron tratamiento convencional21.