Introducción
La predisposición hereditaria al cáncer de mama causada por mutaciones patogénicas de la línea germinal (MPG) representa hasta el 10% de las neoplasias malignas de mama. Estas mutaciones se han observado con mayor frecuencia en los genes BRCA1 y BRCA2, cuya prevalencia se ha estimado en 1 en 300 y 1 en 800 nacidos vivos, respectivamente1,2. Incluso las mujeres portadoras de cáncer de mama con MPG están expuestas a un mayor riesgo de desarrollar un segundo CM1,3. El riesgo especifico que confiere cada mutación se clasifica según el nivel de penetrancia genética en: alto (BRCA1, BRCA2, TP53, CDH1, PTEN, PALB2) si el aumento de riesgo es de 5 veces o más o moderado (RAD51C, RAD51D, BARD1, ATM, CHEK2, BRIP1, otros), si el aumento de riesgo es entre 2 y 5 veces1,4,5.
Para reducir el impacto del cáncer de mama en una portadora de MPG se han propuesto diferentes estrategias, algunas de las cuales ponen foco en la prevención (mastectomía o salpingooforectomía, bloqueo de estrógenos), o en la detección temprana a través del tamizaje por RM. Es un hecho conocido que hasta el 60% de las mujeres portadoras de MPG no optan por la mastectomía reductora de riesgo6-8 y por consiguiente se les recomienda ingresar a un programa de seguimiento con RM para promover la detección temprana de un eventual cáncer.
Las guías internacionales proponen, para pacientes con riesgo de vida acumulado de cáncer de mama mayores de 20%-25% (según los modelos de Gail and Tyrer Cuzick)9,10 y que no fueron sometidas a mastectomía el siguiente esquema de seguimiento: screening anual de mamas con RM con contraste para mujeres de 25 a 29 años; combinación de mamografía y RM de mama con contraste anual para mujeres de 30 a 75 años)11,12.
La RM de mamas se impuso como la mejor herramienta de diagnóstico precoz13-15 observándose una mayor sensibilidad (77%-94%) al compararla tanto con la mamografía (33%-59%)16 como con la ecografía (33%-65%)12,17,18. Además, la RM redujo el riesgo de mortalidad en mujeres con riesgo de cáncer de mama aumentado19. Sin embargo, la especificidad de la RM es menor a la mamografía12,14,20 y muchas veces lleva a biopsias de mama innecesarias.
El objetivo de este estudio fue analizar un grupo de mujeres portadoras de MPG, identificando las diferentes opciones respecto a cirugía reductora, cumplimiento del screening por RM, número de cánceres detectados y cantidad de biopsias innecesarias.
Material y método
Este estudio observacional retrospectivo incluyó mujeres seleccionadas a través de la información recopilada de nuestra base de datos de neoplasias oncológicas hereditarias. Las mujeres recibieron asesoramiento genético pre y postest y un informe médico recomendando un plan de seguimiento y estrategias de prevención detalladas, de acuerdo al perfil de riesgo específico.
Los criterios para la inclusión en el estudio fueron los siguientes: mujeres portadoras de MPG de cualquier gen de susceptibilidad de CM cuya mutación haya sido diagnosticada entre 2015 y 2019, con consentimiento informado firmado de acuerdo con la declaración de Helsinki de 1975, revisada en el 2000.
Las pruebas genéticas se realizaron a través de Invitae Common Hereditary Cancer Panel (Invitae, California), Color Hereditary Cancer Test (Color Genomics, California), o mediante secuenciación de Sanger en el caso de una mutación familiar previamente conocida.
Los datos de seguimiento de las pacientes se obtuvieron mediante contacto telefónico.
A todas las mujeres que decidieron no someterse a una mastectomía de reducción de riesgo se les recomendó que ingresaran a un programa anual de screening con RM de mama, siguiendo con el protocolo de detección temprana vigente en ese momento. El seguimiento fue realizado con RM de mama con o sin mamografía asociada. Cuando la RM de mama detectó lesiones BI-RADS 4 o 5, el protocolo seguido fue realizar una ecografía de second look y una biopsia con aguja gruesa. Aquellas imágenes sospechosas que confirmaron su malignidad en la biopsia fueron definidas como positivo cierto. Un resultado positivo de RM con una biopsia benigna se definió como falso positivo. El seguimiento se cuantificó en unidades mujeres-años, es decir multiplicando el número de mujeres seguidas por el número de años que se siguió cada una.
Resultados
Se reclutaron 134 mujeres mutadas que cumplían los criterios de inclusión y las mismas fueron seguidas durante un período promedio de 23,3 meses. La edad promedio de diagnóstico de MPG fue de 42,5 años.
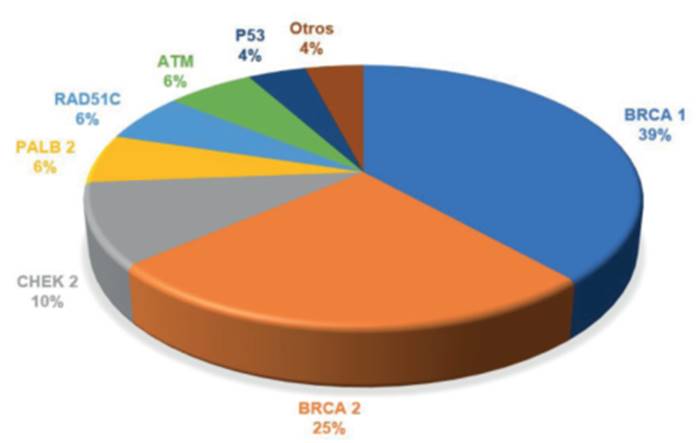
Las mutaciones encontradas en las 134 mujeres se distribuyeron en tercios entre genes BRCA1, BRCA2 y genes no BRCA (figura 1).
La (figura 2) muestra los diferentes caminos seguidos por las 134 mujeres. Veintiséis pacientes optaron por una mastectomía de reducción de riesgo y 21 se perdieron en el seguimiento (no pudieron o no quisieron ser contactadas). Entre las 87 mujeres restantes, 14 no se derivaron al programa de cribado por ser muy jóvenes o debido a que se encontraban cursando un cáncer en etapa avanzada. Las restantes 73 pacientes recibieron una carta con la recomendación de ingresar al programa de cribado anual por RM. Sólo 47 portadoras de MPG (64%) ingresaron finalmente a dicho programa.
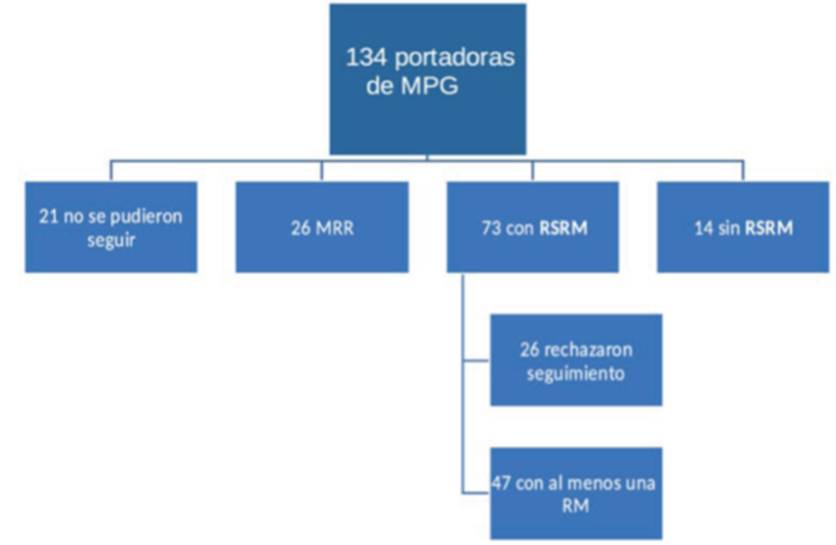
Figura 2: Opciones de seguimiento de las mujeres portadoras de MPG incluidas en este estudio. MRR: mastectomía reductora de riesgo; RSRM: recomendación seguimiento con RM
La distribución de los genes mutados en las 47 pacientes evaluadas por RM se puede observar en la (figura 1).
Veintiseis mujeres no entraron en el programa de screening, 75% de ellas portadoras una mutación BRCA 1 o 2. Las razones que las llevaron a rechazar el screening anual por RM sugerido fueron las siguientes: los médicos tratantes no estuvieron de acuerdo en recomendar la RM en 14 casos (53%), la paciente no estuvo de acuerdo en 10 casos (38%), y la paciente no tenía recursos económicos para acceder a la RM en dos casos (9%).
Entre las 47 mujeres mutadas seguidas por RM, el 57,4% había sido tratado previamente por CM.
Se completaron 91,3 mujeres-años de seguimiento (1,94 años x 47 mujeres) y se diagnosticó con CM a una portadora de BRCA1.
Por otra parte la RM fue informada BIRADS 4 y condujo a una biopsia mamaria con histología benigna (innecesaria) en cinco casos.
Discusión
Las mutaciones patógenas en genes de susceptibilidad confieren a las portadoras un riesgo de desarrollar cáncer de mama a lo largo de la vida de entre 41% y 90% dependiendo de su penetrancia1-4.
Este estudio retrata una cohorte de 134 pacientes portadores de MPG (BRCA y no BRCA) a quienes se efectuó un seguimiento promedio de 23,3 meses. Describe las diferentes opciones de seguimiento que se tomaron y el motivo de su elección. También se presentan los principales resultados obtenidos de los pacientes que accedieron al seguimiento con RM.
El porcentaje de portadoras que optaron por la cirugía de reducción de riesgo en los 12 meses posteriores a conocer un resultado positivo del test genético fue del 23%, lo que concuerda con estudios publicados en la literatura21. Es un hecho conocido que entre la población de mujeres portadoras de una MPG que les confiere un riesgo moderado o alto de desarrollar cáncer de mama a lo largo de su vida, sólo una minoría accede a efectuarse una mastectomía reductora de riesgo, mientras que la mayoría opta sólo por el seguimiento con RM combinado o no con otras medidas de reducción de riesgo como la salpingoooforectomía o el tamoxifeno.
Sin embargo, no todas las mujeres que rechazan la mastectomía se adhieren a un plan personalizado de seguimiento con RM. En nuestra serie, entre las mujeres candidatas a integrar el programa de seguimiento, dos tercios aceptaron la recomendación de RM anual, un porcentaje mucho mayor que el reportado por otros autores22,23.
La pobre adherencia de las pacientes con alto riesgo de cáncer de mama no es un hecho nuevo y si bien numerosos estudios reportan tasas de adherencia menores al 25%22,23, pocos de ellos analizan las barreras que explican los motivos de estos bajos porcentajes.
Un estudio en mujeres militares estadounidenses23 (donde no hay barreras económicas al acceso a la RM) mostró que un 20% de las mujeres que no adherían a la recomendación de seguimiento con RM lo hacían porque cuestionaban la indicación y un 8% porque recibían información contradictoria de su proveedor de salud.
Sin embargo en nuestro estudio este porcentaje es llamativamente más elevado ya que más de la mitad de las mujeres que no aceptaron la recomendación de entrar en el programa de seguimiento con RM, no lo hicieron por recomendación de su médico tratante (mastólogo, oncólogo o ginecólogo). Esto sucedió a pesar de que se envió en cada caso una carta dirigida al profesional, en la cual se detallaban las recomendaciones de seguimiento personalizadas, basadas en las pautas internacionales.
En cuanto a la incidencia de cáncer de mama, numerosos estudios han reportado la incidencia de cáncer de mama en pacientes mutadas en seguimiento con RM24,25, siendo el más importante el MRISC24, estudio neerlandés que incluyó 2.275 mujeres con predisposición genética al cáncer de mama, de las cuales 599 eran portadoras de mutación de elevada penetrancia (BRCA1, BRCA2, TP53, PTEN), con un seguimiento promedio de 4 años y que logró totalizar 8.760 mujeres-años de riesgo. En dicho estudio, la tasa global de detección de cánceres fue de 11,1 cada 1.000 mujeres-años de riesgo pero en las subpoblación de mujeres mutadas fue de 22,5 cada 1.000 mujeres-años de riesgo.
En nuestra serie, compuesta íntegramente por mujeres mutadas, entre las que entraron en el programa de tamizaje con RM se encontró solamente un caso de CM, resultando en una incidencia de cáncer de 11 cada 1.000 mujeres-años de riesgo. Si asumimos que cada mujer se hace en promedio una RM por cada año de riesgo, quiere decir que se precisarían 1.000 resonancias para detectar 11 cánceres de mama.
La menor incidencia detectada en nuestro estudio, comparada con el MRISC, puede tener dos explicaciones:
- La primera es que, a diferencia de las mujeres mutadas en el ese estudio, nuestra población de mujeres no era portadora sólo de variantes alta penetrancia sino que también tenía MPG de moderada penetrancia.
- La segunda es la menor escala de nuestra serie, con un periodo de seguimiento más corto (23,3 meses), habiendo totalizado 91,2 mujeres-años de riesgo.
Aunque las principales debilidades de este estudio se pudieron encontrar en el relativamente pequeño tamaño de la población sometida a screening por RM y el corto período de seguimiento, podemos concluir que en nuestro programa de seguimiento con RM de pacientes mutadas, si bien se logró un porcentaje de adherencia mayor al esperado, en muchos casos la recomendación de adherencia al plan de seguimiento no es aceptada por el médico de cabecera de la paciente.
Estos resultados señalan la necesidad de reforzar en la población médica la información sobre los beneficios de un seguimiento personalizado en pacientes de alto riesgo de cáncer de mama.
Un seguimiento más prolongado, así como futuras investigaciones que involucren tanto a un mayor número de pacientes como a diferentes poblaciones, nos permitirán llegar a conclusiones más sólidas.