Introducción
La hemofilia es una enfermedad hemorrágica hereditaria con transmisión recesiva ligada al cromosoma X, causada por un déficit del factor VIII o IX de la coagulación según se trate de hemofilia A o B, respectivamente1,2.
Se estima que la frecuencia del déficit de FVIII es de 24,6 por cada 100.000 nacimientos de varones y en el caso de déficit de FIX es de 5 por cada 100.000 nacimientos de varones3.
Se clasifican de acuerdo a los niveles del factor deficiente en: leves entre 5% a 40%, moderadas entre 1% a 5% y severas menor al 1% de factor deficiente respectivamente. Dentro de la hemofilia A, el 55% son leves, mientras que un 10% son moderadas y un 35% severas.
Los pacientes con hemofilia severa son propensos a presentar sangrados espontáneos frecuentes, particularmente en articulaciones y músculos2. Estos sangrados articulares recurrentes (hemartrosis) afectan preferentemente rodillas, codos, tobillos y hombros generando una hipertrofia de la sinovial por un proceso de reabsorción de la sangre depositada produciendo un círculo vicioso de hemartrosis e hipertrofia. A su vez la toxicidad del hierro en la articulación genera un proceso inflamatorio que resulta en una afectación progresiva del cartílago articular. Ambas causas generan la destrucción de las articulaciones en forma precoz con limitación del movimiento, dolor y deformación característica de la artropatía hemofílica4-8
En estos pacientes, debido al déficit de factor VIII o IX de la coagulación, encontramos en las pruebas de laboratorio una prolongación del tiempo de tromboplastina parcial activado (APTT), utilizado para valorar las alteraciones de la vía intrínseca del sistema de la coagulación constituyendo una prueba sensible a la disminución de los factores implicados en esta vía (entre ellos FVIII y FIX)9,10. De todas formas, esta sensibilidad es dependiente del reactivo utilizado (distintos orígenes y concentraciones de fosfolípidos y tipos de activadores), así como del equipo empleado para la lectura11-13 por lo que se convierte en una prueba parcialmente orientadora en el seguimiento de estos pacientes14. La determinación del factor deficiente y la eventual búsqueda de un inhibidor adquirido específico de factor, son las herramientas de laboratorio esenciales para el diagnóstico y seguimiento, sobre todo en los casos severos.
La terapia de reemplazo del factor en déficit (VIII o IX) con concentrados comerciales derivados del plasma o recombinantes genéticamente modificados siguen siendo la terapia más utilizada en estos pacientes.
El tratamiento de reemplazo con concentrados de factor se considera “a demanda” cuando se utiliza solo para episodios hemorrágicos y “profilaxis” cuando se basa en la prevención del sangrado2. La profilaxis ha demostrado ser efectiva en la prevención de las hemartrosis en pacientes con hemofilia y es considerada como el gold standard de tratamiento por la Organización Mundial de la Salud (OMS) y la Federación Mundial de Hemofilia (FMH)2,15. El incremento en la utilización de profilaxis ha determinado nuevas definiciones. Para el PEDNET Group16 existen tres tipos de profilaxis :
1. Primaria: tratamiento regular y continuo con factor de la coagulación, luego del primer sangrado articular y antes del segundo año de vida.
2. Secundaria: tratamiento regular y continuo con factor de la coagulación, luego del segundo año de vida y de la segunda o más hemartrosis.
3. Terciaria: se aplica sólo a adultos de forma intermitente por periodos menores de 45 semanas al año.
Existen también diferentes regímenes de profilaxis en relación a las dosis de factor administrado tales como el Protocolo Malmö, el Protocolo Holandés y el Protocolo Canadiense (oscilan entre las 15-50 UI/kg/ dosis entre 1 y 3 veces por semana)16.
Actualmente los regímenes de profilaxis ajustados a la medida del paciente (actividad desarrollada, fenotipo de sangrado del paciente, etcétera) son cada vez más utilizados.
Evidencia reciente sugiere que, a pesar de la existencia de artropatía, la profilaxis terciaria ofrece beneficios en adultos debido a la disminución en la tasa anual de sangrados y del ausentismo laboral, mejorando así la calidad de vida de estos pacientes. Además, la profilaxis también previene sangrados potencialmente mortales como la hemorragia intracraneana17.
En países con limitaciones económicas, los datos sobre esta modalidad de tratamiento son escasos y debido a que resulta dificultoso poder aplicar los regímenes de profilaxis antes indicados por los costos que esto implica, se están evaluando regímenes con dosis bajas de factor VIII (10 UI/kg bisemanal)18. En nuestro país un número importante de pacientes adultos no recibieron profilaxis primaria ni secundaria a lo largo de su vida. En este sentido, a partir de 2007 se comienza con una experiencia de profilaxis terciaria, con concentrado de factor VIII comercial plasmático en pacientes adultos con hemofilia A severa.
Una de las mayores complicaciones del tratamiento con factores de la coagulación es la aparición de inhibidores, son anticuerpos de tipo IgG que neutralizan el FVIII/FIX, su presencia debe ser sospechada ante una mala respuesta al tratamiento y es confirmada por pruebas de laboratorio (rastreo y titulación de inhibidor).
La incidencia acumulativa de desarrollar un inhibidor en el caso de la hemofilia A grave está en el rango del 20% al 40% y aproximadamente del 5% al 10% en casos de hemofilia leve o moderada, mientras que en la hemofilia B es menor al 5%. La mayor incidencia de formación de inhibidores ocurre durante los primeros 20 días de exposición al factor administrado. En el caso de niños que inician la profilaxis tempranamente, la mayoría de los inhibidores aparecerán entre el primer y el segundo año de edad. Un segundo pico de formación de inhibidores tiene lugar a una edad avanzada19.
En Uruguay, de acuerdo a su población de 3,4 millones de habitantes aproximadamente, se estima un total de 300 pacientes con Hemofilia. El Hospital de Clínicas “Dr. Manuel Quintela”, centro de atención de pacientes portadores de hemofilia, tiene registrados aproximadamente 100 pacientes de los cuales 27 presentan hemofilia A severa. Muchos de estos pacientes no recibieron profilaxis primaria ni secundaria. Desde que se inició la profilaxis terciaria, 19 pacientes reciben este tipo de tratamiento en diferentes modalidades. Sin embargo, aún no se dispone de estudios que determinen si esta terapéutica está siendo correctamente administrada, o si podría optimizarse para un mejor aprovechamiento de la misma.
Objetivos
Objetivos primarios
- Determinar el porcentaje de pacientes que logran mantener una adecuada profilaxis (mantener niveles de FVIII mayores a 1% en todo momento) con el régimen actualmente empleado.
- Conocer si la profilaxis utilizada logró una mejora en la independencia funcional de los pacientes, empleando un score validado para dicho fin.
Objetivos específicos
- Comparar la tasa de sangrado anual pre y posinicio de la profilaxis.
- Determinar la variación del consumo de FVIII anual pre y posinicio de la profilaxis.
- Evaluar la necesidad de realizar ajustes en el plan de profilaxis de acuerdo con los niveles de FVIII alcanzados.
- Describir la incidencia de aparición de inhibidor de FVIII luego de instalada la profilaxis.
Material y métodos
Se realizó un estudio observacional, analítico, en uno de los centros de atención de pacientes adultos con coagulopatías congénitas.
Muestras
Se incluyeron a todos los pacientes con hemofilia A severa que asistían a control en el Hospital de Clínicas “Dr. Manuel Quintela” durante 2020 y se encontraban en plan de profilaxis con FVIII plasmático en los últimos 12 meses al momento del estudio, previo otorgamiento del consentimiento informado.
Se obtuvieron tres tomas de muestra de cada paciente:
- A la hora de infundido el factor VIII (pico).
- A las 24 horas de recibido el factor FVIII (basal 1)
- Antes de la siguiente dosis de factor FVIII, que será a las 48 o 72 horas según el plan de profilaxis del paciente (basal 2).
El n es de 8 pacientes.
Se incluyeron en este estudio a todos aquellos pacientes hemofílicos A severos bajo profilaxis terciaria con FVIII de tipo plasmático, que la recibieron menos de 45 semanas al año, mayores de 18 años y que tuvieran la voluntad de participar en este proyecto, otorgando su consentimiento informado escrito.
Se excluyeron a todos aquellos pacientes que no quisieran participar del proyecto, y a aquellos que interrumpieron por cualquier período de tiempo y por cualquier causa el régimen de profilaxis establecido por el equipo tratante y que no contaban con historia clínica previa.
Se solicitó autorización a la Dirección del Departamento de Laboratorio de Patología Clínica y al Departamento y Cátedra de Hemoterapia y Medicina Transfusional, así como la aprobación del presente proyecto al Comité de Ética del Hospital de Clínicas.
Se obtuvo en todos los casos el consentimiento informado (anexo 1) firmado, donde se garantizó que el paciente ha expresado su voluntad de participar.
Recolección de datos
Se analizaron las siguientes variables:
- Dosis de FVIII infundido (UI/kg): cantidad de UI de FVIII que el paciente está recibiendo por kilo de peso corporal.
- Plan de profilaxis: régimen empleado para administrarse la profilaxis semanalmente.
- Régimen bisemanal: administración de FVIII 2 veces por semana.
- Régimen trisemanal: administración de FVIII 3 veces por semana.
- Niveles de FVIII (UI/dl) alcanzados con la profilaxis: nivel de FVIII que alcanzó el paciente con el plan de profilaxis. El mismo se midió mediante la dosificación de FVIII en plasma en tres oportunidades: a la hora de administrado (pico), a las 24 horas de administrado el factor (basal 1) y a las 48 o 72 horas previo a la siguiente dosis de factor según régimen de tratamiento bi o trisemanal, respectivamente (basal 2).
- Episodio de sangrado: cualquier episodio hemorrágico que el paciente presente, ya sea traumático o espontáneo, así como muscular o articular, que haya sido constatado de forma clínica por el médico tratante o mediante estudios de imagen. Se evaluarán dos períodos: bajo régimen de profilaxis con FVIII y previo a la profilaxis. Los datos se extrajeron de la historia clínica de cada paciente.
- Independencia funcional: actividades de la vida cotidiana que el paciente es capaz de realizar. Se evaluó mediante el Functional Independence Score in Hemophilia (FISH)20, que mide 8 ítems: comer y arreglarse, bañarse, vestirse, sentarse, agacharse, subir escaleras, caminar, correr; donde cada ítem se puntúa de la siguiente forma:
1. El sujeto no puede realizar la actividad o necesita asistencia completa para realizarla.
2. El sujeto necesita ayuda parcial o instrumentos modificados o entornos modificados para realizar la actividad
3. El sujeto puede realizar la actividad sin ayuda ni asistencia, pero con una ligera molestia. No puede realizar una actividad similar a la de sus compañeros sanos.
4. El sujeto puede realizar la actividad sin ninguna dificultad, similar a sus compañeros sanos.
El score de FISH tiene un puntaje total entre 8-32 puntos y se aplicó para valorar la independencia funcional antes de la profilaxis y con la profilaxis. Se llevó a cabo mediante un cuestionario a cada paciente.
Las variables antes mencionadas se recolectaron en una planilla por cada paciente diseñada para este fin.
Recolección de muestras de sangre venosa periférica
Las muestras de sangre periférica se tomaron por punción venosa según las normas de la CLSI21, en tubo con citrato de sodio al 3,2% y en tubo seco.
Para determinación de FVIII coagulante y APTT se recolectó la sangre en tubo con citrato de sodio al 3,2% de 2,7 mililitros, en tres oportunidades: pico, basal 1 y basal 2 como se mencionó previamente.
Es importante destacar que tanto la primera muestra de sangre venosa periférica, así como la tercer (pico y basal 2), se tomaron el día que la persona concurrió a recibir la profilaxis, y sólo debió concurrir de forma adicional para la segunda toma de sangre (basal 1).
Las muestras fueron obtenidas por personal calificado para el procedimiento: técnicos en hemoterapia o licenciado de laboratorio, siguiendo las recomendaciones de bioseguridad y de buenas prácticas de la CLSI.
Procesamiento de las muestras
Las muestras fueron centrifugadas a 3.500 rpm por 10 minutos a temperatura ambiente. De esta manera se obtuvo plasma citratado pobre en plaquetas (PPP) de los tubos con citrato de sodio. El plasma obtenido fue separado precozmente (antes de las 4 horas) y se procedió a conservar en alícuotas a -70ºC hasta su procesamiento. Al momento de la utilización, se descongeló rápidamente a baño a 37°C y se procesó dentro de las primeras 2 horas22-24.
A todos los plasmas se les determinó el APTT y FVIII coagulante, en forma paralela utilizando un coagulómetro automatizado BCS XP System (Siemens) utilizando los siguientes reactivos: Pathromtin SL (Siemens) para realización de APTT y Coagulation Factor VIII Deficient Plasma (Siemens) para determinación de FVIII. Previo al procesamiento de las muestras se realizó mantenimiento, calibración y control según recomendaciones del fabricante25. A su vez, a las muestras basal 1 de todos los pacientes se les realizó screening para detección de inhibidores.
Análisis estadístico
Para el análisis de los datos se utilizó Microsoft Excel 2016 y paquete estadístico de SPSS.
Se correlacionaron el número de episodios de sangrado pre y posprofilaxis. Se utilizó para ello el test de Student.
Se tomó como “Mejora del score de independencia funcional” el incremento de al menos 1 punto en cada categoría del score FISH. Se utilizó para valorar la correlación el test de Student.
En todos los casos consideramos significativo un valor de p <0,05.
Aspectos bioéticos del estudio
El presente proyecto se presentó para su evaluación y aprobación por el Comité de Ética del Hospital de Clínicas “Dr. Manuel Quintela”.
Todos los pacientes recibieron información detallada de forma verbal y por escrito, de las características del proyecto y de la confidencialidad de los resultados (se especificó quiénes tendrán acceso a los datos) y se les proporcionó un teléfono de contacto en caso que surjan dudas con respecto al proyecto y sus resultados.
Resultados
Se incluyeron en este estudio todos aquellos pacientes que cumplían los criterios de inclusión, accediendo a participar del mismo, con firma de consentimiento informado.
Se evaluaron 19 pacientes, de los cuales ocho cumplieron con los criterios de inclusión, correspondiendo al 42% (ocho de 19) de los pacientes con HAS que reciben profilaxis terciaria en la institución.
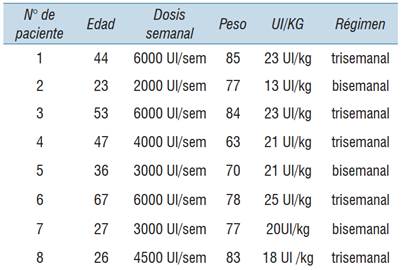
Todos los pacientes incluidos son del sexo masculino, y sus edades se encuentran en un rango de 23 y 67 años, con un promedio de 40 años (tabla 1).
Todos los pacientes se encuentran en profilaxis terciaria, con dosis que van de 13-25 UI/kg con un promedio de 20.5 UI/kg (dosis intermedia en los esquemas actuales de profilaxis 20 a 30 UI/kg). Un paciente recibió una dosis de FVIII más alta (25 UI/kg) dado que tiene como antecedente una hemorragia intracraneana (tabla 1).
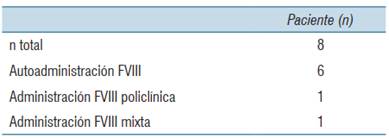
De los ocho pacientes, seis realizan la profilaxis en domicilio, un paciente en policlínica y un paciente la realiza de forma mixta (tabla 2).
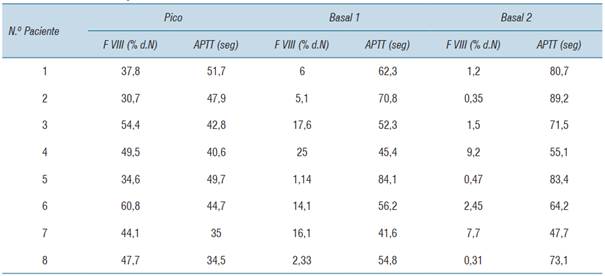
En todos los casos se obtuvieron las mediciones de factor VIII para cada uno de los basales (1 y 2 como fue definido en el diseño del estudio) y en el pico, como se describe en la (tabla 3).
Si tomamos en cuenta los basales, excluyendo el basal 1, cinco de los ocho pacientes cumplen con el objetivo del factor VIII por encima de 1% (pacientes 1,3,4,6,7).
Todos los pacientes (8/8) presentaron valores de FVIII superiores al 1% en las muestras obtenidas como basal 1. Dicho basal es el único valor de los determinados en este estudio que está estandarizado en su medición, ya que se midió en todos los pacientes a las 24 horas de infundido el factor. Para el basal 2 depende del régimen de profilaxis del paciente, el momento en que se determinó el mismo.
Todas las muestras obtenidas luego de 1 hora de infundido el factor lograron niveles hemostáticos del mismo, superiores a 30%.
Los cambios en la independencia funcional durante el tratamiento a demanda versus profilaxis, fueron evaluados mediante la aplicación del score de FISH, que estuvo disponible para todos los pacientes.
De los ocho pacientes evaluados, cinco mejoraron al menos 1 punto el score, mientras que tres de ellos mantuvieron el mismo puntaje. Ningún paciente mostró una peoría del puntaje en relación a capacidad funcional.
El score de FISH mejoró pasando de un valor promedio 22,3 (rango 17-29) en el tratamiento a demanda a un promedio de 24,1 (rango 18-29) en el periodo bajo profilaxis (p=0,026).
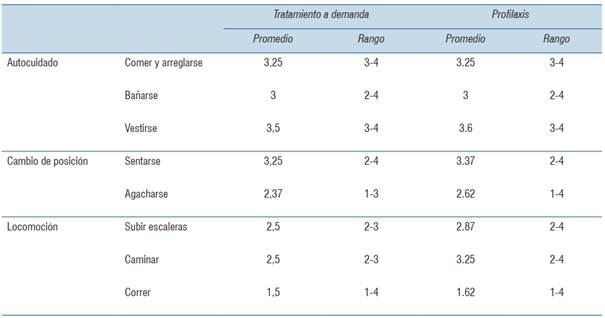
De los ítems evaluados, los que mostraron incremento fueron “locomoción”, dentro de esta, el ítem “caminar” mostró una mejoría, al igual que “subir escaleras”. El ítem de autocuidado no presentó cambios en comparación con ambos períodos. Las tareas que mostraron menor puntuación son las que generan mayor dificultad para realizar, como correr y agacharse (tabla 4).
En relación a los episodios de sangrados se evaluó un periodo similar a un año en cada paciente: previo al inicio de la profilaxis (FVIII a demanda) y bajo régimen de profilaxis con factor VIII.
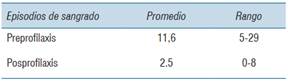
En el periodo donde solo se utilizó tratamiento a demanda, se registraron entre 5 y 29 episodios de sangrados ya sea articular o muscular, con un promedio de 11.6 episodios. Para el tratamiento de dichos sangrados se utilizó un total de 3490.00 UI de FVIII (rango 20.000-108.000 UI de FVIII anuales/paciente). Como se mencionó previamente un paciente presentó un episodio de sangrado intracraneano.
Del total de episodios de sangrado durante la profilaxis, se constató una disminución de 4.76 veces, con un promedio de 2,5 episodios (rango de 0-8) con respecto a los episodios en el período de FVIII a demanda (p= 0,019) (tabla 5).
Durante el periodo de profilaxis, 3 pacientes no presentaron sangrados, en tanto que 4 pacientes tuvieron menos de 5 episodios y un paciente presentó la misma cantidad de episodios de sangrados en ambos períodos (8 vs 8), siendo éste, quien recibió la dosis menor de UI de FVIII semanalmente (13 UI/Kg).
El consumo total de UI de FVIII para el período de profilaxis fue de 1.794.000 UI, lo que implica un aumento de 5,1 veces el consumo de UI de FVIII utilizado para tratamiento de sangrados pre profilaxis (1.794.000 UI vs 349.000 UI respectivamente.
En ninguno de los pacientes estudiados se detectó la presencia de inhibidor de FVIII (datos no mostrados).
Limitaciones del estudio
Una de las limitaciones que presenta este trabajo es el tamaño de la muestra que fue de ocho pacientes, si bien es una muestra pequeña, corresponde al 42% de pacientes que se encuentran bajo profilaxis terciaria en nuestra institución. Una segunda limitación es no haber podido evaluar los cambios en cuanto a los efectos que la profilaxis tiene en el retraso evolutivo a la artropatía severa, valorada por el score radiológico de Petterssen. Sería importante poder evaluar en estudios posteriores ya que la mejora en el score FISH se correlaciona pobremente con los cambios del score de Petterson, sobre todo en adultos con artropatía severa.
Discusión
En los países desarrollados la profilaxis con factores de la coagulación es recomendada para pacientes adultos, esta recomendación se basa en que disminuye el número de episodios de sangrados, mejora la capacidad funcional lo que mejoraría la calidad de vida. Sin embargo, en los países en vías de desarrollo la costo-efectividad de esta modalidad de tratamiento, debido al incremento de costos directos que se produce por el aumento en los requerimientos de factores de la coagulación comerciales y su disponibilidad limitada, genera controversia, sobre todo en pacientes con artropatía severa establecida donde los beneficios específicos sobre las mismos son discutidos.
En Uruguay los pacientes pediátricos reciben profilaxis casi en su totalidad, pero en la población de pacientes adultos, aunque se viene incrementando anualmente, todavía es reducido el número de pacientes que reciben profilaxis terciaria.
Del análisis de los datos obtenidos, se observó una reducción estadísticamente significativa de los episodios de sangrado en el periodo que recibieron tratamiento profiláctico con FVIII de 4,76 veces cuando se comparó con el periodo de tratamiento a demanda (previo al inicio de la profilaxis), pasando de un promedio de 11,9 episodios anuales a 2,5 (p= 0,019).
En otras publicaciones, como la realizada por Valentino y colaboradores26, Collins y colaboradores27 y Manco Johnson28 obtuvieron resultados similares con una reducción de la tasa de sangrado anual durante la profilaxis en comparación al tratamiento a demanda.
Esta reducción de la tasa de episodios de sangrado anual y la consiguiente disminución del dolor, se acompañó de una mejoría significativa en la independencia funcional de los pacientes, lo que se tradujo en los cambios en sentido positivo registrados en el score FISH (p=0,026). Los cambios fueron apreciados por los pacientes como una mejoría en su calidad de vida.
Los ítems que mayor impacto positivo tuvieron con la profilaxis, están vinculados a la sección locomoción, donde caminar y subir escaleras fueron los que registraron mayores cambios positivos.
Los pacientes incluidos no presentaron otros tratamientos (sinovectomías, y otras intervenciones quirúrgicas) que pudieran contribuir a la mejoría de la artropatía hemofílica la cual se reflejaba en los ítems valorados en score FISH.
Se registró un incremento en el consumo en UI de FVIII cuando se compararon ambos períodos de tratamiento, pasando de 349.000 UI FVIII en el período a demanda a 1.794.000 UI de FVIII en el período de profilaxis, o sea un incremento de 1.445.000 UI, lo que representó un consumo de 5,14 veces más de UI de concentrado de factor comercial cuando se utilizó el régimen de profilaxis.
Este aumento del consumo de FVIII era esperable y se ha visto en otros trabajos similares. Hua y colaboradores29, quienes hacen referencia a un aumento del costo en el régimen de profilaxis sin especificar cuan mayor es, dado que no era objetivo del estudio. El incremento constatado en nuestro estudio, fue aproximadamente el doble de consumo de lo observado en los trabajos publicados.
En cuanto a la medición de FVIII se observa que tres de ocho pacientes mantuvieron valores mayores al 1% del nivel de factor VIII en todo momento, tomando en cuenta todos los basales. Sin embargo, tanto el basal 2 no está estandarizado en cuanto a su medición y la toma del factor, dichas variables dependen del régimen de tratamiento de cada paciente. Es por esto, que el basal 1 es el valor más representativo a analizar, ya que fue medido en todos a las 24 horas de haber recibido el factor. Analizando el basal 1, se destaca que todos los pacientes presentaron niveles aceptables de FVIII (mayor a 1%) en este basal. Ya que este nivel no pudo ser mantenido en el tiempo en algunos casos (basal 2), sugiere que se debe estudiar un cambio de esquema de administración de factor en estos pacientes. Está ampliamente estudiado que la farmacocinética del factor administrado es muy variable según el paciente, Collins y colaboradores25) demuestran en su estudio que no solo hay diferencias en la farmacocinética por la edad, sino por grupos de pacientes, por lo que además de la individualización de la terapia, se recomienda el estudio farmacocinético del fármaco para cada paciente para un mejor aprovechamiento de la terapéutica. Esto no fue evaluado en nuestro estudio ya que el objetivo de este trabajo fue evaluar el comportamiento de la profilaxis en distintos momentos mediante la determinación de los niveles de FVIII. En futuros estudios, se podría evaluar la farmacocinética con el objetivo de realizar una profilaxis ajustada e individualizad a cada paciente.
Con respecto a las otras muestras obtenidas como basal 2, como ya se mencionó, la distancia temporal entre la toma de la muestra y la aplicación de la profilaxis no es constante en todos los pacientes y depende del régimen que reciban (dos o tres veces por semana), lo cual explicaría las diferencias encontradas.
Igualmente, como se observa en la (tabla 2), todos los pacientes en algún momento (al menos en un basal) obtuvieron un nivel de factor VIII superior a 1%, esto es importante ya que si bien no es constante en algún momento se alcanza el objetivo, lo cual es mejor que no recibir ningún tipo de profilaxis.
Destacamos positivamente que ningún paciente presenta inhibidor de FVIII, lo que permite continuar implementando esta terapéutica sin otras complicaciones, si bien en la bibliografía está documentado que entre el 25% al 40% de los pacientes con hemofilia A severa presentan inhibidor del FVIII durante el tratamiento, que se suele manifestar dentro de los 50 primeros días de tratamiento30.
Conclusiones
Este es el primer trabajo realizado en Uruguay sobre los efectos de profilaxis terciaria con FVIII sobre reducción en el número de episodios de sangrado e independencia funcional de los pacientes con hemofilia.
Este estudio demuestra que el régimen de profilaxis terciaria con dosis intermedias (20 UI/kg) en pacientes adultos con artropatía severa fue beneficioso en reducir la tasa de sangrados anuales y mejorar su capacidad funcional, y a pesar de que no se evaluó en nuestro estudio, los pacientes percibieron en su mayoría que también mejoró su calidad de vida.
Se valoró el nivel de FVIII alcanzado con la profilaxis. Si bien no se logró el nivel objetivo de FVIII mayor al 1% en el total de los pacientes, la reducción en la tasa de sangrados fue significativa en la mayoría de los pacientes.
Tomando en cuenta este trabajo se podrán realizar modificaciones en los esquemas de profilaxis para lograr una mayor respuesta en aquellos que no alcanzan el objetivo terapéutico.
No se detectó la presencia de inhibidor de factor VIII en la totalidad de pacientes estudiados.
Se observó un incremento del consumo de FVIII por encima de lo registrado en la bibliografía consultada, lo que será motivo de análisis evaluar la posibilidad de reducir el consumo de FVIII a futuro sin que afecte los resultados terapéuticos, adaptándose a los pacientes y la disponibilidad de recursos del país.