Introducción
La poliquistosis renal autosómica dominante (PQRAD) es la enfermedad renal hereditaria más frecuente. Es una enfermedad caracterizada por la progresiva aparición de quistes renales que suelen conducir a la enfermedad renal crónica extrema en la edad adulta1. En el mundo tiene una prevalencia estimada de 1 cada 500-2.000 personas2,3. La prevalencia en Uruguay es desconocida. En el Programa de Salud Renal de Uruguay, al cierre del ejercicio 2021, sobre un total de 27.000 pacientes con enfermedad renal crónica (ERC), 450 (1,6%) tenían PQRAD. Dentro de éstos, algo más del 40% tenían una pérdida anual de filtrado glomerular mayor a 5 ml/minuto (datos no publicados del Programa de Salud Renal). Los pacientes con PQRAD constituyen entre 6% y 10% de los pacientes en terapia de reemplazo renal (trasplante renal y diálisis) en varios registros a nivel mundial4. En el Registro Uruguayo de Diálisis, al final del ejercicio 2019, del total de pacientes activos (2.801), 166 (5,9%) se encontraban en terapia dialítica crónica a causa de la PQRAD5.
La aprobación en el uso del antagonista del receptor V2 de la vasopresina, tolvaptán, ha marcado un cambio significativo en el tratamiento de esta enfermedad. Sumado a los cuidados generales brindados a estos pacientes, destinados a enlentecer la progresión de la enfermedad renal (corrección de acidosis metabólica, bloqueo del sistema renina-angiotensina-aldosterona, control óptimo de la hipertensión arterial), tolvaptán actúa sobre mecanismos específicos vinculados al crecimiento de los quistes renales y el deterioro consecuente del filtrado glomerular6. En el presente trabajo se realiza una revisión descriptiva sobre el beneficio del tratamiento con tolvaptán. Se finaliza con una recomendación práctica sobre un posible algoritmo de selección de pacientes que pueden beneficiarse del inicio del tratamiento con este fármaco.
Metodología
Se trata de una revisión descriptiva. Se realizó una búsqueda en bases de datos bibliográficos Pub-Med/MEDLINE, SCOPUS y Google Académico de trabajos publicados en el período 2012-2022 en idiomas inglés y castellano. Del total de trabajos publicados se seleccionaron aquellos con diseño prospectivo, aleatorizado y controlado, así como subanálisis derivados de los primeros. La información se organizó en tres segmentos: mecanismo de acción del tolvaptán, estudios clínicos con tolvaptán y prescripción de tolvaptán.
Desarrollo y discusión
Mecanismo de acción del tolvaptán
La formación de quistes en la PQRAD es un proceso complejo que surge como consecuencia de la alteración de múltiples mecanismos que controlan el diámetro del túbulo renal, la proliferación celular excesiva y la secreción de fluidos e interaciones patológicas entre células epiteliales mutadas con una matriz extracelular anormal y macrófagos intersticiales activados7. La vasopresina, actuando sobre los receptores V2 presentes principalmente en túbulos colectores y rama ascendente gruesa del asa de Henle (principales sitios de cistogénesis), constituye el agonista más poderoso para la generación de AMP cíclico (AMPc). La vasopresina circula en niveles más elevados en pacientes con PQRAD para compensar el déficit de concentración urinaria que presentan. Los niveles de AMPc tisulares aumentados en la PQRAD determinan una interrupción en la tubulogénesis. Estimulan la secreción de líquido a nivel tubular y activan vías de señalización proliferativas a ese nivel, determinando un aumento en la producción de citoquinas y factores de crecimiento que dan como resultado un estímulo al crecimiento de las células que recubren los quistes entre otros factores7. El tolvaptán es un antagonista del receptor V2 de la vasopresina. Además del efecto buscado de bloquear la producción de AMPc y sus consecuencias, la poliuria es una consecuencia lógica de su uso.
Selección de pacientes
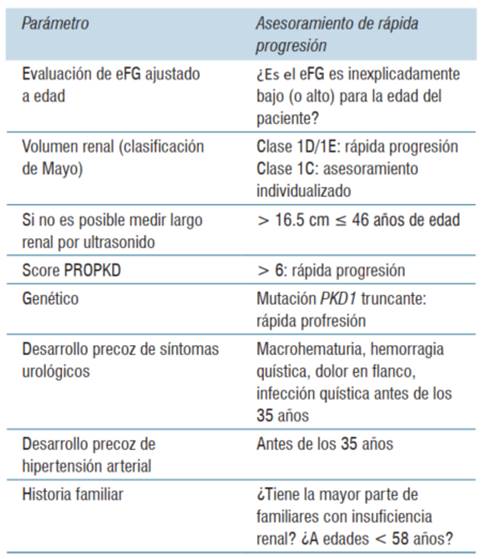
Solo un subgrupo de pacientes sufrirá una rápida progresión de la PQRAD y alcanzará insuficiencia renal temprana. Esto determina la necesidad de seleccionar adecuadamente quiénes pueden beneficiarse del tratamiento con tolvaptán, que por otra parte no está exento de efectos no deseados8. El volumen renal total es el indicador más sensible de progresión de la enfermedad8,9. Múltiples evidencias señalan que el volumen renal total proporciona una métrica de progresión de la enfermedad, que se puede utilizar entre otras cosas, para evaluar la eficacia de los tratamientos instaurados9(tabla 1). Esto es válido incluso en pacientes con niveles normales de función renal antes que los procesos patológicos de la PQRAD determinen fibrosis extensa y pérdida irreversible del tejido renal funcionante9.
Estudios clínicos con tolvaptán (tabla 2)
Tabla 2: Resumen de los principales estudios que evaluaron eficacia y seguridad de tolvaptán en el tratamiento de la poliquistosis renal autosomica dominante (PQRAD).
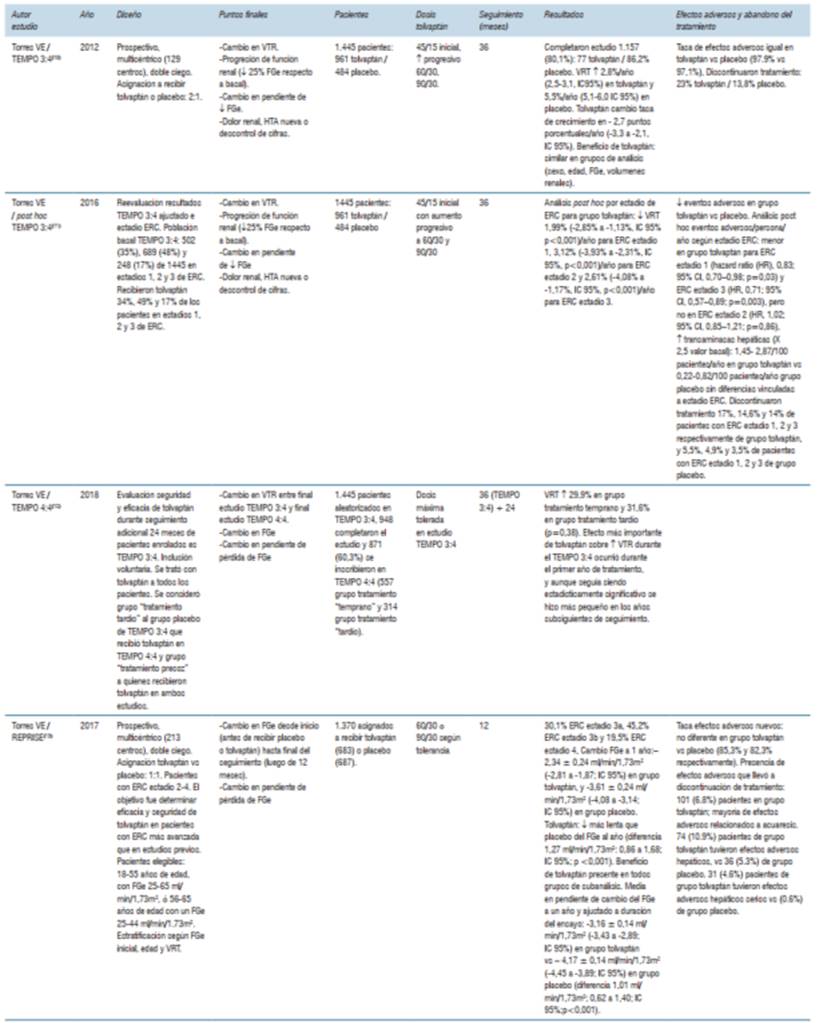
TEMPO 3:410 (Tolvaptán Efficacy and Safety in Management of Autosomal Dominant Polycystic Kidney Disease and its Outcomes) fue un estudio prospectivo, multicéntrico (129 centros de todo el mundo), realizado entre 2007 y 2009. El objetivo primario fue evaluar el cambio en el volumen renal total, medido como porcentaje de crecimiento anual evaluado con resonancia magnética a los 12, 24 y 36 meses de iniciado el estudio. Los objetivos secundarios fueron evaluar la progresión de la función renal establecida como una pérdida del 25% en el filtrado glomerular respecto al valor basal al inicio del estudio, la presencia de dolor renal definida por la necesidad de tratamiento con analgésicos o tratamiento invasivo a causa del dolor, la presencia de hipertensión arterial definida por el inicio de hipertensión arterial o necesidad de incremento en la dosis de fármacos antihipertensivos que venía recibiendo, y la presencia de albuminuria de nueva aparición. Otro objetivo secundario fue evaluar el cambio en la pendiente de declinación del filtrado glomerular estimado por el valor recíproco de la creatininemia. Fue doble ciego, y se asignó en un ratio 2:1 a recibir tolvaptán o placebo. Los grupos de pacientes se parearon de acuerdo a algunas características clínicas: presencia o ausencia de hipertensión arterial previa, clearance de creatinina <80 o ≥80 ml/min, volumen renal total <1.000 o ≥1.000 ml y región geográfica de procedencia. Fueron incluidos 1.445 pacientes, 961 asignados a recibir tolvaptán y 484 a recibir placebo. La dosis administrada fue inicialmente de 45 mg en la mañana y 15 mg en la tarde, con aumento progresivo de dosis a 60 y 30 mg, y a 90 y 30 mg. Se realizó evaluación clínica al inicio semanal mientras se titulaba la dosis, cada 4 meses durante el transcurso del tratamiento y cada 1 a 6 semanas una vez finalizado el tratamiento. El tiempo total de tratamiento fue 36 meses. Completaron el estudio 1.157 (80,1%) pacientes, 77% del grupo tolvaptán y 86,2% del grupo placebo. En el análisis primario se incluyeron 1.307 pacientes. La adherencia fue >90% en 845 pacientes de los 961 del grupo tolvaptán, con una dosis promedio de 95 mg/día. Luego de completado el seguimiento, el volumen renal total aumentó 2,8% por año (2,5-3,1, IC95%) en el grupo tolvaptán y 5,5% por año (5,1-6,0 IC 95%) en el grupo placebo. Tolvaptán cambió la tasa de crecimiento en -2,7 puntos porcentuales/año (-3,3 a -2,1, IC 95%). Tolvaptán fue beneficioso (para enlentecer el aumento de volumen renal) en todos los grupos de tratamiento: sexo, edad <35 y ≥35 años, volumen basal <1.500 ml y ≥1.500 ml, clearance de creatinina estimado <80 y ≥80 ml/min y presencia/ausencia de hipertensión arterial. El deterioro de la función renal medido por la recíproca de la creatininemia fue favorable para el grupo tolvaptán con -2,61 mg/ml-1 de creatininemia/año comparado con -3,81 mg/ml-1 año en el grupo placebo. El tratamiento logró un incremento de la recíproca de la creatininemia de 1,20 ml/min-1 año en el grupo tolvaptán (0,62-1,78 IC 95%; p <0,001). Esto se tradujo en un aumento de la creatininemia desde 1,05 a 1,21 mg/dl en grupo tolvaptán vs. 1,04 a 1,27 mg/dl en el grupo placebo (diferencia media -0,09 mg/dl, -0,13 a -0,06; IC 95%). Este beneficio sobre el filtrado glomerular fue similar en todos los grupos de subanálisis. Los eventos clínicos evaluados en el objetivo secundario combinado (deterioro del filtrado glomerular, dolor renal, hipertensión arterial, albuminuria) fueron menores en el grupo tolvaptán vs placebo (44 vs 50 eventos, HR 0,87, 0,78-0,97, IC 95%; p 0,005). La tasa de efectos adversos fue igual en el grupo tolvaptán vs placebo (97,9% vs 97,1%). El grupo tolvaptán tuvo con mayor frecuencia efectos adversos vinculados a la acuaresis (sed, poliuria, nocturia y polidipsia) mientras que el grupo placebo tuvo con más frecuencia efectos adversos vinculados a la poliquistosis (dolor renal, hematuria, ITU y dolor lumbar). 23% del grupo tolvaptán y 13,8% del grupo placebo discontinuaron el tratamiento. Del grupo tolvaptán, 8,3% lo discontinuaron por síntomas vinculados a acuaresis y 1,2% por elevación de enzimas hepáticas. Los autores concluyeron que tolvaptán en comparación con placebo desaceleró el incremento en el volumen renal y la disminución del filtrado glomerular estimado durante un periodo de seguimiento de 3 años, pero se asoció con una mayor tasa de interrupción del tratamiento a consecuencia de la presencia de eventos adversos.
En un análisis post hoc del estudio TEMPO 3:411, Torres y colaboradores reevaluaron los resultados en función de los diferentes estadios de enfermedad renal crónica (ERC) que tenían los participantes. Basalmente en el estudio TEMPO 3:4, 502 (35%), 689 (48%) y 248 (17%) de 1.445 pacientes cursaban estadios 1, 2 y 3 de ERC respectivamente. Se randomizaron a recibir tolvaptán 34%, 49% y 17% de los pacientes en estadios 1, 2 y 3 de ERC. Se asignaron a recibir placebo 36%, 47% y 17% de los pacientes en estadios 1, 2 y 3 respectivamente. El volumen renal total anual aumentó 2,8% en el grupo tolvaptán versus 5,5% en el grupo placebo. El análisis post hoc por estadio de ERC para el grupo tolvaptán mostró reducción de volumen de 1,99% (-2,85% a -1,13%, IC 95% p <0,001)/año para ERC estadio 1, 3,12% (-3,93% a -2,31%, IC 95%, p <0,001)/año para ERC estadio 2, y 2,61% (-4,08% a -1,17%, IC 95%, p <0,001)/año para ERC estadio 3. El cambio medio de mínimos cuadrados final de volumen en todo el período de tratamiento fue 5,9%, 7,2% y 11,1% para los grupos de ERC 1, 2 y 3 respectivamente en el grupo tolvaptán, y de 13,4% (p <0,001), 18,2% (p <0,001) y 21,6% (p <0,001) para el grupo placebo. El análisis de los objetivos secundarios complejos mostró menor número de eventos en el grupo tolvaptán comparado con el placebo. El análisis post hoc según grupo de ERC de eventos adversos/persona/año también fue menor en el grupo tolvaptán para ERC estadio 1 (hazard ratio [HR], 0,83; 95% CI, 0,70-0,98; p=0,03) y ERC estadio 3 (HR, 0,71; 95% CI, 0,57-0,89; p=0,003), pero no en ERC estadio 2 (HR, 1,02; 95% CI, 0,85-1,21; p=0,86). El efecto del tolvaptán sobre la declinación del filtrado glomerular mostró en el TEMPO 3:4 un descenso de -3,7 a -2,72 ml/min/año (26,5%; p<0,001). En el presente análisis post hoc según estadio de ERC, el descenso del filtrado glomerular con tolvaptán decreció 0,40 ml/min/año (95% CI, 20,25 a 1,05; p=0,23) en ERC estadio 1, 1,13 ml/min/año (95% CI, 0,61-1,66; p 0,001) en ERC estadio 2 y 1.66 ml/min/año (95% CI, 0,83-2,45; p 0,001) en ERC estadio 3. En el estudio TEMPO 3:4 pacientes que recibieron tolvaptán tuvieron más efectos adversos vinculados a la acuaresis mientras que el grupo placebo tuvo más efectos adversos vinculados a la PQRAD. Los episodios de hipernatremia cuando se discriminó por estadio de ERC fueron más frecuentes en ERC estadio 3 que recibieron tolvaptán comparado con el grupo placebo. El aumento en las transaminasas hepáticas (>2,5 veces el valor normal) fue 1,45 a 2,87/100 pacientes/año en el grupo tolvaptán comparado con 0,22-0,82/100 pacientes/año en el grupo placebo sin diferencias vinculadas al estadio de la ERC. Discontinuaron el tratamiento 17%, 14,6% y 14% de pacientes con ERC estadio 1, 2 y 3 respectivamente del grupo tolvaptán, y 5,5%, 4,9% y 3,5% de pacientes con ERC estadio 1, 2 y 3 del grupo placebo. Los autores concluyeron que tolvaptán fue igualmente eficaz en reducir la tasa de aumento del volumen renal en pacientes con PQRAD que tenían ERC estadio 1-3, y que los efectos del tratamiento fueron mayores durante el primer año de tratamiento, pero también fueron significativos durante el segundo y tercer años, lo que resultó en un efecto incremental en el tiempo.
El estudio TEMPO 4:412 (Tolvaptan Efficacy and Safety in Management of Autosomal Dominant Polycystic Kidney Disease and its Outcomes) fue un ensayo diseñado para evaluar la eficacia y seguridad del tolvaptán durante 24 meses adicionales de seguimiento de los pacientes que participaron y completaron el estudio TEMPO 3:410. Se incluyó a los pacientes que completaron el estudio TEMPO 3:4 y que voluntariamente (y en un periodo no mayor a 6 meses de terminado el primer estudio) quisieran extender el tiempo de tratamiento y observación. A la totalidad de pacientes del estudio TEMPO 4:4 se los trató con tolvaptán, considerándose grupo “tratamiento precoz” a los que recibieron tolvaptán durante el TEMPO 3:4 y grupo “tratamiento tardío” a los que formaron parte del grupo placebo en el estudio TEMPO 3:4. El objetivo primario fue evaluar si tolvaptán tenía efectos modificadores sobre el cambio en el volumen renal total desde la finalización del estudio TEMPO 3:4 y la finalización de este estudio (TEMPO 4:4) según grupos de tratamiento “precoz” o “tardío”. Los objetivos secundarios fueron la evaluación del cambio en el filtrado glomerular y cambios en la pendiente de filtrado glomerular y volumen renal total también discriminados para cada grupo de tratamiento. Se tituló la dosis de tolvaptán hasta llegar a la máxima dosis tolerada para cada individuo en el ensayo TEMPO 3:4. Se realizó evaluación clínica con los mismos criterios que en el estudio TEMPO 3:4 al inicio y en los meses 1, 3, 6 y cada 6 meses hasta completar los 24 meses de seguimiento. De 1.445 pacientes (961 tolvaptán y 484 placebo) aleatorizados en el TEMPO 3:4, un total de 948 completaron el estudio y 871 (60,3%) se inscribieron en el TEMPO 4:4 (557 del grupo tratamiento “temprano” correspondientes al 58% de los que recibieron tolvaptán en el estudio previo; 314 del grupo tratamiento “tardío” correspondientes al 64,9% de los que formaron parte del grupo placebo en el estudio previo). El volumen renal total aumentó 29,9% en los individuos tratados tempranamente y 31,6% en los que recibieron tratamiento tardío (p=0,38). El efecto más importante del tolvaptán sobre el aumento del volumen renal total durante el TEMPO 3:4 en individuos del grupo tratamiento “temprano” ocurrió durante el primer año de tratamiento, y aunque seguía siendo estadísticamente significativo se hizo más pequeño en los años subsiguientes de seguimiento. Esta desaceleración del crecimiento del volumen renal total después de la reintroducción del tolvaptán al inicio del TEMPO 4:4 en el grupo de tratamiento “temprano”, se correlacionó con el tiempo de retraso que hubo entre un estudio y otro (R=-0,19, p <0,001), y se observó principalmente en el grupo de pacientes del cuartil con el tiempo más largo sin tratamiento (efecto del tratamiento desde el inicio de TEMPO 4:4 hasta el mes 12 comparando el cuartil 4 con el cuartil 1, -2,97% por año, p=0,06). Dado que el objetivo primario del estudio no fue alcanzado, el análisis preespecificado de los objetivos secundarios corre riesgo de ser erróneos, por lo que los autores consideraron que los resultados de los objetivos secundarios tuvieron sólo un carácter exploratorio y no confirmatorio. El punto final secundario clave fue el vinculado al cambio en el filtrado glomerular desde el inicio del TEMPO 3:4 hasta el final del TEMPO 4:4 en los grupos de tratamiento “temprano” versus “tardío”. La diferencia entre grupos se mantuvo en cada punto de tiempo, lo que sugiere que el efecto del tolvaptán sobre la disminución del filtrado glomerular en el TEMPO 3:4 se mantuvo durante los dos años adicionales del TEMPO 4:4 (3,15 ml/min/1,73m2, p <0,001). A diferencia de lo que pasó con los cambios en el volumen renal total, los cambios en el filtrado glomerular durante el primer año de TEMPO 4:4 en el grupo tratamiento “temprano” no se correlacionaron con los retrasos en el tiempo entre los dos estudios. La pendiente en el cambio del volumen renal total en TEMPO 4:4 fue mayor en el grupo de tratamiento “tardío” (6,16 versus 4,96%/año, diferencia de tratamiento 1.011, IC 95%, p=0,05). Luego del inicio de tolvaptán en TEMPO 4:4 se produjo un efecto sustancial sobre el crecimiento del volumen renal total durante el primer año sólo en los pacientes del grupo de tratamiento “tardío”, mientras que en el grupo tratamiento “temprano” este efecto fue mitigado. La pendientes de pérdida del filtrado glomerular en TEMPO 4:4 fueron similares en grupos de tratamiento “temprano” y “tardío” (-3,26 versus -3,14 ml/min/1,73m2/año; diferencia de tratamiento -0,11, IC 95%, P=0,73). Los autores concluyeron que los resultados del estudio TEMPO 4:4 respaldan la presencia de un efecto modificador sostenido de tolvaptán sobre el filtrado glomerular estimado, con un perfil de seguridad similar al observado en el estudio TEMPO 3:4.
El estudio REPRISE13, (Replicating Evidence of Preserved Renal Function: an Investigation of Tolvaptan Safety and Efficacy in ADPKD), fue un ensayo fase 3, con retiros aleatorios, multicéntrico (213 centros en todo el mundo), doble ciego, controlado con placebo. Fueron incluidos pacientes con PQRAD con ERC estadio 2 a estadio 4 (temprano), con el objetivo de determinan la eficacia y seguridad de tolvaptán en pacientes con ERC más avanzada que los incluidos en estudios previos. Se siguió un protocolo que incluyó un control más frecuente de los efectos tóxicos en el hígado (no se pudieron anticipar en los estudios TEMPO 3:4 ni TEMPO 4:4 con el monitoreo realizado). Los pacientes elegibles debían tener entre 18-55 años de edad, con un filtrado glomerular estimado entre 25 y 65 ml/min/1,73m2, o entre 56-65 años de edad con un filtrado glomerular estimado entre 25 y 44 ml/min/1,73m2. Los del grupo de mayor edad debían tener adicionalmente evidencia de una disminución del filtrado glomerular estimado de más de 2 ml/minuto/1,73m2/año. Hubo un período previo a la aleatorización de 8 semanas dividido en una fase de selección, una fase de preinclusión simple ciego con placebo, y un período de tolvaptán simple ciego que comprendió una fase de ajuste de dosis y otra de preinclusión. Se asignó en una relación 1:1 a recibir tolvaptán (en dosis matutina-vespertina de 60 + 30 mg, y 90 + 30 mg según tolerancia de los pacientes) o placebo. El periodo de seguimiento fue 12 meses. La aleatorización se estratificó según FG estimado inicial (≤ 45 o > 45 ml/minuto/1,73m2), la edad del paciente (≤55 o >55 años) y el volumen renal total (≤2.000 o >2.000 ml o desconocido). Se les realizó pruebas mensuales de laboratorio a los pacientes. El punto final primario fue el cambio en el filtrado glomerular estimado desde el inicio (antes de recibir placebo o tolvaptán) hasta el final del seguimiento (luego de completado el periodo de un año), ajustado al tiempo que cada paciente participó en el ensayo. Los valores de filtrado glomerular se estimaron a partir del valor de la media de tres creatininemias basales, y de la media de tres creatininemias obtenidas durante el seguimiento luego de completado un año de tratamiento. El punto final secundario fue el cambio en la pendiente de filtrado glomerular estimado, derivado de la pendiente estimada para cada paciente. Hubo una estrecha monitorización de la toxicidad hepática, considerándose frente a elevaciones en el nivel de transaminasas por encima de tres veces el límite normal, elevaciones en la bilirrubina por encima de dos veces el nivel normal, y/o la presencia de eventos adversos hepáticos graves (eventos que obliguen a la discontinuidad del tratamiento). De un total de 2.292 pacientes evaluados, 1.496 ingresaron al período simple ciego de tolvaptán, de los cuales 126 se retiraron antes de la aleatorización por presentar efectos adversos (poliuria, nocturia, sed, polidipsia). Los restantes 1.370 fueron asignados a recibir tolvaptán (683) o placebo (687). Un total de 95,8% del grupo tolvaptán y 95,9% del grupo placebo completaron los controles del mes 12 del estudio. Un total de 30,1% tenían ERC estadio 3a, 45,2% ERC estadio 3b y 19,5% ERC estadio 4. La media en el cambio del filtrado glomerular estimado a 1 año fue de -2,34 ± 0,24 ml/min/1,73m2 (-2,81 a -1,87; IC 95%) en el grupo tolvaptán, en comparación con -3,61 ± 0,24 ml/min/1,73m2 (-4,08 a -3,14; IC 95%) en el grupo placebo. Tolvaptán se asoció con una disminución más lenta que placebo del filtrado glomerular estimado al año (diferencia 1,27 ml/min/1,73m2: 0,86 a 1,68; IC 95%; p<0,001). Este beneficio de tolvaptán estuvo presente en todos grupos de subanálisis: sexo, estadio de la ERC (excepto para ERC estadio 2), área geográfica, así como en subgrupo de menores de 55 años y pacientes de raza blanca. No se mantuvo el beneficio en el pequeño grupo de pacientes mayores de 55 años, que no eran de raza blanca o que se encontraban con ERC estadio 2. La media en la pendiente de cambio del filtrado glomerular estimado a un año y ajustado a la duración del ensayo, fue -3,16 ± 0,14 ml/min/1,73m2 (-3,43 a -2,89; IC 95%) en el grupo tolvaptán, comparado con -4,17 ± 0,14 ml/min/1,73m2 (-4,45 a -3,89; IC 95%) en el grupo placebo (diferencia 1,01 ml/min/1,73m2; 0,62 a 1,40; IC 95%; p<0,001). El análisis por subgrupos de este punto final secundario mostró beneficio de tolvaptán en todos los subgrupos excepto en aquellos con ERC estadio 2, mayores de 55 años o de raza negra. Durante el periodo doble ciego las tasas de efectos adversos nuevos no fueron diferentes en el grupo tolvaptán comparado con el placebo (85,3% y 82,3% respectivamente). Luego de la randomización las tasas de poliuria, nicturia y sed, polidipsia y boca seca, diarrea y fatiga, fueron más altas en el grupo tolvaptán, mientras que las tasas de edema periférico, dolor renal e infección del tracto urinario fueron más altas en el grupo placebo. La presencia de efectos adversos que llevó a la discontinuación del tratamiento en el grupo tolvaptán aparecieron en 101 (6,8%) pacientes; la mayoría de los efectos adversos estuvieron relacionados a la acuaresis. Un total de 74 (10,9%) pacientes de los que recibieron tolvaptán tuvieron efectos adversos hepáticos, comparado con 36 (5,3%) del grupo placebo. Un total de 31 (4,6%) pacientes del grupo tolvaptán tuvieron efectos adversos hepáticos serios comparado con 4 (0,6%) del grupo placebo. Los autores concluyeron que tolvaptán determinó una disminución más lenta que el placebo del filtrado glomerular estimado, durante un período de seguimiento de un año en pacientes con PQRAD en etapa avanzada.
En un estudio de Edwards y colaboradores14, los autores se propusieron evaluar la progresión de la PQRAD en 97 pacientes tratados de forma continua con tolvaptán durante periodo de tiempo variable (1,1 a 11,2 años) y seguidos en la Clínica Mayo, comparados con una población de controles pareados o modelos predictivos de evolución de la enfermedad. Fueron incluidos pacientes en seguimiento en la Clínica Mayo, que participaron previamente en los estudios TEMPO 2:415, TEMPO 3:411, TEMPO 4:412, NOCTURNE16 y REPRISE13. Se utilizaron tres estrategias para determinar si el efecto del tolvaptán sobre el filtrado glomerular estimado observado en los ensayos clínicos fue sostenido y acumulativo: se compararon las pendientes de pérdida del filtrado glomerular estimado y la presencia de reducción de 33% del filtrado glomerular estimado con respecto al filtrado glomerular inicial en pacientes tratados con tolvaptán en comparación con controles. Los controles fueron seleccionados del estudio CRISP (Consorcio para Estudios de Imágenes Radiológicas de Enfermedad Renal Poliquística)16 y el estudio HALT17 (HALT-PKD Trial Investigators: Angiotensin blockade in late autosomal dominant polycystic kidney disease), emparejados en una proporción 1:2 por sexo, edad y filtrado glomerular estimado. El objetivo fue determinar si la administración de tolvaptán durante periodos de tiempo entre 1,1 y 11,2 años se asociaba a una reducción en la pérdida de filtrado glomerular estimado (tasa anualizada de disminución del filtrado glomerular), independientemente de la duración del seguimiento. Se realizó un análisis de las pendientes de filtrado glomerular estimado de pacientes con PQRAD tratados con tolvaptán por duración de seguimiento, comparado con poblaciones de referencia no tratadas con tolvaptán, y estratificados por severidad de la PQRAD y el estadio de la ERC, y comparado con poblaciones de referencia (grupos tratados con placebo de los ensayos TEMPO 3:4 y REPRISE). Adicionalmente se comparó el valor del filtrado glomerular estimado y el filtrado glomerular predictivo (mediante ecuación predictiva previamente validada) en el último control de los pacientes con PQRAD tratados con tolvaptán, con el propósito de determinar si el tratamiento con tolvaptán alteraba la tasa prevista de disminución de filtrado glomerular y si esto daba como resultado una diferencia acumulada en el tiempo. Un total de 128 pacientes con PQRAD en seguimiento en Clínica Mayo participaron en al menos uno de los estudios de tolvaptán (TEMPO 2:415, TEMPO 3:411, TEMPO 4:412, NOCTURNE16 y REPRISE13). Al final del estudio todos tuvieron la oportunidad de inscribirse en este ensayo de intención de tratamiento. De 45 pacientes que participaron en estudios de 1 a 8 semanas, 13 declinaron ingresar y 7 adicionales que recibieron placebo en los ensayos previos rechazaron la inscripción. Los 108 pacientes restantes fueron incluidos para el análisis, 11 de ellos habían recibido tolvaptán por menos de un año, 7 de estos 11 habían sido asignados al grupo placebo en el estudio REPRISE13. Los 97 pacientes restantes fueron incluidos en el análisis de eficacia. El efecto del tolvaptán sobre la disminución del filtrado glomerular estimado, fue determinado comparando cada paciente tratado (97 pacientes) con dos controles emparejados (194 pacientes). Las tasa de disminución de filtrado glomerular estimado en pacientes tratados con tolvaptán calculadas desde el valor basal (-2,20 ± 2,44 ml/min/1,73 m2/año) y luego de 1 mes de iniciado el tolvaptán (-1,97 ± 2,44 ml/min/1,73 m2/año) fueron significativamente (p <0,001) más lentas que la de los controles (-3,50 ± 2,09 ml/min/1,73m2/año), en todos los estadios de la ERC. Se compararon las pendientes de filtrado glomerular estimado de los pacientes tratados con tolvaptán durante ≥3 años o ≥5 años y sus respectivos controles. En ambos casos la pendiente fue más lenta en el grupo tolvaptán que en el grupo control. El análisis de Kaplan-Meier mostró que el riesgo de una reducción de 33% del filtrado glomerular estimado desde el valor inicial, fue significativamente menor en el grupo de pacientes tratado con tolvaptán comparado con los controles (RR 0,63, 0,38-0,98; IC 95% y RR 0,53, 0,31-0,85; IC 95% respectivamente). Para determinar si el efecto del tolvaptán sobre la tasa de disminución del filtrado glomerular estimado disminuía con la duración en el tiempo se compararon las pendientes de filtrado glomerular estimado en pacientes tratados entre 1-5 años (-2,28 ± 2,53 y -1,96 ± 2,83 ml/min/1.73m2) y aquellos tratados por > 5 años (-2,08 ± 1,55 y -1,97 ± 1,57 ml/min/1,73m2). Las pendientes fueron similares en ambos grupos de pacientes en general y en todas las etapas de la ERC, así como en todos los grupos de gravedad de la PQRAD, y más bajas que en todos los grupos de pacientes que recibieron placebo en los estudios TEMPO 3:411 y REPRISE13. Para determinar si el efecto del tolvaptán sobre el filtrado glomerular estimado aumentaba con el tiempo de seguimiento se utilizó una ecuación predictiva validada para estimar la diferencia entre los valores de filtrado glomerular estimado observado y los valores predictos. La diferencia entre valor observado-valor predicto fue mayor cuando la creatininemia del mes 1 fue utilizada para el cálculo, y esta diferencia aumentó a medida que se prolongó el seguimiento (pendiente de 0,63 ml/min/1,73m2/año, 0,19 a 1,07; IC 95%; p=0,006 utilizando el valor inicial; y 0,96 ml/min/1,73m2/año, 0,47 a 1,45; IC 95%; p<0,001 utilizando el valor de creatininemia del mes Los autores concluyeron que los pacientes tratados con tolvaptán tuvieron tasas más bajas de disminución del filtrado glomerular estimado y de reducción de 33% del filtrado glomerular con respecto al inicio del estudio, en comparación con los controles emparejados, independientemente del estadio de la ERC. Las tasas anualizadas de disminución del filtrado glomerular estimado no disminuyeron durante la duración del seguimiento y fueron consistentemente más bajas en el grupo tolvaptán que en los grupos placebo. La diferencia entre los valores de filtrado glomerular estimado observado y predicho en el último seguimiento con tolvaptán, aumentó con la duración del seguimiento, lo que sugiere que el efecto del tolvaptán sobre la reducción del filtrado glomerular fue sostenido y acumulativo.
En un reciente estudio, Torres y colaboradores18 se trazaron como objetivo evaluar la seguridad y tolerabilidad a largo plazo del tolvaptán en el tratamiento de la PQRAD. Los pacientes elegibles fueron aquellos que completaron los estudios REPRISE13 (sea en la rama tolvaptán o placebo), TEMPO 4:412 o TEMPO 3:410. Los pacientes que interrumpieron o discontinuaron el tratamiento en alguno de los estudios anteriores por razones diferentes a la elevación de las transaminasas hepáticas también podían participar. En todos los casos debían tener diagnóstico de PQRAD, edad ≥18 años y un filtrado glomerular estimado ≥20 ml/min/1,73m2. Aquellos con filtrado glomerular estimado <20 ml/min/1,73m2 podían inscribirse pero requerían de su asociación a un monitor médico y la aprobación del patrocinador que garantizaran un control más frecuente. El estudio se desarrolló entre setiembre de 2014 y diciembre de 2018 y se planificó que su duración se extendiera hasta que el último paciente enrolado en el estudio REPRISE13 cumpliera 18 meses de tratamiento. En referencia a los tratamiento recibidos, los paciente provenientes del estudio TEMPO 4:412 permanecieron en el último nivel de dosis en que se encontraban cuando transitaban el TEMPO 3:410, y los provenientes del estudio REPRISE13 o de ensayos anteriores comenzaron con tolvaptán en dosis dividida de 45/15 mg con titulación ascendente cada 3-4 días a 60/30 o 90/30 según la tolerabilidad. En todos los casos se permitió titulación descendente a criterio del investigador de acuerdo con la tolerabilidad de los pacientes. Se realizaron pruebas mensuales de función hepática durante los primeros 18 meses de exposición acumulativa a tolvaptán, con seguimiento cada tres meses a partir de entonces. El resto de las evaluaciones clínicas y de laboratorio siguió un esquema similar a las de función hepática, incluyéndose signos vitales, examen físico dirigido, revisión de plan de dieta y revisión de medicaciones que recibían de forma concomitante. De 1.814 potenciales candidatos seleccionados se inscribieron 1.803 en el estudio. En un total de 1.800 que recibieron una dosis de tolvaptán mayor o igual a la estipulada se analizó la seguridad, y 1.488 (83%) completaron el estudio. La distribución según estadio de la ERC fue 19% estadio 2, 55% estadio 3 (24% 3a y 31% 3b), y 22% estadio 4. Durante el estudio, el rango de duración de la exposición a tolvaptán fue 1-1435 días con una mediana de exposición de 651 días. La frecuencia de efectos adversos fue similar en los tres grupos de procedencia de los ensayos anteriores. Los efectos adversos más frecuentes fueron asociados a la PQRAD o al mecanismo de acción del tolvaptán. La frecuencia y tipo de efecto adverso más común en pacientes recién expuestos a tolvaptán fue muy similar a la descrita en los estudios previos. En un análisis por exposición acumulada a tolvaptán, las interrupciones fueron más frecuentes en pacientes durante los primeros 18 meses de exposición a tolvaptán. Murieron nueve pacientes durante el seguimiento, y ninguna de estas muertes estuvo vinculada con el uso del fármaco. Los autores concluyeron que tolvaptán fue seguro y bien tolerado cuando se administró dos veces al día en dosis dividida (45/15, 60/30 y 90/30), y que los resultados de seguridad para tolvaptán en este estudio fueron consistentes con el perfil de seguridad conocido sobre la base de ensayos clínicos previos de tolvaptán. El control hepático mensual durante los primeros 18 meses de exposición a tolvaptán y cada tres meses desde entonces, permitió la detección temprana de elevaciones de las transaminasas y una intervención eficaz (incluida la interrupción y suspensión del fármaco) durante los períodos de mayor susceptibilidad de efectos adversos hepáticos.
En un estudio de Castelejein y colaboradores19, los autores se propusieron evaluar si el tratamiento con tolvaptán se asoció a menor número de eventos de dolor renal “clínicamente significativo”, así como la asociación entre las características clínicas de la PQRAD (antecedentes de dolor renal, infección, nefrolitiasis o hematuria) y la incidencia de eventos de dolor renal agudo durante un periodo de observación de tres años. Analizaron además el efecto del uso de tolvaptán sobre la incidencia de nuevos eventos de dolor renal. El estudio se constituyó como “exploratorio” post hoc del estudio TEMPO 3:410. Los criterios de inclusión y la población participante en el mismo fueron iguales que en el TEMPO 3:410. La evaluación de los pacientes se realizó al inicio, cada 4 meses durante la fase de tratamiento y dos veces durante 2-6 semanas de completado el estudio. Al inicio del estudio se realizó una entrevista estandarizada para recolectar información demográfica y del historial médico, incluyendo la existencia de episodios de dolor renal previos. Se evaluó durante el seguimiento la presencia de episodios de dolor renal agudo, considerándose tal cuando los episodios de dolor requirieron intervención médica y se pudo constatar de que el dolor estaba asociado al riñón. El dolor se clasificó operativamente en 5 grupos: leve (cuando requirió prescripción de paracetamol), moderado (cuando se prescribieron otros analgésicos no narcóticos), moderadamente grave (cuando requirió prescripción de analgésicos no narcóticos pero determinó limitación de la actividad física), severo (cuando requirió prescripción de analgésicos narcóticos) y grave (cuando hubo necesidad de internación o de intervenciones invasivas). El objetivo primario fue determinar el efecto del uso de tolvaptán en la incidencia de dolor renal. Objetivos adicionales fueron evaluar la asociación de las características clínicas de la PQRAD con la incidencia de nuevos eventos de dolor agudo, la asociación entre nuevos eventos de dolor agudo con características basales de los pacientes y los posibles mecanismos por los cuales el tolvaptán disminuye eventualmente la incidencia de dolor renal agudo. La población estuvo integrada por un total de 1.445 pacientes con PQRAD provenientes del estudio TEMPO 3:410, con edad media de 39 ± 7 años, el filtrado glomerular estimado de 81 ± 22 ml/min/1,73m2 y la mediana de tamaño renal total 1.692 (RIQ 750-7.555) ml. Al inicio del estudio 50,9% informaron tener antecedentes de dolor renal. En el grupo placebo 16,7% de pacientes tuvieron un episodio de dolor renal durante el seguimiento de 3 años, los antecedentes asociados fueron infección del tracto urinario, nefrolitiasis, hematuria, dolor renal previo y ser del sexo femenino. No hubo asociación entre el tamaño renal total basal, el tamaño renal ajustado por altura o el filtrado glomerular estimado con el desarrollo de dolor renal. En contraste con lo ocurrido en el grupo placebo, 10,1% de los pacientes que recibían tolvaptán tuvo dolor renal en el seguimiento a 3 años. Los mismos antecedentes hallados en el grupo placebo (infección del tracto urinario, nefrolitiasis, hematuria, dolor renal previo y ser del sexo femenino) tuvieron asociación con la presencia de dolor renal en el grupo tolvaptán. El uso de tolvaptán se asoció a una menor incidencia de primeros eventos de dolor renal en comparación con el grupo placebo (p <0,001), con una reducción del riesgo de desarrollar dolor renal de 36% (HR 0,64, 0,48 a 0,86; IC 95%). La diferencia en la incidencia acumulada de pacientes que sufrieron dolor renal entre grupos tolvaptán y placebo aumentó con el tiempo. En el análisis por subgrupos no hubo asociación entre el desarrollo de dolor y la gravedad de la enfermedad. El número necesario a tratar para prevenir un evento de dolor renal varió de 35 pacientes cuando se toma en cuenta cualquier evento de dolor, a 384 cuando se toma en cuenta eventos de dolor grave que requirieron hospitalización o intervención invasiva. Se intentó investigar un posible mecanismo del tolvaptán para reducir los episodios de dolor renal. Los pacientes que tuvieron dolor renal agudo tenían una tasa de crecimiento del volumen renal total similar a aquellos con PQRAD que no tuvieron dolor agudo. La reducción significativa en el desarrollo de dolor renal se acompañó de reducciones similares en la incidencia de complicaciones renales como infecciones del tracto urinario, nefrolitiasis y hematuria macroscópica. Los pacientes que tuvieron dolor renal tuvieron una tasa de complicaciones relacionadas con la enfermedad más elevada comparado con los que no tuvieron dolor. Los autores concluyeron que tolvaptán disminuyó la incidencia de eventos de dolor renal, independientemente de las características de los pacientes que lo predisponen a dolor renal, y posiblemente debido a la reducción de las complicaciones relacionadas con la PQRAD (tabla 2).
Prescripción del tolvaptán
Los estudios clínicos mostraron globalmente que tolvaptán tuvo un efecto beneficioso sobre el incremento en el volumen renal total, el deterioro del filtrado glomerular estimado y el desarrollo de otras complicaciones vinculadas a la PQRAD como el dolor renal. Este beneficio fue mantenido en el tiempo, independiente del tamaño renal total y del estadio de la ERC de los pacientes tratados. Por otra parte, el fármaco, mostró un adecuado perfil de seguridad, ya que si bien los efectos adversos estuvieron presentes, la mayor parte de éstos no fue grave. El perfil global de la población involucrada en los estudios permite desde el punto de vista práctico seleccionar un grupo en los que el beneficio de la prescripción fue medido (figura 1). Sin perjuicio de ello, es posible que otros grupos minoritarios de pacientes podrían ser potenciales beneficiarios de la medicación, especialmente aquellos que sin ajustarse al perfil “exacto” concordante con el de los participantes en los estudios, tiene manifestaciones clínicas y/o analíticas que sugieren su carácter de progresores rápidos. En la (figura 1) se muestra un esquema práctico de selección de pacientes, propuesto por el Grupo de trabajo sobre trastorno renales hereditarios de la European Renal Association6.
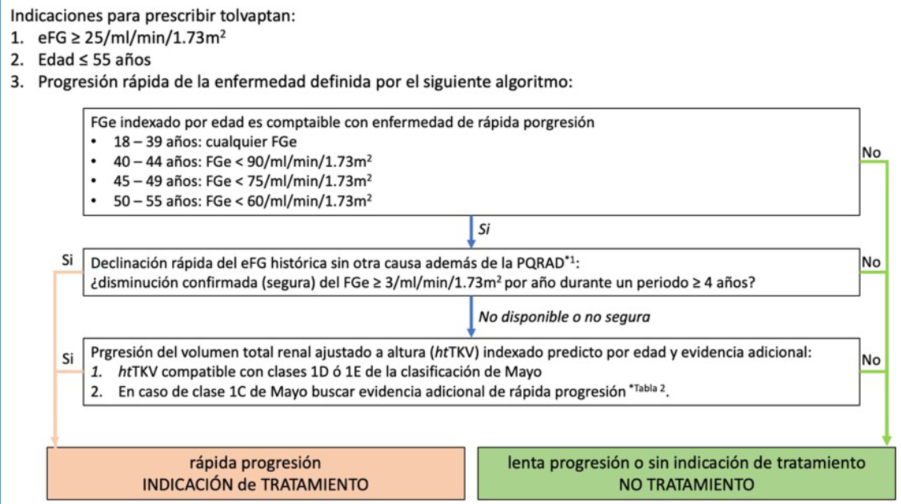
Figura 1: Algoritmo para evaluar la progresión rápida de la PQRAD como indicación de inicio de tratamiento con tolvaptán. Es válido únicamente para pacientes con PQRAD confirmada, edad ≤55 años y filtrado glomerular estimado ≥25 ml/min/1,73m2.
Cuando hay explicación alternativa de caida del eFG (enfermedad vascular, nefropatía diabética, etc) el inicio de tratamiento debe considerarse en presencia de rápida caída del eFG. Modificado de 6.
Conclusiones y perspectivas
Tolvaptán constituye en el momento actual una opción terapéutica específica para prevenir la progresión y algunas complicaciones, en pacientes seleccionados con PQRAD. Su indicación debe acompañarse del conjunto de medidas no específicas dirigidas a enlentecer la progresión de la ERC20. Junto con la búsqueda de estrategias para minimizar los efectos adversos del tratamiento con tolvaptán21, un conjunto de nuevos fármacos se encuentran en desarrollo y evaluación con el fin de constituirse en tratamientos específicos dirigidos a enlentecer la progresión de la ERC en pacientes con PQRAD22-27.