Introducción
La fiebre Q es una enfermedad zoonótica causada por Coxiella burnetii, una bacteria Gram negativa que está ampliamente distribuida. Diversas especies de animales, tanto vertebrados como invertebrados, pueden actuar como reservorios de este patógeno; sin embargo, son los rumiantes domésticos (bovinos, ovinos y principalmente caprinos) la fuente más frecuente de infección en humanos1. En el año 2001 fue catalogada como una enfermedad reemergente en Uruguay2, y actualmente es una de las enfermedades y eventos sanitarios de notificación obligatoria ante la división de vigilancia epidemiológica del Ministerio de Salud Pública (Decreto N°41/012). La enfermedad en animales está listada como de declaración obligatoria por la Organización Mundial de Sanidad Animal (OIE)3. La diseminación de C. burnetii se ve facilitada por la baja dosis infectiva y su transmisión principalmente aerógena, incluso se especula que la inhalación de una sola bacteria podría causar infección, por tal motivo integra la lista B de agentes de bioterrorismo del “Centers for Disease Control and Prevention” (CDC) de Estados Unidos4.
Es frecuentemente una enfermedad ocupacional, las personas expuestas de forma directa o indirecta al ganado tienen más riesgo de adquirir la infección5. Coxiella burnetii presenta gran resistencia a agentes medioambientales físicos y químicos, lo cual favorece su transmisibilidad. Rastrear las fuentes de exposición es desafiante ya que la bacteria puede ser transmitida por al menos siete vías. La infección por vía aerógena mediante la inhalación de partículas contaminadas por productos del parto o abortos de rumiantes es la vía más comúnmente reportada6. La transmisión digestiva mediante la ingestión de leche o derivados lácteos contaminados no pasteurizados es menos frecuente y su relevancia epidemiológica continúa bajo estudio7,8. En 1956 se comprobó una mayor termorresistencia de C. burnetii respecto de Mycobacterium tuberculosis, agente causal de la tuberculosis humana, lo que determinó que la temperatura de pasteurización de la leche se elevara de 61,7 a 63,0 °C con tiempo de retención de 30 min. para asegurar la destrucción de ambas9. Otras rutas de transmisión consideradas infrecuentes incluyen la transplacentaria10, la sexual11, la percutánea (a través de garrapatas infectadas), la conjuntival12 y las transfusiones sanguíneas13.
Determinar la fuente de infección también se dificulta dada la posibilidad de C. burnetii de propagarse grandes distancias debido a la acción del viento14, y por su resistencia a condiciones ambientales hostiles con la capacidad de sobrevivir en el ambiente incluso por años. Estos factores hacen que la bacteria pueda alcanzar lugares distantes, e incluso llegar a áreas urbanas desde zonas rurales15.
La mayoría de las infecciones en humanos (~60%) son asintomáticas16. En casos sintomáticos, la característica más sobresaliente de la fiebre Q es la diversidad en sus manifestaciones clínicas17, pudiendo cursar de forma aguda o crónica. El amplio espectro de signos y síntomas no específicos en la presentación aguda condiciona la identificación de la enfermedad, pudiendo determinar un subdiagnóstico y en consecuencia un subreporte de la misma18. La forma aguda de fiebre Q se caracteriza por fiebre de inicio abrupto con un patrón bifásico de hipertermia en aproximadamente 25% de los pacientes6, acompañada comúnmente por cefalea, mialgia, artralgia, fotofobia, linfadenopatía, conjuntivitis, escalofríos, vómitos y náuseas, diarrea y faringitis19. La forma aguda también puede incluir hepatitis, neumonía, meningoencefalitis6,20,21, o erupciones cutáneas inespecíficas localizadas como máculas o pápulas6.
La presentación crónica es desarrollada por 2% a 5% de los pacientes que sufren enfermedad clínica22, e incluso los pacientes infectados de forma subclínica están bajo riesgo de desarrollar enfermedad clínica crónica23. Entre los factores de riesgo para la forma crónica se incluyen edad avanzada, valvulopatías cardíacas, prótesis/injertos vasculares, aneurismas, insuficiencia renal, inmunosupresión/inmunocompromiso o embarazo24,25. La forma crónica se manifiesta principalmente con endocarditis, pero incluye también neumonía, meningitis, pericarditis y miocarditis, afección osteoarticular, vasculitis y trastornos hepáticos, con tasa de mortalidad más elevada que la presentación aguda6,20,21.
Una de las secuelas frecuentes de la fiebre Q es el síndrome de fatiga, que se desarrolla en 20% de los pacientes con infección aguda y se caracteriza por un cuadro de fatiga persistente que puede prolongarse incluso por años26. Esta fatiga se acompaña de jaquecas, sudoración, artralgia, mialgias, fasciculaciones musculares, visión borrosa y linfadenitis26. El síndrome de fatiga crónica fue identificado como la principal secuela económica durante el brote más extenso de fiebre Q reportado hasta la actualidad, ocurrido en los Países Bajos. Estas pérdidas económicas estuvieron asociadas al absentismo laboral y los perjuicios en la calidad de vida de los pacientes27.
El objetivo del presente trabajo fue compilar y revisar las publicaciones que describen casos de fiebre Q en humanos en Uruguay, de modo de evaluar sus características epidemiológicas, y recordar a la fiebre Q como una zoonosis vigente en nuestro medio. Discutimos además la disponibilidad de pruebas diagnósticas disponibles en la actualidad en el país.
Material y método
Se realizó una búsqueda bibliográfica en las bases de datos CAB Abstracts, Medline vía Ovid, PubMed, Web of Science, Scopus y Google Scholar. Para la misma se definieron las palabras clave “fiebre Q”, “Coxiella burnetii”, “Coxielosis”, “Uruguay”; tanto en español como en inglés (“Q fever”, “Coxiella burnetii”, “Coxiellosis”, “Uruguay”). Inicialmente no se aplicaron restricciones en cuanto al año de publicación, diseño metodológico empleado o especie afectada. Publicaciones no disponibles en formato digital en internet fueron obtenidas en formato físico en bibliotecas de instituciones locales ((Facultad de Veterinaria, Facultad de Medicina y el Instituto Nacional de Investigación Agropecuaria (INIA)). Trabajos no revisados por pares (bibliografía gris) fueron también incluidos y evaluados. La información del monitoreo anual (2014-2019) de enfermedades profesionales que realiza el Banco de Seguros del Estado (BSE) también fue revisada.
Desarrollo
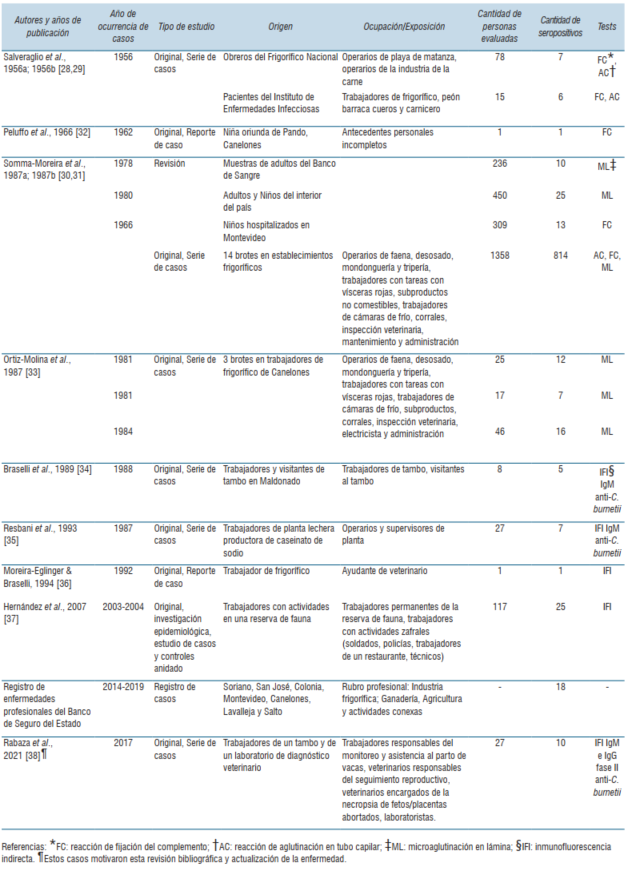
Se identificaron 15 publicaciones, tres de las cuales fueron excluidas por no tratarse de estudios de casos en humanos, sino de evaluaciones serológicas en animales domésticos mediante muestreos por conveniencia (ovinos, bovinos y cerdos). Uno de los trabajos identificados (autoría de Tosi y colaboradores) fue eliminado, ya que estaba referenciado como “en elaboración” y no fue posible acceder a su versión final. Trataba sobre una serie de casos de fiebre Q ocurridos en trabajadores de un frigorífico de Canelones en la década de 1970. Cuatro publicaciones28-31 presentaban dos brotes en revistas a nivel local y regional. Se incluyó solo una versión de cada trabajo, representando una vez a ambos brotes28,30. Finalmente, fueron incluidas nueve publicaciones28,30,32-38. En la (tabla 1) se resume la información obtenida en la revisión bibliográfica de las distintas fuentes.
Tabla 1: Resumen de información de trabajos obtenidos en la revisión bibliográfica sobre fiebre Q en Uruguay
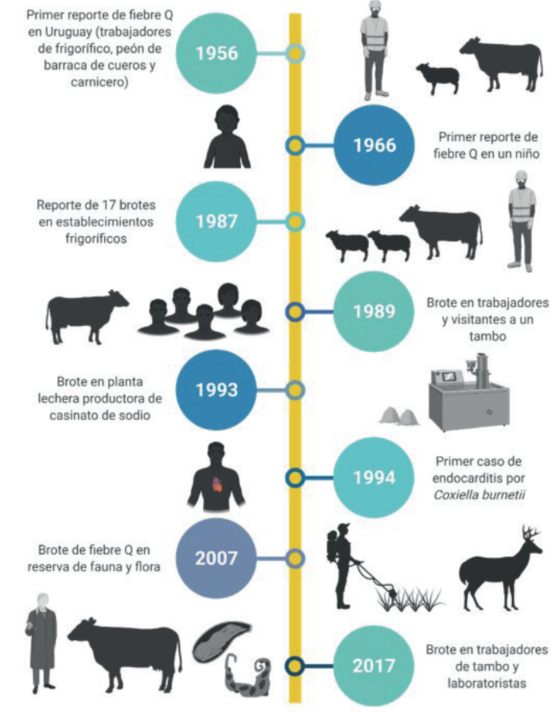
Las fuentes consultadas describen casos de fiebre Q en Uruguay en una ventana de 63 años (1956-2019) (figura 1). Todos los estudios fueron investigaciones originales (9/9) y uno30 incluyó también una breve revisión de casos previos (1/9). Dos publicaciones describieron casos individuales32,36, mientras que siete describieron series de casos28,30,33-35,37,38, de las cuales sólo una tenía un diseño de casos y controles anidado37.
El primer estudio de la enfermedad en Uruguay fue publicado en 195628. Este trabajo realizó una investigación seroepidemiológica mediante reacción de fijación del complemento (FC) y reacción de aglutinación en tubo capilar (AC) en 78 personas expuestas laboralmente a ganado (operarios de la playa de faena del Frigorífico Nacional y obreros de la industria de la carne) y en 15 enfermos febriles agudos de causa indeterminada del Instituto de Enfermedades Infecciosas, actual Instituto de Higiene, independientemente de cumplir o no labores de riesgo para fiebre Q. Siete personas de las expuestas laboralmente (7/78, 8,97%) fueron seropositivas con títulos de 1/16, pero sin especificación de tipo de anticuerpo. No se dispuso de información sobre manifestaciones clínicas. De los siete seropositivos, tres fueron evaluados por AC, dos por FC y dos por ambas técnicas. Del total de 15 enfermos febriles agudos, seis fueron seropositivos (6/15, 40,0%) con títulos 1/16 pero sin especificación de tipo de inmunoglobulina. Dos fueron evaluados por FC y cuatro por FC y AC. Sólo uno de ellos, trabajador de frigorífico, manifestó además de la hipertermia, cefaleas, astenia, sudoración y dolores abdominales. De los otros cinco seropositivos, tres realizaban trabajos que pudieron determinar un riesgo ocupacional (un trabajador de frigorífico, un peón de barraca de cueros y un carnicero) y dos carecían de vínculo epidemiológico con ganado.
En 1966 se publicó el primer caso de fiebre Q infantil, ocurrido en 1962 en una niña de 7 años oriunda de Pando, Canelones, con un cuadro encefalítico, manifestaciones bronconeumónicas y síndrome cutáneo caracterizado por múltiples máculas congestivas y equimosis en la piel del tronco y miembros inferiores32. Dos años luego de su internación, dos muestras de suero conservadas obtenidas en la etapa aguda y convaleciente, junto a una muestra colectada transcurridos 27 meses desde la etapa aguda fueron sujetos a una evaluación serológica en la que se estudiaron anticuerpos contra varios agentes virales y bacterianos, entre ellos C. burnetii mediante FC. Los títulos obtenidos fueron 1/128, 1/32 y 1/8, respectivamente, sin aclaración del tipo de inmunoglobulina estudiada. Los antecedentes personales incompletos, fundamentalmente la falta de datos epidemiológicos, impidieron la identificación de la fuente de exposición.
El primer caso de endocarditis por fiebre Q en Uruguay fue reportado en 1994 en un ayudante veterinario de frigorífico que había sido diagnosticado con un soplo sistólico con estenosis aórtica en su niñez36. Fue evaluado por inmunofluorescencia indirecta (IFI) para fiebre Q, presentando un título de 1/64 sin especificación de tipo de anticuerpo.
En 1987 tuvo lugar un brote de fiebre Q en una planta lechera productora de caseinato de sodio35. De los 27 operarios evaluados, siete (25,9%) resultaron seropositivos mediante IFI para detección de anticuerpos IgM anti C. burnetii. Los títulos de anticuerpos no fueron reportados. Sólo los siete operarios seropositivos presentaron cuadro clínico, cuyos síntomas predominantes fueron respiratorios, acompañados de hipertermia, cefaleas, sudoración y mialgias.
En el año 1988 se produjo el primer brote de fiebre Q con nexo a un establecimiento agropecuario con bovinos lecheros (tambo)34. Hasta ese momento todos los casos reportados habían ocurrido en establecimientos de faena de rumiantes, o habían estado asociados a la industria cárnica o a la comercialización de carne, excepto el caso en la niña32 y dos de los casos descritos en el primer reporte de la enfermedad en el país28, en los que el vínculo epidemiológico no fue establecido. El brote afectó a cinco adultos, trabajadores de un tambo de Maldonado y sus familiares, que habían visitado el tambo. Todos presentaron un cuadro clínico similar con fiebre, cefaleas, artromialgias, astenia, sudoración y tos. Se detectó IgM anti C. burnetii mediante IFI (título en todos los casos de 1/20) sin especificación de la fase antigénica. Se especuló que la infección resultó de la inhalación de material contaminado; ninguno de los afectados había consumido leche cruda.
La evaluación de un brote ocurrido en una reserva de fauna autóctona ubicada en Maldonado incluyó un estudio de casos y controles que involucró a 117 trabajadores (soldados, policías, técnicos y trabajadores de un restaurante ubicado dentro de la reserva)37. Un total de 25 trabajadores (25/117; 21,3%) resultaron seropositivos mediante IFI para IgM (1/50) e IgG (1/200). Todos los trabajadores seropositivos reportaron síntomas clínicos compartibles con fiebre Q como hipertermia (39-42°C), mialgias, cefaleas y dolor ocular, artritis y sudoración. No se reportó sintomatología en los trabajadores seronegativos.
La última publicación sobre la enfermedad investigó un brote en trabajadores de un tambo bovino y técnicos de un laboratorio de diagnóstico veterinario en Colonia38.
Discusión
En 2017 se registró un brote de abortos bovinos en un tambo de Colonia. Los fetos y placentas producto de estos abortos fueron enviados al laboratorio de la Plataforma de Investigación en Salud Animal de INIA La Estanzuela para investigación diagnóstica. La evaluación histopatológica, la identificación del agente mediante inmunohistoquímica y PCR, sumado al estudio y descarte de otros agentes abortígenos, permitió llegar al diagnóstico etiológico de placentitis y aborto por C. burnetii39. Este diagnóstico motivó la notificación al Ministerio de Ganadería Agricultura y Pesca y al Ministerio de Salud Pública, y la consiguiente evaluación serológica de 27 empleados del laboratorio y del tambo que habían tenido algún grado de exposición a los animales abortados o al material remitido para estudio. Se realizó un estudio retrospectivo en el cual se analizó el tipo de inmunoglobulinas (fase II anti C. burnetii IgG e IgM) y sus títulos esperados según el momento de la evaluación serológica en referencia a la posible ventana de exposición al ganado lechero abortado. Los resultados de esta investigación sugirieron que la exposición directa o indirecta al ganado abortado pudo haber sido una fuente del agente en estos trabajadores38. Esto motivó la realización de esta revisión histórica de casos de fiebre Q en Uruguay, evaluando sus características epidemiológicas, con especial interés en la fuente probable de exposición. Discutimos además los abordajes diagnósticos disponibles en la actualidad en el país.
El primer estudio de fiebre Q en Uruguay consistió en la investigación epidemiológica de sueros en un grupo de personas expuestas por su actividad laboral y una investigación clínica que permitió la comprobación del primer caso clínico en el país28,29. Desde 1956, se han identificado al menos 18 brotes de fiebre Q en trabajadores de frigoríficos y plantas procesadoras de carne mediante FC, AC, microaglutinación en lámina (ML) e IFI28-31,33,36. De un total de 1540 personas estudiadas serológicamente, 863 (56,0%) fueron positivas por alguna de estas pruebas (figura 2). Del total de positivas, 585 (585/863; 67,8%) presentaron síntomas compatibles, sin reporte del número de sintomáticos entre los seronegativos. Se registraron tres brotes en el sector lechero, uno en la industria láctea (planta lechera) y dos en tambos, estudiados mediante IFI cuantificando IgM anti C. burnetii en los dos primeros brotes e IgG e IgM anti C. burnetii fase II en el más reciente. En estos brotes ocurridos en el sector lechero, 20 personas (34,5%) fueron seropositivas de un total de 58 personas evaluadas34,35,38. Veintisiete personas del total de analizadas (27/58; 46,5%), y diecisiete del total de seropositivos (17/20; 85,0%), tuvieron síntomas clínicos compatibles con fiebre Q. Uno de estos brotes involucró a dos de cuatro laboratoristas de un laboratorio de diagnóstico veterinario38. Uno de los laboratoristas seropositivos reportó síntomas. Todos estos casos fueron vinculados epidemiológicamente con exposición a ganado o a material proveniente de ganado.

Figura 2: Frecuencia de personas evaluadas y seropositivas a Coxiella burnetii según ámbito de ocurrencia laboral.
El único brote con conexión epidemiológica con rumiantes silvestres cautivos se registró en una reserva de flora y fauna autóctona de Maldonado. Un total de 117 trabajadores fueron estudiados por IFI y 25 (21,4%) resultaron seropositivos37. Diecisiete personas del total de seropositivos (17/25, 68,0%) tuvieron síntomas clínicos, mientras que no se reportó el número de personas sintomáticas seronegativas. Se identificó por serología a un lote de venados de campo (Ozotoceros bezoarticus) como la fuente de infección más probable, a pesar de que otras fuentes no fueron investigadas y en consecuencia no descartadas37. Una alta mortalidad en el grupo de venados debido a trastornos respiratorios y dificultades al parto se había registrado desde 1990. Entre febrero y diciembre de 2003, un grupo de 20 cabras fue introducido y alojado en un potrero cerca de los venados. Se habían detectado garrapatas en la reserva, pero sin identificación de especie. Durante la última época de parición de los venados (octubre a abril), se registraron mortinatos y muerte de crías recién nacidas. Ningún estudio diagnóstico fue realizado sobre los venados muertos o abortados. Se comprobó una seropositividad del 22,7% de los venados adultos (5/22 sueros analizados) mediante ELISA. Fueron evaluadas cuatro cabras, resultando seronegativas. Se sospechó que los casos de fiebre Q pudieron haber resultado de la inhalación de partículas contaminadas con C.burnetii generadas durante tareas de corte de césped y rastrillaje de material cortado por el personal que carecía de adecuadas medidas de protección. Del total de trabajadores evaluados (117), 32 (27,3%) realizaban este tipo de tareas. Del total de seropositivos, 17 estaban expuestos a tareas de corte de pasto (17/32; 53,1%), mientras que ocho desempeñaban otras actividades dentro de la estación (8/85; 9,4%). Se estimó una concordancia temporal entre la aparición de los casos de fiebre Q en los trabajadores y la época de parición de los ciervos, momento en el que pudieron haber ocurrido altos niveles de excreción del agente al medio. Se evidenció una asociación significativa entre la realización de actividades que generan la aerolización de materiales o la exposición a los mismos y la presentación de anticuerpos contra C. burnetii. Según el monitoreo de enfermedades profesionales y accidentes de trabajo del BSE en los últimos periodos de reportes (2014-2019) se registraron 18 casos (13 hombres y cinco mujeres) de fiebre Q en Uruguay sobre un total de 1128 casos de enfermedades profesionales declaradas. Este es un monitoreo de patologías adquiridas por la exposición a factores de riesgo durante la realización de actividades laborales de todos los trabajadores dependientes, y de aquellos independientes que cuenten con un seguro a tal efecto donde están contemplados todos los grupos de trabajo del Ministerio de Trabajo y Seguridad Social. Todos los casos de fiebre Q fueron registrados en el litoral sur del país y fueron vinculados a la industria frigorífica o a actividades de ganadería o agricultura. La limitada información disponible impidió caracterizar estos casos en detalle. La información de este monitoreo no reporta los criterios diagnósticos, por ejemplo, si fue basado en serología y acompañado también por clínica, haciendo poco clara la definición de estos casos.
La mayoría de los estudios incluidos en esta revisión fueron estudios epidemiológicos descriptivos, solo un trabajo planteó un abordaje analítico-observacional mediante un estudio de casos y controles que permitió identificar factores asociados con la ocurrencia de la enfermedad37. Según las publicaciones incluidas en la revisión, la mayoría de los brotes fueron vinculados a factores de riesgo derivados de la organización del trabajo, fundamentalmente exposición a ovinos y bovinos en frigoríficos, y en menor medida a bovinos en establecimientos productores de leche. Todos los brotes de fiebre Q registrados en Uruguay han asumido la inhalación de partículas contaminadas como la vía más probable de transmisión. No existen reportes que sospechen infecciones por ninguna otra de las posibles vías de infección.
Por su manifestación clínica poco específica y el complejo diagnóstico de la enfermedad, los datos epidemiológicos (exposición a rumiantes) son de fundamental importancia40. Al tratarse de una bacteria altamente infecciosa, su cultivo se debe realizar bajo niveles III de seguridad biológica, condiciones disponibles sólo en un limitado número de centros de referencia y ninguno hasta el momento habilitado en Uruguay. El aislamiento no se incluye en la práctica de rutina diagnóstica porque, además de ser riesgoso, insume un prolongado tiempo de cultivo41. El diagnóstico de la enfermedad se realiza más frecuentemente de forma indirecta. Las pruebas serológicas incluyen ML, FC, ELISA, e IFI. La IFI es el método diagnóstico de referencia para fiebre Q, incluso mediante la evaluación de puntos únicos de muestreo1,42. La seroconversión mediante el análisis de muestras pareadas, o incrementos marcados de al menos cuatro veces el valor inicial de las inmunoglobulinas, son fuertes indicativos de exposición reciente.
Debido a la variación de los lipopolisacáridos de la membrana externa, C. burnetii tiene diferentes fases antigénicas (fase I y II), que determinan la formación de diversos tipos de anticuerpos (fase II anti C. burnetii IgG e IgM y fase I anti C. burnetii IgG, IgM e IgA). El perfil de inmunoglobulinas es empleado para distinguir entre exposiciones agudas y crónicas a C. burnetii y así estimar la ventana de exposición al agente. Por ejemplo, las exposiciones recientes se caracterizan por una reacción inmunológica contra antígenos de fase II, mientras que los anticuerpos antifase I predominan en las exposiciones de larga data43,44. Las estimaciones sobre la cinética de anticuerpos se han construido en base a datos de casos clínicos de fiebre Q14,22. No hay estudios disponibles sobre la cinética de la respuesta humoral en casos asintomáticos, que son, de hecho, el resultado más frecuente de la infección por C. burnetii. Los anticuerpos IgM fase II son los primeros en aparecer próximo a las dos semanas siguientes a la infección, pero son rápidamente superados por IgG II44. El pico de IgM II se da a las cuatro semanas posinfección y empieza gradualmente a decaer, mientras que los anticuerpos IgG antifase II tienen mayor persistencia, incluso de años. IgG antifase I aparece de forma más tardía y alcanza su pico a las 24 semanas posinfección44. En formas crónicas de la enfermedad, como las endocarditis, se encuentran altos niveles de IgG anti fase I e IgA anti fase I43.
El análisis completo del perfil de inmunoglobulinas provee un panorama mucho más informativo sobre el momento de exposición18. Las pruebas serológicas, incluyendo FC, ELISA e IFI presentan niveles adecuados de sensibilidad y especificidad. Entre estas, la IFI es la que presenta niveles más altos de ambos indicadores45. Por su lado, el ELISA y la FC han evidenciado algunas deficiencias puntuales en los niveles de sensibilidad para la detección de anticuerpos anti C. burnetii fase II y fase I, respectivamente45. Asimismo, el ELISA puede dar reacciones cruzadas frente a infecciones con otras bacterias intracelulares como Legionella o Bartonella6. Si bien la IFI es usada como la técnica de referencia, se sugiere el uso concomitante de PCR para la detección de ADN de C. burnetii en sangre o suero para identificar pacientes con exposición reciente en los cuales la seroconversión aún no ha ocurrido, o aquellos que recién están desarrollando anticuerpos y presentan muy bajos niveles de IgM fase II1,43. El uso complementario de las técnicas moleculares y serológicas parece ser el camino más adecuado a seguir en un abordaje diagnóstico. Mientras que la PCR es útil en las primeras fases de la infección, cuando las evaluaciones serológicas fallan en la detección de los anticuerpos, el ADN de C. burnetii se vuelve indetectable en las muestras de sangre a medida que la respuesta inmune se desarrolla, y es cuando la investigación serológica es clave46. La sensibilidad y la especificidad alcanzada por las PCR a tiempo final y a tiempo real son superiores a las obtenidas por las pruebas serológicas, especialmente aquellos protocolos que investigan segmentos genómicos que se encuentran en copias múltiples en el genoma (por ejemplo IS1111), lo que permite alcanzar incluso mayor sensibilidad de detección en comparación con evaluaciones de genes en copia única (por ejemplo Com1). Actualmente en Uruguay el diagnóstico se basa en serología por IFI y ELISA para los anticuerpos IgM e IgG fase I y II, el cual es realizado mediante kits importados en al menos tres laboratorios. No hay ningún laboratorio de diagnóstico humano que realice abordajes moleculares, por lo tanto no es posible la comprobación del patógeno en muestras clínicas humanas en el país. Sin embargo, en el campo veterinario se han realizado avances en este sentido, contando con una prueba de PCR a tiempo final para detección de C. burnetii en muestras de abortos bovinos en INIA, experiencia que podría ser capitalizada por laboratorios de humanos. El diagnóstico temprano, y por tanto la pronta implementación de tratamientos antibióticos, puede reducir la morbilidad asociada a los casos de fiebre Q y la proporción de casos que requieren hospitalización47.
Si bien existe evidencia acerca de la presencia de C. burnetii en Uruguay causando casos de fiebre Q desde hace más de medio siglo, este patógeno no parece estar comúnmente incluido dentro del abanico de agentes causales considerados por el personal médico ante casos clínicos con sintomatología compatible con fiebre Q. Los seres humanos cohabitamos en una relación compleja e interdependiente con animales de compañía, silvestres y de producción, de los que dependemos para nuestra alimentación y sustento, así como con los ecosistemas en los que nos alojamos. La presente revisión de casos de fiebre Q en Uruguay muestra fundamentalmente la exposición asociada al tipo laboral. Una estrecha colaboración entre médicos especialistas en salud ocupacional y aquellos del primer nivel de atención, infectólogos, y veterinarios parece ser esencial en el combate a las zoonosis desde la perspectiva de la salud pública.
Las enfermedades zoonóticas pueden transmitirse directamente por contacto con los animales, por el consumo de alimentos o por el contacto con el ambiente contaminado, así como también por la acción indirecta de vectores. Existen más de 800 patógenos zoonóticos42) que son responsables anualmente de más de dos millones de muertes y de causar enfermedad en más de dos mil millones de personas48. Las zoonosis son una problemática en ascenso, más de tres cuartos de los patógenos que afectan a humanos surgidos en las últimas décadas tienen conexión con animales49. En los últimos años se ha puesto énfasis sobre la importancia del vínculo entre las enfermedades en los animales, la salud pública y el medio ambiente, reflejado esto en el relativamente reciente tratamiento de la salud como un concepto único, bajo el lema de “una salud” (“One Health”)50.
Conclusiones
Existe evidencia de C. burnetii causando fiebre Q en Uruguay desde el año 1956. El diagnóstico presuntivo de esta afección zoonótica se vería facilitado en humanos al tener presente sus características epidemiológicas y el riesgo laboral. La fiebre Q debería considerarse dentro del abanico de enfermedades potenciales en pacientes con cuadros febriles de origen desconocido, especialmente en aquellos con algún tipo de conexión epidemiológica con rumiantes y sus productos. En todos los brotes de fiebre Q registrados hasta el momento se asumió la inhalación de partículas contaminadas como mecanismo de infección. Si bien las infecciones por otras vías no se han reportado ni sospechado localmente, estas vías infrecuentes de infección no deberían desestimarse.