Introducción
La neumonía es una de las principales causas de hospitalización y muerte a nivel mundial, representa la tercera causa de admisión hospitalaria y es la principal causa infecciosa de ingreso a la unidad de cuidados intensivos (UCI). Determina una mortalidad global de 10% a 14%, siendo más elevada en los mayores de 65 años y en pacientes con comorbilidades, llegando hasta un 50% en aquellos que requieren ingreso a UCI1. Concomitantemente la neumonía nosocomial y la asociada a la ventilación mecánica constituyen una de las principales infecciones asociadas a cuidados de la salud en pacientes hospitalizados, determinando importante morbilidad, mortalidad y aumento de la utilización de recursos2.
La identificación precoz del microorganismo causante de infección permite dirigir el tratamiento antibiótico, reduciendo la morbimortalidad y mejorando el pronóstico, al disminuir la terapia antibiótica inicial inadecuada (TAII). En pacientes con sepsis grave la TAII puede llegar a triplicar el riesgo de mortalidad intrahospitalaria3. Diferentes estudios con gran número de pacientes han demostrado el impacto de la TAII en la mortalidad por sepsis4, siendo clásico el trabajo de Kumar donde la administración eficaz de antimicrobianos en la primera hora de hipotensión documentada se asoció con un aumento de la supervivencia al alta hospitalaria en pacientes adultos con shock séptico5. Estrechamente vinculado a lo anterior, el aumento de la resistencia microbiana es un problema de salud mundial, con alto impacto en la mortalidad de pacientes críticos, ya que la multirresistencia es una de las principales causas de TAII. Esta situación genera un círculo vicioso caracterizado por la necesidad de ampliar el espectro antimicrobiano empírico, conduciendo muchas veces a sobretratamiento, toxicidad y presión de selección de microorganismos resistentes, resultando en un aumento progresivo de tratamientos empíricos inadecuados y muerte6,7.
Para abordar la problemática señalada, se han diseñado estrategias basadas en la administración de antimicrobianos dentro de un enfoque multidisciplinario (médicos clínicos, infectólogos, microbiólogos, farmacólogos), denominadas programas de optimización antimicrobiana (Antimicrobial Stewardship Program). El objetivo de estos programas es combatir la resistencia bacteriana, mejorar los resultados clínicos y controlar los costos asociados al uso de antimicrobianos8,9. Uno de los pilares de estos programas es la utilización de nuevas herramientas diagnósticas, logrando disminuir el tiempo de identificación microbiológica y la susceptibilidad antibiótica. Por métodos microbiológicos convencionales, el tiempo promedio de identificación de gérmenes en muestras respiratorias es de 48-72 horas. En los últimos años se han desarrollado nuevos métodos de diagnóstico microbiológico, destacándose la técnica de amplificación de ácidos nucleicos mediante reacción en cadena de la polimerasa en tiempo real (PCR), con la que el tiempo de diagnóstico microbiológico se reduce a solo algunas horas, con la ventaja además de poder identificar agentes virales, de difícil aislamiento por métodos tradicionales10. Además puede detectar genes involucrados en mecanismos de resistencia, permitiendo adoptar en forma temprana medidas de aislamiento, así como la adecuación del plan antibiótico7,11.
En nuestro hospital contamos recientemente con el sistema de PCR multiplex Biofire® Pneumonia Panel plus, por lo que decidimos llevar adelante el siguiente estudio teniendo como principal objetivo determinar la utilidad del panel respiratorio en el diagnóstico microbiológico precoz y la adecuación de la antibioticoterapia empírica en pacientes con neumonía ingresados en UCI comparado con métodos de cultivo tradicionales.
Material y métodos
Se realizó un estudio descriptivo, retrospectivo y observacional. Se incluyeron pacientes mayores de 18 años internados en la UCI del Hospital Maciel que ingresaban o desarrollaban neumonías en el periodo comprendido entre junio de 2020 y julio de 2021. En estos pacientes además de estudios microbiológicos tradicionales (hemocultivos, cultivos respiratorios, antígeno neumocócico o Legionella pneumophila en orina), en casos seleccionadas se realizó panel neumonía (PN) en muestras respiratorias. Los criterios para solicitar PN fueron: pacientes graves con diagnóstico clínico-radiológico de neumonía pero sin diagnóstico microbiológico inicial, pacientes con antibioticoterapia previa o inmunodeprimidos, pacientes que si bien tenían diagnóstico microbiológico presentaban mala evolución y aquellos con dudas acerca del foco infeccioso. La identificación microbiana convencional se realizó inicialmente por espectrometría de masas MALDI-TOF MS (matrix assisted laser desorption ionization-time of flight-mass spectrometry) (BioMérieux®Inc Durham), complementándose por métodos automatizados de identificación y susceptibilidad antibióticas: VITEK® 2 (BioMérieux®Inc Durham).
En relación a las infecciones respiratorias bajas definimos neumonía aguda comunitaria (NAC) a aquella en la que el paciente no ha tenido contacto reciente con centros asociados al cuidado de la salud (internaciones hospitalarias, centros de diálisis); neumonía nosocomial (NN) a aquella neumonía iniciada después de las 48 horas del ingreso hospitalario en pacientes sin asistencia respiratoria mecánica (ARM), mientras que la neumonía asociada a la ventilación mecánica (NAV) se consideró a partir de las 48 horas de ARM invasiva12.
Biofire® Pneumonia Panel plus
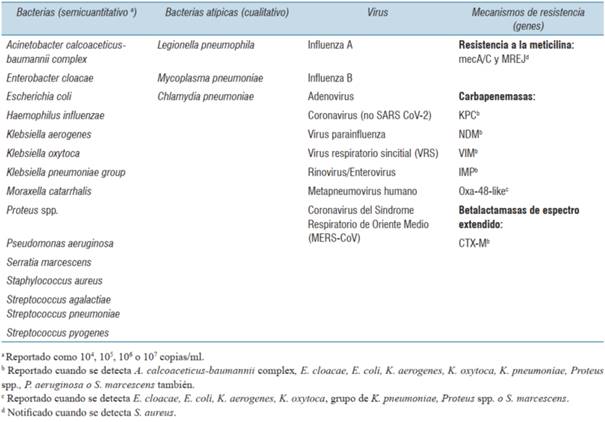
El PN utilizado es una prueba de diagnóstico molecular in vitro basada en PCR que analiza muestras respiratorias y es capaz de identificar simultáneamente en aproximadamente una hora 27 patógenos frecuentemente involucrados en infecciones del tracto respiratorio inferior y 7 marcadores genéticos de resistencia antibiótica. Esta prueba identifica 18 bacterias (11 Gram negativas, 4 Gram positivas y 3 atípicas) y 9 virus que causan neumonía. Dentro de la identificación bacteriana, 15 gérmenes se informan semicuantitativamente, siendo el punto de corte de detección por encima de 1035 copias de genomas/ml. Las tres bacterias atípicas, 9 virus y 7 genes de resistencia se informan cualitativamente (tabla 1). La técnica se encuentra validada para aplicación en muestras respiratorias que incluyen expectoración, aspirado traqueal (AT) y lavado bronquioalveolar (LBA).
Análisis estadístico
Para la recolección de datos se utilizó el sistema de gestión informatizado (Epimed Monitor UCI®), asegurando confidencialidad de los mismos. Se analizaron datos demográficos, motivo de ingreso, gravedad (SAPS II, Simplified Acute Physiology Score), necesidad de ARM y mortalidad. Se revisaron las historias clínicas obteniendo datos sobre tipo de neumonía, antibioticoterapia empírica, motivo de solicitud del PN. Todos los resultados de PN se cotejaron con sus respectivos cultivos para determinar el diagnóstico microbiológico definitivo.
Los cultivos respiratorios se procesaron: AT en forma cualitativa según desarrollo en cuadrantes: sin desarrollo, escaso (+1), moderado (+2), abundante (+3), muy abundante (+4), interpretando +4 como >105 UFC/ml, como punto de corte significativo; LBA procesado en forma cuantitativa, considerando recuentos de ≥104 UFC/ml como punto de corte significativo. Se evaluó calidad de las muestras (esputo, AT) con tinción de Gram, según presencia de células inflamatorias polimorfonucleares (PMN >25) y células descamativas epiteliales (<10) del tracto respiratorio. En LBA se valoró la presencia de PMNs y bacterias. Se realizó tinción de Ziehl Neelsen complementariamente en algunas situaciones. Se utilizaron medios de cultivo de agar sangre ovina, agar chocolate y Mac Conkey agar, incubándose a 35 ºC -36ºC, 48 h al aire y atmósfera de CO2 5%-10% (AS-ACHOC). Se utilizaron también métodos fenotípicos para la detección de resistencia bacteriana como ser cromatográficos para carbapenemasas (test NG CARBA-5Ô; NG Biotech, Francia) difusión en agar con discos inhibidores (ROSCOÔ Diagnostica, DK Taastrup), test enzimáticos para detección de betalactamasas (bLactaÔ test BIO-RAD, France), test modificado de inactivación de carbapenem para carbapenemasas (CLSI M100, ED 31:2021), se estudió la sensibilidad a colistina de ser necesario, con prueba de elución con discos de colistina en tubos (Colistin Broth Disk Elution CLSI M100, ED 31:2021). Se priorizó la comunicación rápida de resultados del PN por medio de aplicaciones móviles (“apps”) como estrategia para optimizar tiempos de respuesta rápidos.
La comparación de resultados por ambos métodos podía ser concordante o discordante. Se consideró concordancia positiva cuando cultivo y PN coincidían en los microorganismos y en la resistencia, mientras que se definió concordancia negativa a la ausencia de recuperación de germen en ambos métodos. Por último, los estudios eran discordantes cuando diferían en los microorganismos o en sus mecanismos de resistencia. Por tanto, utilizando como gold standard los métodos microbiológicos convencionales se definieron en las determinaciones bacterianas los siguientes indicadores de acuerdo para el análisis de concordancia entre panel y cultivo:
- Acuerdo positivo: verdadero positivo = panel positivo y cultivo positivo.
- Acuerdo negativo: verdadero negativo = panel negativo y cultivo negativo.
- Falso positivo = panel positivo y cultivo negativo.
- Falso negativo = panel negativo y cultivo positivo.
Se calculó el porcentaje de concordancia positiva (PCP) como (verdadero positivo / (verdadero positivo + falso negativo)) 100% y el porcentaje de concordancia negativa (PCN) fue calculado como (verdadero negativo / (verdadero negativo + falso positivo)) 100%.
Durante el período del estudio se realizaron reuniones periódicas entre el staff de la UCI y microbiólogos para la revisión de cada uno de los casos y valoración del impacto clínico del PN. Con el resultado del PN, definimos cinco posibles conductas respecto a la antibioticoterapia: sin cambios, escalada, desescalada, adecuación o interrupción del tratamiento. Se definió desescalada cuando se cambió un plan inicial efectivo por uno de menor espectro dentro del misma clase de antibióticos (por ejemplo, ceftazidime por ampicilina sulbactam), o de una clase diferente (por ejemplo, vancomicina a cefazolina) o la interrupción de uno o más medicamentos de un plan combinado. Por el contrario, el aumento del espectro antibiótico se definió como escalada. La adecuación terapéutica se definió como el inicio o cambio de antibiótico no efectivo o no de elección, a otro antibiótico de similar espectro de acción. Para esto se tomó en cuenta la antibioticoterapia prescripta dentro de las 48 h previas a la toma de la muestra de secreciones13. En relación al tratamiento antibiótico, nuestro servicio se basa en las pautas ConsenSur II para el tratamiento de la NAC, y en las guías IDSA (Infectious Diseases Society of America) y pautas de la Sociedad Argentina de Terapia Intensiva para tratamiento de las NAV14-16.
En el procesamiento estadístico se utilizó Statistical Package for the Social Sciences (SPSS) versión 21. Se realizó un análisis descriptivo para la distribución de frecuencias absolutas y relativas de las variables estudiadas. En las cuantitativas se calcularon medidas descriptivas como media y desvío estándar, y porcentajes para las cualitativas. Para el análisis de asociación de variables categóricas se aplicó test de chi cuadrado o test exacto de Fisher, según correspondiera. En los porcentajes de concordancia se estimaron intervalos de confianza 95% para proporciones binomiales. Se consideró como estadísticamente significativo un valor p <0,05.
Resultados
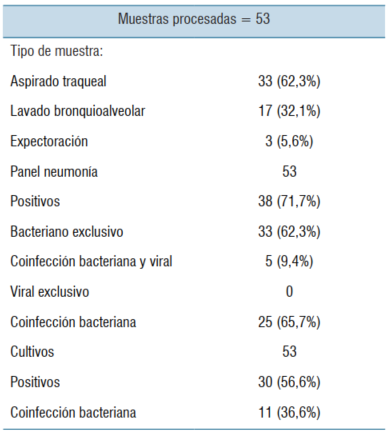
Se incluyeron un total de 51 pacientes que presentaron un total de 53 episodios de neumonía en los cuales se aplicó el PN. En la (tabla 2) se resumen las características de la serie. 13 pacientes presentaban algún tipo de inmunocompromiso, 5 pacientes tenían virus de la inmunodeficiencia humana (VIH), 3 recibían corticoterapia en forma crónica y 5 pacientes tenían algún tipo de enfermedad neoplásica al momento del ingreso. La principal causa de ingreso fue la patología respiratoria con 67% de los casos, seguida por pacientes neurocríticos en un 23% y, en menor medida, politraumatizados graves, con patología cardiovascular y postoperatorios de cirugía compleja.
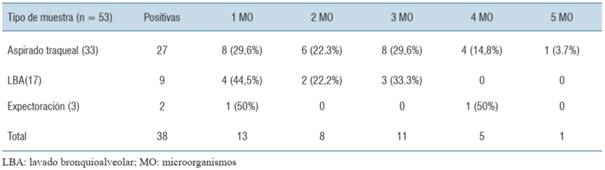
De las 53 muestras analizadas, la mayoría correspondieron a secreciones respiratorias obtenidas por AT (62,3%). Se obtuvo identificación microbiológica en 38 (71,7%) de los PN, frente a 30 (56,6%) de los cultivos correspondientes, valor p no significativo. En 33 de los paneles se identificaron exclusivamente bacterias y en los 5 restantes se detectó asociación viral y bacteriana. De los cultivos con desarrollo, el 36,6% presentó más de una bacteria, mientras que de los paneles positivos el 65,7% identificó más de una bacteria. Estos datos se muestran en la (tabla 3), mientras que la (tabla 4) resume el número de microrganismos detectados en función del tipo de muestra.
Tabla 4: Número de microorganismos detectados por el panel neumonía discriminado por tipo de muestra.
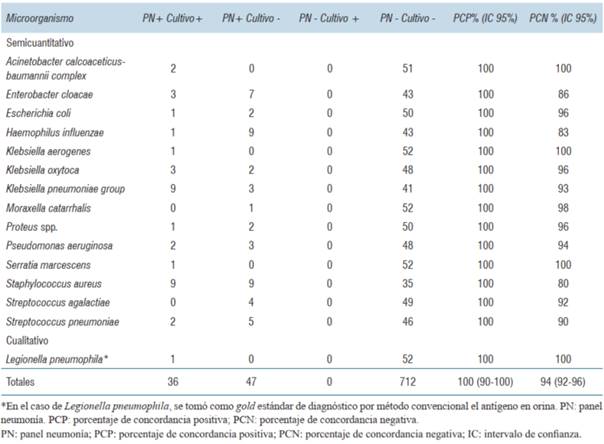
El germen más identificado en PN fue el Staphylococcus aureus, seguido por Klebsiella pneumoniae, Haemophilus influenzae y Enterobacter cloacae. El virus más frecuentemente identificado fue rinovirus/enterovirus y entre las bacterias atípicas se identificó un solo caso de Legionella pneumophila. En cuanto a genes de resistencia el panel informó 9 detecciones, el más frecuente la betalactamasa de espectro extendido (BLEE) CTX-M. En (tabla 5) se presentan todos los elementos detectados por PN, mientras que en (tabla 6) se resume la concordancia entre resultados del panel y métodos de microbiología convencionales. En relación a la evaluación general del desempeño del panel, se halló un PCP del 100% (IC 95%: 90-100) y PCN del 94% (IC 95%: 92-96) en comparación con métodos tradicionales microbiológicos. Un resultado PN negativo y cultivo positivo ocurrió exclusivamente en el caso de gérmenes no testeados por el panel, aislándose dos casos de Stenotrophomonas maltophilia, uno de Staphylococcus epidermidis, uno de Staphylococcus haemolyticus, uno de Pantoea spp., uno de Citrobacter braakii, y un caso de Candida spp.
Tabla 6: Concordancia entre la identificación de microorganismos detectados en panel neumonía y la microbiología convencional.
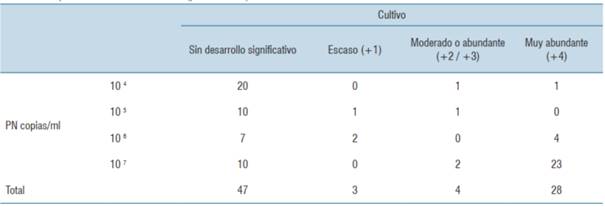
En la (tabla 7) se observa la relación entre recuento semicuantitativo del PN frente a desarrollo semicuantitativo del cultivo bacteriano. En los cultivos que presentaron muy abundante desarrollo (+4) de un determinado germen, el PN informó un recuento de 107 en 82% (23/28), pero detección de 104 o 105 en un solo caso (3,6%). En el caso opuesto de cultivo sin desarrollo, una detección de 107 ocurrió solo en 21% (10/47), predominando en este grupo sin desarrollo las cuantificaciones bajas (104/105), en 64% de los casos (30/47). En el análisis de chi cuadrado se encontró asociación estadística entre ambas variables con valor p <0,0001.
Tabla 7: Relación entre recuento semicuantitativo del panel neumonía y desarrollo semicuantitativo del cultivo bacteriano por métodos habituales (p <0,0001).
En relación a la detección de resistencia, el PN informó 9 resultados: cinco CTX-M, tres resistencia a meticilina y un NDM. De las cinco CTX-M informadas por el PN, el cultivo desarrolló bacterias con BLEE en tres casos, mientras que en los dos restantes no se recuperó germen. En los tres S. aureus con resistencia a meticilina (SAMR) detectados por el panel, el cultivo desarrollo SAMR en dos casos ya que en el tercero no hubo desarrollo. Hubo una única detección de carbapenemasas en la serie y fue de tipo NDM, en este caso panel y métodos tradicionales coincidieron. En un caso los métodos tradicionales informaron mecanismo de resistencia no detectado por PN (resultado falso negativo); panel y cultivo coincidieron en identificación (K. oxytoca) pero el PN no detectó resistencia mientras que el cultivo informó el germen como BLEE.
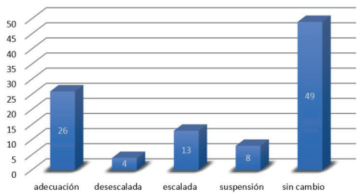
En cuanto al impacto del PN en la antibioticoterapia se encontró una modificación de la misma a partir del resultado del PN en un 51%; en la (figura 1) se describe el tipo de cambio realizado.
Discusión
Las opciones actuales de pruebas de diagnóstico etiológico de infecciones respiratorias incluyen cultivo, pruebas moleculares y detección de antígenos. En los últimos años se han publicado múltiples estudios que avalan la utilización de la técnica de PCR para diagnóstico en infecciones graves. El diagnóstico molecular rápido basado en paneles ha demostrado disminución del tiempo de identificación microbiológica en bacteriemias, así como reducción de la antibioticoterapia de amplio espectro y el tratamiento de contaminantes17,18. Hallazgos similares informan estudios en infecciones respiratorias: el trabajo francés conducido por Peiffer sugiere que el uso de sistema multiplex PCR (Unyvero platform, Curetis AG, Holzgerlingen, Germany) en pacientes con neumonía grave, mejora la terapia antimicrobiana empírica y reduce el uso de antibióticos de amplio espectro19. En lo que respecta específicamente al Pneumonia Panel plus, varios estudios previos han encontrado una excelente concordancia entre este método molecular y el cultivo estándar20-22.
Nuestra serie consta de 51 pacientes etariamente jóvenes (media 45,6 años), cursando casi la mitad NAC (47,2%) y el resto NN o NAV. Estas infecciones fueron graves, lo que se evidencia por el SAPS elevado, el requerimiento de ARM mayor al 90%, el shock en 37,2% y el síndrome de distrés respiratorio agudo (SDRA) en una tercera parte de los casos, además de estadía en UCI prolongada con media de 19,7 días. Todo esto determina la elevada mortalidad encontrada que se situó en un 37,2%. El diagnóstico etiológico de las neumonías fue elevado, obteniendo un germen en el 56,6% de los cultivos y mejorando esta cifra con el PN que permitió identificación microbiológica en 71,7% de los casos. La prevalencia de enfermedad por COVID fue de un 23,5%, mientras que la identificación de otro virus por el PN fue baja, con solo 5 dianas virales, destacándose la ausencia de influenza, lo que resulta concordante con la baja circulación del virus durante el periodo del estudio tanto en Uruguay como en el resto del Cono Sur23. La identificación de la etiología infecciosa específica en pacientes con neumonías graves es relevante y se ha asociado con reducción estadísticamente significativa de la mortalidad, al permitir una terapia eficaz dirigida24. Es en estos pacientes graves donde la PCR ha demostrado mayor utilidad, permitiendo un diagnóstico microbiológico precoz con adecuación del tratamiento antibiótico, disminuyendo la TAII y mejorando los resultados25.
Como describimos en las (tabla 3) y (tabla 4), la mayoría de los PN con resultados positivos identificaron coinfección bacteriana o bacteriana/viral. Si nos centramos solo en la identificación bacteriana, de los 38 resultados positivos solo 13 PN detectaron exclusivamente una sola bacteria, mientras que en los restantes 25 (65,7%) se identificaron dos o más bacterias, con un máximo de 5 dianas bacterianas en el caso de un panel. Al analizar los cultivos positivos, el desarrollo múltiple se presentó en un porcentaje menor, alcanzando un 36,6%, pero con ningún desarrollo de más de dos gérmenes. Trabajos similares al nuestro coinciden en un nivel elevado de detección de más de un germen, con porcentajes de detección múltiple de la PCR de entre 42,3% a 48%20,21. Existe evidencia reciente que cuestiona el paradigma tradicional de neumonía monomicrobiana, describiéndose episodios de coinfecciones bacterianas, además del reconocimiento de coinfección viral en un número importante de casos, incluidos casos de NN26. Hasta hace relativamente poco años se creía que, si bien la infección viral respiratoria era habitual, su evolución hacia neumonía e insuficiencia respiratoria severa era infrecuente. En las últimas dos décadas, la aparición de técnicas diagnósticas sofisticadas y la evidencia empírica obtenida a partir de la epidemia del síndrome respiratorio agudo y grave (SARS) causada por SARS-CoV en 2003, de la pandemia por gripe A (N1H1) en 2009 y actualmente la pandemia a SARS-CoV-2, permitió reconocer a los virus como agentes de neumonías graves ya sea como agente único o en coinfecciones bacterianas27. En este sentido, en un estudio previo realizado en nuestra UCI en pacientes con infección respiratoria aguda grave, utilizando métodos de biología molecular, hallamos un porcentaje elevado de coinfección bacteriana/viral de 17%28. De todas formas, en caso de hallazgos de múltiples gérmenes, el diagnóstico de coinfección es complejo y definir al verdadero patógeno responsable de la infección no resulta sencillo. La cuantificación de carga microbiana por métodos moleculares puede ser de ayuda, ya que los aislamientos con mayores cargas en copias/ml (>106/107), tienen más probabilidades de ser clínicamente significativos29. Por otra parte, trabajos que comparan la concordancia en la semicuantificación bacteriana entre PN y cultivos tradicionales muestran una coincidencia de entre 23%-53%, encontrándose en el panel habitualmente valores mayores en copias/ml que los hallados en UFC/ml en los cultivos, describiéndose una relativa sobreestimación de carga bacteriana por parte del PN20,30,31.
En relación al desempeño general del panel, la concordancia encontrada en nuestro trabajo entre PN y el cultivo de rutina bacteriano, fue elevada con un PCP de 100% y un PCN de 94%. Estos resultados son similares a los reportados por Buchan, que informa un PCP de 96,2% y un PCN de 98,1% sobre 259 muestras respiratorias. Este trabajo encuentra resultados falsos negativos solo en tres casos, correspondiendo todos los cultivos a un desarrollo de 103 UFC/ml, situándose por debajo del umbral de detección del panel (21). Este alto nivel de concordancia es ratificado en un reciente estudio multicéntrico dond, sobre 2.476 muestras se obtuvo un PCP de 92,9% y PCN de 96,1%31. En nuestra serie no obtuvimos ningún falso negativo (lo que explica el PCP de 100%), ya que los únicos casos con desarrollo bacteriano pero PN negativo correspondieron a gérmenes no incluidos en el panel. Algunos de estos gérmenes fueron interpretados como contaminantes o colonizantes en el caso de pacientes inmunocompetentes (S. epidermidis, S. haemolyticus, C. albicans) o como agentes poco frecuentes de neumonía en pacientes inmunocomprometidos (S. maltophilia, Citrobacter spp., Pantoea spp.). Por lo tanto se debe recordar que, si bien el PN detecta gran número de microorganismos, la prueba no es exhaustiva y existen patógenos no incluidos que hay que tener presente: Morganella spp., Citrobacter spp., S. maltophilia, Nocardia spp., Mycobacterium tuberculosis, Pneumocystis jirovecii y otros hongos patógenos. La PCR condujo a un diagnóstico no sospechado de legionelosis que fue concordante con el antígeno de Legionella pneumophila en orina.
En nuestra experiencia clínica, un PN negativo descarta una neumonía por gérmenes habituales y nos obliga (de existir alto nivel de sospecha de infección respiratoria) a plantear gérmenes específicos, o a la búsqueda en otros casos de un foco alternativo al respiratorio. En este sentido queremos destacar en nuestra serie dos ejemplos clínicos. El primero, una paciente de sexo femenino, VIH negativo, bajo tratamiento corticoide crónico, ingresada a UCI con planteo de NAC. La radiografía de tórax mostraba compromiso intersticial a predominio perihiliar bilateral, y el PN no detectó ningún germen, por lo que se decidió la realización de fibrobroncoscopía con LBA para búsqueda de Pneumocystis carinii, que resultó positiva. El segundo caso se trataba de un paciente de sexo masculino cursando postoperatorio de esofagectomía por cáncer esofágico, que 48 h después de la cirugía instaló fiebre y disnea, con radiografía que mostraba consolidación bibasal. Se planteó inicialmente NN realizándose PN que fue negativo, por lo que se solicitó tomografía de tórax que mostró colección mediastinal, llevando a la reintervención quirúrgica, constándose mediastinitis posterior.
El PN identificó 47 determinaciones bacterianas que no fueron reportadas por los cultivos (tabla 6). Las detecciones con cultivos negativos más comunes fueron S. aureus, H. influenzae, E. cloacae y S. pneumoniae, aunque se observó al menos una detección de cultivo negativo para todos los gérmenes menos para A. baumannii, K. aerogenes y S. marcescens. En estos casos “falsos positivos” la mayoría de las identificaciones del PN (30/47, 64%) correspondieron a cuantificaciones bajas de 104 o 105, sumado a que la gran mayoría de los pacientes (86,8%) habían recibido antibióticos previos a la toma, lo que podría explicar en parte la ausencia de desarrollo en los cultivos, ya que la exposición a antibióticos previa a la recolección puede reducir drásticamente la recuperación de patógenos potenciales a partir de muestras clínicas32,33. Además, se debe tener presente, que el aumento de resultados positivos en pruebas moleculares puede deberse a que las mismas detectan tanto organismos viables y no viables (de ahí que no se recomiende para el seguimiento del tratamiento), así como detección de gérmenes en bajo conteo o no recuperados en cultivo debido a características de crecimiento exigentes como se describe por ejemplo en H. influenzae21. Por el contrario, cuando el cultivo bacteriano presentó muy abundante desarrollo de un determinado germen, el PN mostró adecuado nivel de correlación cuantificando dicho germen en 107 copias/ml en un 82% de los casos (tabla 7), encontrándose asociación estadísticamente significativa entre el recuento semicuantitativo del PN y el desarrollo semicuantitativo de los cultivos por métodos habituales (p <0,0001). Por lo tanto, la diferenciación de colonización e infección resulta un desafío. No existe actualmente evidencia clara sobre la cinética de aclaramiento del material genómico bacteriano en el pulmón, por lo que en métodos tan sensibles como la PCR se debe ser cauteloso, ya que se puede incurrir en sobrediagnóstico. Si bien no se describen umbrales consensuados, determinaciones elevadas de 106 o 107 copias/ml de un germen patógeno sumado a una correcta interpretación clínica permitirá realizar un diagnóstico de alta probabilidad de infección pulmonar25.
En lo que respecta a la detección de marcadores de resistencia a antibióticos, el PN informa condicionalmente la presencia de resistencia genética en el caso de muestras con patógeno bacteriano identificado (estando los genes no necesariamente asociados al mismo) por lo que, si se identifican diferentes bacterias y un gen de resistencia, no será posible vincular la resistencia a uno de los microorganismos detectados. Además, la sobreexpresión de algunos genes de resistencia intrínsecos (como la β-lactamasa AmpC) no es detectado por el panel, así como BLEE diferentes del grupo CTX-M o carbapenemasas diferentes a las del panel. El impacto de la detección molecular de mecanismos de resistencia antimicrobiana se ha asociado con resultados positivos que incluyen, reducción del tiempo hasta el inicio de antibioticoterapia apropiada, disminución de la estadía en UCI y reducción de la mortalidad34,35. En nuestra serie, en los S. aureus el PN detectó tres casos de resistencia a la meticilina coincidiendo (2/2) con cultivo de SAMR ya que en el tercer caso el cultivo no desarrolló germen. En ensayos clínicos de gran tamaño que aplican el PN sobre muestras de LBA, la sensibilidad para la detección de resistencia a la meticilina se situó en 88,9% y la especificidad en 91,4%36, siendo estos resultados comparables a los de otras técnicas de biología molecular37, concluyendo ambos estudios que el diagnóstico por este método es confiable para la detección de SAMR en pacientes con neumonía, permitiendo el ajuste de la terapéutica antibiótica. La incidencia de carbapenemasas en la serie fue muy baja, aislándose un solo caso de Enterobacter cloacae productor de NDM, siendo coincidentes el PN y los métodos fenotípicos utilizados. El mecanismo de resistencia más frecuentemente hallado fue la identificación de BLEE, donde el PN detectó en cinco casos el gen CTX-M, coincidentes en tres casos con el cultivo, mientras que en los dos restantes casos el cultivo no presentó desarrollo. El único caso de la serie donde se encontró un falso negativo (cultivo con germen resistente no detectado en PN) fue en el caso de una K. oxytoca identificada por ambos métodos, pero informada BLEE solo por el VITEK2 y otros métodos fenotípicos. Debemos tener presente que, si bien la CTX-M es la enzima mayormente implicada en la determinación de este tipo de resistencia, existen diversidad de enzimas capaces de conferir el fenotipo BLEE. Un razonamiento similar podemos aplicar a las enzimas productoras de carbapenemasas que abarcan un gran número de enzimas más allá de las testeadas por el PN.
De acuerdo con nuestros datos y coincidiendo con la literatura analizada podemos afirmar que el valor predictivo positivo del PN es elevado para la detección de mecanismos de resistencia, lo que implica que la detección de un marcador genético específico indica alta probabilidad de resistencia fenotípica a la correspondiente clase de antibióticos. Esta detección permitirá una temprana escalada terapéutica además de la implementación de prácticas adecuadas de aislamiento para la prevención y el control de infecciones. Por el contrario, el valor predictivo negativo es reducido, por lo que el hecho de no detectar un gen específico no debe interpretarse como fenotipo de susceptibilidad. Como siempre la “gestión del riesgo” para resistencia bacteriana es fundamental en la definición del plan antibiótico en pacientes graves21.
Basándonos en los resultados del PN definimos, en más de la mitad de los casos (51%), un cambio en la conducta antimicrobiana empírica. La adecuación del plan antibiótico en 26% de los casos fue la modificación más frecuente (habitualmente cambio de ampicilina sulbactam por cefalosporinas de primera o tercera generación no antipseudomónicas), seguida por 13% de escalada del plan antimicrobiano (inicio de carbapenémicos al detectar CTX-M, colistina en detección de NDM, ceftazidime al detectar Pseudomonas aeruginosa o vancomicina si SAMR), suspensión en 8% y desescalada en 4% de los paneles (suspensión de antibióticos en terapia combinada). Cabe aclarar que cuando el resultado del PN determinó modificación del plan antibiótico, el informe posterior del cultivo no alteró en ningún caso dicha conducta, no ocurriendo en esta serie terapéutica inadecuada inducida por el resultado del panel.
Como hemos analizado anteriormente, el acrescente desarrollo de resistencia bacteriana es un problema mundial. El tratamiento de infecciones graves nos enfrenta continuamente al delicado equilibrio entre un plan antibiótico que asegure una adecuada terapia inicial y el riesgo de aumentar la resistencia bacteriana. Es aquí donde los métodos de diagnóstico rápido cobran valor, pudiendo reducir la exposición a antibióticos innecesarios y de amplio espectro, dirigiendo la terapia para tratar los patógenos más probables en función de los factores de riesgo del paciente38. Los estudios que analizan el impacto de la PCR en pacientes con neumonía muestran una elevada tasa de adecuación de la terapia antibiótica. El estudio multicéntrico francés conducido por Monard encontró un 77% de cambio en los antimicrobianos empíricos con la utilización de la PCR, demostrando que el tratamiento antibiótico guiado por PCR fue más frecuentemente adecuado en comparación con el tratamiento empírico25. El estudio de Peiffer que evaluó el rendimiento e impacto de PCR multiplex en pacientes de UCI cursando NN o NAV, comunicó que la PCR podría haber conducido al inicio más temprano de un antibiótico eficaz en 21% de los pacientes y a la desescalada temprana en 39%, llevando a solo 1% de terapia inadecuada. Todo esto con una mediana del tiempo de respuesta de la prueba de 4,6 h19. Si bien en nuestro estudio no analizamos específicamente la variable tiempo hasta la obtención de los resultados microbiológicos, operativamente el tiempo desde la toma de la muestra respiratoria hasta el resultado del PN promedió entre 2-3 h, en comparación a 48 h por métodos tradicionales.
Una de las limitaciones sustanciales de este estudio, destacada en otros similares, es la falta de un adecuado método de referencia o gold standard contra el cual comparar la técnica. Probablemente la PCR tenga mejor sensibilidad que los cultivos tradicionales o la investigación serológica, lo que determina dificultades de interpretación clínica de los “falsos positivos” y estimación de la precisión diagnóstica del test. Otras limitaciones a tener presente es el de ser un estudio realizado en un solo centro, con relativo bajo número de pacientes y correspondientes a grupos heterogéneos de patologías.
Conclusión
La aplicación clínica de una nueva herramienta diagnóstica implica desafíos que incluyen la revisión del tema, correcta interpretación de los resultados y una necesaria interacción entre el médico clínico y microbiólogo. El PN es un método rápido y preciso, de gran utilidad en el diagnóstico microbiológico precoz y la toma de decisión inicial en cuanto a la antibioticoterapia a implementar. No sustituye a los métodos tradicionales, pero los complementa. Los resultados negativos deben hacernos pensar en gérmenes menos frecuentes o a replantear el diagnóstico.