Introducción
El cáncer más frecuente en los seres humanos es el cáncer de piel no melanoma (CPNM), constituido principalmente por el carcinoma basocelular (CBC) en 75%-80% y el carcinoma de células escamosas (CCE) en 25%1-3.
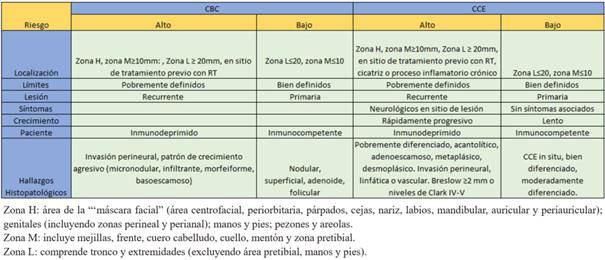
Los CPNM se pueden clasificar en tumores de alto o bajo riesgo. Existen tres zonas corporales de riesgo: H, M y L, detalladas en la (tabla 1)4,5. Son tumores de alto riesgo los localizados en zona L ≥20 mm, en zona M ≥10 mm y todos los localizados en zona H, independientemente del tamaño4,5. Otros factores clínicos e histopatológicos del tumor, así como antecedentes del paciente también son relevantes para definir el riesgo (tabla 1). Los tumores de alto riesgo asocian mayor probabilidad de compromiso nervioso, recurrencia local y metástasis1,6. El tratamiento de elección para estos es la CMM1,4,5,7.
La CMM es una técnica quirúrgica que permite la extirpación del tumor en capas y el estudio histopatológico intraoperatorio del 100% de los márgenes, logrando las mejores tasas de curación con el máximo ahorro de tejido sano8-11 y bajas tasas de recurrencia7. El primer paso de la CMM consiste en la delimitación y extirpación del tumor macroscópicamente visible, habitualmente mediante bisturí o cureta. Esta pieza denominada debulking es enviada para estudio anatomopatológico en diferido mediante inclusión en parafina12. Posteriormente se realizan sucesivas fases de extirpación de tejido en capas y el análisis intraoperatorio de sus márgenes mediante cortes a congelación y tinción con hematoxilina y eosina, hasta asegurar la extirpación completa del tumor12.
Previo a la cirugía se debe realizar una biopsia por punch o afeitado, para confirmar el diagnóstico y el subtipo histológico del carcinoma6,10. Esta representa solo una porción de la lesión y puede ser insuficiente para el diagnóstico del subtipo histopatológico de la totalidad de la misma13-16. Histopatológicamente, el CBC muestra una variedad de patrones de crecimiento que se dividen, según su comportamiento biológico, en no agresivos (superficial, nodular, adenoide y folicular) y agresivos (micronodular, infiltrante, morfeiforme y basoescamoso)1,5. El CCE histopatológicamente se puede clasificar según su grado de diferenciación e invasión, siendo de peor pronóstico el pobremente diferenciado17,18.
El objetivo general del estudio es comparar los hallazgos histopatológicos entre la biopsia incisional previa a la cirugía y la pieza del debulking en los tumores de cáncer de piel no melanoma tratados con CMM en la Unidad de Cirugía Dermatológica del Hospital de Clínicas “Dr. Manuel Quintela” en el período entre noviembre de 2013 y marzo de 2019.
Los objetivos específicos incluyeron:
- Determinar en qué proporción de casos coincidieron el subtipo histopatológico de CPNM informado en la biopsia preoperatoria y en el debulking.
- Determinar en qué proporción de casos el subtipo histopatológico de CPNM informado en la biopsia fue diferente al debulking.
- Analizar los subtipos histopatológicos coincidentes y los disímiles.
- Determinar la proporción de casos disímiles que mostró un subtipo más agresivo.
- Analizar los datos demográficos de la población incluida en el estudio.
Material y métodos
Realizamos un estudio retrospectivo descriptivo incluyendo pacientes de la unidad de cirugía dermatológica con CPNM (primarios y recidivantes) sometidos a CMM en el período correspondiente.
Fueron incluidos pacientes mayores de 18 años, sometidos a biopsia previa a la cirugía, con informes histopatológicos (biopsia y debulking) que incluían el diagnóstico del subtipo tumoral. Se excluyeron pacientes sin biopsia previa a la CMM, sin informes de biopsia y/o debulking disponibles, y/o sin diagnóstico del subtipo tumoral.
A partir de las fichas operatorias de los pacientes, se identificó el número de informe histopatológico de la biopsia y el debulking correspondiente, para su búsqueda y revisión. Los subtipos histopatológicos informados de ambas lecturas fueron codificados y tabulados convirtiéndose en un conjunto de datos para su análisis y comparación.
Se recolectaron las siguientes variables: edad, sexo, fototipo, condición de tumor primario o recidivante, localización, tipo y subtipo histopatológico.
La proporción de casos que resultaron iguales entre las muestras se calculó como el porcentaje de tumores con el mismo diagnóstico de subtipo histológico en biopsia y debulking. Los casos diferentes se calcularon como el porcentaje de tumores en los que el subtipo histológico difirió entre ambas muestras. Se identificaron los casos en que el debulking detectó un subtipo de mayor agresividad que la biopsia.
El proyecto fue aprobado por el Comité de Ética Médica del Hospital de Clínicas “Dr. Manuel Quintela”, Universidad de la República. Los pacientes recibieron previamente la explicación del procedimiento quirúrgico y firmaron el consentimiento informado autorizando el mismo, así como el futuro uso de datos en trabajos científicos relacionados al tema.
Resultados
Se realizaron 318 CMM en el período mencionado. Tras aplicar los criterios de exclusión se incluyeron 202.
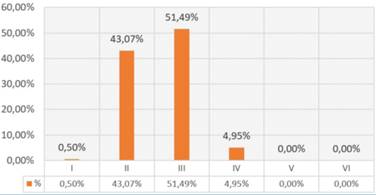
El promedio de edad fue de 72,8 años en hombres y 72,6 años en mujeres, con un rango de edad entre 30 y 92 años. 60,4% correspondieron a hombres y 39,6% a mujeres. La mayoría eran fototipo de Fitzpatrick III (51,49%) y II (43,07%) (figura 1).
En cuanto a la localización, 63,37% se encontraban en zona H, 18,81% en zona L y 17,82% en zona M.
Del total de tumores, 64,85% (131) correspondieron a CBC y el 35,35% (71) a CCE. De estos, 9,4% fueron recidivas y 90.6% primarios. El 95,42% de los CBC fueron primarios, y 4,58% recidivas. El 81,69% de los CCE fueron primarios y 18,31% recidivas.
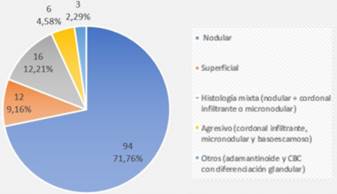
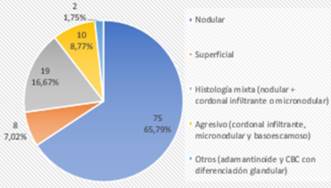
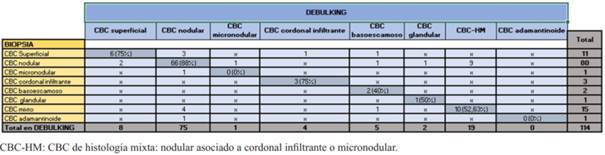
Los subtipos histológicos de CBC informados por biopsia preoperatoria fueron nodular en 71,76%, superficial en 9,16%, subtipo agresivo (cordonal infiltrante, micronodular, basoescamoso) en 4,58%, y un mínimo porcentaje mostró otros subtipos menos frecuentes, como CBC con diferenciación glandular y adamantinoide (2,29%). El 12,21% mostró histología mixta (componente nodular combinado con un componente agresivo) (figura 2). Coincidiendo con la biopsia, el subtipo histológico mayormente informado en el debulking fue el nodular (65,79%), siendo ligeramente mayor el informe de subtipos agresivos y de histología mixta. (figura 3). 17 casos no presentaron tumor en el debulking o mostraron cicatriz.
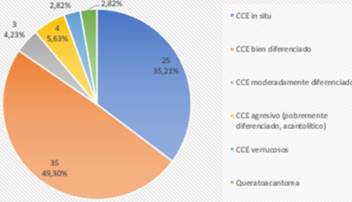
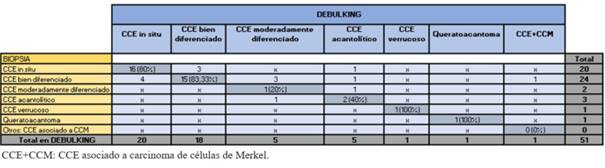
Las biopsias preoperatorias para CCE revelaron más frecuentemente subtipos bien diferenciados (49,30%) y secundariamente CCE in situ (35,21%). Los subtipos agresivos acantolíticos representaron 5,63%. Le siguen el CCE moderadamente diferenciado, los CCE verrucosos y el queratoacantoma (figura 4).
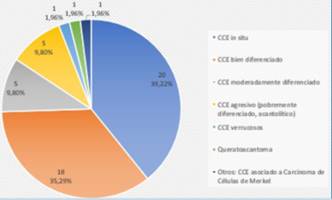
A diferencia de la biopsia, el debulking reveló con mayor frecuencia CCE in situ (39,22%) y secundariamente CCE bien diferenciado. Mostró un aumento en los CCE moderadamente diferenciados y CCE agresivos con respecto a la biopsia. En un caso se halló carcinoma de células de Merkel (CCM) asociado a CCE (figura 5). 20 casos no presentaron tumor en el debulking o mostraron cicatriz.
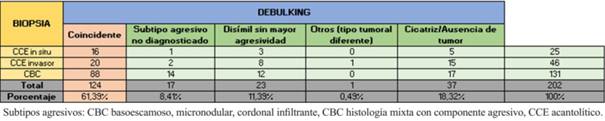
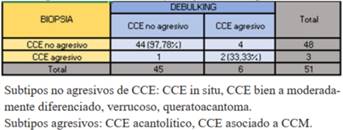
De los 202 tumores la coincidencia entre biopsia y debulking fue de 61,39%, (88 CBC y 36 CCE), con una disimilitud de 20,29%. El 18.32% restante informó cicatriz o ausencia tumoral en el debulking. El debulking mostró un subtipo agresivo no informado en la biopsia en 8,41% de los casos. La biopsia mostró un subtipo diferente al debulking en 11,39% de los casos, sin omitir un subtipo más agresivo. En el CCM asociado a CCE la biopsia solamente informó CCE (tabla 2).
Para el análisis se excluyeron los casos donde el debulking mostró cicatriz o ausencia de tumor, con un total 114 CBC y 51 CCE.
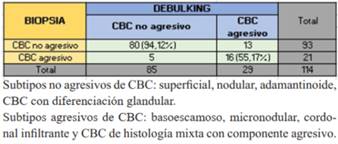
Los subtipos de CBC informados por biopsia y debulking fueron agrupados en no agresivos, y agresivos, incluyendo en estos últimos los de histología mixta. La biopsia informó subtipo agresivo en menor número que el debulking, siendo mayor el diagnóstico de no agresivos. La coincidencia fue de 55,17% en subtipos agresivos y 94,12% en no agresivos (tabla 3).
La similitud entre ambas muestras fue de 88% para CBC nodular, 75% en superficial y cordonal infiltrante, 52,63% en los de histología mixta, 40% basoescamoso y 50% glandular. No hubo coincidencia en los subtipos micronodular y adamantinoide. De los 14 CBC que difirieron la mayoría fueron de histología mixta cuyas biopsias revelaron subtipo nodular. Una minoría correspondió a CBC agresivo con biopsias que informaron subtipo nodular y/o superficial. Un caso fue informado como mixto en la biopsia y basoescamoso en el debulking (tabla 4).
Los subtipos de CCE informados en ambas muestras fueron agrupados en agresivos y no agresivos. En los agresivos se incluyeron los acantolíticos y el CCE asociado a CCM. La biopsia informó subtipo agresivo en menor número que el debulking, siendo mayor el de no agresivos. En subtipos agresivos la coincidencia fue de 33,33%, y 97,78% en no agresivo (tabla 5). La similitud fue de 83,33% en CCE bien diferenciados y 80% en CCE in situ. En verrucosos y queratoacantomas fue de 100%, sin embargo no hubo coincidencia en el CCE asociado a CCM (tabla 6). En los CCE no coincidentes el debulking reveló subtipos acantolíticos mientras las biopsias informaron CCE no agresivos (tabla 6).
El 6,43% de los CPNM mostró disimilitudes entre subtipos no agresivos. El debulking mostró un subtipo de menor agresividad que la biopsia en 5 de 114 CBC y 5 de 51 CCE. Solo uno de estos CCE correspondió a un subtipo agresivo en la biopsia (tabla 6). En cambio, los 5 CBC informados como nodulares en el debulking constituyeron subtipos agresivos en la biopsia (tabla 4).
Discusión
La mayoría de los pacientes en el estudio eran hombres. El promedio de edad fue 72,8 años. Los fototipos predominantes fueron el III y secundariamente el II, esto era esperable dado que los carcinomas de piel se presentan más frecuentemente en pieles claras1,17,19.
Predominaron los CBC, con una relación 1,8:1 respecto al CCE, coincidiendo con los últimos datos epidemiológicos, donde se ha visto que la histórica relación 4:1 ha cambiado a 2-2,5:1 o incluso más cercanas2,4,20. El 90,6% correspondió a tumores primarios, predominando los localizados en zona H.
El subtipo histológico más frecuente de CBC en ambas muestras fue el nodular, mientras la mayoría de los CCE fueron in situ seguidos de CCE bien diferenciado en el debulking y de forma inversa en la biopsia, coincidiendo con la epidemiología general de estos tumores1,21.
La mayoría de los subtipos histopatológicos coincidieron entre ambas muestras, al igual que con múltiples autores6,7,9,16,22-24. De los 202 tumores, la biopsia fue igual al debulking en 61,39% de los casos y difirió en un 20,29%. El debulking mostró un subtipo agresivo no informado en la biopsia en 8,41% de casos, esto significa que aproximadamente 1 de cada 10 CPNM contiene un subtipo agresivo subdiagnosticado por biopsia.
Una causa que podría contribuir a las diferencias es una limitante inherente a la biopsia, ya que representa sólo una pequeña muestra de un tumor que puede ser más grande y heterogéneo7,10. Asimismo, la coincidencia con una cicatriz o zona tratada previamente podría alterar la precisión diagnóstica10,16.
Algunos estudios revelan una igualdad entre biopsia incisional y debulking de la CMM que oscila entre 49,5% y 64%, y las muestras que difieren, en donde el debulking muestra subtipos más agresivos, van de 21,1% a 33,4%7-24. Izikson y colaboradores encontraron una similitud de 51,1% entre ambas muestras, mientras el debulking informó un subtipo agresivo no informado por la biopsia en 21,1% de los casos7. Nuestro resultado de coincidencia general se encuentra en el rango de resultados de otros estudios, siendo más bajo el porcentaje de casos donde el debulking informó subtipos histológicos más agresivos que la biopsia. En 18,2% de los casos el debulking mostró cicatriz o ausencia de tumor, valores similares a los reportados por otros autores7. Swetter SM y colaboradores reportaron que 24% de los CPNM mostraba cicatriz y ausencia de tumor residual en la pieza de escisión quirúrgica, siendo más frecuente en CCE que en CBC (aproximadamente el doble)25. Esto se aproxima a nuestros resultados, encontramos que 28,17% de CCE y 12,98% de CBC mostraron cicatriz o ausencia de tumor en el debulking.
En 6,43% de los casos hubo diferencias entre subtipos no agresivos, y 4,95% mostró menor agresividad en el debulking. Algunos consideran que esto podría deberse a que el sector del tumor que presentaba el subtipo agresivo fuera eliminado con la biopsia16,23.
La similitud del subtipo histológico de CBC entre ambas muestras fue de 70,97%, encontrándose en el rango de los resultados hallados en estudios previos, entre 42,7% y 82%6,13,16,22,23,26. Si consideramos el debulking como referencia, la similitud en CBC de subtipos no agresivos fue 94,12%, y en los subtipos agresivos 55,17%. La mayor coincidencia fue para el CBC nodular, seguido del superficial y cordonal infiltrante. La menor fue para el basoescamoso, mientras que no se halló similitud en los subtipos micronodular y adamantinoide. La disimilitud donde el debulking mostró un subtipo tumoral agresivo no revelado por biopsia corresponde a 11,4%, encontrándose dentro del rango de resultados de otros estudios, que va de 7% a 36,2%16,23,26-28. La mayoría de las desigualdades donde el debulking reveló un subtipo agresivo no informado en la biopsia, correspondieron a CBC de histología mixta. El disímil no agresivo más frecuentemente informado por debulking fue el nodular, mientras la biopsia reveló CBC mixto o micronodular.
Un porcentaje significativo de los CBC (10%-40%) combina más de un subtipo histológico en el mismo tumor6,26. Según Cohen y colaboradores 43% de los CBC presentaban histología mixta con varias combinaciones de patrones de crecimiento agresivo y no agresivo, siendo diagnosticados en la biopsia únicamente el 10%29. En nuestro estudio, 19 CBC presentaron histología mixta confirmada en el debulking, constituyendo el segundo subtipo más frecuente luego del CBC nodular. La biopsia fue coincidente en 10 de 19 casos (52,63%). Es decir que un porcentaje significativo de CBC fue de histología mixta, como se describe en la literatura, pero la biopsia predijo este subtipo en una proporción mucho mayor. Todos resultaron de combinaciones de subtipo nodular y agresivo.
La coincidencia del subtipo histológico de CCE entre ambas muestras fue de 70,59%, muy similar al del CBC. Los de mayor similitud fueron los verrucosos y queratoacantomas, seguidos por el CCE bien diferenciado y en tercer lugar el CCE in situ. No hubo coincidencia en el CCE asociado a CCM. Según Cortés-Peralta y colaboradores, del total de CPNM fueron mayormente coincidentes los CCE moderadamente diferenciados seguidos del bien diferenciado10. Contrario a esto, en nuestro estudio la similitud en el CCE moderadamente diferenciado fue de las más bajas. Si consideramos el debulking como referencia, la coincidencia en los CCE no agresivos fue 97,78%, y 33,33% en subtipos agresivos. Las disimilitudes donde el debulking mostró un subtipo tumoral agresivo no revelado en la biopsia corresponden a 7,84%. En un estudio de Singh y colaboradores se reportó que en 9,1% a 11,1% de los CCE se subestimó la agresividad en la biopsia respecto al debulking28. En nuestro estudio, los casos disímiles correspondieron la mayoría a CCE acantolíticos, informados en la biopsia como subtipos no agresivos. Un caso reportado por nuestro servicio correspondió a un CCE bien diferenciado diagnosticado por biopsia, que el debulking mostró además un sector de células pequeñas monomorfas con núcleos vesiculares. Con sospecha de CCE combinado con CCM se realizó inmunohistoquímica, que confirmó el diagnóstico. Clínicamente, estos tumores son difíciles de sospechar, siendo la biopsia por punch en ocasiones insuficiente para evidenciar el sector de CCM que generalmente se encuentra más profundo en la dermis30.
El porcentaje de CCE in situ según biopsia informado como CCE invasor en el debulking fue de 20%. En un caso la biopsia informó un subtipo agresivo no reportado en el debulking. Por otro lado, la biopsia informó CCE de mayor agresividad que el debulking en 9,8% de los casos.
Conclusiones
La biopsia incisional es parcialmente representativa a la hora de determinar el subtipo histopatológico de un CPNM, y la principal preocupación radica en la no detección de un subtipo agresivo. Nuestros resultados, tanto de coincidencias como de disimilitudes histopatológicas entre biopsia y debulking, se aproximan y apoyan a los hallados en estudios previos. Es importante tener presente el valor limitado de la biopsia para determinar los subtipos histológicos presentes en la totalidad del tumor, ya que aproximadamente 1 de cada 10 CPNM agresivo podría ser subdiagnosticado y eventualmente ser tratado con cirugía convencional, la cual asocia mayor riesgo de recurrencias en comparación a la CMM.
Coincidiendo con estudios previos, también encontramos que un porcentaje significativo de CBC, combina más de un subtipo histológico en distintos sectores de un mismo tumor.
Destacamos la importancia del estudio histopatológico del debulking, que en nuestra experiencia nos permitió además el diagnóstico de un tipo tumoral diferente al CPNM, con comportamiento agresivo.