Introducción
La nefritis lúpica (NL) es la manifestación grave más frecuente del lupus eritematoso sistémico (LES), siendo las formas proliferativas las más frecuentes1. Afecta entre 35%-65% de los pacientes con LES dependiendo de la etnia, sexo y edad, entre otros factores2,3. Es más frecuente en la población afrodescendiente e hispana4,5, quienes además presentan evoluciones más adversas y resultados a largo plazo menos favorables6. De acuerdo con el Registro Uruguayo de Glomerulopatías, la glomerulonefritis lúpica es la cuarta en incidencia, con un 12,2% de todas las biopsias analizadas, y ocupa el segundo lugar en incidencia de glomerulopatías secundarias7,8.
La morbimortalidad del LES se ha modificado sustancialmente9, encontrándose previamente relacionada a la actividad de la enfermedad y a los efectos adversos a corto plazo del tratamiento empleado para inducir la remisión. Actualmente está determinada fundamentalmente por el daño orgánico acumulado que depende de la actividad sostenida en el tiempo de la enfermedad, la aparición de brotes y los efectos adversos de la terapéutica empleada. Un factor clave está relacionado al uso de dosis altas y exposición prolongada a glucocorticoides, con los efectos adversos que ello determina: osteonecrosis, fracturas osteoporóticas, cataratas, diabetes, enfermedades cardiovasculares, y cambios físicos que impactan en la calidad de vida los pacientes, entre otros bien conocidos10-13.
El tratamiento de las manifestaciones severas del LES consiste en inducir la remisión de manera rápida, o lograr el menor nivel de actividad posible, y que esto se mantenga en el tiempo. El tratamiento estándar de las formas proliferativas de NL consiste en la administración de inmunosupresores asociados a glucocorticoides e hidroxicloroquina14,15. En el caso particular de la NL consiste en reducir o suprimir la proteinuria y normalizar o mejorar el sedimento urinario y el filtrado glomerular, evitando el deterioro de la función renal a largo plazo. Es evidente que esto debe hacerse con la menor carga de efectos adversos para el paciente y sin impactar sustancialmente en la calidad de vida.
Aun cuando la evidencia respecto a la efectividad y seguridad de dosis reducidas de glucocorticoides viene en aumento, sigue siendo habitual el uso de dosis altas de prednisona por vía oral, 1 mg/kg/d. Esta dosis ha resultado efectiva, pero con una alta carga de efectos adversos. Los estudios clínicos en los que se comparan dosis elevadas con esquemas reducidos, aunque escasos, apoyan el uso de dosis menores a este esquema clásico. Las recomendaciones actuales del tratamiento postulan dosis de glucocorticoides más bajas para lograr el control de la enfermedad y evitar el daño acumulado(16). Se ha documentado que dosis de prednisona acumuladas mayores a 7,5 mg/d durante el primer año de la enfermedad aumentan significativamente el daño acumulado a 5 años16-18. A su vez, las dosis iniciales de prednisona predicen las dosis acumuladas a los 11 meses. Es decir, si el tratamiento se inicia con dosis altas de prednisona, las dosis acumuladas también serán elevadas, y esto ocurre con independencia del nivel de actividad de la enfermedad19.
Dosis medias diarias mantenidas de 6-12 mg/d determinan un incremento en el riesgo de daño orgánico, tal como lo demuestra el análisis de la Cohorte del Lupus-Hopkins10. A partir de 5 mg/d, los glucocorticoides aumentan el riesgo de infecciones graves que requieren hospitalización20-22. Se ha evidenciado un aumento del riesgo de reactivación de tuberculosis latente e infecciones oportunistas, como neumonía por Pneumocystis jirovecii, a partir de dosis menores de 15 mg/d23-25) y también un aumento del riesgo de reactivación del virus varicela zoster a partir de dosis de 7,5-10 mg/d, incrementándose este riesgo a medida que aumenta la dosis y el tiempo de exposición22.
Por otro lado, existe evidencia creciente que avala el uso combinado de pulsos de metilprednisolona (MTP) en el tratamiento de inducción de la NL, denominado actualmente “tratamiento inicial”, seguido de dosis de prednisona (PDN) no mayores a 30 mg/d26. Se ha comprobado que este esquema es igualmente efectivo y con una menor carga de efectos adversos que el clásico con 1 mg/kg/d, y permite la reducción de la prednisona a no más de 5 a 7,5 mg/d a las 12-15 semanas (3 meses), lográndose así menores dosis acumuladas de PDN.
El objetivo de este trabajo es conocer y comparar la respuesta al tratamiento de pacientes con NL proliferativa en la etapa de tratamiento inicial, de inducción a la remisión y mantenimiento, con dos pautas de tratamiento con prednisona (PDN): dosis iniciales reducidas <30 mg/d y dosis iniciales estándar >30 mg/d.
Materiales y métodos
Se realizó un estudio retrospectivo en la Unidad de Enfermedades Autoinmunes Sistémicas de Médica Uruguaya Corporación de Asistencia Médica (MUCAM). Se incluyeron pacientes con lupus eritematoso sistémico según criterios clasificatorios del ACR de 199727 y que presentaran NL III/IV confirmada histológicamente mediante la clasificación ISN-RPS 2003, asistidos en el período 2016-201928. Se compararon dos grupos de pacientes: una cohorte de pacientes histórica, que había sido tratada según pautas estándar de uso respecto a la cohorte que viene siendo seguida por nuestro equipo.
Se analizaron las siguientes variables: demográficas (sexo y edad), clínicas (tabaquismo, diabetes mellitus, hipertensión arterial), analíticas (filtrado glomerular estimado por fórmula CKD-EPI)29, títulos de fracción C3 del complemento, anticuerpos anti-DNA cualitativos (considerados de forma dicotómica: positivos o negativos), proteinuria de 24 h, dosis de prednisona acumulada a 6 meses de tratamiento (mg/d) y respuesta a 3, 6 y 12 meses de tratamiento. A los efectos de este estudio, se definió respuesta completa como la normalización del sedimento urinario junto con el descenso de la proteinuria a menos de 0,7 g/24 h y valor de creatininemia dentro de 25% respecto al basal30. La actividad de la enfermedad se registró de acuerdo con el índice de actividad: Safety of Estrogens in Lupus erythematosus: National Assessment-SLE Disease Activity Index (SLEDAI-2K)31.
A los 6 meses y al año se registraron efectos adversos de modo dicotómico, presentes o ausentes. Los efectos adversos considerados fueron: infecciones, hipertensión arterial, cataratas, glaucoma, dislipidemia, hiperglicemia, osteoporosis, dermatológicos (acné, estrías), síndrome de Cushing.
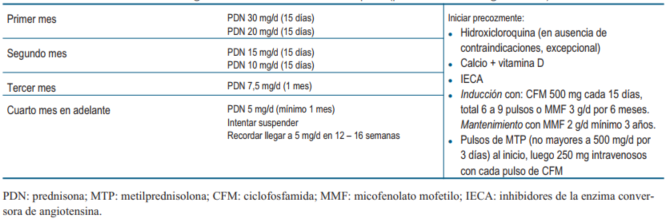
La población de estudio se dividió en dos grupos según la dosis inicial de prednisona (PDNi) estándar (>30 mg/d) o reducida (<30 mg/d). La categorización en grupos según las dosis iniciales de prednisona fue considerada teniendo en cuenta el esquema terapéutico del Hospital Universitario de Cruces - Bilbao32. Este protocolo consiste en la administración de pulsos intravenosos de MTP en dosis de 250-500 mg durante tres días consecutivos y posteriormente dosis de prednisona oral de no más de 30 mg/d, con reducción a 5 mg/d en un plazo no mayor a las 12-16 semanas (tabla 1). A este tratamiento se agrega el “estándar” de inmunosupresores, micofenolato de mofetilo (MMF) o ciclofosfamida (CFM), hidroxicloroquina, calcio y vitamina D e inhibidores de la enzima conversora de angiotensina si corresponde.
Las variables cuantitativas se presentan con medidas de tendencia central y dispersión; media y desvío estándar y mediana y rango, según su distribución. La normalidad se probó mediante test de hipótesis (Shapiro-Wilk) y gráficos. Las variables cualitativas se presentan mediante frecuencias absoluta y relativa. Las comparaciones entre grupos se realizaron mediante test de Chi2 o test de Fisher para los datos cualitativos y mediante test de t de Student o de Wilcoxon, según la distribución, para los datos cuantitativos. La duración de la respuesta hasta la recaída se comprobó mediante curvas de sobrevida de Kaplan Meier, que se compararon mediante el test de log-rank. Se consideró un nivel de significación estadística menor a 0,05. Los datos se procesaron en el programa informático SPSS.
El trabajo se desarrolló de acuerdo con las normas éticas establecidas en la Declaración de Helsinki de la Asociación Médica Mundial. Se obtuvo autorización del Comité de Ética institucional. Los datos fueron tratados con total confidencialidad, para lo cual se anonimizó la información de los participantes.
Resultados
1. Variables demográficas, clínicas, analíticas
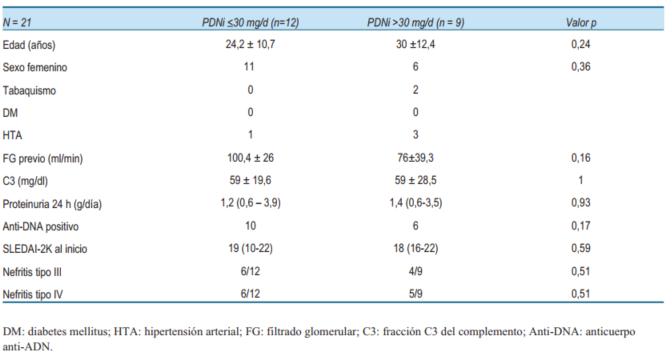
Se incluyeron 21 casos de NL. No hubo diferencias estadísticamente significativas en las características demográficas, clínicas, analíticas e índice de actividad de la enfermedad al momento del diagnóstico de NL entre los grupos PDNi <30 mg/d vs. >30 mg/d (p >0,05) (tabla 2).
2. Tratamientos
Todos los pacientes estaban bajo tratamiento con hidroxicloroquina al diagnóstico de NL. Siete pacientes del grupo PDNi >30 mg/d y 12 pacientes del grupo PDNi <30 mg/d recibieron calcio y vitamina D. Cinco pacientes del grupo PDNi <30 mg/d y 8 pacientes del grupo PDNi >30 mg/d estaban bajo tratamiento con inhibidores de la enzima conversora de angiotensina (IECA); el resto no recibió este tratamiento porque se encontraba contraindicado, por hipotensión o por falta de adherencia. Se observaron diferencias estadísticamente significativas en el número de pulsos de MTP (figura 1A). No se observaros diferencias estadísticamente significativas en la medida de dosis acumuladas de MTP que recibieron los pacientes en el tratamiento de inducción (figura 1B). Hubo diferencias significativas en las dosis acumuladas de CFM en la inducción (figura 1C). Un paciente del grupo PDNi <30 mg/d y un paciente del grupo PDNi >30 mg/d recibió tratamiento de inducción con MMF, todos los demás recibieron tratamiento de inducción con CFM.
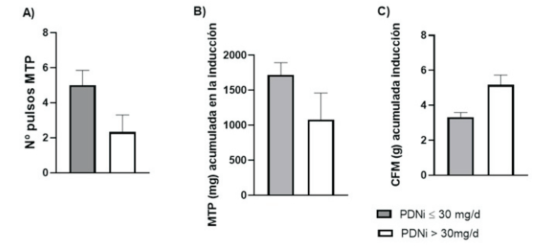
Figura 1: A) Media del número de bolos de MTP. La media fue de 5 ± 2,95 para el grupo PDNi <30 mg/d y 2,33±2,91 para el grupo PDNi >30 mg/d; p = 0,041. B) Media de dosis de MTP acumulada en la inducción. La media fue de 1719 ± 608 para el grupo PDNi <30 mg/d y de 1.083 ± 1.132 para el grupo PDNi >30 mg/d. No se obtuvo diferencia estadísticamente significativa. C) Media de la dosis acumulada de CFM en la inducción. La media fue de 3,31 ±0,90 para el grupo PDNi <30 mg/d y de 5,17 ± 1,48 para el grupo PDNi >30 mg/d; p = 0,021.
Se evidenció una diferencia estadísticamente significativa en la dosis de prednisona acumulada a 6 meses, siendo menor para el grupo con PDNi <30 mg/d (figura 2). Con una media de dosis diaria acumulada de 12,8 ± 4,9 mg/d; con un mínimo de 2,7 mg/d y máximo de 18,4 mg/d para el grupo PDNi <30 mg/d. Para el grupo PDNi >30 mg/d la media de dosis diaria acumulada fue de 30,0 ± 13,1 mg/d, un mínimo de 18,6 mg/d y máximo de 59,4 mg/d; p <0,01.
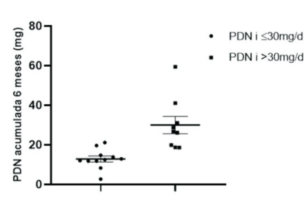
Figura 2: Comparación de la medida de dosis diaria acumulada de prednisona (PDN) en los primeros 6 meses de tratamiento entre los grupos según la dosis inicial. Se obtuvo una diferencia estadísticamente significativa entre los grupos PDN inicial <30 mg/d PDN inicial >30 mg/d; p =0,008; IC95%: 8,20-26,13.
3. Respuesta terapéutica y efectos adversos
No se observaron diferencias significativas en la proporción de pacientes que alcanzaron respuesta completa a los 3, 6, y 12 meses de tratamiento (p >0,05) (tabla 3), ni tampoco se evidenciaron diferencias significativas en el tiempo hasta alcanzar la respuesta completa (figura 3).
Tabla 3: Proporción de pacientes que alcanzaron la remisión completa a los 3, 6 y 12 meses de tratamiento.
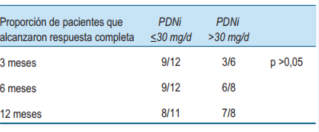
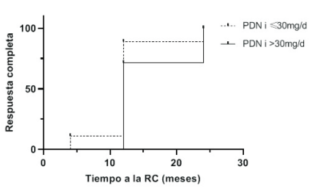
Figura 3: Curva de Kaplan Meier. Tiempo a la respuesta completa. No se observaron diferencias estadísticamente significativas en el tiempo a la respuesta completa entre ambos grupos. Se obtuvo un valor p = 0,27 (test de log-rank).
No se registraron diferencias significativas en los efectos adversos en ambos grupos en el período de observación del estudio.
Discusión
En nuestro trabajo observamos que no existen diferencias significativas en la proporción de pacientes que alcanza respuesta completa entre el grupo que inicia tratamiento con dosis reducidas de PDN respecto al grupo que recibió los clásicos esquemas de dosis elevadas. Tampoco se observaron diferencias en el tiempo de respuesta, habida cuenta que un aspecto crítico en el tratamiento de la NL no solo consiste en inducir la remisión, sino en hacerlo en el menor tiempo posible. Se trata de una observación interesante a la luz de que el grupo de pacientes considerados en uno y otro esquema tienen un comportamiento clínico e histopatológico similar.
En esa línea, se muestra que un tratamiento pautado y sistemático es importante en enfermedades de difícil manejo. No es menor la observación que el grupo de dosis reducidas de glucocorticoides se acompañe de una menor dosis acumulada de ciclofosfamida y un amplio uso de hidroxicloroquina. Es posible que en este aspecto exista sesgo puesto que los dos grupos de pacientes comparados fueron asistidos por equipos diferentes, con un protocolo muy estricto en nuestra cohorte. En el mismo sentido, no es llamativo que el grupo de dosis menores de PDN todos los pacientes recibieran calcio y vitamina D, apoyando todo esto la importancia de la protocolización de los tratamientos.
Es ampliamente conocido que el uso prolongado de glucocorticoides se asocia a daño orgánico permanente33-36, sobre todo en aquellos pacientes expuestos a dosis mantenidas por encima de 20 mg/d37,38. Nuestro grupo ha comprobado, en consonancia con otros, que el daño a largo plazo está particularmente relacionado con las dosis iniciales, independientemente de los niveles de actividad considerados al inicio del cuadro clínico18,19. Teniendo en cuenta el perfil de riesgo asociado a los glucocorticoides, ha surgido la necesidad de desarrollar nuevos esquemas de dosificación que permitan, al mismo tiempo, inducir la remisión de la enfermedad y disminuir el riesgo de desarrollar daño orgánico permanente. Este ha sido el punto de partida para diversos estudios clínicos y farmacológicos.
Los glucocorticoides tienen dos vías de acción, una vía genómica y otra no genómica39, con un perfil diferente en cuanto a sus mecanismos de activación y de seguridad40. La vía genómica se activa a partir de dosis bajas de PDN o equivalente, menores de 7,5 mg/d, y expresa su efecto antiinflamatorio en forma dosis dependiente, alcanzando una saturación cercana al 100% con dosis de 30-40 mg/d. Con dosis de prednisona superiores a 30 mg/d se incrementa el riesgo de efectos adversos sin aumentar el efecto antiinflamatorio11. La vía no genómica, a diferencia de la anterior, tiene un inicio de acción más rápido, un efecto antiinflamatorio más potente y se relaciona con menores efectos adversos, debido en parte a que su efecto es transitorio41,42. Esta vía se activa con dosis más altas de glucocorticoides, a partir de los 100 mg de PDN o equivalente, alcanzando su máximo alrededor de los 250-500 mg, y es especialmente sensible a MTP y dexametasona.
En diversos estudios clínicos se ha demostrado que la activación preferencial de la vía no genómica mediante el uso de bolos intravenosos de MTP permite una rápida disminución de la prednisona oral asociado a menores dosis acumuladas y en consecuencia a menos efectos adversos a corto, mediano y largo plazo43-45.
Desde hace dos décadas, el estudio Euro Lupus Nephritis Trial (ELNT) incluyó bolos de MTP (tres pulsos intravenosos de 750 mg cada uno) seguidos de dosis de prednisona 0,5 mg/kg/d, observando una eficacia comparable a dosis de prednisona más elevadas. En dicho trabajo aún persisten dosis acumuladas elevadas, en parte debido al lento descenso de prednisona, alcanzando 10 mg a los 6 meses30.
El estudio MYLUPUS es el único ensayo clínico aleatorizado y multicéntrico que comparó dosis medias de glucocorticoides orales (0,5 mg/kg/d, n=39), con dosis altas (1 mg/kg/d, n=42) durante la fase de inducción de la NL tipo III-IV asociadas a micofenolato. Las tasas de remisión completa en la semana 24 fueron similares para ambos grupos (19% vs. 21% y 67% vs. 56%, respectivamente, valor p >0,05) con menos infecciones en el grupo de dosis reducida de PDN46. En otro estudio observacional realizado por el grupo de investigación de Cruces-Bilbao, se compararon pacientes con NL clase III-IV-V de las cohortes Lupus-Cruces (CC, n=29) y Lupus-Bordeaux (BC, n=44). El grupo CC presentó mayor número de pulsos de MTP (9,3 vs. 2,3, p <0,05), sin diferencia en la dosis acumulada de la misma. La proporción de pacientes con hidroxicloroquina (100% vs 63%, p <0,05) fue mayor en el CC. En relación con las dosis de prednisona oral, fueron menores para el grupo CC (21 frente a 42 mg/d, p < 0,05), así como también el número de semanas hasta 5 mg/d (12 frente a 22, p <0,05) y las dosis medias diarias a los seis meses (8,3 frente a 21 mg/d, p <0,05). Las tasas de remisión renal completa fueron significativamente más altas en el CC a los seis (69% frente a 30%, p < 0,05) y 12 meses (86% frente a 43%, p <0,05)45. El análisis de regresión evidenció que el número de pulsos de MTP fue un predictor independiente para lograr la remisión completa y reducir los efectos adversos relacionados con los GCC46.
Más recientemente, el ensayo clínico AURA-LV, evaluó la eficacia y seguridad de agregar voclosporina, un inhibidor de la calcineurina, en dosis bajas y altas vs. placebo al tratamiento de inducción de la NL proliferativa asociado a MMF y glucocorticoides en dosis bajas. El diseño del estudio AURA-LV incluyó dosis de glucocorticoides más bajas en los tres grupos. Se usaron bolos de MTP intravenosa en dosis de hasta 250-500 mg seguidos de PDN oral inicial hasta un máximo de 20-25 mg/d y descenso rápido llegando a 2,5 mg/d a las 12 semanas. La eficacia del tratamiento en el grupo placebo respecto de otros estudios que emplean dosis más elevadas de glucocorticoides es similar47 e incluso se evidenciaron tasas de remisión más altas que en estudios anteriores46-48.
Por último, el estudio Rituxilup, que consistió en la administración de rituximab y bolos intravenosos de MTP seguido de un tratamiento de mantenimiento con MMF sin glucocorticoides orales, dio como resultado la remisión completa en 72% de los pacientes con NL de clase III, IV o V en un período medio de 36 semanas49. Con esta evidencia, se ha llegado a plantear la discusión de si se puede prescindir del uso de glucocorticoides en el tratamiento de inducción de la NL50.
De acuerdo con la evidencia expuesta, cada vez contamos con más estudios que avalan que el uso de bolos intravenosos de MTP permite emplear dosis más bajas de prednisona. Con estos esquemas se logra igual tasa de remisión con menores efectos adversos y menor daño acumulado a largo plazo. Nuestros resultados están en línea con estas observaciones. En efecto, observamos mayor uso de pulsos intravenosos de MTP y menores dosis de PDN. Las guías actuales recomiendan el uso de dosis bajas de glucocorticoides con un rápido descenso de estos, para lo cual sugiere el uso de pulsos de MTP16.
Nuestro trabajo tiene limitaciones, derivadas de un análisis retrospectivo de un número de pacientes reducido y con un seguimiento de un año luego del inicio del tratamiento. Es llamativo el escaso uso de IECA, algo que deberá analizarse como un aspecto a corregir en el pautado de estos tratamientos. Por otro lado, la comparación de los efectos adversos fue escasa en la medida que el dato se recolectó de forma dicotómica, lo que puede determinar que exista un subregistro. Dentro de las fortalezas se destaca que por primera vez en nuestro medio se compara un esquema de dosis convencionales de PDN respecto a otro de dosis reducidas de PDN con pulsos de MTP. Asimismo, en nuestro medio son escasas las publicaciones sobre nefritis lúpica. En efecto, solemos utilizar evidencia extrapolada de estudios desarrollados en otros países, con otras características y otras poblaciones.
Este trabajo aporta nueva evidencia en nuestro medio respecto a que el tratamiento de la NL con dosis iniciales reducidas de prednisona, con descenso rápido, asociado al uso de pulsos intravenosos de MTP, más el empleo de inmunosupresores convencionales, en el contexto de un protocolo de tratamiento con uso sistemático de hidroxicloroquina, determina similares respuestas al esquema clásico de dosis iniciales de PDN altas. Asimismo, este esquema de tratamiento de la NL proliferativa que utilizamos se asoció a una menor dosis acumulada de prednisona lo que hace presumir una menor acumulación de daño relacionado con glucocorticoides a largo plazo.