Introducción
En las últimas décadas se ha demostrado la importancia de unos niveles adecuados de vitamina D (VD), tanto para una óptima salud ósea como para la prevención de enfermedades crónicas y diferentes tipos de cáncer1-3. Un punto importante se asocia con las condiciones geográficas. Uruguay, ubicado dentro de una zona templada de América del Sur (entre 30º-35º de latitud sur), experimenta fuertes diferencias de radiación ultravioleta en comparación con el invierno y el verano. La relevancia de estos y otros ítems relacionados con la disponibilidad de VD ha sido enfatizada en una revisión reciente4.
La literatura especializada ha mostrado un énfasis en la VD en mujeres más que en hombres5,6. Desde 2001 hemos reportado niveles séricos inadecuados principalmente en mujeres uruguayas, a pesar de la época de la recolección7-9, generalmente enfocándonos en su potencial papel en la osteoporosis. Otros autores comunicaron hallazgos similares en habitantes locales10,11. Este último artículo11 analizó una muestra que incluía a ambos sexos en conjunto, enfatizando los hallazgos globales y no mostrando características particulares para cada uno de ellos. Se ha sugerido un papel potencial de la VD en la producción de hormonas reproductivas masculinas12, pero un estudio reciente entre hombres jóvenes y sanos no logró encontrar una asociación entre la VD y los niveles de andrógenos13. Más recientemente, investigadores chinos que utilizaron la metodología de aleatorización mendeliana informaron que los niveles de VD genéticamente reducidos se asociaron con una testosterona total más baja14. Algunos expertos reconocen que la evidencia de los ensayos controlados reveló resultados contradictorios15.
El magnesio (Mg), segundo catión intracelular más abundante, juega un papel crítico en la síntesis y el metabolismo de la hormona paratiroidea y la VD. Aproximadamente el 60% del Mg total se almacena en el hueso, un tercio del Mg esquelético reside en el hueso cortical o en la superficie de hidroxiapatita o en la capa de hidratación alrededor del cristal. Las ingestas más altas de Mg en la dieta se asociaron positivamente con una mayor densidad mineral ósea (DMO) en hombres y mujeres de 39 a 72 años, sin embargo, otros estudios no pudieron encontrar estos resultados16.
Teniendo en cuenta que los niveles de VD en hombres, junto con otros parámetros de laboratorio o densitométricos relacionados, no se han informado con frecuencia, realizamos un estudio descriptivo en hombres jóvenes de mediana edad para explorar posibles interrelaciones entre VD y parámetros seleccionados relacionados con la salud ósea, como testosterona, parathormona, antropometría, minerales relevantes (calcio, fósforo, Mg), marcadores de resorción ósea y hallazgos de densitometría. A pesar de ciertas limitaciones logísticas, consideramos la investigación digna de realizar y esperamos lograr un nuevo conocimiento del subconjunto de población citado.
Material y método
Se realizó un estudio transversal en 100 hombres caucásicos sanos de entre 18 y 50 años. Los sujetos pertenecían al subsistema asistencial prepago, debido a las dificultades existentes para encontrar personas en el subsistema hospitalario público que cumplieran con los criterios de inclusión. Éstos fueron: ausencia de endocrinopatías y/o patología disabsortiva, afectación hepática, reumática o insuficiencia renal, ingesta de fármacos que afecten los niveles de vitamina D como glucocorticoides, anticonvulsivantes, rifampicina, calcio o colecalciferol.
Fue un estudio no probabilístico, basado en una muestra de conveniencia. Cada muestra de sangre se tomó en condiciones basales, luego de 8 horas de ayuno, y las muestras se dejaron analizar: 25 (OH) D, calcio total, fósforo, Mg, parathormona intacta (PTH), β-crosslaps, testosterona libre (FT), testosterona total (TT) y globulina transportadora de hormonas sexuales (SHBG). Se empleσ el sistema Roche / Hitachi Cobas C para todas las mediciones plasmáticas. La determinación cuantitativa de VD total se realizó con electroquimioluminiscencia, utilizando como proteína de captura una proteína de unión a VD, que se une a la 25(OH) D3 y la 25(OH) D2. La muestra plasmática se recogió en un tubo que tenía etilendiaminotetraacetato (EDTA). Las variaciones intra e interensayos fueron de 2,2% y 3,4%, respectivamente, para una concentración superior a 15 ng/ml.
Para evaluar los resultados de la medición de VD se tuvieron en cuenta los valores propuestos en las guías de la American Endocrine Society 17. El intervalo de referencia establece tres rangos: deficiencia (≤20 ng / ml); insuficiencia (21-29 ng/ml); y deseable (≥30 ng/ml). La medición del calcio total utilizó el método con o-cresolftalein complexon y se midió fotométricamente. El intervalo de referencia para adultos de entre 18 y 60 años varió entre 8,6 y 10,3 mg/dl. Para la medición del fósforo se utilizó un método basado en la reacción del fosfato con molibdato de amonio, se mide fotométricamente y su intervalo de referencia para adultos se establece en 2,5-4,5 ng/ml. El Mg se midió mediante espectrofotometría de absorción atómica y el intervalo de referencia para la edad adulta fue de 1,6 a 2,6 mg/dl. Los β-crosslaps se midieron mediante ensayo electroquimioluminiscente (ECLA), cuyo valor normal para hombres de 30 a 50 años es de 0,3 ng/ml ± 0,142 ng/ml (desviación estándar). La determinación cuantitativa de PTH se realizó mediante ECLA: mide la PTH intacta mediante la reacción del anticuerpo monoclonal biotinilado con el fragmento N-terminal (1-37), y el anticuerpo monoclonal marcado con quelato de rutenio con el fragmento C-terminal (38-84). El intervalo de referencia se estableció entre 15-65 pg/ml. La estimación de TT fue realizada por la CEPAL. La muestra se extrajo a un tubo con heparina de litio y EDTA. El intervalo de medición es 0,025-15,0 ng/ml. El rango de referencia para los hombres adultos es de 1,88 a 8,82 ng/ml (percentiles 5-95). La SHBG se mide por ECLA, y los valores de referencia para hombres de 20 a 49 años están entre 18,3 y 54,1 nmol/l (percentiles 5-95).
Para evitar los cambios estacionales en la disponibilidad de luz solar, todas las muestras de sangre se recolectaron durante 30 días, desde mediados de julio hasta mediados de agosto de 2015. La DMO se midió mediante absorciometría con rayos X de doble energía (DXA), utilizando un dispositivo Lunar Prodigy Advance Fan-Beam de General Electric. Las mediciones fueron realizadas por el mismo operador y en el mismo centro médico. La DMO se evaluó en tres áreas anatómicas: columna lumbar (L1-L4), cuello femoral, y cadera total. Dado que la población analizada estuvo constituida por hombres menores de 50 años, se tomó como referencia el Z-score. Una puntuación Z se consideró como una DMO baja cuando era igual o inferior a -2,0.
Nuestro cuestionario incluyó datos sobre la edad actual; fecha de nacimiento; antropometría: peso, altura, cintura; antecedentes familiares de osteoporosis y fracturas; un historial personal de fracturas y patologías, indicando cuál/es. El índice de masa corporal (IMC) se calculó con la fórmula habitual: peso (en kg) / altura (en m2). La mayoría de las variables del cuestionario eran originalmente continuas y, cuando fue necesario, se categorizaron con fines de análisis. Las variables de interés seleccionadas se presentaron como valores medios ± desviación estándar (DE) para hacer comparaciones. Todos los cálculos se realizaron con el software STATA (versión 10, Stata Corp LP, College Station, TX, 2007). Se consideró p <0,05 como estadísticamente significativo.
Resultados
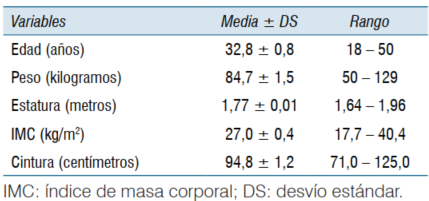
La (tabla 1) describe las características generales de los sujetos estudiados. Se trataba de un subconjunto de jóvenes y de adultos de mediana edad (edad media 32,8 años, rango 18-50), en su mayoría con sobrepeso (IMC medio 27,0), que también se expresó mediante la medición de la cintura (valor medio 94,8 cm).
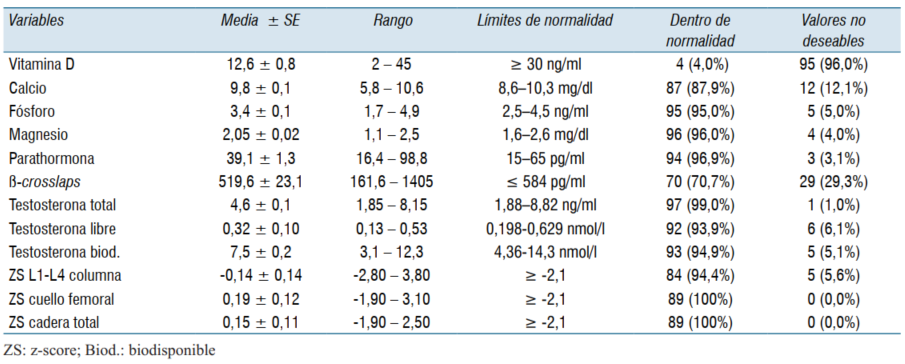
La (tabla 2) describe toda la serie de análisis realizados en la muestra. Una vista general de la tabla indica que una gran proporción de hombres se encuentra dentro de los rangos normales, más del 93,9% de los valores normales. Sin embargo hay tres excepciones: VD con solo 4%, β-crosslaps con 70,7% y calcio con 87,9%. Estos valores no deseables muestran un subconjunto de la población que al mismo tiempo compartía insuficiente VD en suero, estaba experimentando desmineralización ósea y el calcio en suero había comenzado a disminuir por debajo de los límites adecuados.
Tabla 2: Hallazgos derivados de análisis de laboratorio (mediciones en plasma) y densitometrías óseas.
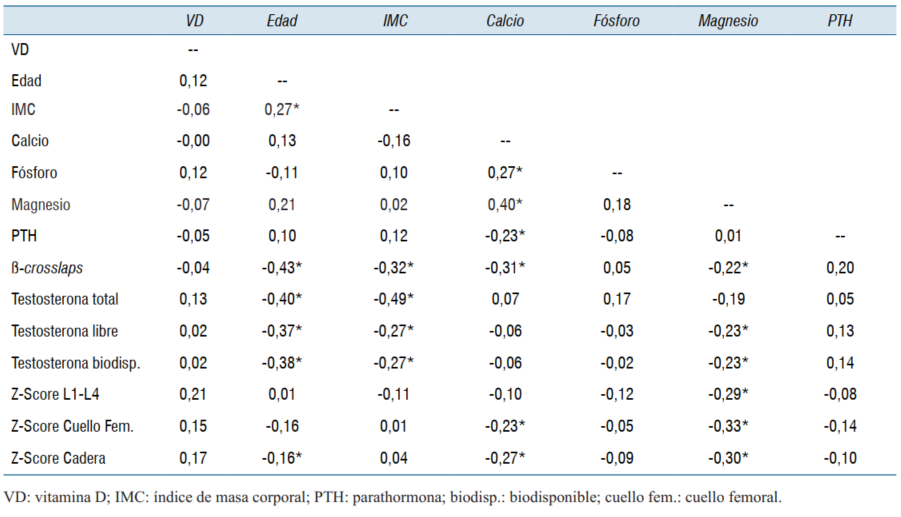
La (tabla 3) muestra los coeficientes de correlación de Pearson para las principales variables de interés. En primer lugar, la VD no se correlacionó significativamente con ninguna otra variable. En segundo lugar, la edad mostró una correlación positiva significativa con el IMC, pero se correlacionó negativamente con β-crosslaps y con todas las formas de testosterona. En tercer lugar, el IMC se correlacionó de manera significativa y negativa con el calcio, los β-crosslaps y todas las formas de testosterona. En cuarto lugar, el calcio mostró correlaciones positivas con fósforo, Mg y TT, mientras que tuvo correlaciones negativas con todas los Z-scores densitométricos. Finalmente, el Mg mostró correlaciones negativas significativas con los Z-scores densitométricos, más fuertes que el calcio. Los coeficientes de correlación entre la testosterona sérica y los Z-scores densitométricos variaron entre 0,07 y .18, y ninguno fue 0, estadísticamente significativo (resultados no mostrados).
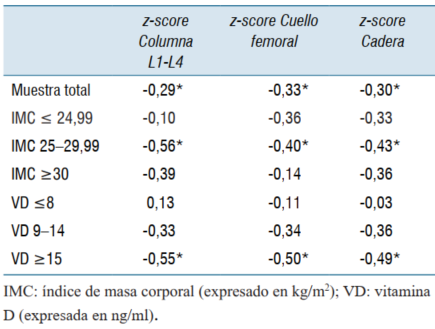
En último término, la (tabla 4) muestra los coeficientes de correlación para el Mg sérico y los Z-scores densitométricos, estratificados por los niveles de IMC y VD. La correlación global, significativamente inversa, que se muestra entre el Mg y los Z-scores, mantiene su importancia y aumenta su magnitud solo en los estratos de sujetos con sobrepeso y aquellos con niveles de VD ≥ 15 ng/ml.
Discusión
En nuestra muestra de varones uruguayos detectamos una gran proporción de valores de VD por debajo de los límites deseables. Los datos no han mostrado ninguna correlación significativa entre la VD sérica y las variables exploradas. El tamaño de la muestra y el momento de la extracción de sangre -mediados de invierno, lo que probablemente esté ligado a los bajos valores de VD encontrados- limitan las posibles conclusiones. La misma consideración podría aplicarse a la latitud de Montevideo (34º 50’ Sur). Puede hacerse una comparación simple con valores medios de 37,7 ng/dl obtenidos entre los jóvenes de la ciudad brasileña de Sao Paulo -en una latitud de 23º 34’ Sur-, aunque sólo la mitad de las muestras fueron recolectadas durante invierno-primavera18. Es útil reconocer una vez más el valor de la ubicación geográfica. De hecho, incluso el subconjunto de trabajadores del interior del país de esos sujetos jóvenes19 o sujetos mayores20, todos ellos dentro de la misma población base, mostraron valores medios de VD más altos que los hombres jóvenes uruguayos. Las correlaciones más altas y positivas (entre r = 0,015 y r = 0,021) encontradas con Z-scores densitométricos, aunque no son significativas, sugieren una relación plausible, y se necesitaría analizar una muestra más grande para confirmar esta suposición. Además, dado que obtuvimos todos los parámetros durante un período corto, no podemos descartar la posibilidad de que durante otras temporadas (por ejemplo inmediatamente después del verano), los valores de VD puedan experimentar cambios en sus interrelaciones con los parámetros estudiados.
En cuanto a los valores de VD y testosterona, no se encontró asociación significativa. Un estudio entre hombres jóvenes y sanos daneses ya no había logrado encontrar una asociación entre la VD y los niveles de andrógenos13. Nuestro estudio tiene similitudes con el de Lerchbaum y colaboradores15, también realizado en una pequeña muestra. Aunque este último fue muy estricto con las condiciones de elegibilidad y se trató de un estudio de intervención, las variaciones de VD tampoco se reflejaron en TT ni en FT. En este sentido, los resultados de los estudios son contradictorios. Comunicaciones previas sugirieron un papel potencial de la VD en la producción de hormonas reproductivas masculinas12,21,22, y se encontró un aumento significativo de los niveles de andrógenos después de la suplementación con VD en hombres obesos sometidos a reducción de peso23. Sin embargo, otros estudios no encontraron un efecto de VD significativo en TT24,25. En atletas se ha visto que la concentración de TT no refleja el status de VD: no se encontraron correlaciones ni con la fuerza, la resistencia así como tampoco con la composición corporal26.
Nuestro estudio también encontró que la edad y el IMC estaban significativamente correlacionados (r = 0,274, p <0,05): cuanto mayor era la edad y el IMC, menores eran sus valores de testosterona y también sus valores de β-crosslaps. Es plausible que cuando los hombres envejecen y, al mismo tiempo, aumentan su IMC, su testosterona disminuya. Pero lo que observamos también fue que al tener correlaciones negativas entre β-crosslaps y edad e IMC, los hombres parecían perder menos calcio. Por lo tanto, al no tener asociación entre VD y β-crosslaps, la correlación negativa encontrada para el Z-score del cuello femoral y la cadera no puede explicarse fácilmente solo por la edad. Además, habríamos esperado encontrar una correlación inversa más fuerte con el VD y el IMC, como se observó en estudios recientes27, sin embargo, nuestro análisis mostró una r = -0,059 no significativa. No podemos descartar que una muestra más grande proporcione relevancia a este hallazgo.
Es interesante destacar que en un estudio reciente se vio que las ingestas de Mg y sodio se asociaron significativa y positivamente con la DMO de cuello femoral en mujeres adolescentes, aunque no en varones(28). Por el contrario, en adultos de uno y otro sexo, de edades 39-72 años, elevadas ingestas de Mg dietario se asociaron positivamente con una DMO mayor(29). La investigación más reciente señala que una suplementación de VD comparada contra placebo por 2 años en adultos saludables de población general y no seleccionados por una insuficiencia de VD, no mejoró la DMO o la estructura ósea30. Los efectos no variaron por sexo, raza, IMC o niveles de VD. Estas inconsistencias no hacen otra cosa que reflejar la complejidad y variabilidad humana en cuanto a las interrelaciones de los elementos analizados en el presente trabajo.
En cuanto a los niveles de PTH, encontramos correlaciones positivas no significativas con el IMC (r = 0,117) y con la cintura (r = 0,158, datos no mostrados). Además, la VD mostró una correlación leve, negativa no significativa con el IMC (r = -0,059), como se citó más arriba. Estos resultados tienen similitudes con los de Raposo y colaboradores31, quienes exploraron las relaciones de VD y PTH con el síndrome metabólico. Nuestros resultados fueron comparables con los de ellos. Nuestro estudio sugiere que los resultados podrían mejorarse con un tamaño de muestra más grande. Además, en la tabla 4 se informa una correlación negativa significativa entre la PTH y el calcio sérico (r = -0,226, p <0,05). Curiosamente, la correlación difiere según las categorías de IMC: entre los sujetos de peso normal, fue más fuerte y significativa (r = -0,380, p <0,05) que en los hombres obesos con sobrepeso (r = -0,07, NS) (resultados no mostrados).
Inesperadamente, el Mg sérico mostró correlaciones negativas, casi siempre significativas, con los niveles de testosterona, los β-crosslaps y los Z-scores densitométricos. Sus coeficientes de correlación más fuertes se encontraron en el estrato con sobrepeso y entre los niveles de VD de 15 ng/ml y más. Se ha reconocido que los niveles bajos de Mg son un factor de riesgo de osteoporosis y también se asocian con niveles reducidos de PTH y VD16. Se ha encontrado también que el riesgo más bajo de mortalidad por todas las causas lo poseen pacientes con concentraciones suficientes de VD y con una ingesta elevada de Mg, comparados con aquellos deficientes en VD y con ingesta baja de Mg32.
Estudios recientes indican que las enzimas que sintetizan y metabolizan la VD dependen del Mg: el tratamiento con Mg aumentó la concentración de VD cuando las concentraciones iniciales estaban cercanas a 30 ng/ml, pero la disminuyó cuando la línea base fue más alta. El estado óptimo de Mg puede ser importante para a su vez optimizar el estado de VD33. Sin embargo, dado que el Mg es un antagonista del calcio, sus altas concentraciones pueden alterar la relación calcio/Mg, lo que conduce a funciones celulares desreguladas. Debe tenerse en cuenta que el Mg, como un componente principal del hueso, promueve el crecimiento y la regeneración ósea. No obstante, puede inhibir químicamente la cristalización del fosfato cálcico amorfo en hidroxiapatita: desde una cierta perspectiva, el Mg juega un papel dual en la biomineralización ósea34.
En este sentido, un estudio de hace pocos años35 remarcó que las mujeres posmenopáusicas en el quintil más alto de ingesta de Mg tenían mayor incidencia de fractura de muñeca. Teniendo en cuenta los niveles séricos de Mg encontrados en nuestro estudio, el 96% de los hombres los tenían dentro del rango normal, lo que dificulta cualquier interpretación de nuestros hallazgos. Las interrelaciones complejas no se pueden interpretar directamente, sin embargo, una investigación reciente presentó, como un intento, lo que llamaron sujetos “obesos metabólicamente saludables/no saludables”, que incluían PTH sérica, Mg, VD y otros parámetros, para hacer la distinción36.
Reconocemos algunas limitaciones y debilidades en nuestro estudio en cuanto al tamaño de la muestra y el número restringido de datos incluidos en el cuestionario sobre la historia clínica individual. Teniendo en cuenta las posibles interacciones entre la VD sérica y la ausencia/presencia de determinadas patologías crónicas comunes (por ejemplo síndrome metabólico) que habitualmente se tratan farmacológicamente, debe tenerse en cuenta como limitación. La muestra de conveniencia tiene sus limitaciones, pero consideramos el valor prometedor que tenía, ya que nos permitió describir ciertas variables en un subconjunto de población que aún no ha sido estudiado en nuestro país. A pesar de las limitaciones, los autores creímos que la probabilidad de lograr un nuevo conocimiento como resultado de esta pequeña investigación era alta. Las pruebas de laboratorio se realizaron en la misma institución y siguiendo las mismas metodologías. Lo mismo ocurre con los estudios de densitometría ósea, que se realizaron en el mismo centro de referencia.
En base a estudios previos de niveles de VD en mujeres y hombres jóvenes uruguayos7,11, en mujeres posmenopáusicas8,9, y también en base al presente estudio, podemos reconocer que existe una alta prevalencia de niveles inadecuados de VD en Uruguay. La preocupación obvia con respecto a estos datos es la osteoporosis y el alto impacto de sus consecuencias9. Además, los niveles bajos de VD encontrados en hombres jóvenes y de mediana edad podrían representar un factor de riesgo para el cáncer colorrecta37-39, por más que recientemente un estudio extranjero sólo halló dicho riesgo en mujeres40. De hecho, los hombres uruguayos vienen experimentando durante varios años un aumento sostenido en la incidencia y la mortalidad por cáncer colorrectal41, y el subconjunto masculino muestra tasas altas en las comparaciones internacionales42. Por lo tanto, considerando un estudio reciente en hombres nórdicos con sobrepeso43, aunque la muestra analizada en el presente estudio es pequeña, podría llevar a tener en cuenta los posibles beneficios de una suplementación con VD en individuos uruguayos con sobrepeso-obesidad. Sin embargo, dado que las recomendaciones son actualizadas periódicamente por expertos internacionales44, se convierte en una cuestión a decidir sobre una base más amplia en un futuro próximo.