Introducción
Los pacientes adultos con menos de 200 cm de intestino delgado se definen como pacientes con síndrome de intestino corto (SIC). Las enterectomías secundarias a la isquemia intestinal, las complicaciones quirúrgicas, incluida la cirugía bariátrica, las enterectomías masivas y la catástrofe abdominal por patología traumática se han convertido en las principales causas1,2. La necesidad crónica de suplementación intravenosa determina la falla intestinal crónica (FIC) o tipo III1,2. La nutrición parenteral (NP) es el tratamiento de sostén esencial para pacientes con FI y define su condición; si bien los pacientes sobreviven, las complicaciones asociadas con la NP crónica (NPC) son múltiples, pueden ser graves y frecuentemente condicionan la evolución. No obstante, la NPC sigue siendo el tratamiento estándar para los pacientes con FIC. La modalidad de NPC domiciliaria (NPD) como soporte vital está destinada estratégicamente a mantener el estado nutricional e hidroelectrolítico, así como mejorar la calidad de vida (CV), minimizando las complicaciones del uso a largo plazo de la NPC hospitalaria (infección relacionada con el catéter y trombosis venosa de los angioaccesos). Así como también reducir la probabilidad de enfermedad hepática (principales indicaciones del trasplante intestinal), enfermedad ósea metabólica, deterioro de la función renal y los costos asociados3-5. En Europa, se estima que la prevalencia de NPD para FIC oscila entre 5 y 80 por millón de habitantes, con una incidencia que varía entre 7,7 y 15 pacientes con FIC dependiente de NPC por millón de habitantes por año6,7. Lamentablemente, en la actualidad la NPD no forma parte de las prestaciones obligatorias en nuestro país, lo que determina una barrera de accesibilidad a esta técnica de soporte vital para un número cada vez mayor de pacientes que la necesitan. Resulta así completamente inaccesible para poblaciones de bajos recursos, existiendo únicamente casos puntuales en nuestro país, como el del paciente que presentamos7. Por otro lado, el procedimiento quirúrgico más utilizado para convertir una anatomía altamente desfavorable en una más favorable para la rehabilitación del intestino es la cirugía de rehabilitación autóloga del tracto gastrointestinal (CRATGI), proceso que involucra a todos los procedimientos que tienen como objetivo reconstruir el tracto gastrointestinal, reclutar segmentos intestinales abandonados en el abdomen y cerrar ostomías, restableciendo la continuidad del tránsito intestinal8-11. Este procedimiento, cuando es desarrollado por un equipo experimentado, junto a otras estrategias de alargamiento intestinal, ha modificado la historia natural de la enfermedad. Permite aumentar el número de pacientes capaces de lograr la autonomía intestinal y la independencia de NPC. Los avances quirúrgicos, en cuidados intensivos y en NP, junto a la consolidación de unidades multidisciplinarias de terapia nutricional e insuficiencia intestinal para el tratamiento de la FIC en las últimas décadas, han permitido que dos tercios de los pacientes que desarrollan el SIC sobrevivan a su hospitalización inicial, y que un número similar sobreviva al primer año luego de desarrollar la FIC. Sin embargo, poco más de la mitad de los adultos con FIC logran independizarse completamente de la NPC dentro de los 5 años posteriores al diagnóstico y menos del 6% abandonarán la NP utilizando métodos convencionales si no se logra la independencia en los primeros 2 años posteriores a la resección intestinal12. Afortunadamente, en los últimos años la atención de estos pacientes se centró en promover la rehabilitación intestinal utilizando un análogo recombinante del péptido 2 similar al glucagón humano (sGLP-2) producido mediante tecnología de ADN recombinante a partir de E. coli. El sGLP-2 (teduglutide) se ha convertido en la primera opción médica para pacientes seleccionados con FIC secundaria a SIC que no han logrado independencia a la NPD con la optimización del tratamiento estándar, con el potencial de reducir o eliminar la NP13,14. Pre sentamos el primer paciente en Uruguay con FIC que se trata con teduglutide luego de 17 años de dependencia a la NPC.
Caso clínico
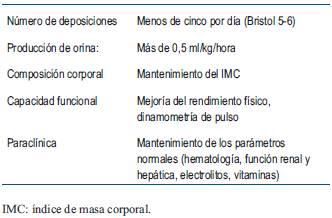
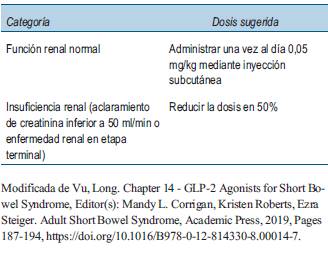
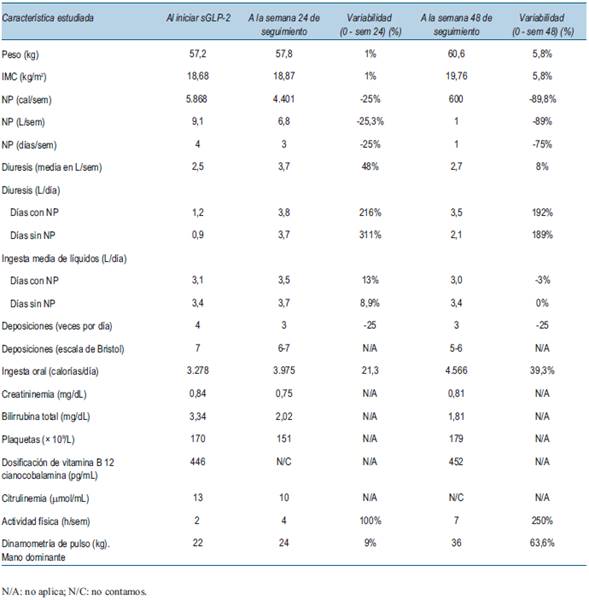
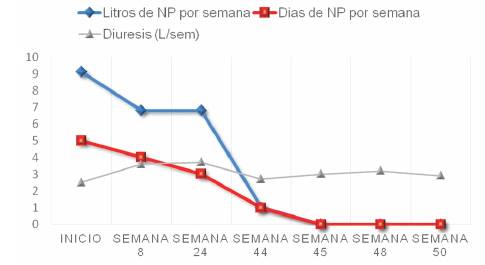
Se trata de un paciente de sexo masculino de 24 años, estudiante universitario, que a los 6 años (31/8/2002) presentó un infarto intestino mesentérico extenso en el contexto de una panarteritis nodosa, requiriendo una enterectomia masiva. Su remanente intestinal presentaba una longitud intestinal postquirúrgica (LIPQ) de aproximadamente 10 cm (7 cm de yeyuno y 3 cm de íleon) con una anatomía postquirúrgica (APQ) tipo III (anastomosis yeyuno ileal con válvula ileocecal preservada y colon en continuidad)18. La asistencia del paciente que presentamos fue conducida por un equipo de referencia durante su edad pediátrica en Uruguay. Luego de la CRATGI en 2002, recibió NPC de forma ininterrumpida, completando 17 años de NPD. El paciente desarrolló múltiples complicaciones graves asociadas a la NPC y a la FIC, destacándose la enfermedad hepática (biopsia de julio de 2015: METAVIR estadio 2, fibrosis moderada). Por lo que fue contactado con la Unidad de Soporte Nutricional Clínico, Rehabilitación y Trasplante de Intestino del Hospital Universitario de la Fundación Favaloro en Argentina donde fue evaluado, dados los factores predictores negativos para rehabilitación con tratamiento estándar y la elevada probabilidad de requerir trasplante hepatointestinal. En la (tabla 1) se observan los factores predictivos negativos que presentaba el paciente. Posteriormente el mismo fue referenciado a nuestro equipo para tratamiento y seguimiento conjunto de su FIC en la edad adulta. Desde 2017 recibe NPD nocturna en forma cíclica con emulsiones lipídicas de alternativa ahorradoras de lípidos omega 6. En ese mismo año se realizó nueva biopsia hepática que no evidenció cambios con respecto a la previa. Nuestro paciente inició el tratamiento con sGLP-2 (teduglutide) el 12 de diciembre de 2019, luego de un recurso de amparo en la justicia por uso compasivo, dado que es un medicamento de alto costo. Los objetivos para el manejo médico y nutricional con este fármaco se observan en la (tabla 2). Se administró sGLP-2 0,05 mg/kg/día una vez al día por vía subcutánea aproximadamente a la misma hora cada día y los controles se programaron a las 2, 4, 8, 12, 16, 18, 20 y 24 semanas. Posteriormente, se programaron visitas de seguimiento cada 2 meses. Al inicio del tratamiento con sGLP-2, la NPD se administraba en infusión de 12 horas diarias 4-5 veces a la semana por catéter tunelizado de larga duración. En la (tabla 3) se muestra la estrategia de dosificación de teduglutide con relación a la función renal. El aporte nutricional semanal por vía parenteral y la evolución del resto de las variables estudiadas se observan en la (tabla 4). El paciente logró reducir el volumen semanal de NPD con respecto al que requería previo al inicio del tratamiento con sGLP-2 en un 25% en la octava semana de tratamiento. En la actualidad está completamente independizado de la NPD. Los objetivos del tratamiento se alcanzaron adecuadamente antes de la semana 24. Durante las primeras 76 semanas de seguimiento no ha presentado reacciones adversas ni complicaciones asociadas al tratamiento con sGLP-2.
Discusión y comentarios
Los pacientes con SIC desarrollan cuadros severos de desnutrición y deshidratación que comprometen la vida, además del normal desarrollo en los niños, de tal manera que requieren de una intervención nutricional especializada desde el inicio, de lo contrario no sobreviven. Si esta intervención tiene indicación de nutrición parenteral (NP), el cuadro se denomina falla intestinal (FI) (1. La FI ha sido la falla orgánica menos conocida y la última en ser reconocida hasta ahora. No fue hasta 2013 que la FIC debida a una enfermedad benigna se incluyó como un trastorno en la lista ORPHANET de enfermedades raras (Código ORPHA: 294422) (15. La posibilidad de reversibilidad de la falla intestinal crónica depende de múltiples factores que se observan en la (tabla 1)16. Los pacientes incapaces de rehabilitación se mantienen en NPD como única alternativa, con una sobre vida a los 5 años cercana al 80%17,18.
Actualmente la NP continúa siendo la principal terapéutica para pacientes con FI, sin embargo su uso a largo plazo puede generar complicaciones que determinen la necesidad de trasplante de intestino, combinado (hígado-intestino) o multivisceral. (3-7,18-20 No obstante, a pesar del desarrollo del trasplante de intestino a nivel mundial, los resultados no han sido los deseados. A esto se suma que existen importantes limitaciones de accesibilidad al procedimiento15-21. Estos hechos han reflotado el interés en el campo de la rehabilitación de pacientes con FIC. Se ha promovido la rehabilitación intestinal como objetivo primario para recuperar la suficiencia del intestino e independizarse de la NPC. Los avances en las técnicas quirúrgicas y sobre todo en el tratamiento médico han hecho posible que, hasta pacientes con menos de 20 cm de intestino puedan alimentarse e hidratarse por vía oral sin necesidad de NP o trasplante15-21. Los pacientes con FIC que han logrado resultados favorables en cuanto a su sobrevida y rehabilitación son particularmente aquellos que accedieron a una NPD segura y de calidad, que fueron tratados en centros especializados que cuentan con un programa multidisciplinario compuesto por clínicos, cirujanos, gastroenterólogos, nutriólogos, nutricionistas, enfermeros, psicólogos, intensivistas, infectólogos, paliativistas y asistentes sociales. Estos equipos logran una gestión adecuada de la catástrofe abdominal que genera el problema y de la falla intestinal secundaria. En conjunto tienen como principales objetivos devolverles la suficiencia intestinal reduciendo o eliminando la dependencia a la NPC y mejorando su CV. Al mismo tiempo que optimizan los costos relacionados con la asistencia de estos pacientes22. Uno de los resultados más relevantes publicados hasta la fecha es que el manejo médico y nutricional, realizado por un equipo de referencia, permite reducir significativamente los requerimientos de NPD (en hasta 40%) en la mayoría de los pacientes antes de considerar el uso de sGLP-223,24. Por lo que el esfuerzo debe destinarse a la conformación de estos equipos y este fármaco nunca deba ser considerado como el primer sustituto de la NPD. La tasa de mortalidad de los pacientes con FIC con NPD es de aproximadamente 20%-30% después de 5 años, que es aproximadamente igual a la supervivencia de los pacientes después del trasplante intestinal25. En 2012 el sGLP-2 fue aprobado por la FDA. La probabilidad de alcanzar la suficiencia intestinal, incluso en pacientes con anatomía desfavorable, ha aumentado con su introducción en los protocolos de tratamiento para pacientes seleccionados8-10,13,26. Actualmente en centros de referencia, únicamente aquellos pacientes que no pudieron continuar reduciendo el volumen de NPD en un período de aproximadamente 6 meses, son evaluados para iniciar sGLP-2. Existen fórmulas predictivas dispo nibles para estimar la probabilidad de destete de la NPD en este grupo de pacientes, lo que facilita una evaluación objetiva que evita indicaciones inadecuadas de un medicamento de alto costo11,12,27.
Las células L intestinales enteroendocrinas producen proglucagón que se escinde para formar glucagón, así como múltiples fragmentos de péptido derivado de proglucagón (PGDP), incluidos el péptido 1 similar al glucagón (GLP-1) y el péptido 2 similar al glucagón (GLP-2), denominados así porque comparten aproximadamente el 50% de los mismos aminoácidos que el glucagón28. Estos PGDP y el glucagón comparten acciones relacionadas que regulan el equilibrio de nutrientes y energía. La unión de GLP-2 a su receptor en las células intestinales determina a una mayor absorción de carbohidratos, aminoácidos y lípidos directamente a través del crecimiento de las células epiteliales intestinales, lo que provoca un aumento en el área de superficie de la mucosa de absorción (aumento de la altura de las vellosidades del intestino delgado, la profundidad de las criptas, el peso intestinal)29. Los estudios en animales y humanos muestran un aumento del flujo sanguíneo visceral y portal con la infusión de GLP-230. También puede inhibir la motilidad gastrointestinal y la secreción de ácido gástrico para aumentar el tiempo de absorción de nutrientes31. Estas acciones intestinotróficas y antiapoptóticas se consideraron el objetivo terapéutico para el tratamiento del SIC y la FIC (figura 1). Estos cambios estructurales y funcionales a nivel intestinal son los que han permitido reducir o eliminar la dependencia a la NP en hasta 60% de los pacientes con una media de 50 semanas de tratamiento, así como ocurrió con el caso que presentamos31-36. Los pacientes se consideran “respondedores tempranos” si el volumen de NP se reduce más del 20% del valor inicial antes de la semana 24, y “respondedores tardíos” si la respuesta positiva ocurre después de 24 semanas de tratamiento con sGLP-227. Nuestro paciente logró reducir un 25% del volumen de NPD a la semana 8, sin presentar efectos adversos significativos que obligaran a suspender el tratamiento. En la (figura 2) se observa la evolución de los requerimientos de NPD en relación con el tiempo de tratamiento. Las demás variables de resultado se ven en la (tabla 4). Al mismo tiempo se observó una mejoría en su composición corporal, así como su capacidad funcional evaluada por dinamometría de pulso. Las perspectivas a futuro con este paciente son lograr la independencia completa de la NPD y suspender posteriormente el sGLP-2. Actualmente (semana 76 de tratamiento) el paciente cursa su semana 30 sin necesitar NP. Según resultados alentadores recientemente publicados, aproximadamente la mitad de los pacientes que ya no recibían NPD pudieron interrumpir el tratamiento con sGLP-2, con un tiempo medio de tratamiento posterior de 63,5 semanas (DE ± 45,2). Manteniendo el peso, estado funcional, diuresis, número de deposiciones y estabilidad del medio interno, probablemente vinculado a su efecto acumulativo27.
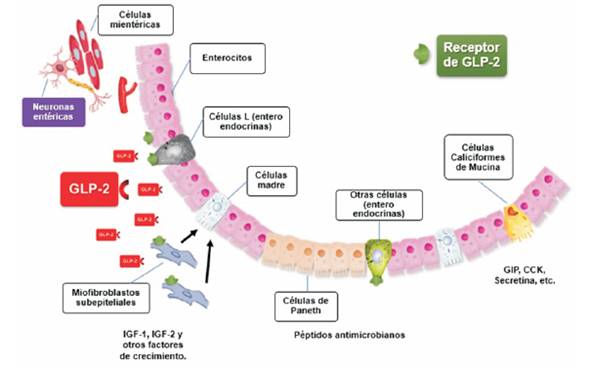
Figura 1A: Esquema del mecanismo de acción del GLP-2 a nivel intestinal. El GLP-2 (péptido 2 similar al glucagón) es liberado por las células L del íleon distal y el colon y actúa de forma aguda para enlentecer la motilidad proximal y aumenta de forma crónica el área de superficie mucosa, aumentando la capacidad de transporte de nutrientes. TPCC: tasa de producción de células de cripta. Modificado de: Sigalet DL. Nonruminant Nutrition Symposium: The role of glucagon-like peptide-2 in controlling intestinal function in human infants: regulator or bystander? J Anim Sci. 2012 Apr;90(4):1224-32. doi: 10.2527/jas.2011-4704.

Figura 1B: Efectos del péptido 2 similar al glucagón y sus mediadores sobre las células diana en el tracto gastrointestinal. La activación de los receptores de GLP-2 (GLP-2R) en las neuronas entéricas estimula la liberación de óxido nítrico (ON) y péptido intestinal vasoactivo (VIP). El ON aumenta el flujo sanguíneo mesentérico y aumenta la captación de aminoácidos y glucosa, y el VIP reduce la infiltración de células inmunes, la liberación de citocinas proinflamatorias y la apoptosis en los enterocitos. Los factores de crecimiento liberados de los miofibroblastos subepiteliales por activación de GLP-2R, incluido el factor de crecimiento similar a la insulina (IGF) -1, IGF-2, el factor de crecimiento de queratinocitos (KGF) y el factor de crecimiento epidérmico (EGF)-miembros de la familia ErbB, median el aumento de la proliferación y crecimiento de diversas células de las criptas intestinales. La expresión de las proteínas de unión estrecha celular que controlan la permeabilidad intestinal se ve afectada por el GLP-2 y depende del receptor de IGF-1. La síntesis y la actividad normales de los péptidos antimicrobianos producidos por las células de Paneth dependen de la activación de GLP-2R. Otras células enteroendocrinas que secretan factores como el péptido inhibidor gástrico (GIP), la secretina y la colecistoquinina (CCK) expresan GLP-2R y tienen varios efectos posteriores. Modificado de: Connor EE, Evock-Clover CM, Wall EH, Baldwin RL 6th, Santin-Duran M, Elsasser TH, Bravo DM. Glucagon-like peptide 2 and its beneficial effects on gut function and health in production animals. Domest Anim Endocrinol. 2016 Jul;56 Suppl:S56-65. doi: 10.1016/j.domaniend.2015.11.008.
Conclusiones
La incidencia de pacientes con SIC y FIC ha aumentado a lo largo de los años. El progreso de la medicina de cuidados intensivos y las técnicas de nutrición parenteral han mejorado significativamente el pronóstico de individuos que han perdido gran parte de su tracto intestinal como nuestro paciente. Presentamos la versión narrativa de un caso clínico único en nuestro país, un paciente con FIC y factores predictivos clásicos negativos para la rehabilitación intestinal con tratamiento estándar. La NPD segura y de alta calidad, conducida por un equipo especializado, ha permitido la supervivencia de este paciente, que sin embargo no estuvo exenta de complicaciones a largo plazo. El sGLP-2 ha revolucionado el tratamiento de la FIC y permitió la independencia de la NPD como ocurre en un porcentaje significativo de pacientes. Se impone la necesidad de establecer y consolidar equipos multidisciplinarios con experiencia en el manejo de los pacientes con falla intestinal en nuestro país.