1. Introducción
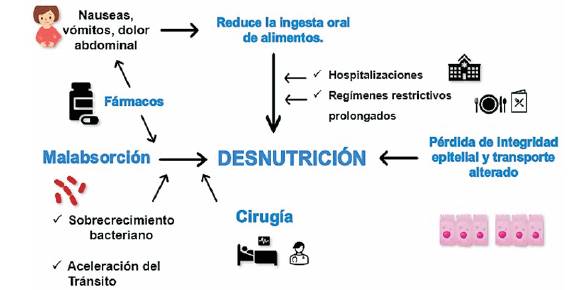
Las enfermedades inflamatorias del intestino (EII), la colitis ulcerosa (CU) y la enfermedad de Crohn (EC) se caracterizan por una inflamación crónica recidivante y remitente del tracto gastrointestinal. La CU se limita a la capa mucosa del colon, casi siempre involucra el recto y puede extenderse para involucrar porciones más proximales del intestino grueso de manera continua. La EC por su parte se caracteriza por determinar inflamación transmural y omisión de áreas de compromiso (segmentos de intestino de apariencia normal interrumpidos por áreas de enfermedad) de todo el tracto gastrointestinal desde la boca hasta el ano. Como resultado del compromiso del tracto gastrointestinal, la desnutrición es un problema frecuente en pacientes con EII, algunos estudios han informado una prevalencia de 70%-80% de los pacientes hospitalizados con EII y en 20%-40% de los pacientes ambulatorios con EC1. La desnutrición puede ocurrir tanto en la CU como en la EC, pero la prevalencia de desnutrición proteicoenergética y de nutrientes específicos parece ser mayor en la EC en comparación con la CU, probablemente porque puede afectar cualquier parte del tracto gastrointestinal. Generalmente es secundaria a reducciones en la ingesta oral, pérdidas gastrointestinales aceleradas, al tratamiento farmacológico (glucocorticoides, sulfasalazina) y al hipermetabolismo que determina mayores requerimientos nutricionales durante la enfermedad activa. La desnutrición es uno de los factores más importantes asociados con una mala evolución clínica en pacientes con EII, por lo que la evaluación del estado nutricional y la necesidad de terapia nutricional desempeñan un papel fundamental en la atención clínica de estos pacientes1. En la (figura 1) se resumen los mecanismos de desnutrición en pacientes con EII.
En la base etiopatogénica de las EII existe una interacción compleja, y no completamente comprendida, de múltiples factores que incluyen la genética, el sistema inmunológico, los factores microbianos y ambientales, en particular la dieta. Se han identificado mutaciones en uno o más de aproximadamente 200 genes que codifican o modulan la expresión de proteínas que afectan las funciones de regulación inmunológica en pacientes diagnosticados con EII2. Por otro lado, los estudios epidemiológicos revelan una mayor prevalencia de EII en países desarrollados, las tasas de incidencia se están acelerando en países occidentalizados siguiendo un patrón evidenciado previamente en el siglo XX en el mundo occidental3. Esto pone de relieve el impacto limitado de la genética y la importancia potencial de los factores ambientales en la patogénesis, sugiriendo que el estilo de vida occidental típico, incluida la dieta, puede contribuir al desarrollo de la EII. Cuando el individuo se expone a un desencadenante ambiental, puede generarse una respuesta desregulada del sistema inmunológico de la mucosa a la microbiota que reside dentro de la luz intestinal, culminando en una respuesta inflamatoria exagerada4. Existe un interés creciente por comprender el papel que puede desempeñar la dieta en la patogenia y el tratamiento de la EII, lo que podría traducirse en una mejora de los resultados cínicos en pacientes con EII1.
1.1. EII e inflamación
En la EC la inflamación puede ocurrir a través de la longitud del tracto GI y no se limita a la mucosa, sino que es transmural, afectando el grosor total del tejido. La ubicación anatómica de la enfermedad puede cambiar con el tiempo, pero es más común encontrarla en el intestino delgado distal, donde se encuentra en el 47% de los casos en el momento del diagnóstico, mientras que afecta al colon en el 28% de los casos y en el 21% de los casos compromete al íleon y al colon. Por otro lado, la CU está confinada al colon y la inflamación afecta solo a la mucosa5.
Las EII y sus síntomas asociados se pueden atribuir a la respuesta inflamatoria prolongada y disfuncional. Los cambios en la arquitectura de la mucosa intestinal, estenosis, engrosamiento intestinal, ulceraciones, alteración de la motilidad y malabsorción son algunos ejemplos de las consecuencias de la respuesta inflamatoria intensificada en las EII. Los síntomas típicos de la enfermedad tales como dolor intestinal y extraintestinal, distensión abdominal, diarrea, esteatorrea, pérdida de peso y desnutrición son manifestaciones de niveles aumentados de citocinas locales y circulantes y otros productos de la inflamación. La EII es habitualmente una enfermedad intermitente que se caracteriza por recaídas (brotes) y remisiones. Los factores ambientales pueden desencadenar una recaída o ayudar a mantener la remisión, por lo que el conocimiento de estos factores es importante para el manejo clínico de estos pacientes. Sin embargo, los factores desencadenantes potenciales son múltiples (genéticos y ambientales), y con frecuencia son difíciles de predecir. Además, pueden transcurrir varios años entre el inicio, el daño histológico, los síntomas y el diagnóstico de EII. De particular interés es la interacción compleja entre la dieta de un paciente, su microbioma intestinal y el sistema inmunológico y cómo pueden manipularse para controlar mejor su enfermedad, mejorar la eficacia de los tratamientos y reducir los riesgos y efectos secundarios asociados con las terapias médicas tradicionales6. Las reacciones normales a la dieta pueden causar síntomas gastrointestinales (gases, distensión abdominal, dolor, calambres y diarrea) y pueden confundirse con una enfermedad activa. Los factores dietéticos que se considera que provocan una enfermedad activa incluyen una ingesta elevada de azúcar, lípidos específicos, metabolismo anormal de aminoácidos que contienen azufre como en la hiperhomocisteinemia, ingesta inadecuada de nutrientes como el folato y vitamina D, e intolerancias o alergias alimentarias individuales. Por otro lado, existe datos que apoyan el hecho de que la lactancia y el consumo de frutas, verduras, fibra dietética y lípidos omega-3 son protectores7. Si bien durante mucho tiempo ha existido la percepción del paciente sobre el papel que desempeña la dieta en el inicio y el curso de la enfermedad, la evidencia que respalda esto y cómo manipular de manera óptima la ingesta dietética y proporcionar consejos dietéticos prácticos y sólidos ha sido limitada.
2. Aspectos nutricionales en las EII
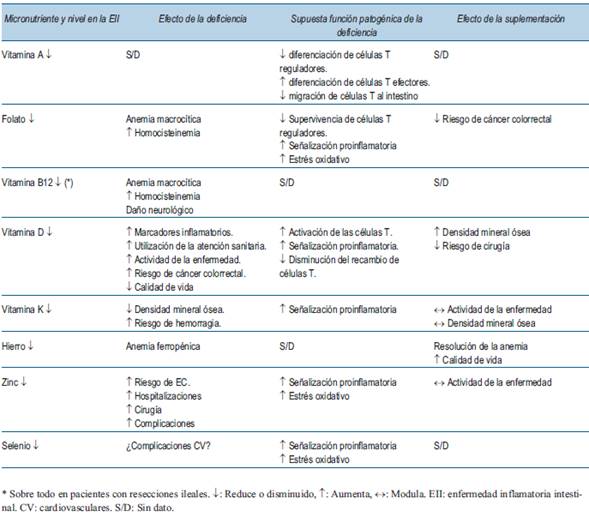
Los pacientes con EII ya están en riesgo de deficiencias de micronutrientes y macronutrientes y esto puede verse agravado por la evitación de alimentos sin supervisión. Debido a la ingesta crónica deficiente, el aumento de las tasas de renovación de proteínas y el aumento de las pérdidas intestinales de nutrientes durante las fases de la enfermedad activa, puede haber una pérdida neta de proteínas. Una revisión sistemática informó que hasta un 60% de los pacientes con EII tienen una masa muscular disminuida en comparación con los sujetos sanos.8 La sarcopenia se ha asociado con una mayor necesidad de cirugía y resultados quirúrgicos deficientes en la EII, así como con la osteopenia9. En la (tabla 1) se muestra la frecuencia de las deficiencias de micronutrientes más comunes en pacientes con EII. La deficiencia de micronutrientes esenciales conduce a efectos secundarios deletéreos que involucran el metabolismo, la expresión génica y el estrés oxidativo10. En el contexto de la EII, el papel de los micronutrientes en el control genético y la antioxidación es de particular importancia. Las vitaminas A, B y E se han implicado en la regulación de las respuestas inmunitarias y la homeostasis en el intestino, inhibiendo la liberación de citocinas inflamatorias y favoreciendo la diferenciación de los linfocitos reguladores sobre los linfocitos T efectores proinflamatorios11. En pacientes sanos, la producción de especies reactivas de oxígeno (ROS) se equilibra con la actividad de micronutrientes antioxidantes como las vitaminas A y E, así como las enzimas que requieren metales traza (zinc y selenio, por ejemplo) como cofactores. En la EII, la desregulación inmunitaria y la inflamación dan como resultado un aumento de la producción de ROS, lo que subyace aún más a la importancia de los micronutrientes antioxidantes para mitigar la patogénesis de la EII12. No está claro si es el aumento de la gravedad de la enfermedad el responsable de las deficiencias de micronutrientes al afectar la absorción o si por el contrario son los niveles cada vez menores de micronutrientes, que actúan como antioxidantes y reguladores inmunitarios, los responsables de la progresión de la EII. En la (tabla 2) se presentan las implicaciones inmunológicas de las deficiencias de micronutrientes, en pacientes adultos con EII.
Tabla 1: Frecuencia de deficiencias nutricionales en pacientes con enfermedad inflamatoria intestinal (EII). (Adaptado de Balestrieri et al47).
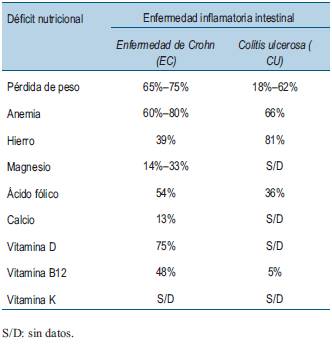
Tabla 2: Implicaciones inmunológicas y resultados clínicos asociados con las deficiencias de micronutrientes en la EII. (Adaptado de Kilby y colaboradores48).
2.1. Interacciones entre la dieta, el microbioma y el sistema inmune en las EII
La disbiosis es un desequilibrio en la composición del microbioma intestinal y es una característica de la EII. Esto se caracteriza por la pérdida de diversidad microbiana, particularmente de bacterias anaeróbicas favorables y productoras de ácidos grasos de cadena corta (AGCC) como Faecalibacterium prausnitzii , así como un mayor número de especies patógenas invasoras y adherentes desfavorables como Escherichia coli invasora adherente13. Se postula que cuando la disbiosis y la función microbiana alterada se combinan con la función de barrera de la mucosa alterada como ocurre en las EII, se produce inflamación de la mucosa14. La dieta influye en el sistema inmunológico y la respuesta inflamatoria tanto a través de su capacidad para alterar la estructura y función microbiana como a través de interacciones con las defensas de la mucosa intestinal y las células inflamatorias directamente.
En la (figura 2) se esquematizan los mecanismos propuestos de interacciones patológicas entre la dieta y el sistema inmunitario que pueden contribuir al riesgo de desarrollar EII y la actividad de la enfermedad. Aunque los estudios epidemiológicos nutricionales están limitados por muchos factores de confusión, algunas relaciones fueron sólidas y consistentes entre los estudios. La ingesta de leche materna, frutas y verduras y una mayor proporción de ácidos grasos n -3/n -6 en la dieta parecen protectores mientras que la ingesta de bebidas azucaradas se asocia con un mayor riesgo de ambas formas de EII. La carne roja parece estar relacionada solo con el riesgo de CU, y un mayor consumo de emulsionantes y grasas animales parece aumentar el riesgo de EC. La evidencia más sólida de la reducción del riesgo en el desarrollo de EC se encuentra con el pescado, particularmente como parte de una dieta mediterránea, así como con una ingesta adecuada de zinc y vitamina D, mientras que la ingesta de ácido docosahexaenoico (DHA), un ácido graso no esencial poliinsaturado de la serie omega-3 puede reducir el riesgo de CU15,16. Por otro lado, la actividad de la enfermedad también puede estar modulada por la dieta, con evidencia de que la fibra dietética, una alta proporción de ácidos grasos poliinsaturados (PUFA) n -3/n -6 en la dieta puede disminuir el riesgo de brotes en ambas formas de EII. Los niveles disminuidos de zinc y vitamina D se han asociado inversamente con niveles de actividad de la enfermedad y peores resultados de salud en ambas formas de EII17.Los factores que aumentan el riesgo de brotes en la CU incluyen el ácido mirístico y la carne roja. Se ha demostrado que las dietas bajas en gluten y dietas bajas en carbohidratos de cadena corta no digeribles (FODMAP) mejoran los síntomas residuales en aquellos con EII en remisión, específicamente en aquellos con síndrome de intestino irritable concomitante18. En la (tabla 3) se esquematiza la relación entre los componentes dietéticos y el impacto en el control de la enfermedad y en la (figura 3) se muestra una representación esquemática del mecanismo propuesto de interacción favorable entre la dieta y la inmunidad intestinal que puede proteger del desarrollo de la EII y mejorar la actividad de la enfermedad.
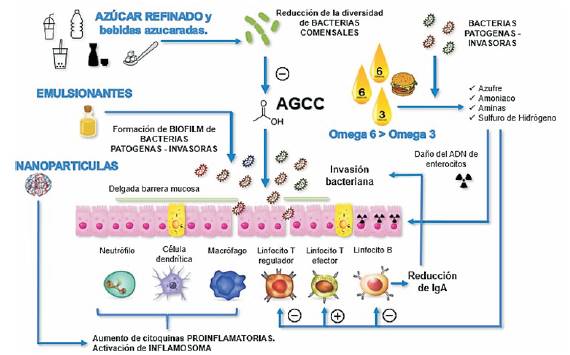
Figura 2: Interacciones entre la dieta y el sistema inmune y su impacto en las enfermedad inflamatoria intestinal (adaptado de: Wark et al 49). AGCC: ácidos grasos de cadena corta.
Tabla 3: Componentes dietéticos y su impacto en el control de la enfermedad. (Adaptado de Wark y colaboradores49).
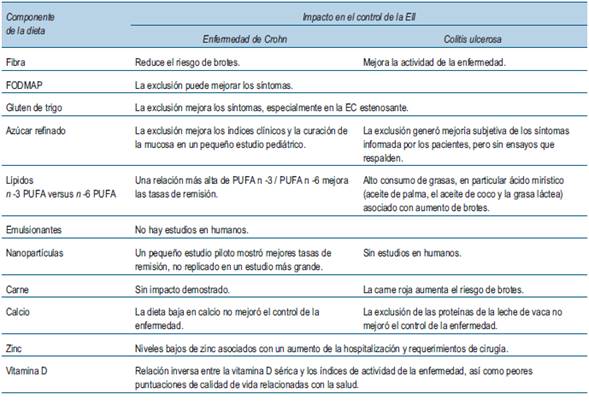
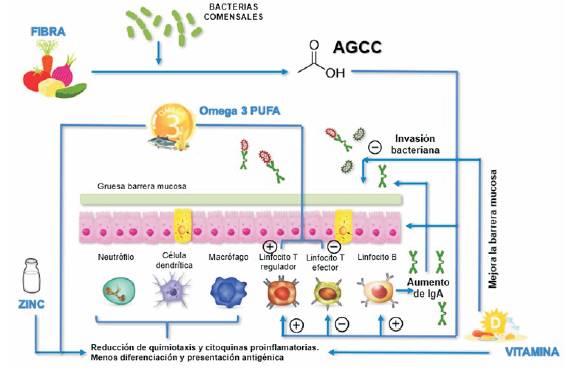
Figura 3: Interacción favorable entre la dieta e inmunidad intestinal en pacientes con enfermedad inflamatoria intestinal(adaptado de: Wark et al 49). AGCC: ácidos grasos de cadena corta; PUFA: ácidos grasos poliinsaturados.
3. Terapia nutricional en las EEI
Se han estudiado tres modelos o enfoques principales de intervención dietética para su uso en la práctica clínica con el objetivo de colaborar en el control de los brotes de EII fundamentalmente en la EC; estos son
Debido a la naturaleza restrictiva de muchos de estos regímenes dietéticos, se reservan en gran medida para los pacientes más graves o para aquellos que deban evitar el uso de medicamentos a base de esteroides.
3.1 Nutrición enteral exclusiva y nutrición enteral parcial
La nutrición enteral exclusiva (NEE) implica el suministro del 100% de las necesidades nutricionales de una persona como una fórmula nutricional líquida administrada por vía oral o enteral durante un período de 6 a 8 semanas. Se postula que la NE modula la respuesta inmune intestinal al reducir la exposición al antígeno. En consecuencia parece ejercer un efecto antiinflamatorio sobre la mucosa intestinal al reducir la producción de IL-6 y aumentar la producción de factor de crecimiento similar a la insulina (IGF) -1, generando cambios en el microbioma intestinal y el metaboloma, disminuyendo significativamente la diversidad bacteriana intestinal por debajo de los niveles previos al tratamiento y facilitando la curación de la mucosa, al limitar la actividad de la microbiota patógena con el reposo intestinal inducido21. En este sentido un metaanálisis y una revisión Cochrane de ensayos controlados aleatorios (ECAs) investigan el efecto de la NE en la EC22,23. Estos estudios han demostrado principalmente que la NE como única nutrición puede inducir la remisión clínica y la curación de la mucosa en la EC. Se ha observado que la NE es eficaz en el tratamiento de la fase aguda de la EC, con tasas de remisión que oscilan entre el 20% y el 84,2%, independientemente de la ubicación de la enfermedad24. Otros metaanálisis más recientes han sugerido que existe beneficio de la NEE para la inducción y el mantenimiento de la remisión de la EII en comparación con el placebo en pacientes adultos con EC, pero no en comparación con los corticosteroides25,26.
3.1.1. Inducción de la remisión
El metaanálisis de Zachos y colaboradores, que incluyó 192 pacientes adultos tratados con NE y 160 con corticosteroides, indicó que la NE es menos eficaz que los corticosteroides para inducir la remisión de la EC activa. Sin embargo, el metaanálisis fue realizado hace más de diez años y los pacientes que completaron con éxito la NE lograron tasas de remisión comparables a las de los que recibieron corticosteroides24. Sugiriendo que una de las principales barreras para la eficacia es la adherencia del paciente al tratamiento con NEE27. Posteriormente un gran estudio retrospectivo chino mostró que los pacientes con EC que completaron la terapia con NEE antes del tratamiento quirúrgico de la EC tenían un riesgo menor de complicaciones y reoperaciones e intervalos libres de inmunosupresores más prolongados en comparación con los pacientes sin terapia con NEE28.
3.1.2. Mantenimiento de la remisión
La NEE podría usarse no solo para controlar el brote sino también para mantener la remisión29.Varios estudios han evaluado la eficacia de la NE para mantener la remisión inducida médica o quirúrgicamente30,31. Estos estudios han mostrado tasas de recurrencia significativamente más bajas en pacientes tratados con NEE que en aquellos con una dieta normal. Por otro lado, Takagi y colaboradores aleatorizaron a 51 pacientes con EC que habían alcanzado recientemente la remisión, 26 para recibir la mitad de su ingesta calórica como NE y 25 para tener una dieta libre32.Durante un seguimiento medio de 11,6 meses, la tasa de recaída fue del 34,6% en el grupo “medio enteral” y del 64% en el grupo de dieta libre. Por su parte, Hanai et al. comparó en tres grupos el efecto de la 6-mercaptopurina (6-MP), una dieta elemental y ninguna terapia en pacientes en mantenimiento de la EC. Después de 24 meses, las tasas de remisión clínica en los grupos de dieta elemental y 6-MP fueron significativamente más altas que en el grupo de control. No hubo diferencias significativas entre el grupo de 6-MP y el grupo de dieta elemental33. En otro estudio prospectivo que incluyó a 40 pacientes adultos con EC que alcanzaron la remisión clínica, en el que 50% de los pacientes recibieron infusión continua de dieta elemental durante la noche y una dieta baja en grasas durante el día, mientras que la otra mitad no recibió terapia nutricional ni restricción alimentaria, se observó que 25% en el grupo NE y 65% en el grupo sin NE tuvieron una recaída clínica durante el período de observación de un año34.
Se esperaba que la administración de nutrición enteral parcial (NEP: 50% de nutrición enteral y 50% de dieta sin restricciones) pudiera mejorar el cumplimiento. Cuando se comparó la NEP con la NEE, el régimen de NEE fue muy superior35. Con la intención de optimizar el enfoque de la NEP, Levine y colaboradores diseñaron recientemente un estudio de 12 semanas que compara la NEE estándar y una dieta de exclusión de EC específica (DEEC) más la NEP en una población pediátrica36. Esta dieta consistió en alimentos que tenían menos probabilidades de tener efectos adversos sobre el microbioma y la barrera intestinal, evitaron los alimentos ricos en emulsionantes y edulcorantes artificiales. La tasa de aceptabilidad del paciente fue mayor con DEEC que con la NEE y las tasas de respuesta clínica no fueron estadísticamente diferentes entre los dos regímenes de dieta. Esto parece prometedor, postulando la utilización de un enfoque dietético menos restrictivo para lograr tasas de remisión no inferiores a la terapia NEE. En este sentido, el estudio CD-TREAT evaluó los efectos de una dieta individualizada, cuyo objetivo era recrear los beneficios de una NEE mediante la exclusión de componentes dietéticos específicos, como el gluten, la lactosa y el alcohol. Se observó un impacto similar a la NEE en el microbioma intestinal, la inflamación y la respuesta clínica en un modelo de rata, así como en adultos y niños con EC. Esta dieta fue más fácil de cumplir para los pacientes y más aceptable que la NEE37.
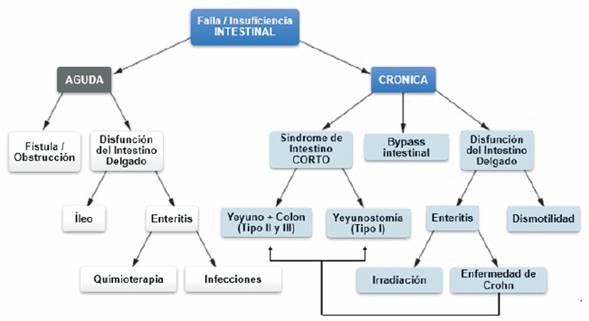
3.1.3 Tratamiento de la falla o insuficiencia intestinal
La EC puede determinar una insuficiencia o falla intestinal, y esta entidad es la afección intestinal más representativa en la que la terapia nutricional constituye un componente fundamental del tratamiento en estos pacientes38. En la (figura 4) se observa un esquema de las causas de insuficiencia y falla intestinal.
El rango y el tipo de terapia nutricional requerida en pacientes con insuficiencia intestinal depende de la extensión y ubicación de los segmentos intestinales enfermos, principalmente en el intestino delgado, que muestran alteraciones en la capacidad de absorción. Si la presentación clínica de la insuficiencia intestinal muestra una afección grave, como el síndrome del intestino corto (SIC) con falla intestinal, la suplementación intravenosa de líquidos, electrolitos y diversos nutrientes sería un componente importante de la estrategia de tratamiento. Aunque se dispone de pruebas y pautas limitadas con respecto al momento óptimo y los métodos de implementación e interrupción de la nutrición enteral (NE) o la nutrición parenteral (NP), generalmente se recomienda intentar la reintroducción de la NE tan pronto como los pacientes se recuperen de una enfermedad intestinal grave39.
3.2 Nutrición parenteral
Dado que los antígenos de la dieta pueden ser estimulantes importantes para el sistema inmunológico de las mucosas, el reposo intestinal con nutrición parental total (NPT) se ha considerado como una opción terapéutica en la EII con falla intestinal. El objetivo de la NPT como terapia primaria para la EII es lograr el reposo intestinal, corregir los déficits nutricionales y eliminar los estímulos mucosos antigénicos. Varios estudios han analizado el efecto de la NPT y en la década de 1980, especialmente, la NPT se utilizó para tratar a pacientes con EC de moderada a grave40.
Müller y colaboradores evaluaron de forma prospectiva el efecto de la NPT en 30 pacientes con EC, por lo que el 83% logró la remisión, pero la recaída fue frecuente. La cirugía podría evitarse en 25 de 30 pacientes con EC complicada con 3 semanas de NPT hospitalaria seguida de 9 semanas más de NP domiciliaria41. Greenberg y colaboradores compararon el efecto de la NPT, la NPP con NE de baja dosis, o la NPP con una dieta normal suplementaria. No hubo diferencias significativas en las tasas de remisión: 71% en el grupo de NPT, 58% en el grupo de NPP con NE y 60% en el grupo de NPP y dieta normal42. La NPT desempeña un papel en la curación de las fístulas enterocutáneas posoperatorias que surgen de una anastomosis quirúrgica o de fístulas complicadas en la EC38. Cuando se comparan NPT y NE, la NPT se asocia con costos más altos y riesgos significativos, incluida la sepsis asociada al catéter venoso central, y debe restringirse a pacientes con falla intestinal que no pueden recibir una nutrición adecuada por vía enteral43.
3.3. Rol de los probióticos
Las estrategias que modulan la disbiosis podrían ser una opción terapéutica en la EII. Los probióticos pueden mejorar el equilibrio microbiano intestinal, mejorando la función de barrera intestinal y mejorando la respuesta inmune local. Sin embargo, no existe evidencia sólida que justifique el uso de ninguna de las cepas probióticas que se han probado en el pasado en el tratamiento de la EC44,45. El uso de probióticos en pacientes con EC ha producido resultados ambiguos y los ensayos disponibles son pequeños, con muy pocos ensayos controlados, aleatorizados y doble ciego. Los datos más convincentes hasta ahora sobre el efecto de los probióticos en la EII se han encontrado en la prevención y el mantenimiento de la remisión de la pouchitis. Varios estudios confirman la eficacia del uso del preparado probiótico #VSL3 para prevenir la pouchitis o mantener la remisión en pacientes en que se indujo la misma por medio de antibioticoterapia46.
En la (tabla 4) se resumen los efectos de las intervenciones nutricionales en la enfermedad inflamatoria intestinal y en la (tabla 5) se exponen las intervenciones nutricionales en la enfermedad de Crohn. Mientras que en la (tabla 6) se observa un esquema para guiar el tratamiento nutricional en pacientes con enfermedad activa complicada.
Tabla 4: Resumen de los efectos de las intervenciones nutricionales en la enfermedad inflamatoria intestinal.

Tabla 5: Resumen de intervenciones nutricionales médicas en la enfermedad de Crohn activa. (Wark et al49).
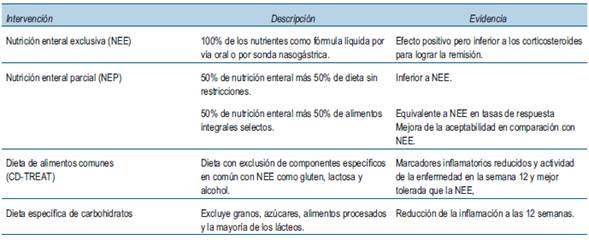
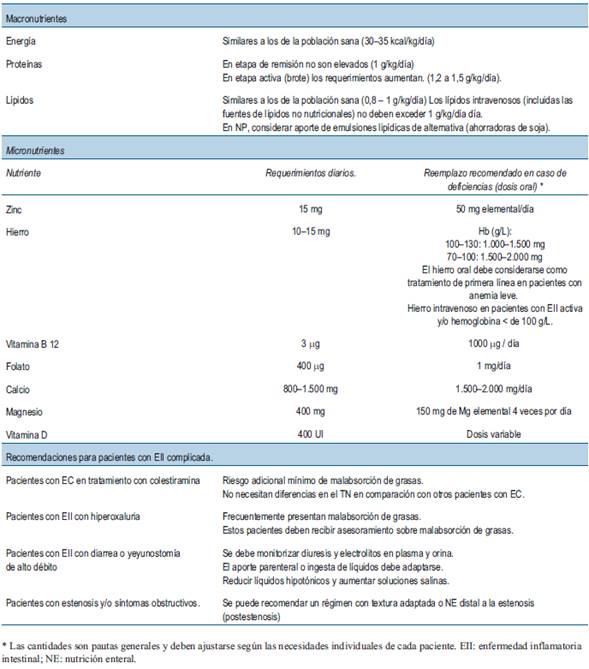
Tabla 6: Tratamiento nutricional (TN) en pacientes con EII. Consideraciones actuales sobre nutrientes específicos y micronutrientes aplicables a pacientes con EII (adaptado de Bischoff et al 50).
4. Conclusiones
La terapia farmacológica sigue siendo el pilar del tratamiento de la EII. Sin embargo, los aspectos nutricionales son especialmente relevantes ya que potencialmente influyen en la actividad de la enfermedad y, por tanto, en su morbilidad. La disbiosis inducida por la nutrición contribuye a la patogenia de la EII, por lo que las modificaciones en la dieta tanto para la prevención como para el tratamiento de la EII son una estrategia de tratamiento deseable. Parece sustancial que los médicos clínicos conozcan los componentes específicos de la dieta que ejercen efectos tanto proinflamatorios como antiinflamatorios en el contexto de EC y CU. Probablemente la terapia nutricional encuentre su lugar en un enfoque de tratamiento personalizado de estos pacientes en la esfera de una estrategia de tratamiento necesariamente multidisciplinario que permita lograr un control óptimo de la enfermedad y minimizar los efectos secundarios no deseados.