Introducción
El síndrome de Boerhaave (SB) es una causa poco frecuente de dolor torácico y/o epigástrico que aparece bruscamente, generalmente posterior a esfuerzo de vómito, planteándose como causa de ruptura un aumento repentino de la presión intraluminal. Suele acompañarse de neumomediastino, derrame pleural uni o bilateral, y en la mayoría de los casos evoluciona a la mediastinitis, situación que amenaza la vida1,2.
Caso clínico
Hombre 63 años, ex fumador, hipertenso. Luego de ingesta copiosa, presenta vómitos profusos e intensa epigastralgia acompañada de edema facial, consultando en centro secundario. Se constata enfisema subcutáneo en cara, cuello y tórax con radiografía de tórax que muestra neumomediastino, trasladándose a emergencia del Hospital Maciel. Ingresa vigil, dolorido, apirético, estable en lo hemodinámico y respiratorio. Electrocardiograma con taquicardia sinusal sin elementos de isquemia aguda. De la paraclínica se destaca: glóbulos blancos de 18.000/mm3; resto incluido troponinas sin alteraciones. Valorado por cirujano solicita tomografía computarizada (TC) cuello, tórax y abdomen que informa: enfisema subcutáneo de distribución simétrica en sector cervical, a nivel torácico enfisema mediastinal extendido a región paracardíaca disecando espacios peritraqueales, periesofágicos y periaórticos. Cerca del hiatus colección con nivel hidroaéreo. Derrame pleural bilateral mayor a izquierda. Mediante contraste hidrosoluble vía oral (VO), se observa colección paraesofágica izquierda, sin pared propia, de 5 x 6 cm, probablemente relacionada a fuga de contraste (figura 1).
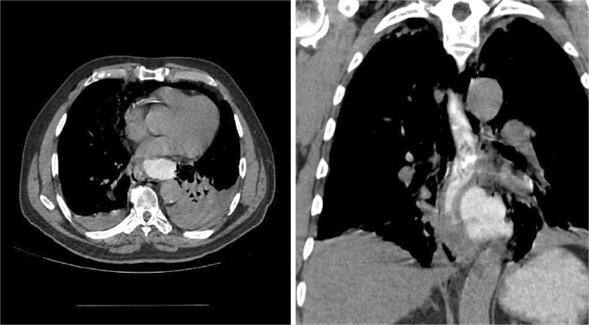
Figura 1: Tomografía computada de tórax con contraste vía oral. Se observa fuga de contraste con colección paraesofágica izquierda. Derrame pleural bilateral mayor a izquierda donde produce atelectasia pasiva del lóbulo inferior izquierdo. En el corte frontal se observa la topografía de la perforación a nivel del tercio inferior del esófago a izquierda.
Con planteo de SB, se opera de urgencia. Abordaje por toracotomía izquierda, se constata mediastinitis con pseudomembranas y colección lateroesofágica distal izquierda. Se visualiza desgarro longitudinal total de pared esofágica anterior de 3 cm, confirmándose diagnóstico. Se realizó esofagorrafia sobre tubo de Kehr (sacado por contrabertura) colocando parche de músculo intercostal pediculizado sobre rafia. Toilette mediastinal y pleural. Se colocaron dos drenajes, pleural y mediastinal. Se confeccionó yeyunostomía de alimentación.
Ingresa en posoperatorio a unidad de cuidados intensivos, intubado, sin vasopresores ni insuficiencia respiratoria. Se mantiene asistencia respiratoria mecánica (ARM) y se continuó tratamiento antibiótico con ampicilina sulbactam y amikacina. Presenta buena evolución, sin disfunción multiorgánica, recibe antibioticoterapia por 10 días. Se logra desvincular de la ARM a los 5 días, otorgándose alta a cuidados moderados 12 días posteriores al ingreso. Buena evolución posterior. Se retiró tubo T sin incidentes, no desarrollando fístula esófago-pleural, siendo dado de alta hospitalaria en buenas condiciones. Fallece años después en la misma clínica quirúrgica por un cáncer de colon estadio IV.
Discusión
En 1723 el Dr. Herman Boerhaave describe por primera vez esta patología luego de asistir al Gran Almirante de la flota holandesa, el Barón Jan van Wassenaer, el cual posingesta copiosa de alimentos presentó vómitos profusos y dolor torácico en hemitórax izquierdo, falleciendo 17 horas después. En la autopsia, Boerhaave evidenció la rotura de la cara posterior izquierda del esófago, a 5 cm del diafragma3,4.
Se define al SB como una ruptura esofágica espontánea, descartando traumatismos, instrumentación esofágica, ingestión de objetos extraños o patología esofágica previa. Se diferencia del síndrome de Mallory-Weiss en que este cursa solamente con laceración de la mucosa, y en el SB se produce ruptura completa de la pared del órgano5-7. Como mecanismo fisiopatológico se plantea un aumento brusco de presión intraluminal que alcanza hasta 290 mmHg, generalmente producido por esfuerzo de vómito. Esta hipertensión intraluminal se ve favorecida por ocurrir con músculo cricofaríngeo conscientemente cerrado, pudiendo observarse también en otros esfuerzos a glotis cerrada1,6. La ruptura afecta en 80% de los casos al tercio inferior del esófago, hecho favorecido por condiciones anatómicas como la disminución del grosor de la capa muscular en dicho sector, entrada de vasos y nervios y falta de estructuras de soporte. Los desgarros suelen producirse siguiendo el eje longitudinal debido a la disposición de haces musculares del tercio inferior esofágico, más frecuentemente a izquierda, como sucedió en el caso presentado. Menos frecuentemente la ruptura ocurre a nivel subdiafragmático y cervical. Son factores predisponentes la hernia hiatal, enfermedad por reflujo gastroesofágico y alcoholismo6.
La ruptura esofágica es infrecuente, aproximadamente 3,1 casos/1.000.000 de habitantes, correspondiendo 15%-20% a rupturas espontáneas. Afecta más frecuente a hombres, principalmente entre 40 y 60 años5. La perforación esofágica es una de las patologías más graves que afectan el tracto digestivo. La mortalidad es consecuencia de la infección producida por la perforación, incluyendo mediastinitis, neumonía, pericarditis o piotórax. La supervivencia depende del diagnóstico precoz y el tratamiento quirúrgico adecuado. La mortalidad se estima en 20%-39% para ruptura espontánea, con un aumento de 2% por cada hora de retraso del tratamiento quirúrgico6,7. Si bien la presentación clínica es variable, característicamente se trata de pacientes de mediana edad que tras ingesta copiosa de alimentos presentan vómitos seguidos de dolor torácico intenso, disnea, neumomediastino, enfisema subcutáneo y finalmente sepsis y shock, de no diagnosticarse y tratarse a tiempo1,3,4. La relación temporal entre vómitos y dolor tiene gran valor semiológico ya que el vómito es el evento inicial, acompañado posteriormente de dolor torácico intenso. El complejo sintomático integrado por vómitos, dolor torácico y enfisema subcutáneo se denomina tríada de Mackler y se presenta en forma completa solo en 14%-30% de los casos, siendo altamente sugestivo de la enfermedad5,6. El dolor torácico suele ser muy intenso y localizarse en la región subesternal o el hemitórax izquierdo, pudiendo irradiar a cuello, hombros o espalda. En ocasiones, si la perforación es muy distal, el dolor es abdominal, simulando un cuadro abdominal agudo8. Puede existir disnea, por participación pulmonar o pleural, fiebre relacionada a infección mediastínica y hematemesis, generalmente de escasa entidad9.
En relación a los estudios diagnósticos, la radiografía de tórax permite aproximar al diagnóstico y descartar diferenciales. Puede mostrar derrame pleural izquierdo. Un hallazgo característico pero infrecuente (20%), es el signo de V de Naclerio que corresponde a bandas radiolúcidas que atraviesan los planos faciales detrás del corazón en la zona mediastinal izquierda, adoptando la forma de V y que se correlacionan con la presencia de neumomediastino1,6,9. Los estudios contrastados, como esofagograma con administración de contraste hidrosoluble (contraindicados contrastes de bario por provocar mediastinitis o su peoría), identifican la perforación en 75% de los casos, sabiendo que un estudio normal no descarta esta patología si la sospecha es alta. Actualmente la TC con administración de contraste hidrosoluble por vía oral es el estudio imagenológico de elección y logra identificar la solución de continuidad en la mayoría de los casos. Permite además valorar complicaciones y descartar diagnósticos diferenciales. En cuanto a estudios endoscópicos, su realización es controvertida, teniendo como ventaja determinar la localización exacta de la perforación y su extensión, permitiendo una mejor planificación quirúrgica. Como desventaja presentan riesgo elevado de complicaciones relacionadas a inyección de aire a nivel del esófago, con riesgo de neumotórax, neumomediastino, aumento de la ruptura y mayor riesgo de infecciones6,9.
El tratamiento se basa en el sostén de las funciones vitales, control del foco infeccioso y resolución de la perforación. Las medidas iniciales consisten en reposición hídrica, terapia antimicrobiana de amplio espectro dirigida a anaerobios de cavidad bucal y flora entérica, suspensión absoluta de vía oral, inhibidores de bomba de protones y soporte nutricional temprano una vez lograda la estabilización del paciente4,6.
En lo quirúrgico existen distintas estrategias, que se definirán según la estabilidad del paciente, el mecanismo de lesión, el tiempo de transcurrida la misma y la viabilidad esofágica4. En la literatura se reportan desde conductas conservadoras no quirúrgicas hasta esofagectomías radicales. Si bien no se han establecido estándares de tratamiento para el SB, las tendencias actuales plantean el cierre primario del esófago independientemente del intervalo de tiempo entre perforaciones y cirugía, basándose fundamentalmente en condiciones locorregionales5,6. Existe debate aun sobre la necesidad de reforzar la línea de sutura del esófago, ya sea con parche pediculado de los tejidos cercanos o de la malla absorbible4). Es de suma importancia la exhaustiva realización de toilette mediastinal y pleural, con colocación posterior de drenajes pleurales y mediastinales. Una alternativa es la técnica utilizada en nuestro paciente, en el que se realizó la esofagorrafia sobre tubo en forma de T para generar una fístula controlada de esófago6,10,11. En este caso nos decidimos por esta técnica ya que se trataba de una lesión muy evolucionada, en la que no era planteable (por las características locales y la situación fisiológica del paciente) una rafia primaria, así como tampoco embarcarse en una esofagectomía, procedimiento de mucho mayor morbilidad12-14. El desarrollo posterior de la cirugía torácica videoasistida ha permitido la reparación primaria sin necesidad de toracotomía con buenos resultados. Presenta como ventaja mejor visualización de la perforación, menor tiempo de recuperación, mejor control del dolor, como contrapartida conlleva mayor tiempo de cirugía, por lo que debiera realizarse en paciente estables6,15.
La esofagectomía radical se utiliza como técnica de salvataje en pacientes que presentan severa disfunción multiorgánica; similar la exclusión esofágica bipolar, que consiste en realizar ligadura a nivel de cardias y confeccionar una esofagostomía cervical. También se ha descrito el tratamiento endoscópico con colocación de stent metálico autoexpandible, logrando de esta forma excluir la perforación esofágica y favorecer la cicatrización, permitiendo retomar la vía oral precozmente. En su contra se describe una extensa lista de complicaciones: migración del stent, sangrado, estenosis, sepultación en la pared esofágica y dificultad en su extracción posterior con mayor mortalidad. En cuanto al tratamiento conservador (no operatorio) se aplica a pacientes muy seleccionados, generalmente diagnosticados precozmente, con perforaciones pequeñas, habitualmente cervicales y sin disfunciones. En estos casos se debe realizar una estricta vigilancia de la actividad infecciosa y presencia de fallas orgánicas4,6.
Como procedimientos adicionales se deberá emplazar acceso enteral para nutrición, por ejemplo, yeyunostomía de alimentación y gastrostomía de degravitación6,10,11. En lo posible, siempre se tratará de conservar el esófago. La conducta deberá definirse muchas veces en el intraoperatorio según los hallazgos, de acuerdo a la experiencia y disponibilidad de recursos.
En suma, la perforación esofágica espontánea es una patología grave, poco frecuente, con clínica muy inespecífica, lo que dificulta su diagnóstico. Es una enfermedad con alta mortalidad, debido fundamentalmente al retraso diagnóstico y por lo tanto terapéutico; requiriendo en la mayoría de los casos una resolución quirúrgica, además de un adecuado tratamiento antibiótico y soporte nutricional















