Introducción
En Uruguay, el cáncer es responsable del 24,6% de los fallecimientos y el cáncer colorrectal (CCR) ocupa el tercer lugar en incidencia y el segundo en mortalidad en hombres, con una tasa de 38,31 y 19,12/100.000 habitantes, respectivamente, y el segundo en incidencia y mortalidad en el sexo femenino con tasas de 27,82 y 12,78/100.000 habitantes, respectivamente1.
Está bien establecido el valor del CEA para el seguimiento del CCR; por lo tanto, debe solicitarse una vez realizado el diagnóstico y previo al comienzo del tratamiento como punto de referencia inicial2-4. En nuestro país, en la práctica clínica habitual, aún se observa que el CEA se solicita como prueba diagnóstica e incluso de tamizaje5.
En relación con esto, el presente estudio tiene como objetivo general evaluar el rendimiento del CEA para el diagnóstico del CCR en dos centros hospitalarios, uno de la capital (Hospital Maciel) y otro del interior (Cooperativa Médica de Florida), abarcando un período de 19 años (2000 - 2019), y como objetivos específicos determinar la sensibilidad, especificidad, valor predictivo positivo, negativo y eficacia del CEA en forma general y específica para cada estadio de la enfermedad.
Material y método
Se trata de un estudio prospectivo que evalúa el rendimiento de una prueba diagnóstica. La población estuvo constituida por los usuarios de ambos centros, a los cuales se les realizó dosificación de CEA y fibrocolonoscopía en el período comprendido por el estudio.
Para determinar el estadio de la enfermedad se consideraron aquellos casos que fueron operados o que se confirmó una metástasis a distancia mediante biopsia y estudio anatomopatológico.
Se incluyeron todos los casos que cumplían con los criterios establecidos. Se determinó que el número de casos incluidos tendría un mínimo de diez casos en cada celda de la tabla de contingencia, tal como lo establece Sánchez Pedraza6.
Fueron incluidos todos los pacientes adultos (mayores de 15 años), a quienes se les realizó videocolonoscopía en el período considerado que cumplieron los siguientes requisitos:
1) videocolonoscopía total en los usuarios sin CCR y videocolonoscopía total o parcial para aquellos con CCR y la confirmación histológica de adenocarcinoma;
2) contar con determinación de CEA dentro de los 30 días previos o posteriores a la videocolonoscopía, y
3) para la estadificación, el informe anatomopatológico de la pieza quirúrgica y la confirmación histológica de metástasis a distancia.
Fueron excluidos del presente estudio:
1) aquellos casos en que la videocolonoscopía fue parcial en los usuarios sin CCR o los evaluados únicamente con colon por enema;
2) las variedades histológicas diferentes a adenocarcinoma;
3) los cánceres de colon a los cuales se les realizó la determinación del CEA posteriormente al tratamiento quirúrgico;
4) pacientes con enfermedad inflamatoria intestinal y pólipos intestinales;
5) los cánceres de recto que recibieron tratamiento neoadyuvante, y
6) videocolonoscopías con informes de mala preparación colónica.
El análisis se realizó mediante la utilización de una calculadora de pruebas diagnósticas.
Resultados
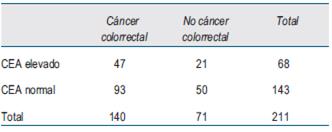
Se analizaron 211 casos clínicos de los cuales 140 tenían diagnóstico histológico de CCR a través de la biopsia endoscópica y 71 con fibrocolonoscopía total sin CCR. La totalidad tenía determinación de CEA.
La distribución de los valores de CEA se muestra en la (tabla 1). Se destaca que su valor estuvo elevado en 33,5% de los pacientes con diagnóstico de CCR y en 29,5% de las personas sin CCR.
En referencia al análisis por estadio de la enfermedad, precisamos que no se efectuó para el estadio 0, ya que no hubo casos, y tampoco para el estadio I, pues tampoco hubo casos con valores de CEA por encima del rango normal. También fueron excluidos del análisis aquellos casos en los cuales no fue posible estadificarlos por no haber sido operados, por ser irresecables o no haber accedido al informe anatomopatológico.
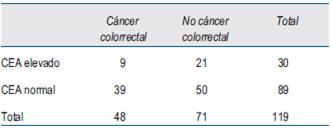
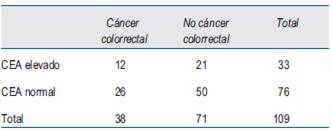
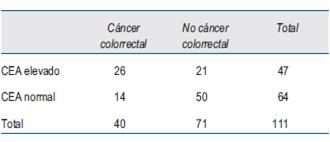
El número de casos incluidos para el análisis en cada estadio se muestra en la (tabla 2), (tabla 3)y (tabla 4).
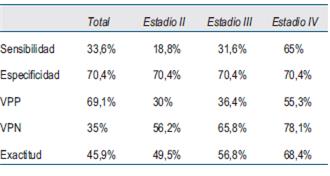
Los resultados del análisis se presentan en la (tabla 5).
Discusión y comentarios
Los marcadores tumorales son ampliamente utilizados para evaluación y control de pacientes con cáncer. Si bien existe un importante nivel de evidencia que establece el uso de nuevos biomarcadores para la detección precoz del CCR, marcadores conocidos, como el CEA, han sido extensamente evaluados en relación al diagnóstico y manejo del CCR7.
El CEA es una glicoproteína producida por las células columnares y caliciformes en el colon normal, así como en el CCR, y tiene una vida media entre 3 a 11 días8. El CEA monoclonal (mCEA) puede ser expresado por una amplia variedad de adenocarcinomas, incluyendo los que se originan en el colon, y continúa siendo un componente importante en la evaluación de los CCR9. Tan10, en un metaanálisis basado en 20 estudios, muestra que el CEA es un marcador con elevada especificidad, aunque con baja sensibilidad en condiciones de recurrencia. Aun así, el CEA es ampliamente utilizado como marcador tumoral junto con la clínica, la imagenología y la endoscopía para seguimiento de los CCR9. De hecho, es considerado el de mayor rendimiento costo-efectividad para detectar recidivas posquirúrgicas11 y la mejor opción para monitorizar la enfermedad diseminada durante la terapia sistémica12.
Como resultados del presente estudio, se observan los bajos valores de exactitud y rendimiento del CEA considerando la totalidad de los casos analizados, así como cuando se los discriminó por estadio. Estas cifras son menores a las comunicadas por Carvajal 13, cuyos valores de sensibilidad y especificidad fueron 79,9% y 88,2%, respectivamente. Lo mismo ocurrió cuando se las comparó con los resultados de López14, quien analizó los diversos parámetros de acuerdo al rango de valores de CEA. Determinó que la sensibilidad y el VPN disminuyen en rangos superiores de CEA, ocurriendo lo contrario con la especificidad y el VPP. Dichos valores oscilaron: sensibilidad entre 31% y 75%; especificidad entre 57% y 97%; VPP entre 42% y 83%, y finalmente el VPN entre 77% y 85%.
El resultado de nuestro análisis es coincidente con la opinión de diversos autores15-22, que han postulado la utilidad del CEA como prueba de seguimiento del CCR y no como prueba de tamizaje o confirmación diagnóstica, ya que las pruebas de tamizaje requieren una alta sensibilidad y para la confirmación diagnóstica una alta especificidad23, criterios que como acabamos de demostrar en nuestro trabajo, el CEA no cumple. Estos conceptos son avalados por el trabajo de Fletcher24, quien determinó una sensibilidad de 36% y especificidad de 87% en los estadios A y B de Dukes, calificando estos valores como inaceptablemente bajos y de escaso valor como prueba de tamizaje.
Estos consideraciones realizadas previamente se vinculan a que el CEA puede elevarse en otros cánceres, por ejemplo, el de estómago, pulmón, endometrio, páncreas, vejiga, mama, ovario; pero, además, en enfermedades no oncológicas: cirrosis, hepatitis crónica activa, ictericia obstructiva, diverticulitis, enfermedad inflamatoria intestinal, úlcera péptica, pólipos intestinales, pancreatitis, enfermedad pulmonar obstructiva crónica, insuficiencia renal crónica y tabaquismo, entre otras (habiéndose comunicado que hasta un 8% de los fumadores presenta cifras superiores a 8 o 10 ng/ml) 25.
El presente estudio permite concluir que el CEA, como prueba de confirmación diagnóstica del CCR, muestra un bajo rendimiento, que se hace más evidente en los estadios precoces de la enfermedad.