Introducción
La implantación del blastocisto fuera del revestimiento endometrial de la cavidad uterina se considera un embarazo ectópico1. Si bien es parte de las principales causas de muerte materna en el primer trimestre de embarazo, en los últimos años se viene presentando un fenómeno de disminución en las defunciones, hecho que podría explicarse por los avances en el diagnóstico precoz, consecuencia de un aumento de la sensibilidad en la determinación de la gonadotropina coriónica humana (beta-HCG) y la ecografía transvaginal de alta resolución realizada de forma temprana2,3. La detección oportuna permite la generación de opciones terapéuticas diferentes al tratamiento quirúrgico, que van desde el manejo expectante al tratamiento médico. Es así que el tratamiento médico con metotrexate aparece como una alternativa eficaz y segura para las pacientes estables y con criterios específicos de selección4. Se estima que entre 60%-65% de los embarazos ectópicos podrán ser candidatos al tratamiento3,5. Aumentando, de este modo, la morbimortalidad materna y la conservación de la capacidad reproductiva de las mujeres que cursan un embarazo ectópico1.
En el contexto actual de la pandemia por Covid-19 algunas sociedades científicas consideran que el tratamiento médico con metotrexate es de primera línea y cobra mayor importancia para evitar el ingreso hospitalario y el abordaje quirúrgico6.
El objetivo del presente trabajo es reportar la experiencia del tratamiento médico con metotrexate en el departamento de Paysandú. Secundariamente, determinaremos la satisfacción de las usuarias frente a éste y su fertilidad posterior.
Marco teórico
El embarazo extrauterino o ectópico (EE), del griego ektopos (fuera de lugar), corresponde a la implantación del trofoblasto fuera del útero, comúnmente en la trompa y rara vez en el ovario o cavidad peritoneal7.
La incidencia del EE ha aumentado en las últimas décadas hasta alcanzar el 1%-2%, debido a tres condiciones: el incremento de los factores de riesgo, el incremento en la aplicación de técnicas de reproducción asistida y el uso de métodos diagnósticos más sensibles y específicos que permiten detectar casos asintomáticos8.
Sin embargo, la mortalidad materna ha disminuido gracias al diagnóstico precoz, determinado por la ecografía transvaginal, y determinaciones seriadas de beta-HCG con una sensibilidad de 96%, una especificidad de 97% y un valor predictivo positivo de 95%, siendo las pruebas más eficientes para este diagnóstico8.
La detección precoz nos ha hecho evidente el curso natural de la enfermedad, con muchas gestaciones tubarias prácticamente indolentes y con una baja probabilidad de hemorragia repentina. Por lo cual, el tratamiento pasa a depender del lugar, del tamaño, del estado de la trompa y de los deseos de la paciente por conservar la fertilidad9.
En el siglo XIX el ginecólogo británico Robert Lawson Tait impuso el concepto de que la extirpación del órgano enfermo era la única oportunidad que tenía la paciente para salvar su vida10. El abordaje en la actualidad tiene claramente dos vertientes: la quirúrgica laparoscópica, hasta ahora la más extendida, y la no quirúrgica con conducta expectante o tratamiento médico con metotrexate3.
Algunos embarazos tubáricos serán reabsorbidos espontáneamente determinando la opción de conducta expectante, pero en un 10%-30% de ellos se requerirá un tratamiento quirúrgico posterior9.
El metotrexate es un antagonista del ácido fólico que se une al sitio catalítico de la dihidrofolatoreductasa (DHFR), enzima que reduce el ácido fólico a tetrahidrofolato. Esta inhibición interrumpe la síntesis y reparación del ADN y las replicaciones celulares, inactivando de ese modo la proliferación del trofoblasto3,11,12. Está indicado en pacientes hemodinámicamente estables, con beta-HCG <5.000, un diámetro de masa <4 cm y en ausencia de latido embrionario13,14. Su uso se contraindica ante discrasia sanguínea preexistente, transaminasas elevadas o hepatopatía crónica por su toxicidad para los hepatocitos, elevación de creatinina >1,5 mg/dl, dado que su excreción es renal, úlcera péptica activa, lactancia materna, dudas ante embarazo intrauterino, inmunodeficiencia y enfermedad pulmonar activa, excepto asma13-16.
Existen diferentes técnicas de aplicación del metotrexate: vía sistémica o vía local mediante inyección directa. La vía sistémica es más práctica, sencilla de administrar, no invasiva, y no requiere destreza quirúrgica9,17. El esquema de dosis utilizado es debatido. Hay tres protocolos publicados para su administración sistémica: dosis única, dos dosis y dosis múltiple16,18. El régimen de dos dosis puede considerarse como una alternativa al régimen de dosis única en mujeres con un alto valor inicial de beta-HCG (13.
Con dosis única, la tasa de éxito a nivel internacional ronda el 70%-88%, es tan efectivo como la dosis múltiple, con menor costo y menores efectos adversos16,19-21.
En el análisis de costos la diferencia a favor del tratamiento médico versus resolución quirúrgica es destacable, por no necesitar hospitalización ni ingreso a block10).
La tasa de efectos adversos es por debajo de 10%, generalmente son dependientes de la dosis y duración del tratamiento. Corresponden a úlcera péptica, estomatitis, gastritis, náuseas y vómitos, dolor abdominal a los 2-3 días del inicio, posiblemente por el efecto citotóxico en el tejido trofoblástico, flatulencias, mielotoxicidad, hepatotoxicidad y fotosensibilidad, que se puede disminuir con aumento de la ingesta de líquidos y evitando la exposición solar. Los menos frecuentes son neumonitis y alopecia que revierte una vez culminado el tratamiento12-14,16,21.
Una vez seleccionadas las pacientes y previo al inicio de la terapéutica se debe informar con claridad las ventajas y desventajas de cada uno de los tratamientos, debiendo dar la paciente su consentimiento por escrito. Es importante educar a las usuarias sobre los síntomas de ruptura tubárica y enfatizar en la necesidad de buscar atención médica inmediata si éstos ocurren. La búsqueda de una nueva gestación se deberá relegar hasta pasado los tres meses de la inyección de metotrexate por su posible efecto teratogénico9,14. La monitorización intensiva de beta-HCG al cuarto y séptimo día en suero es obligatoria para detectar un fracaso inminente del tratamiento, por lo que el seguimiento será clínico y paraclínico, existiendo indicación de ecografía solo en caso de sospecha de rotura tubárica reciente, la cual ronda en un 7%16,17. Si el valor de beta-HCG entre los días 4-7 disminuye un 15% o menos, se debe la repetir dosis de metotrexate; si ocurre lo contrario, se realizará beta-HCG semanalmente hasta obtener niveles inferiores a 15 IU/l11,13,16).
Hablamos de persistencia trofoblástica cuando los niveles de beta-HCG ascienden o no caen lo esperado, correspondiendo a un 8%-10% de los tratamientos médicos, 8% de las salpingostomías laparoscópicas y 4% de las laparotómicas22.
El riesgo de recurrencia ronda 5%-25% según diferentes estudios y no varía con la modalidad del tratamiento instaurado23.
Una vez superado el cuadro, se estima una fertilidad posterior, según Bonin y colaboradores, de 75%-80,7%, siendo similar para las diferentes opciones de tratamiento10,13,24.
Metodología
Realizamos un estudio retrospectivo, observacional, de una serie de casos clínicos con EE tubario manejados con tratamiento médico en el servicio de Ginecología y Obstetricia de Corporación Médica de Paysandú (COMEPA) y del Hospital Escuela del Litoral (HEL).
Se recogieron los datos del sistema de información quirúrgica de ambos centros, donde constaba el diagnóstico de EE para nuestro n total de la muestra y el registro de las oficinas de farmacia de ambos centros sobre el uso de metotrexate en el servicio de ginecología durante el período 1º de enero de 2014 al 31 de diciembre de 2017, comprendiendo cuatro años.
El departamento de Paysandú tiene una población de 113.107 habitantes, 23.439 son mujeres en edad reproductiva. Dentro de la localidad hay dos centros que cuentan con block quirúrgico que fueron incluidos en nuestro trabajo (COMEPA y HEL), por lo que estimamos el haber accedido a la mayoría de los cuadros de EE en mujeres del departamento.
El 10 de octubre 2018 se llamó telefónicamente a todas las pacientes en las que se realizó tratamiento médico con metotrexate a dosis de 50 mg/m² intramuscular, se efectuó un interrogatorio basado en su deseo gestacional, embarazo espontáneo posterior al tratamiento y su experiencia con el uso de metotrexate (anexo 1).
Se incluyeron las pacientes con diagnóstico de EE que recibieron metotrexate a dosis de 50 mg/m² intramuscular y se excluyeron en las que se realizó tratamiento quirúrgico o conducta expectante.
Como variables utilizamos: prestador de salud, edad de las pacientes, factores de riesgo (antecedentes de abortos espontáneos, dispositivos intrauterinos, antecedente de EE previo, infertilidad), método anticonceptivo utilizado previamente, edad gestacional al momento del diagnóstico, diámetro de la masa anexial, nivel de beta-HCG día 1, día 4 y día 7, tiempo transcurrido desde el inicio del tratamiento hasta la negativización de la beta-HCG, tipo de resolución del cuadro clínico, complicaciones, fertilidad posterior de manera espontánea, tiempo transcurrido desde la beta-HCG hasta concepción y conformidad con el tratamiento.
Se consideró fracaso el tratamiento médico cuando fue necesario tratamiento quirúrgico, ya sea por sospecha clínica de rotura, o si luego de la segunda dosis de 50 mg/m² de metotrexate intramuscular, no se logró un descenso de al menos 15% de beta-HCG entre el cuarto y séptimo día.
La fertilidad futura se definió como el tiempo que transcurrió hasta la ocurrencia de una gestación intrauterina viable espontánea.
Para el procesamiento de datos se utilizó el sistema IBM SPSS Statistics 24.0 (Statistical Package for the Social Sciences).
Se presenta el artículo posfacto al Comité de Ética en la Investigación de Sanatorio Americano (CEI- SASA). Se tomaron medidas para garantizar la confidencialidad de datos de acuerdo a la declaración de Helsinki y se realizó consentimiento informado a todas las participantes.
Resultados
En los cuatro años de estudio hubo 67 EE, de ellos, 13 recibieron tratamiento médico, 77% en la salud privada y el 23% restante en la salud pública.
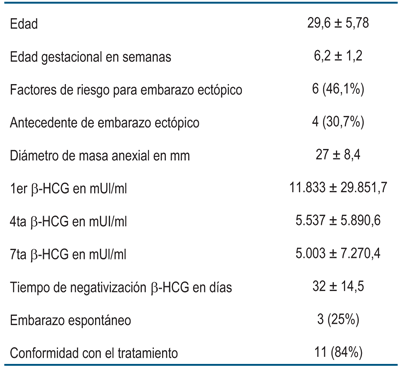
De las características de la población en las que se realizó metotrexate (tabla 1), los rangos de edades fueron de 21 a 40 años, con una media de 29,6 años y un desvío estándar de 5,78 años. Seis pacientes presentaban factores de riesgo, de las cuales cuatro tenían antecedente de EE previo. Sobre la anticoncepción utilizada previamente, seis pacientes no utilizaban ningún método, cuatro usaban anticoncepción hormonal combinada, una de barrera y dos usuarias sin datos. La edad gestacional de presentación fue entre 4 y 8 semanas con una media de 6,2 semanas. En cuanto al diámetro de la masa anexial se obtuvo una media de 27 mm con un desvío estándar de 8,7 mm, para un total de 11 pacientes. Los valores iniciales de beta-HCG presentaron una media de 11.833 y un desvío estándar de 29.851,7. El nivel al cuarto día presentó una media de 5.537 para el total de pacientes y un desvío estándar de 5.890,6. El número de beta-HCG realizadas al séptimo día fueron 12 de las 13, con una media de 5003 y un desvío estándar de 7.270,4.
En cuanto al tiempo transcurrido desde la primera beta-HCG hasta tornarse negativa varió entre 7 a 57 días, con un promedio de 32 días para un total de siete pacientes. Hay dos pacientes, con dificultad en el seguimiento, que se consideraron dentro del éxito en el tratamiento por no registrarse actos quirúrgicos en ellas. Las otras cuatro restantes culminaron con tratamiento quirúrgico por complicaciones o falla en el tratamiento.
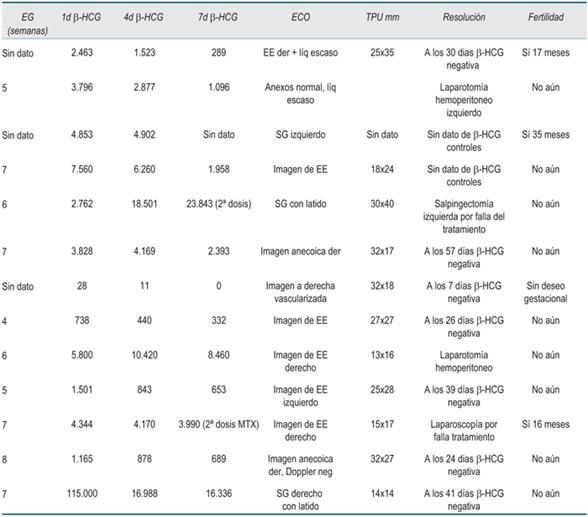
Hoy día, para la indicación de metotrexate, se requiere de hemodinámica estable, con beta-HCG <5000, un diámetro de masa < 4 cm y en ausencia de latido embrionario. Los médicos tratantes de cuatro mujeres no siguieron dicha recomendación, como se visualiza en la (tabla 2). De igual modo, se obtuvo un éxito en el tratamiento con metotrexate sistémico a dosis de 50 mg/m² intramuscular en nueve pacientes de un total de 13, correspondiendo a 69,2%.
Según el cuestionario de conformidad con el tratamiento planteado, de las 13 pacientes solo dos lo indicaron como una experiencia negativa, perteneciendo a los ectópicos rotos; se obtuvo 84% de aceptación. La fertilidad futura ocurrió en tres de las 11 pacientes con deseo concepcional (25%). El tiempo que transcurrió para la nueva gestación fue entre 16 meses y 35 meses con una media de 23 meses.
Discusión y conclusiones
El éxito global del tratamiento con metotrexate sistémico para el EE, definido como la resolución de éste sin necesidad de cirugía, oscila entre 75% a 95%, según la bibliografía internacional4,12,25. En nuestro departamento, en el año 2001, Leoni y colaboradores reportaron una serie de cinco EE tratados con metotrexate con un porcentaje de éxito de 100%26. Los valores obtenidos en nuestro caso rondaron el 69,2% de éxito, por debajo de lo que informan datos nacionales e internacionales.
Esta diferencia con respecto a la literatura se puede atribuir a la disparidad entre los médicos tratantes para la selección de las pacientes candidatas a metotrexate, si bien ninguna presentaba contraindicación absoluta para su realización, no todas cumplían con los criterios para su uso15. En la tabla 2, en negrita, destacamos a las cuatro pacientes que quedarían por fuera si aplicáramos el protocolo RCOG (Royal College of Obstetricians and Gynaecologists)15, aunque se puede observar que dos de ellas evolucionaron favorablemente al tratamiento. Si excluyéramos a las cuatro pacientes que no cumplían con criterios clínicos y paraclínicos, nuestro porcentaje de éxito para tratamiento médico ascendería a 77,7%.
Cabe destacar que dos usuarias con tratamiento exitoso ya habían recibido, en 2013 y 2014, metotrexate a la misma dosis y una de ellas logró actualmente un embarazo espontáneo sin complicaciones, por lo que el 100% de las pacientes que habían tenido un EE previamente tratado con metotrexate, volvieron a tener éxito. Incluso una de las pacientes que respondió nuevamente a metotrexate, tenía un valor de beta-HCG -HCG extremadamente elevado (115000 mUI/ml), siendo catalogado como predictor de falla15.
Por otra parte, hubo 67 EE en cuatro años, se realizó tratamiento quirúrgico a 51 pacientes (76%), metotrexate a 13 (19%) y se planteó conducta expectante en tres pacientes (5%), datos similares a la revisión de Hsu, JY27).
De las 51 pacientes intervenidas quirúrgicamente, 69% correspondía al ámbito público, donde se lleva a cabo formación universitaria; estos números son discordantes con los obtenidos por la revisión de Hsu, JY, donde en los centros docentes había 16% más de probabilidades de recibir metotrexate27. Es necesario mencionar que en nuestro departamento no se usa metotrexate de forma ambulatoria, y que todas las pacientes tienen como prestador de salud COMEPA o HEL, por lo cual contamos con un bajo sesgo en el número de pacientes con tratamiento médico.
Cuando analizamos los factores de riesgo y las características de la población, la edad tuvo un rango de 21 a 40 años, con una media de 29,6 años y un desvío estándar de 5,78 años, lo que concuerda con la revisión de Hsu JY y colaboradores, en julio de 201727.
Tenían factores de riesgo para embarazo extrauterino 6 (46,1%) de las 13 pacientes, porcentaje conocido internacionalmente15. Sobre la anticoncepción utilizada previamente, seis pacientes no utilizaban ningún método, a diferencia con lo publicado por Furlong en 2002, que aseguraba que el uso de anticonceptivos orales de progestágeno, implantes de progestágeno, dispositivos intrauterinos y ligaduras de trompas, era lo que predisponía a esta patología en la población general28.
Otra variable que se desprende de nuestro estudio es el tiempo transcurrido hasta la negativización del valor de -HCG, que varió entre 7 a 57 días, rondando los 32 días. Tiempo similar es reportado en la bibliografía, donde se estima una resolución completa a las 2-4 semanas, con un máximo de ocho semanas13. Sí debemos resaltar que dos pacientes no continuaron con los controles de seguimiento correspondientes. Dai y colaboradores, en un artículo publicado recientemente, proponen eliminar la medición de beta-HCG al cuarto día con el fin de disminuir costos y obtener una mejor adherencia al seguimiento ambulatorio, pudiendo ser una alternativa beneficiosa sobre todo en nuestro medio29.
Se presentaron cuatro complicaciones en las 13 pacientes, dos pacientes fueron intervenidas por vía laparotómica con diagnóstico presuntivo de rotura, dos culminaron con tratamiento quirúrgico laparoscópico por falla en el tratamiento médico.
Sobre la conformidad con el tratamiento planteado, solo dos de las 13 pacientes lo indicaron como una experiencia negativa, por la intensidad del dolor y el requerimiento de varios días de internación. El 84% lo consideró aceptable, destacando a su vez que aquellas pacientes que lo recibieron previamente, lo volvieron a solicitar en esta nueva gestación ectópica. Ninguna relató como experiencia desfavorable la presencia de efectos adversos. La publicación, en 2001, de Sowter y colaboradores, que compara resultados psicológicos y físicos en mujeres con tratamiento médico y cirugía laparoscópica, mostró puntaciones a favor del metotrexate en cuanto al funcionamiento físico, sin diferencias significativas en las puntaciones de estado de ansiedad y depresión30).
Con respecto a la fertilidad futura, de las mujeres que tuvieron éxito en el tratamiento solo el 25% logró un embarazo viable espontáneo, aunque una paciente no tenía deseo concepcional en ese momento. Valor por debajo de la bibliografía internacional, que oscila entre 67%- 80,7%24,32. El tiempo transcurrido hasta la concepción fue muy variable, de 16 a 35 meses10.
Si bien una limitante de nuestro trabajo es el hecho de ser retrospectivo, pudiéndose ver afectado por sesgos innatos a este tipo de estudio, sumado al número pequeño de la muestra, su realización nos permitió reflejar el análisis de nuestra experiencia en esta práctica clínica, dar a conocer las diferentes opciones que se tienen hoy día para el manejo de la patología y objetivar la variabilidad de técnicas aplicadas según el profesional actuante, por lo que sería conveniente realizar a nivel nacional un estudio prospectivo, multicéntrico, con un protocolo determinado para conocer la tasa de éxito nacional y comenzar a instaurar en nuestro país este tratamiento beneficioso.
Los autores concluyen que el uso de metotrexate en el EE se practica en Paysandú desde hace casi una década con buenos resultados y una buena aceptación por parte de las usuarias.