Introducción
La enfermedad causada por el nuevo coronavirus del síndrome respiratorio agudo severo (SARS-CoV-2) es una neumonía viral que presentó un brote inusual en la provincia de Wuhan, China, en diciembre de 2019. La aparición del SARS-CoV-2 ha sido marcada como la tercera introducción de un coronavirus altamente patógeno después del coronavirus del síndrome respiratorio agudo severo (SARS-CoV) y del coronavirus del síndrome respiratorio del Medio Oriente (MERS-CoV) en el siglo XXI. La aparición y desarrollo de la enfermedad COVID-19 dependen de la interacción virus-sistema inmune, habiéndose reconocido como responsables de la severidad del cuadro clínico factores virales, tales como el tipo de virus, carga, título y viabilidad viral. Por su parte, los factores del sistema inmunitario del individuo incluyen la genética (sistema HLA), edad, sexo, mecanismos de regulación neuroendócrina-inmune y, finalmente, el estado nutricional1).
Metodología
El objetivo de la presente revisión es establecer una serie de conclusiones basadas en la evidencia actual sobre el metabolismo y la terapia nutricional en el paciente crítico, y en particular en el paciente crítico con Covid-19, para desarrollar una estrategia nutricional con sustento en la evidencia clínica más reciente. Se realizó una revisión sistemática de tipo cualitativo y crítico de la literatura médica actualizada. Con búsqueda bibliográfica en revistas de las principales sociedades científicas relacionadas en diferentes bases de datos: Medline, Scopus, Cochrane Central, EMBASE, con el objetivo de identificar principalmente ensayos clínicos aleatorios, revisiones sistemáticas y metaanálisis, estudios observacionales y guías de práctica clínica que hayan sido publicadas hasta abril de 2020. En la búsqueda se incluyeron artículos en idioma inglés y español y las palabras claves fueron las siguientes: ARDS, coronavirus; Covid-19; critical care; critically ill; ICU; intensive care; intensive care unit; metabolism; nutrition; nutritional support; nutrition therapy; paciente crítico; SARS-CoV2. Los datos resumidos se analizaron junto con las recomendaciones existentes para intervenciones nutricionales en UCI publicadas por ESPEN y ASPEN y revisadas en perspectiva de la pandemia de COVID-19.
Desarrollo y discusión
Las consideraciones actuales de terapia nutricional (TN) en UCI para pacientes con COVID-19 emplean recomendaciones indirectas basadas en poblaciones similares de pacientes críticos; por ejemplo, en condiciones como el síndrome de distrés respiratorio agudo (SDRA), la sepsis o la lesión renal aguda, mientras se esperan los resultados de estudios clínicos que proporcionen mayor evidencia en este grupo específico de pacientes críticos.
Aspectos clínicos de los pacientes críticos con COVID-19 y terapia nutricional
La falla respiratoria aguda y la disfunción multiorgánica (DMO) representan las dos causas más importantes de admisión de pacientes críticos con COVID-19 a UCI. En tal sentido, Wang y colaboradores2 identificaron que el 20% de los pacientes estudiados presentaron un SDRA, y el 9% presentó shock. Por su parte, 71% de los pacientes ingresados a UCI requirieron asistencia respiratoria mecánica, y de éstos, el 28% requirió ventilación en decúbito prono según los datos reportados por Bhatraju y colaboradores3 en Estados Unidos; asimismo, la tasa de letalidad de 50% reportada en esta serie es similar a la indicada para pacientes críticos en hospitales chinos. En particular, es importante destacar que dentro de los factores pronósticos en estos pacientes adultos se destacan: adultos mayores, comorbilidades previas (diabetes mellitus, obesidad, hipertensión arterial, enfermedad cardiovascular o respiratoria crónica) y la malnutrición crónica. La edad avanzada y la presencia de comorbilidades se asocian a malnutrición con grados variables de sarcopenia, factores que son independientes del índice de masa corporal (IMC)4. Por otro lado, un IMC aumentado parece estar relacionado con un mal pronóstico, lo cual avala un posible rol de la obesidad sarcopénica en el pronóstico de estos pacientes con COVID-195. Por otra parte, bajos niveles de prealbúmina sérica predicen la progresión de la falla respiratoria inicial al SDRA de acuerdo a lo demostrado por Wu y colaboradores6. Un hecho significativo es el impacto nutricional de la enfermedad crítica sobre el músculo estriado esquelético, el cual está dado por la movilidad reducida, inflamación sistémica, los fenómenos de hipermetabolismo e hipercatabolismo, así como por un aporte inadecuado de nutrientes. Es importante destacar que dichos fenómenos pueden verse exacerbados en los pacientes infectados graves por SARS-CoV-27,8.
Momento de inicio de la terapia nutricional en pacientes con COVID-19 en la UCI
En el paciente crítico la TN, y en particular la nutrición enteral (NE), debe ser iniciada en forma precoz o temprana (24-36 horas de la admisión o dentro de las primeras 12 horas posteriores a la IOT y conexión a la ventilación mecánica). En efecto, la NE temprana es una estrategia que ha demostrado mejorar la sobrevida, reduciendo la incidencia de complicaciones infecciosas9.
Terapia nutricional en pacientes con COVID-19 e inestabilidad hemodinámica
Los pacientes críticos y en particular aquellos con disfunción hemodinámica exhiben una mayor incidencia de disfunción gastrointestinal aguda. En este contexto, en los estados de shock, se genera un desequilibrio en la relación suministro/demanda de oxígeno a nivel intestinal, con el consiguiente riesgo de isquemia intestinal no oclusiva cuya incidencia varía entre 0,3% y 8,5%, con una mortalidad que oscila entre 46% y 100%10. El uso de vasopresores per se no contraindica el inicio de la NE. Sin embargo, es importante destacar que los fármacos vasoactivos tienen efectos sistémicos que conllevan un riesgo aumentado de intolerancia digestiva. Con respecto a la dosis del fármaco vasoactivo, los estudios han encontrado diferentes resultados; sin embargo, es posible concluir que el uso de dosis bajas y estables de vasopresores se asocian con mejores resultados y mejor tolerancia intestinal, considerándose que una dosis de noradrenalina inferior a 0,14 gammas/kg/min se asocia a una mejor tolerancia de la NE11. Por su parte, un gran estudio observacional que incluyó a 5.969 pacientes comparó los resultados entre NE precoz versus tardía en pacientes ventilados con shock que requieren dosis bajas (<0,1 mg/kg/min), medias (0,1-0,3 mg/kg/min) o altas (>0,3 mg/kg/min) de noradrenalina. La tasa de mortalidad a los 28 días fue significativamente menor en el grupo de NE precoz versus tardía, que recibió dosis bajas de noradrenalina (OR, 2,9%; IC95%, 4,5%-1,3%), y en el grupo de dosis media de noradrenalina (OR 6,8%; IC95%, 9,6%-4,0%). Por su parte, en el grupo de dosis altas de noradrenalina la mortalidad a los 28 días no difirió de modo significativo entre los grupos (OR 1,4%; IC95%, 7,4%-4,7%)11.
En la actualidad persiste la controversia sobre la prescripción de la NE en presencia de inestabilidad hemodinámica y sostén vasopresor. En este sentido, ha sido establecido que en pacientes hipotensos (PAM <50 mmHg), así como en aquellos en los cuales se inicia la infusión de catecolaminas, o en quienes se requieren dosis crecientes de vasopresores con el objetivo de mantener la estabilidad hemodinámica, no debe iniciarse o debe procederse a la suspensión inmediata de la NE, continuando con la monitorización hemodinámica y de la tolerancia gastrointestinal11. En 2018, en el NUTRIREA-II, Reignier y colaboradores, en pacientes con shock, observaron un mayor riesgo de isquemia esplácnica e intolerancia gastrointestinal inducida por la NE “forzada”12. Sin embargo, en un reciente análisis post hoc del NUTRIREA-II se identificaron valores más altos de citrulina después de tres días de NE, lo cual es traducción de una mayor masa de enterocitos funcionantes. Estos hallazgos permiten afirmar que la NE es beneficiosa para la mucosa intestinal incluso en aquellos pacientes con shock o algún grado de disfunción hemodinámica13.
El inicio de una NE trófica o (10-20 ml/h) con progresión gradual es la mejor estrategia basada en volumen para este tipo de pacientes. Esta estrategia requiere de un estrecho monitoreo clínico, pesquisando la aparición de signos de alarma de isquemia intestinal (dolor y distensión abdominal, hipertensión abdominal, hipotensión arterial con aumento del requerimiento del sostén vasopresor) y lactatemia en ascenso, son indicadores posibles de isquemia intestinal. La NE debe ser discontinuada frente al deterioro de la condición hemodinámica, reevaluando la perfusión del tracto intestinal14.
Terapia nutricional en función del nivel de sostén respiratorio en el paciente con COVID-19
La neumonía grave y la sepsis Covid-19 deben considerarse como un criterio o factor de riesgo para desnutrición. Desde el puno de vista práctico, es adecuado que la estrategia de TN en estos pacientes considere la fase de la enfermedad y el tipo de soporte respiratorio indicado para cada paciente individual. En tal sentido, es necesario integrar la TN al tratamiento global de la enfermedad, incluso desde las primeras etapas previo a la admisión a UCI.
Pacientes sin ventilación mecánica invasiva
Con respecto a la TN en pacientes en ventilación mecánica no invasiva (VNI), Terzi y colaboradores observaron que el 60% de los pacientes sufrieron hambre durante los primeros dos días de tratamiento, en tanto que 2,6% recibió NE15. Recibieron nutrición oral menos del 50% de los pacientes con VNI. Con frecuencia en los pacientes con SDRA y VNI los requerimientos proteico-calóricos son insatisfechos y estos pacientes se mantienen en balance nitrogenado (BN) negativo16. El trabajo respiratorio representa una gran parte del gasto energético (hasta 25%), habiéndose demostrado que el balance calórico negativo puede coadyuvar al deterioro respiratorio17. Por su parte, los efectos de la NE temprana en aquellos pacientes que requieren VNI no han sido ampliamente investigados. Sin embargo, es posible afirmar que la indicación de NE se asocia a algunas complicaciones cuando el paciente requiere VNI, sobre todo en aquellos en los que esta modalidad ventilatoria se prolonga. En tal sentido, Kogo y colaboradores observaron que más del 50% de los pacientes fueron incapaces de mantener la vía oral y en ellos la tasa de complicaciones fue mayor (53% 32/60& frente a 32% 15/47 p = 0,03), así como los tiempos de ventilación mecánica (16 7-43 versus 85-20 días, p = 0,02) en favor de aquellos pacientes que recibieron NE18. La NE minimiza la aparición de complicaciones infecciosas en comparación con la NE tardía y la NP temprana19. Por su parte, es posible afirmar que cuanto más profundo sea el déficit nutricional preexistente, peores serán los resultados y, por tanto, los pacientes con desnutrición previa deben ser alimentados sin demora para evitar la peoría de su estado general20.
Cuando se considera el riesgo-beneficio, los pacientes previamente desnutridos se benefician de la TN iniciada dentro de las primeras 24-48 horas de la admisión, en tanto que el inicio de la TN puede retrasarse en aquellos pacientes con buen estado nutricional previo7,8.
Es posible considerar la NP periférica (NPP) en aquellos pacientes malnutridos previos en los que la colocación de una sonda nasogástrica (SNG) resulte en fugas de aire o dilatación gástrica que dificulta la función diafragmática, o pueda comprometer la efectividad de la VNI o la bioseguridad al aumentar el riesgo de aerosolización. Si bien este problema puede evitarse con máscaras de VNI especiales con un puerto para SNG, éstas no siempre se encuentran disponibles en nuestras unidades. Pocos estudios han descrito la implementación de la TN cuando se utiliza la técnica oxigenación de alto flujo (OAF). Existe evidencia limitada que indica que la ingesta de calorías y proteínas puede permanecer inadecuada para prevenir o tratar la malnutrición en pacientes que requieren esta técnica21. Por otro lado, en un estudio reciente la administración de OAF permitió la alimentación oral completa en la totalidad de los pacientes incluidos22.
Pacientes con COVID-19 en ventilación mecánica invasiva
Fase aguda de la enfermedad crítica (etapa de reanimación inicial)
Requerimientos proteicos: el aporte de proteínas y en particular de proteína de alto valor biológico rica en aminoácidos esenciales tiene como objetivo optimizar la síntesis de proteínas musculares para atenuar el desgaste muscular y estimular el proceso de restitución muscular. La pérdida proteica muscular aumenta cuatro veces durante las primeras 24 horas de la enfermedad crítica, pudiendo reducirse la masa muscular esquelética a razón de 1 kg/día por hipercatabolismo durante los primeros diez días de la enfermedad crítica23. Sin embargo, el aporte proteico óptimo durante la enfermedad crítica es un tema de debate y la relación riesgo/beneficio del aporte proteico durante las diferentes fases de la disfunción orgánica están poco estudiados. Diversos estudios observacionales han demostrado que la provisión de más proteínas en comparación con una menor ingesta proteica en la UCI se asocia a mejores resultados con mayor sobrevida, aunque los datos existentes en pacientes sépticos son escasos24.
Van den Berghe y colaboradores, en un análisis secundario del estudio PEPANIC, han definido que el inicio muy temprano de proteínas puede asociarse con resultados adversos, posiblemente secundarios a la inhibición de la autofagia25. Recientemente, el estudio PROCASEPT ha sugerido que los efectos del aporte proteico son variables en los pacientes con sepsis en relación con otros pacientes críticos no sépticos26. En estado crítico, la administración de proteína debe ser prioridad y sobre la base de la información limitada y no hacer daño, se puede recomendar la progresión gradual hasta alcanzar el objetivo de proteínas mayor a 1,3 g/kg/día27.
En pacientes obesos, el cálculo de 1,3 g/kg/día se debe hacer con peso ajustado. Se calcula el peso corporal ajustado como peso corporal ideal + (peso corporal actual - peso corporal ideal)* 0,3328. En la actualidad, el estudio EFFORT (NCT03160547), hasta el momento el ensayo clínico más grande, tiene como objetivo resolver la controversia entre las dosis altas (>2,2 g/kg/d) y bajas de proteínas.
Considerando la importancia de preservar la masa y la función del músculo estriado esquelético, actualmente se considera la actividad física controlada como un complemento de implementación precoz en los pacientes críticos con vistas a mejorar los efectos beneficiosos de la TN7,8.
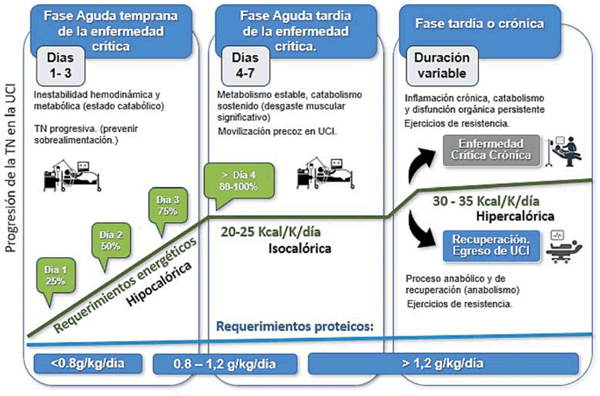
Requerimientos calóricos y progresión del aporte enteral. La producción de energía endógena en la enfermedad crítica temprana (primeras 72 horas) no puede ser abolida por la TN; por tanto, se recomienda un aumento progresivo durante esta fase con el objetivo de prevenir la sobrealimentación29. Weijs y colaboradores y el grupo liderado por Singer en Israel han descrito una relación en forma de U entre el aporte energético y la mortalidad a los 60 días, concluyendo que un 70%-80% del gasto energético medido por calorimetría indirecta es óptimo, en tanto que un aporte superior o inferior están asociados con una mayor mortalidad30. Sin embargo, cuando se interpretaron los resultados del estudio PERMIT31 sobre underfeeding permisivo versus nutrición eucalórica o la nutrición hipercalórica versus eucalórica (1,5 kcal/mL vs 1,0 kcal/mL) en el estudio TARGET32, no existieron diferencias en los outcomes clínicos evaluados con una ingesta calórica baja, normal o alta durante la fase precoz de la enfermedad crítica.
En la (tabla 1) se muestran las recomendaciones actuales sobre requerimiento energético y macronutrientes en pacientes críticos aplicables a pacientes con COVID-19.
Tabla 1: Recomendaciones actuales sobre requerimiento energético y macronutrientes en pacientes críticos con COVID-197,8.
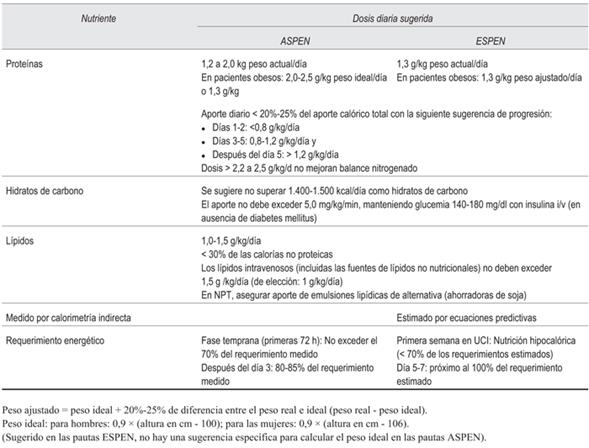
Este enfoque se basa en la optimización de la NE como primer paso. Sin embargo, resulta dificultoso cumplir con los objetivos de proteínas sin generar sobrealimentación. La mayoría de las fórmulas enterales tienen un bajo porcentaje de proteínas en relación con las calorías totales, no siendo posible obtener ingestas superiores a 1,0-1,2 g/kg/día33. Otras formas de mejorar la ingesta proteica es mediante el uso de suplementos proteicos por vía enteral o recurrir al empleo de soluciones de aminoácidos por vía parenteral.
En la (figura 1) se propone una estrategia nutricional dirigida a minimizar el riego de overfeeding y underfeeding en pacientes críticos.
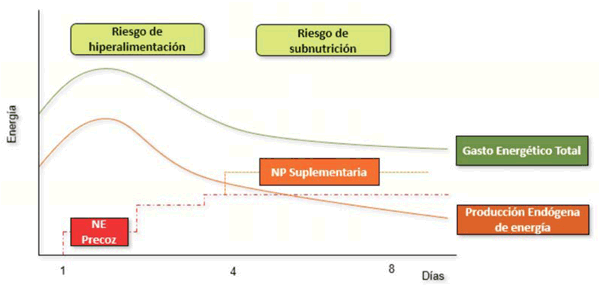
Figura 1: Estrategia nutricional óptima con el objetivo de minimizar el riesgo de overfeeding y underfeeding en pacientes críticos. NE: nutrición enteral; NP: nutrición parenteral.
Estrategias para maximizar la nutrición enteral. Momento de inicio de la nutrición parenteral. En aquellos pacientes críticos que no toleran la dosis completa de NE durante la primera semana de UCI, el inicio de la nutrición parenteral (NP) suplementaria debe considerarse de manera individual. La NP no se debe iniciar hasta que no se hayan agotado todas las estrategias tendientes a maximizar la tolerancia de la NE. Desde el inicio de la NE se recomienda el empleo de agentes proquinéticos, en especial metoclopramida 5-10 mg i/v c/8 h, pudiendo recurrirse al empleo de mosapride o cisapride por vía enteral (los cuales están contraindicados en presencia de QT largo corregido o del uso concomitante de hidroxicloroquina por el COVID-19). Los macrólidos i/v, en particular eritromicina a una dosis inferior a 500 mg/d, es una opción actualmente no disponible en nuestro medio.
La vía enteral es con frecuencia gástrica mediante el emplazamineto de una SNG, aunque debido a la alta frecuencia de disfunción gastrointestinal con gastroparesia y riesgo de aspiración, el acceso yeyunal es a veces una opción para considerar. El inicio temprano de la NP suplementaria (NPS), antes de los días 3-7, no se recomienda en base a los resultados del metaanálisis propuesto por Bost y colaboradores34. Sin embargo, en los pacientes COVID-19, el umbral para iniciar la NPS podría ser más bajo debido a la necesidad de disminuir la exposición del personal al reducir los cuidados de enfermería necesarios para mantener y monitorizar la NE.
Fase posreanimación
Una vez lograda la estabilización con una reanimación exitosa, es necesario incrementar el aporte de proteínas (1,3-2,2 g/kg/d) y calorías (25-30 kcal/kg peso/día) con el objetivo de minimizar la pérdida adicional de masa magra y promover la recuperación funcional35.
Terapia nutricional en pacientes críticos con COVID-19 en posición prono
La severidad de la falla respiratoria en los pacientes con COVID-19 puede requerir la adopción de ventilación en decúbito prono (DP). Dichos pacientes podrían presentar un mayor riesgo de intolerancia a la NE gástrica, aunque la NE en DP es factible y segura; por otra parte, es probable que su implementación en la práctica diaria sea dificultosa particularmente para profesionales sin experiencia específica en nutrición clínica que se desempeñarán en un entorno difícil y de riesgo36. En relación con la NE yeyunal en estos pacientes, y con el objetivo de minimizar la exposición potencial al virus, el uso de NE yeyunal en pacientes con COVID-19 debe limitarse a casos excepcionales de intolerancia grave a la NE gástrica.
En la (figura 2) se observan los puntos clave de la TN en UCI en función de la fase de la enfermedad por SARS-CoV-2 en UCI.
Estrategias fármaco-nutricionales para optimizar la inmunidad en las infecciones virales
Diferentes micronutrientes (vitaminas y elementos traza) tienen un reconocido efecto inmunomodulador siendo esenciales para la inmunidad celular y humoral37. Así, es posible encontrar una conexión entre la deficiencia de algunos micronutrientes, en particular selenio, y la patogenicidad de algunos ARNvirus, como son los coronavirus38. En tal sentido, la deficiencia de este micronutriente se ha asociado a una modificación en el genoma viral y por ende en el fenotipo, por lo cual podría ser capaz de modificar la virulencia del virus. Se necesita una mayor comprensión del vínculo entre la nutrición y el SARS-CoV-2, ya que la aptitud del patógeno también puede depender de los recursos disponibles del huésped39.
Por otra parte, en los pacientes críticos la deficiencia absoluta, o al menos los bajos niveles séricos, son frecuentes debido a la fuga capilar característica de la inflamación sistémica, por lo que debe asegurarse la repleción de éstos40.
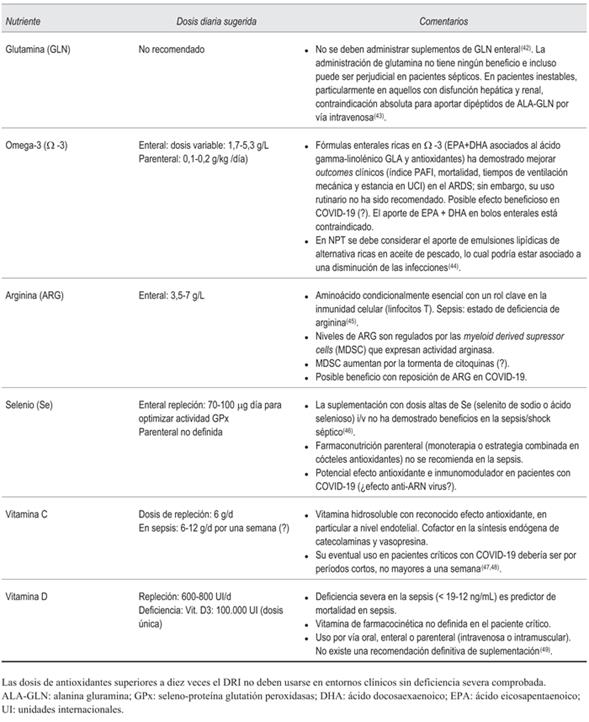
En la (tabla 2) se presenta una breve descripción de los nutrientes específicos y de los micronutrientes más comúnmente estudiados en el momento actual.
Tabla 2: Consideraciones actuales sobre nutrientes específicos y micronutrientes aplicables al paciente crítico con COVID-197,8.
El estudio LEEP-COVID de la Duke University Medical Center, Estados Unidos, evaluará los cambios metabólicos y nutricionales en pacientes críticos con COVID-19 con la finalidad de comprender, guiar y optimizar la terapia nutricional en estos pacientes (NCT04350073).
Puntos clave
- La TN en pacientes críticos con Covid-19 debe iniciarse en forma precoz.
- Los pacientes con sepsis por COVID-19 y shock séptico no presentan contraindicación para iniciar una NE trófica, con la excepción de que las dosis de vasopresores se encuentren en aumento, presenten elementos de disoxia tisular o disfunción gastrointestinal aguda con intolerancia a la NE. El inicio de una NE trófica o (10-20 ml/h) con progresión gradual es la mejor estrategia basada en volumen para este tipo de pacientes.
- En pacientes críticos con COVID-19 que no se encuentren en VM invasiva, y en quienes no se alcanza el objetivo nutricional con la vía oral, la primera opción a considerar es el aporte de suplementos nutricionales orales (SNO); posteriormente, en caso de que la vía oral no sea posible o la misma sea insuficiente, debe recurrirse a la NE gástrica emplazando una SNG. Es factible considerar la NP periférica en pacientes con COVID-19 en VNI.
- Cuando no se dispone de calorimetría indirecta y se recurre a ecuaciones predictoras, o a la regla del pulgar, y el paciente se encuentra estable hemodinámicamente se puede estimar 15-20 kcal/kg/día como dosis de inicio.
- La sobrealimentación temprana debe ser evitada. La ingesta calórica temprana agresiva conduce a más episodios de hiperglucemia de estrés y a un mayor requerimiento de insulina.
- Como el déficit calórico acumulativo y prolongado debe prevenirse, tolerar un déficit limitado (20%- 30% en la primera semana de la UCI) parece ser beneficioso.
- Debe incrementarse el aporte a 50%-70% en el día 3.
- Después del día 3 se deben hacer incrementos progresivos para alcanzar el 80%-100% de los requerimientos estimados entre los días 5 y 7.
- La nutrición hipocalórica o eucalórica no confieren beneficios clínicos cuando la ingesta de proteínas es reducida.
- En estado crítico la administración de proteína debe ser prioridad, la progresión gradual hasta alcanzar el objetivo de proteínas mayor a 1,3 g/kg/día debe ser considerada.
- La NE en pacientes con COVID-19 en decúbito prono es factible y segura.
- Es necesario asegurar un adecuado aporte de vitaminas y elementos traza siguiendo una estrategia de repleción y eventualmente de farmaconutrición.
Conclusiones
La pandemia de COVID-19 determina un desafío sin precedentes en la UCI dado que no existen medidas preventivas demostradas para evitar la evolución a la enfermedad crítica y los tratamientos curativos disponibles en esta fase de la enfermedad carecen de evidencia clínica de calidad que los sustenten actualmente. En este escenario complejo, es probable que las medidas que contribuyan a mantener un sistema inmunitario saludable y las terapias de sostén en la UCI (incluida la TN) sean armas esenciales contra las infecciones graves por SARS-CoV-2.