Introducción
La lesión cerebral traumática es una de las principales causas de mortalidad y discapacidad((1)), se estima que 57 millones de personas han sido hospitalizadas alrededor del mundo con algún grado de traumatismo craneoencefálico y al año representan aproximadamente 10 millones de hospitalizaciones y muertes2,3. Esta es una condición que tiene un alto impacto socioeconómico trayendo consigo altos costos en salud; se estima que en Estados Unidos se ha incrementado hasta 76,1 millones de dólares3-5.
En la fisiopatología del trauma craneoencefálico se producen dos tipos de daños neurológicos, al momento del trauma (primaria), causado por mecanismos como edema cerebral, formación de radicales libres o liberación de inflamatorios (lesión secundaria)6,7, por lo que se han estudiado diversas medidas farmacológicas para prevenir o reducir los efectos de los mecanismos secundarios, como corticoides y sulfato de magnesio, los cuales no han demostrado beneficios8,9. Es importante buscar un medicamento seguro y clínicamente efectivo que funcione como neuroprotector tras recibir un traumatismo craneoencefálico, y la progesterona parece ser buena candidata.
La progesterona es una hormona sexual con funciones neuroactivas y esteroideas que tiene acciones sobre el sistema nervioso central 10. Esta hormona está presente en el cerebro de hombres y mujeres en concentraciones pequeñas, aproximadamente iguales11.
Ciertamente, hay una amplia distribución de receptores de progesterona con amplia acción de la hormona gonadal y la diversidad de funciones, como el crecimiento y diferenciación neuronal12, su supervivencia13, plasticidad14, y modulan funciones cognitivas15.
En modelos experimentales in vitro y estudios con animales sugieren que el tratamiento posterior a la lesión con progesterona disminuye el edema cerebral, atenúa el daño de los radicales libres y reduce la pérdida neuronal en modelos de animales con trauma craneoencefálico16.
Nosotros conducimos una revisión sistemática para que nos muestre la evidencia científica existente sobre la administración de progesterona en pacientes adultos con traumatismo craneoencefálico grave y su impacto con la mortalidad y pronóstico neurológico.
Método
El esquema a seguir será de acuerdo a las recomendaciones de metaanálisis y revisiones sistemáticas de la declaración PRISMA17, para la presentación de revisiones sistemáticas y metaanálisis, y el manual Cochrane de revisiones sistemáticas y metaanálisis18.
Búsqueda
Se realizó búsqueda de ensayos clínicos aleatorizados (RCT’s) a través de PUBMED (hasta 2019); Registro Especializado Cochrane Injuries Group (hasta 2019); Registro Cochrane Central de Ensayos Controlados (The Cochrane Library) (hasta 2019); MEDLINE (Ovid) hasta 2019; EMBASE (Ovid); PubMed (http://www.ncbi. nlm.nih.gov/sites/entrez) (hasta 2019); además de la lista de referencia de los estudios incluidos y otros datos relevantes de los estudios potencialmente elegibles. Nosotros realizamos la búsqueda en internet a través de Google Scholar (www.googlescholar.com) para búsqueda de literatura gris y de estudios en revistas no indexadas y la base de datos de Science Direct (www.sciencedirect.com) con los términos seleccionados en la estrategia de búsqueda.
La búsqueda se construyó usando términos y descriptores del Medical Subject Heading (MeSH), todos combinados con operadores booleanos.
Brain Injuries (*drug therapy; *mortality); Disability Evaluation; Glasgow Coma Scale; Injury Severity Score; Intracranial Pressure (drug effects); Neuroprotective Agents (adverse effects; *therapeutic use); Progesterone (adverse effects; *therapeutic use); Randomized Controlled Trials, Humans.
La estrategia de búsqueda completa se encuentra en el (anexo A).
Criterios de inclusión
Se incluyeron ensayos clínicos aleatorizados que evalúan pacientes con trauma craneoencefálico grave (escala de Glasgow 8), que incluyan población adulta (>18 años de edad), que compare el uso de progesterona versus placebo, sin tener en cuenta dosis, vía y velocidad de administración, cuyos resultados clínicos sean mortalidad y pronóstico neurológico.
Análisis estadístico
De manera individual y separada se extrajeron los siguientes datos: mortalidad, pronóstico (buen pronóstico y mal pronóstico). Se contactaron a los autores por datos faltantes. Las dudas se aclararon mediante consenso de los autores. El análisis estadístico se realizó a través del riesgo relativo (RR) con un intervalo de confianza de 95% (IC95%) con la metodología Mantel-Haenszel para variables dicotómicas, con un modelo de análisis de efecto fijado calculado mediante el software Review Manager 5.3. La heterogeneidad se evaluó mediante el cálculo de chi cuadrado (I2), siendo por encima de 50% una alta heterogeneidad de los estudios incluidos en el análisis. La variable primaria a evaluar fue la mortalidad, la secundaria buen y mal pronóstico neurológico.
Evaluación de riesgo de sesgo
Las revisiones sistemáticas fueron evaluadas por dos autores de manera independiente, posteriormente se realiza consenso entre los revisores para la evaluación de riesgo de sesgo de los estudios incluidos, de acuerdo a los lineamientos del manual Cochrane para revisiones sistemáticas (Centro Cochrane Iberoamericano, traductores. Manual Cochrane de Revisiones Sistemáticas de Intervenciones, versión 5.3, actualizada en octubre de 2016, internet). Barcelona: Centro Cochrane Iberoamericano; 2012. (http://www.cochrane.es/?q=es/node/269), cuyo modelo se muestra a detalle en (anexo B).
Los siguientes dominios fueron evaluados y ubicados en las siguientes categorías dependiendo de su validez y del riesgo de sesgo en: bajo riesgo de sesgo, riesgo de sesgo no claro o alto riesgo de sesgo:
- Generación de secuencia.
- Ocultamiento de la asignación.
- Cegamiento de los participantes y de los evaluadores.
- Datos incompletos de los resultados.
- Notificación selectiva de los resultados y otros tipos de sesgo.
Planeamos evaluar el sesgo de publicación por gráficos de embudo y lineal pruebas de regresión (Eger Test), sin embargo, hubo muy pocos estudios incluidos para permitir un análisis significativo. Evaluaremos los sesgos de publicación en futuras versiones de la revisión, si hay diez o más estudios incluidos en el metaanálisis.
Resultados
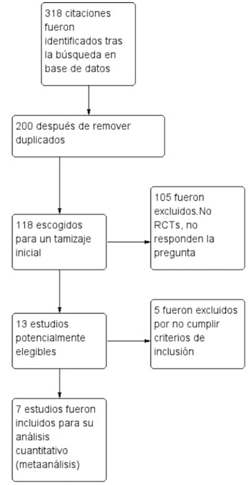
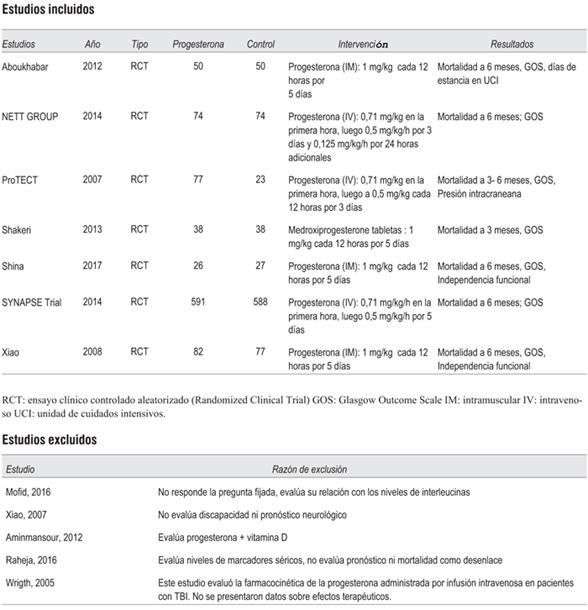
Tras realizar la búsqueda sistemática de la información, siguiendo nuestra estrategia, se identificaron 318 citas bibliográficas, de las cuales 18 se consideraron potencialmente elegibles sobre la base de título o el resumen, o ambos, y se obtuvieron los textos completos. Después de una revisión del texto completo, 13 ensayos se consideraron elegibles, cinco fueron descartados por no cumplir criterios de inclusión19-23 y siete reunieron los criterios de inclusión para la revisión (figura 1) (anexo C)24-30.
Se evaluó el riesgo de sesgo para los distintos estudios escogidos mediante la metodología descrita y se encontró que el 20% de los estudios presenta alto riesgo y 10% de riesgo no claro de sesgo de reporte selectivo, sesgo de asignación y cegamiento de los resultados, 20% riesgos sobre el cegamiento de los participantes, 30% de riesgo de otros tipos de sesgo. Ningún estudio tuvo algún riesgo de sesgo. Dos de los estudios elegidos están libres de riesgo de sesgo (SYNAPSE y NETT) (figura 2) y (figura 3).25,29
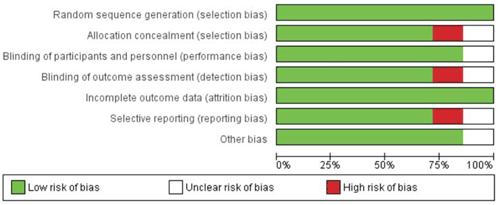
Figura 2: Gráfico de riesgo de sesgo: los juicios de los autores de la revisión sobre cada elemento de riesgo de sesgo se presentan como porcentajes en todos los estudios incluidos.

Figura 3: Resumen del riesgo de sesgo: revisión de las opiniones de los autores sobre cada elemento de riesgo de sesgo para cada estudio incluido.
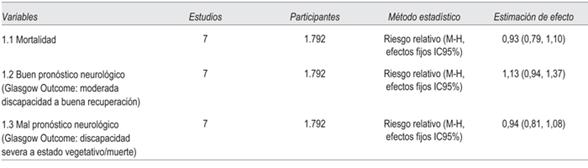
Se escogieron siete estudios para el análisis final que involucran a 1.792 pacientes. En todos los estudios se evaluaron las variables primarias y secundarias a seis meses mediante la escala de Glasgow evolutiva.
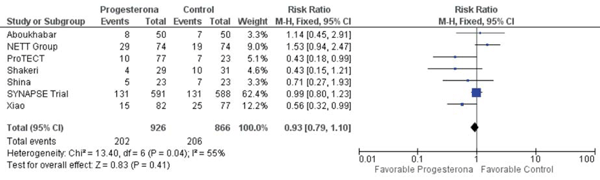
No hubo reducción de la mortalidad en pacientes en quienes se administró progesterona posterior al trauma comparado con el grupo control (RR 0,93, IC95% 0,79-1,10 p= 0,41) sin significancia estadística, hubo evidencia de alta heterogeneidad entre los estudios (X2 = 13,4 df = 6 I2= 55% p= 0,04) (tabla 1) y (figura 4 ).
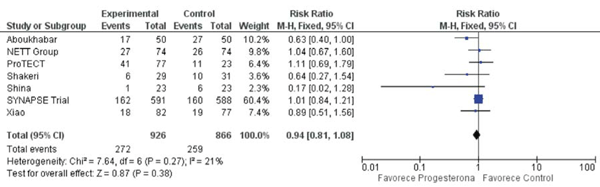
El protocolo de cuidado neurocrítico con administración de progesterona no muestra diferencia significativa en comparación a control en el contexto de desenlaces neurológicos favorables (discapacidad moderada a buena recuperación evaluada por escala de Glasgow evolutiva 5 - 6) (RR 1,07, IC95% 0,97-1,17 p= 0,20) (X2 = 17,46 df = 6 I2= 66% p= 0,08) (figura 5), se evidencia alta heterogeneidad de los estudios que pueden afectar el análisis estadístico de este desenlace clínico y no favorables (estado vegetativo a discapacidad severa, GOS-E 1-3) (RR 0,94, IC 95% 0,81-1,08 p= 0,27) (X2 = 7,64 df = 6 I2= 21% p= 0,27) (figura 6).
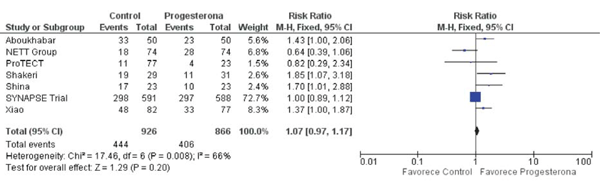
Figura 5: Forest plot de comparación: 1 progesterona vs control, desenlace: 1.2 buen pronóstico neurológico (Glasgow Outcome: moderada discapacidad a buena recuperación).
Discusión
La administración de progesterona posterior al trauma craneoencefálico muestra muchos avances a nivel experimental31. Por ser liposuble atraviesa fácilmente la barrera hematoencefálica y alcanza el equilibrio con el plasma dentro de una hora de la administración32.
A pesar de los extensos datos preclínicos y dos prometedores ensayos de centro único25,26,33, progesterona no fue asociada con cualquier beneficio sobre el placebo, según lo medido por el puntaje GOS-E a los seis meses en este gran ensayo clínico multicéntrico. Los grupos fueron bien equilibrados para la gravedad de la lesión, y tanto el análisis por intención de tratar y a priori planeado. El análisis de la población objetivo fue congruente en mostrar ningún efecto de tratamiento. Se han realizado muchas pruebas negativas o resultados no concluyentes en las arduas búsquedas de un tratamiento para traumatismo craneoencefálico. De los diversos ensayos clínicos, ninguno ha tenido éxito34.
En nuestra revisión sistemática y metaanálisis no encontramos evidencia de que la progesterona pudiera disminuir la mortalidad a mortalidad general (RR 0,93, IC95% 0,79-1,10 p= 0,41), ni el pronóstico neurológico no favorable (estado vegetativo a discapacidad severa, GOS-E 1-3) (RR 0,94, IC95% 0,81-1,08 p= 0,27).
En el año 2016 fue publicada en la Cochrane library una revisión sistemática (Ma J y colaboradores)10, donde fueron incluidos cinco estudios donde se comparó el uso de progesterona con el mantenimiento de normotermia en niños y adultos (sin límite de edad) que requirieron hospitalización posterior a un trauma craneoencefálico. En esta revisión no se discriminó la severidad del trauma y se incluyeron estudios donde se evaluaba esta técnica en pacientes con TCE moderado o grave, donde no se encontraron diferencias significativas con el grupo control, en esta revisión, a diferencia de las que conducimos, se excluyeron fármacos como el acetato de medroxiprogesterona.
Este año se publicó un metaanálisis publicado en Drug Design, Development and Therapy donde se evaluaron ocho ensayos clínicos con un total de 2.251, con una disminución significativa en mortalidad y pronóstico neurológico adverso a tres meses del seguimiento; sin embargo, no hubo diferencia significativa a los seis meses posteriores al traumatismo, se estratificaron los resultados sobre la vía de administración intramuscular e intravenosa, y los efectos benéficos solo se mostraron en el grupo donde se administró progesterona por vía intramuscular (35).
Limitaciones
Los trabajos muestran gran variación entre los protocolos utilizados en relación con la dosis y la vía de administración de progesterona, así como en la velocidad de infusión y el tiempo de aplicación de ésta después del trauma. Otros puntos débiles fueron la existencia de pocos estudios clínicos aleatorizados de calidad y la gran heterogeneidad de pacientes que se incluyen en los estudios.
Aunque algunos de los ensayos incluidos en esta revisión fueron bien realizados en términos de tamaño de muestra y minimización del sesgo, su utilidad para determinar los efectos del tratamiento con progesterona para el TBI agudo estaba limitada por la heterogeneidad de las poblaciones, la inconsistencia de las intervenciones y las limitaciones de los resultados medidos.
Conclusiones
No se encontró evidencia de que la administración de progesterona posterior a un traumatismo craneoencefálico pueda reducir la mortalidad o mejorar los desenlaces neurológicos; sin embargo, los hallazgos son limitados y la calidad de la evidencia es baja o moderada, por lo que se necesitan más estudios de calidad y de adecuado muestreo.