Introducción
En nuestro país el cáncer de mama (CM) es la principal causa de muerte por cáncer en la mujer y con exclusión del cáncer de piel no melanoma es el cáncer más frecuente en el sexo femenino, dando cuenta de aproximadamente 650 muertes por año y 1.800 casos nuevos al año, de los cuales 99 corresponden a mujeres menores de 40 años (período 2007-2011), lo que representa aproximadamente 5,4% de todos los casos diagnosticados1,2.
Aunque el CM no es habitual en mujeres menores de 40 años, involucra a mujeres en edad fértil que se encuentran en plena actividad laboral, por lo que su diagnóstico tiene un mayor impacto a nivel personal, familiar y social.
La edad es un factor pronóstico desfavorable para estas pacientes, siendo las tasas de recaída local y a distancia y mortalidad mayor en las mujeres jóvenes3-9. Así, en la práctica clínica habitual la edad de la paciente es un factor de peso mayor y frecuentemente las pacientes jóvenes reciben tratamientos sistémicos más agresivos10.
Previamente nuestro grupo reportó las características clínico patológicas; el estatus de HER2, receptores de estrógenos (RE) y receptores de progesterona (RP) estudiados mediante inmunohistoquímica (IHQ); la sobrevida libre de enfermedad (SVLE) y la sobrevida global (SVG) en pacientes uruguayas diagnosticadas de CM antes de los 40 años11. La SVG y la SVLE a cinco años fueron 79% y 72%, respectivamente, menor a la reportada en pacientes de la población general y de mayor rango etario.
Si bien la peor evolución se ha vinculado al retraso en el diagnóstico, la mayoría de nuestras pacientes fueron diagnosticadas en estadios localizados y la totalidad realizó los tratamientos según las pautas vigentes. Por otra parte, la proporción de subtipos desfavorables (triple negativos (TN) y HER2+) fue mayor a lo reportado para mujeres de todas las edades con CM, por lo que su peor evolución podría ser explicada por su perfil biológico.
En relación al riesgo genético, a pesar de que la mayor parte de los CM diagnosticados en pacientes jóvenes son esporádicos, estas pacientes tienen un mayor riesgo de presentar una predisposición hereditaria para el desarrollo de la enfermedad, siendo los genes BRCA1 y 2 (BReast CAncer 1 y 2) los que usualmente se encuentran implicados. Entre 11,6% y 17% de las mujeres con diagnóstico de CM menores de 40 años presenta una mutación en algunos de estos genes12,13. En nuestro estudio, el 17% de las pacientes incluidas presentaron AF significativos, lo cual, sumado a la temprana edad de aparición de cáncer en estas pacientes, sugeriría una predisposición hereditaria al CM o de ovario, o ambos.
BRCA1 es un gen supresor de tumor que cuando se encuentra mutado predispone al CM y otros tumores, en particular cáncer de ovario14-17.
Las mutaciones de línea germinal en estos genes explican aproximadamente el 20%-40% de los CM familiares. Además, su expresión se encuentra disminuida, sin mutación génica que lo explique, en aproximadamente 30%-50% de los CM esporádicos18,19.
El gen BRCA1 codifica una proteína nuclear que interactúa con un gran número de proteínas reguladoras que participan en procesos celulares fundamentales, tales como la reparación del ADN, la transcripción, el control del ciclo celular y la apoptosis. En particular, se ha demostrado que está implicada en la reparación del daño genético contribuyendo al mantenimiento de la integridad del genoma20,21.
Desde el punto de vista molecular no existe una clara caracterización de los tumores en las mujeres jóvenes. Si bien en la población general, 30%-35% de los CM esporádicos presentan pérdida de función de BRCA1, asociada a cambios epigenéticos, no hemos encontrado estudios en la literatura que reporten el nivel de expresión de BRCA1 en mujeres menores de 40 años con CM esporádico12,13,19,18,22.
En el presente estudio se realiza la determinación de la expresión tumoral de BRCA1 mediante IHQ en las muestras de tumores de pacientes diagnosticadas de CM antes de los 40 años con el fin de analizar la correlación entre su grado de expresión y la evolución, siendo nuestro objetivo investigar si es un factor pronóstico de sobrevida en estas mujeres.
Objetivo
Evaluar el nivel de expresión de la proteína BRCA1 mediante IHQ e investigar si la expresión tumoral de BRCA1 es un factor pronóstico de la SVLE y la SVG a cinco años.
Material y método
Se trata de un estudio retrospectivo en el cual se seleccionaron pacientes diagnosticadas de CM antes de los 40 años en el período comprendido entre el 1º de enero de 2006 y el 31 de diciembre de 2012, con disponibilidad de muestra tumoral parafinada en archivo para realizar técnicas IHQ y que hubiesen dado su consentimiento informado. En caso de que la paciente hubiese fallecido, se solicitó consentimiento para la utilización de material de archivo (bloques de parafina) al familiar más cercano accesible. Las pacientes fueron asistidas en el Servicio de Oncología del Hospital Universitario de Clínicas, en el Hospital de la Mujer Paulina Luisi del Centro Hospitalario Pereira Rossell (CHPR) y en el Centro de Asistencia del Sindicato Médico del Uruguay (CASMU-IAMPP).
La recolección de datos se realizó a través del estudio minucioso de las historias clínicas.
Se obtuvieron los siguientes datos: edad de la paciente al diagnóstico; antecedentes gineco-obstétricos (edad de la menarca, estado menopáusico al diagnóstico, utilización de anticonceptivos orales, gestas, lactancia y duración de la misma); AF significativos (contando a la paciente, tres o más casos de CM/cáncer de ovario, al menos uno antes de los 50 años); tipo y grado histológico; tamaño tumoral; estado de los ganglios linfáticos axilares; estadio de acuerdo con la clasificación TNM; estatus de HER2, RE y RP estudiados mediante IHQ; tratamientos realizados (cirugía, tratamiento radiante o sistémico); recaída tumoral (local o sistémica).
Los estudios de IHQ para determinación del estatus de HER2, RE, RP y Ki 67 son parte del trabajo rutinario de los departamentos de anatomía patológica de las instituciones donde se asistieron las pacientes. El nivel de expresión de HER2 se determinó mediante Herceptest (Dako, Carpinteria, CA, USA). Los informes de los resultados de la inmunomarcación para HER2 se basaron en las recomendaciones vigentes en el período en que fueron estudiadas las pacientes, considerándose positivo el resultado con inmunotinción 3+. En casos IHQ 2+ se definió el estatus HER 2 mediante Fluorescent In Situ Hybridization (FISH).
Se definieron tres subtipos tumorales en base a la expresión positiva o negativa por IHQ y FISH, en caso de ser necesario, de HER2, RE y RP:
1) RRHH +, HER2-: RE+ y RP+, HER2-; RE-/RP+, HER2-; RE+/RP-, HER2-.
2) HER2 positivo: HER2 positivo, RE/RP + o -.
3) RE-, RP-, HER2- (triple negativo).
Se calculó SVG y SVLE para la población total y según la expresión de BRCA1 por IHQ, utilizando el método de Kaplan-Meier y el test de log rank. Se usó un nivel de significancia estadística de p <0,05. El paquete estadístico usado fue el SPSS 22.
La puesta a punto de la técnica y la determinación de BRCA1 mediante IHQ se realizó de forma centralizada, automatizado en equipo Autostainer Link 48. Se utilizaron los anticuerpos monoclonales anti-BRCA1 MS110 dirigido contra la región comprendida entre los 304 aminoácidos del extremo N-terminal y GLK-2 contra la región comprendida entre los aminoácidos 1839-1863, del extremo C-terminal. Para utilizar el anticuerpo monoclonal MS110 se empleó una dilución 1/100 y para el anticuerpo monoclonal GLK-2 se utilizó una dilución 1/50. Para analizar el nivel de expresión de la proteína BRCA1 se utilizaron los patrones acordados en la literatura considerando un resultado positivo cuando la inmunoexpresión nuclear o citoplasmática, o ambas, era >10% y negativo cuando la expresión era 10% en el núcleo y citoplasma de las células tumorales23-27.
Aspectos éticos
El presente estudio se realizó de acuerdo a las normas éticas internacionales para las investigaciones biomédicas: Normas del MERCOSUR sobre regulación de los estudios clínicos y la Declaración de Helsinski de la Asociación Médica Mundial (atendiendo a su última enmienda de octubre del 2013). Se mantuvo el anonimato de las pacientes en el análisis, contándose con la aprobación de los comités de ética de las instituciones participantes. Se incorporaron únicamente las pacientes que dieron su consentimiento informado. En caso de que la paciente hubiese fallecido, se solicitó consentimiento para utilización de material de archivo (bloques de parafina) al familiar más cercano accesible.
Resultados
El análisis incluyó 40 de las 107 pacientes diagnosticadas de CM antes de los 40 años, en las que fue posible contar con la muestra tumoral parafinada para realizar técnicas IHQ y con el consentimiento informado.
Veintisiete pacientes (67,5%) fueron asistidas en el CASMU; 12 pacientes (30%) en el CHPR, y 1 (2,5%) en el Servicio de Oncología del Hospital de Clínicas.
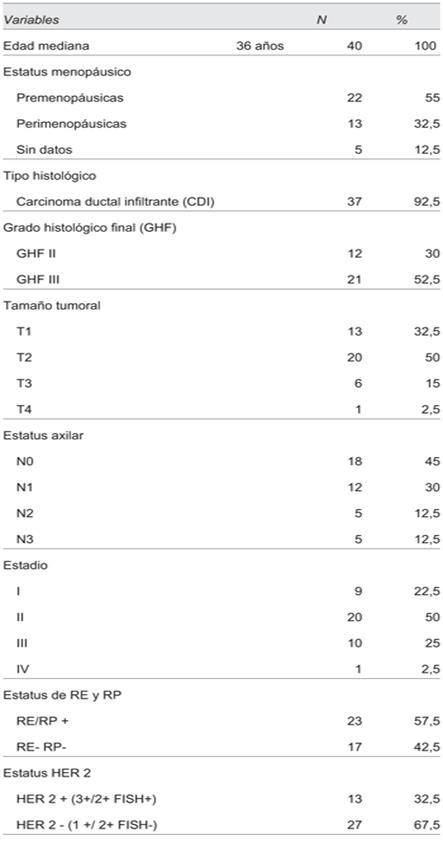
La edad mediana al momento del diagnóstico fue de 36 años (rango 29 a 39 años), la mayoría de las pacientes eran premenopáusicas al diagnóstico (22 pacientes, 55%), 13 fueron perimenopáusicas (32,5) y en el resto de las pacientes no se contaba con el dato. En relación con los factores de riesgo para el desarrollo de la enfermedad, considerando factores de riesgo hormonales: 5 pacientes (12,5%) tuvieron menarca precoz (antes de los 12 años), 5 (12,5%) fueron nuligestas y 8 pacientes (20%) tuvieron AF significativos de CM u ovario. El tipo histológico ductal infiltrante fue el más frecuente (37 pacientes, 92,5%), con alto grado histológico (21 pacientes, 52,5%). La mayoría de los tumores se encontraban limitados a la mama y la axila al momento del diagnóstico: el 82,5% de las pacientes tuvieron tumores menores a 5 cm y el 75% no tuvo compromiso axilar o tuvo menos de tres ganglios metastásicos. El 72,5% de las pacientes se presentaron en estadios precoces de la enfermedad. Las características clínico-patológicas de las pacientes se muestran en la (tabla 1).
Tabla 1: Características clínico-patológicas, estadio, RRHH y HER 2 de las pacientes incluidas en el estudio (n= 40).
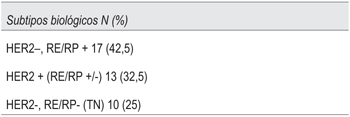
Con respecto al perfil biológico: 17 pacientes (42,5%) fueron HER2-, RE/RP+, 13 (32,5%) fueron HER2+ y las restantes 10 pacientes (25%) fueron clasificadas como triple negativas (tabla 2).
En cuanto al tratamiento sistémico, 33 pacientes (82,5%) recibieron quimioterapia y todas las mujeres con tumores mayores a 1 cm o axila positiva, HER 2 positivos, recibieron tratamiento con trastuzumab adyuvante. Todas las pacientes con CM RE o RP positivos, o ambos, recibieron hormonoterapia. Quince pacientes (37,5%) presentaron recaída en la evolución, el 66,6% (10 pacientes) de estas presentaron recaída sistémica exclusiva, 2 (13,3%) presentaron recaída locorregional exclusiva y 3 (20%) presentaron recaída locorregional y sistémica. En todas las pacientes que presentaron recaídas sistémicas se utilizó tratamiento sistémico en base a quimioterapia ± terapias dirigidas u hormonoterapia. Las pacientes con recaídas locorregionales recibieron tratamiento local con cirugía ± radioterapia y tratamiento sistémico en algún momento de su evolución.
La SVG a cinco años para el total de las pacientes fue de 73%, mientras que la SVLE a cinco años fue de 60%; no se alcanzó la mediana para la SVG, ni para la SVLE.
Análisis de la expresión de BRCA1 por inmunohistoquímica
La detección y localización de la proteína BRCA1 mediante IHQ se realizó utilizando dos anticuerpos monoclonales dirigidos contra diferentes regiones de la proteína, de acuerdo a lo descrito en Material y método (figura 1).
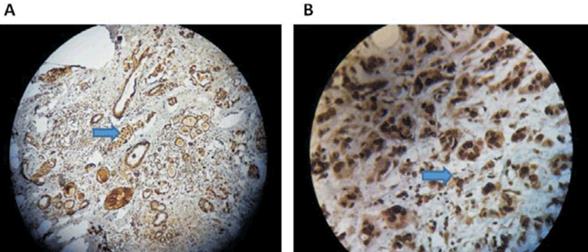
Figura 1: Técnica de IHQ: cortes de carcinomas mamarios incluidos en parafina en los cuales se observa la inmunomarcación a nivel nuclear y citoplasmático (flechas). A) Inmunomarcación utilizando el anticuerpo MS 110, dilución 1:100, 100 x. B) Inmunomarcación utilizando el anticuerpo GLK2, dilución 1:50, 400 x.
Dado que la pérdida de expresión de la proteína BRCA1 es uno de los mecanismos que puede estar en la base de la carcinogénesis mamaria, nos centraremos en el análisis de los casos con una inmunomarcación <10% en los núcleos y el citoplasma de las células tumorales, considerados como negativos.
La expresión de BRCA1 fue negativa en 11 de las 40 pacientes incluidas (27,5%) utilizando el anticuerpo MS110 y en 16 de las 40 pacientes incluidas (40%) utilizando el anticuerpo GLK2 (tabla 3). En 8 casos (20%) ambos anticuerpos presentaron una inmumomarcación <10% en los núcleos y el citoplasma de las células tumorales. Esto evidencia una discordancia en la inmunomarcación dado que esos casos representan el 72% de los negativos para MS110, pero solo el 50% de los negativos para GLK2.
Expresión de BRCA1 y evolución de la enfermedad
Durante el seguimiento, 14 pacientes presentaron una recaída de la enfermedad. Cuando se evaluó la expresión tumoral de BRCA1 en esas pacientes, se observó que la proporción de casos con inmunomarcación <10% fue mayor con el anticuerpo GLK2 (8/14, 57%) que con el anticuerpo MS110 (5/14, 36%), aunque la diferencia no fue estadísticamente significativa. Las cinco pacientes que presentaron inmunomarcación <10% con el anticuerpo MS 110 también presentaron inmumarcación <10% para GLK2.
Por otra parte, el porcentaje de recaídas fue mayor cuando ambas inmunomarcaciones fueron negativas (5/8, 62,5%) que cuando lo fue solo para GLK2 (3/8, 37,5%), o solo para MS110 (0/3), aunque la diferencia no fue estadísticamente significativa (chi cuadrado, p=0,39).
Asimismo, se evaluó la sobrevida en función de la expresión de BRCA1 para cada anticuerpo. Para MS110 la SVG a cinco años para las pacientes con expresión tumoral <10% fue de 70% y de 79% para las pacientes con expresión >10%, no siendo esta diferencia estadísticamente significativa (p = 0,122) (figura 2).
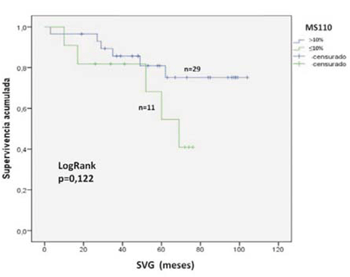
Figura 2: SVG a cinco años de acuerdo a la expresión tumoral de la proteína BRCA1 analizada mediante el anticuerpo MS110. La inmunomarcación se consideró positiva (>10%, línea azul) o negativa (<10%, línea verde). La diferencia entre los grupos se consideró significativa con un valor de p<0,05 (test de log rank).
La SVLE a cinco años para las pacientes con expresión tumoral <10% fue de 62% y de 55% para las pacientes con expresión >10%, no siendo esta diferencia tampoco estadísticamente significativa (p = 0,297) (figura 3). Las medianas de SVLE y SVG se muestran en la (tabla 4).
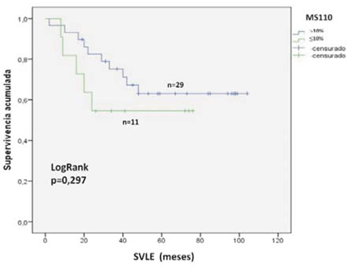
Figura 3: SVLE a cinco años de acuerdo a la expresión tumoral de la proteína BRCA1 analizada mediante el anticuerpo MS110. La inmunomarcación se consideró positiva (>10%, línea azul) o negativa (<10%, línea verde). La diferencia entre los grupos se consideró significativa con un valor de p<0,05 (test de log rank).
Para GLK2, la SVG a cinco años para las pacientes con expresión <10% fue de 56% y de 85% para las pacientes con expresión >10%, siendo esta diferencia estadísticamente significativa (log rank, p = 0,015) (figura 4). La SVLE a cinco años para las pacientes con expresión tumoral <10% fue de 40% y de 72% para las pacientes con expresión >10%, siendo esta diferencia también estadísticamente significativa (log rank, p = 0,034) (figura 5). Las medianas de SVLE y SVG se muestran en la (tabla 4).
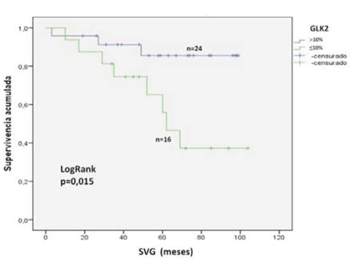
Figura 4: SVG a cinco años de acuerdo a la expresión tumoral de la proteína BRCA1 analizada mediante el anticuerpo GLK2. La inmunomarcación se consideró positiva (>10%, línea azul) o negativa (<10%, línea verde). La diferencia entre los grupos se consideró significativa con un valor de p<0,05 (test de log rank).
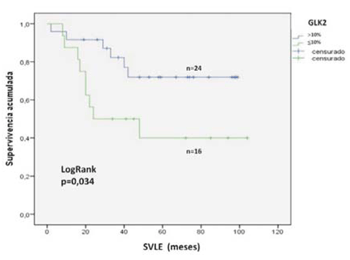
Figura 5: SVLE a cinco años de acuerdo a la expresión tumoral de la proteína BRCA1 analizada mediante el anticuerpo GLK2. La inmunomarcación se consideró positiva (>10%, línea azul) o negativa (<10%, línea verde). La diferencia entre los grupos se consideró significativa con un valor de p<0,05 (test de log rank)
Discusión
Con respecto a las variables clínico-patológicas de las pacientes incluidas en este estudio, 20% de las pacientes tenían AF significativos, lo cual, añadido a la temprana edad de aparición de cáncer en estas pacientes, hace pensar en una predisposición hereditaria al CM o de ovario, o ambos. Diversos trabajos muestran que las mutación en genes BRCA1 o 2 se presentan entre el 11,6% y el 17% de las mujeres con diagnóstico de CM menores de 40 años, siendo esta cifra similar a la hallada en nuestro estudio12,13.
Si confrontamos nuestros resultados con los reportados tanto en estudios nacionales28 como internacionales29-30 sobre frecuencia de subtipos biológicos para mujeres de todas las edades con CM, nuestras pacientes presentaron mayor porcentaje de subgrupos biológicos agresivos HER 2+ (32,5%) y TN (25%). Estos resultados son coincidentes con lo evidenciado por Cancello y colaboradores en un estudio que incluyó mujeres menores de 35 años, donde los porcentajes de pacientes por subtipos biológicos fueron los siguientes: HER 2+ (21%), TN (16,2%) y receptores hormonales +/HER 2- (49,8%)31. La mayoría de nuestras pacientes presentaron tumores pequeños con estadios localizados I y II (72,5%).
Como ya fue mencionado, aunque la mayor parte de los CM en la mujer joven son esporádicos, esta población tiene mayor riesgo de presentar una predisposición hereditaria para el desarrollo de la enfermedad, siendo los genes BRCA1 y 2 los más frecuentemente involucrados. En el Reino Unido se ha descrito, por ejemplo, que aproximadamente el 3% de todos los CM se atribuyen a mutaciones BRCA 1 o BRCA 2, siendo la proporción mayor en mujeres con diagnóstico antes de los 36 años, con un porcentaje que varía entre 6% y 9%22.
A pesar de que se sabe que aproximadamente en 30%-55% de las pacientes portadoras de CM esporádico existe una pérdida de función del gen BRCA1 asociada a cambios epigenéticos18,19, no hemos encontrado estudios que reporten el nivel de expresión de BRCA1 en mujeres menores de 40 años con CM esporádico.
Dado que en las mujeres jóvenes no existe una clara caracterización molecular del CM, pensamos que la investigación en este sentido debería ser una prioridad de la investigación científica.
En lo que se refiere a la ubicación intracelular de la proteína BRCA1, su expresión exclusiva a nivel nuclear podría estar reflejando su fenotipo normal, ya que su sitio habitual es el núcleo celular, donde participa en la reparación del ADN, la transcripción, el control del ciclo celular y la apoptosis20,21. Si bien antes se pensaba que BRCA1 se encontraba a nivel nuclear y que la tinción citoplasmática era un artefacto técnico, en la actualidad se reconoce que debido a las mutaciones que pueden afectar al gen, la proteína BRCA1 permanece en el citoplasma celular y no se trasloca al núcleo celular, por lo que puede hallarse tanto a nivel nuclear como citoplasmático32.
En relación con la evolución de la enfermedad, 14 de las 40 pacientes incluidas en nuestro estudio (35%) presentaron recaída durante el seguimiento. La mayoría de estas (8 pacientes, 57,1%) presentaron inmunomarcación <10% con el anticuerpo GLK 2 y más de un tercio de las mismas (5 pacientes, 35,7%) presentaron inmunomarcación <10% con el anticuerpo MS110. Es de destacar que las cinco pacientes con inmunomarcación MS110 negativa presentaron también inmunomarcación para GLK2 negativa. El hecho de que el porcentaje de recaídas fuera mayor cuando la inmunomarcación fuera negativa para ambos anticuerpos sugiere que la ausencia total de la proteína BRCA1, y, por lo tanto, de su función, se asocia con una mala evolución. En este sentido, la SVLE y la SVG fueron menores cuando la inmunomarcación fue negativa para GLK2. Sin embargo, los análisis de sobrevida de acuerdo a la inmunomarcación de MS110 no alcanzaron significación estadística, aunque la SVLE fue menor para las pacientes con inmunomarcación negativa. Este resultado podría ser explicado por el bajo número de pacientes, por lo que pensamos en un futuro poder incluir más pacientes en el estudio, para darle mayor poder estadístico.
Los resultados obtenidos con GLK2 coinciden con lo reportado por Kim y colaboradores, quienes reportaron un pronóstico desfavorable al disminuir la expresión de BRCA1 en el núcleo y citoplasma de las células tumorales de la mama26, lo que no hace pensar que el nivel de expresión de BRCA1 por IHQ del anticuerpo monoclonal GLK-2 podría ser útil como marcador predictivo de recaída. Así, en nuestro estudio, el nivel de expresión de BRCA1 determinado mediante IHQ con GLK2 constituyó un factor de mal pronóstico, ya que las pacientes con expresión nuclear y citoplasmática <10% tuvieron menor SVLE y SVG, siendo esto concordante con estudios internacionales, donde se evidencia que en el CM hereditario y esporádico la disminución de la expresión de BRCA1 a nivel nuclear y citoplasmático se ha asociado a un peor pronóstico y a una menor supervivencia33-36. A nivel nacional, en una comunicación previa, Zanetti y colaboradores reportan que bajos niveles de expresión tumoral del transcripto (ARNm) de BRCA1 se correlacionan con una peor evolución en 60 pacientes portadoras de CM esporádico37.
Esto podría ser explicado a la metilación aberrante del promotor del gen, que ocasiona la pérdida de su expresión y por ende de su función dentro de la célula.
En nuestro estudio, este mecanismo podría estar involucrado en los casos con inmunomarcación negativa de ambos anticuerpos, lo que podría ser analizado en futuros trabajos. En los casos con inmunomarcación negativa exclusivamente de GLK2, dado que el anticuerpo reconoce el extremo carboxi-terminal de la proteína, podría deberse a la presencia de una mutación de línea germinal del gen que determine una proteína truncada, lo que debería confirmarse mediante secuenciación del gen.
Como limitantes debemos mencionar que solo fue posible incluir 40 de las 107 pacientes diagnosticadas de CM antes de los 40 años, lo que podría introducir un sesgo en nuestro estudio. Esto se explica porque se incluyeron únicamente a las pacientes que contaban con muestra tumoral parafinada para realizar técnicas IHQ y con consentimiento informado.
En este sentido debemos tener en cuenta el pequeño tamaño muestral, por lo que desafortunadamente no fue posible indagadar la asociación entre las variables clínico-patológicas, subtipos moleculares y el marcador IHQ, quedando esto pendiente para el futuro.
Por otro lado, el estudio incluyó pacientes asistidas en tres instituciones de Montevideo, lo que puede generar un sesgo en los resultados al momento de interpretarlos como representativos de la población nacional.
De esta forma, queda pendiente para estudios a futuro la evaluación de las características de la enfermedad en un mayor número de pacientes, incluyendo pacientes del interior del país.
Teniendo en cuenta el hecho de que aún no se tienen estudios preliminares publicados en Uruguay respecto a la expresión de BRCA1 en nuestra población, se requieren otras investigaciones con series más grandes para llegar a conclusiones sobre su posible utilidad pronóstica o predictiva.
Conclusión
La pérdida de expresión de BRCA1 mediante GLK-2, que sugiere la presencia de una proteína truncada, se asoció a una menor SVG y SVLE de forma estadísticamente significativa. Nuestros resultados concuerdan con lo reportado en la literatura y evidencian que la disminución de la proteína BRCA1 determinada mediante IHQ con la clona GLK2 podría tener un valor pronóstico desfavorable para las pacientes jóvenes portadoras de CM.