Introducción
La tuberculosis (TB) constituye un problema prioritario para la salud pública mundial1. Actualmente, representa la novena causa de muerte en el mundo y la primera por enfermedades infecciosas, estando por encima del VIH/SIDA1. En el año 2016, se estima que 10,4 millones de personas en el mundo contrajeron TB, lo que equivale a una incidencia global de 142 casos cada 100.000 habitantes, registrándose 1,67 millones de muertes1.
Se estima que un tercio de la población mundial estaría infectada por M. tuberculosis y que solo 5% a 10% podría desarrollar la enfermedad a lo largo de su vida. Sin embargo, existen condiciones que aumentan el riesgo de desarrollarla, principalmente las vinculadas a inmunodepresión por enfermedades (VIH, enfermedades autoinmunes, hematooncológicas, etcétera), o por administración de drogas inmunosupresoras2-4.
En el grupo de drogas inmunosupresoras utilizadas en la actualidad se destacan los fármacos anti- TNF(, los que han demostrado ser altamente beneficiosos en el tratamiento de enfermedades inflamatorias crónicas, como la artritis reumatoidea (AR), espondilitis anquilosante (AE), enfermedad de Crohn (EC) y colitis ulcerosa crónica (CUC). Las principales complicaciones de estos fármacos son las infecciones y en particular la TB. La TB se podría desarrollar a partir de la reactivación de una infección tuberculosa latente (ITBL) en un individuo que ha tenido contacto previamente con M. tuberculosis, o por progresión de una infección adquirida en forma reciente5.
Se resumen los principales mecanismos que determinan la asociación entre el uso de anti- TNF( y TB.
TNF( y TB
EL TNF( es un componente fundamental en la respuesta inmune del huésped frente a M. tuberculosis. Su acción sinérgica con el IFN gama, mediador central de linfocitos Th1, contribuye a la activación de los macrófagos y posterior diferenciación en células epiteloides, lo cual determina la constitución del granuloma. La ausencia de TNF( produce la disrupción de éste con la posibilidad de progresión de la infección y eventual diseminación.
Anti-TNF( y TB
Los fármacos anti- TNF( se diferencian por sus mecanismos de acción:
1) anti- TNF( solubles que interactúan principalmente con TNF( soluble (TNFR1): adalimumab, infliximab, golimumab, certolizumab y
2) anti- TNF( que interactúan con el receptor de TNF ligado a la membrana (TNFR2): etanercept.
El TNFR1 es esencial para la formación del granuloma, a diferencia de TNFR2, que tiene una acción menor, lo cual explicaría las diferentes acciones de estos fármacos en relación con el granuloma tuberculoso (disrupción y diseminación del M. tuberculosis) y, por lo tanto, al riesgo de reactivación de una ITBL6.
En Uruguay, el Fondo Nacional de Recursos (FNR) como institución parte del Sistema Nacional Integrado de Salud, brinda cobertura financiera para tratamientos con fármacos biológicos, entre ellos los anti- TNF(. En el año 2010 comenzó la cobertura para AR y posteriormente se amplió para EA, EC y CUC, lo cual ha determinado una utilización progresiva de dichos fármacos en nuestro medio.
Por otra parte, se ha observado un cambio en la situación epidemiológica de la TB en Uruguay, ocurriendo un aumento progresivo de la incidencia, la cual alcanzó 25,7/100.000 habitantes para el año 2016. Los casos se distribuyen en forma diferente según los departamentos, siendo Montevideo el que registra la incidencia mayor: 38,6/100.000 habitantes. En relación con los grupos etarios, se concentra en edades jóvenes (15 a 54 años), lo que traduce una alta transmisibilidad de la infección en la comunidad7.
El objetivo principal del estudio fue conocer la incidencia de TB en la población que inició tratamiento con fármacos anti- TNF( (adalimumab, etanercept, golimumab e infliximab) bajo la cobertura del FNR en el período entre 2010 y 2016. Los objetivos secundarios fueron analizar las formas de presentación de la TB y la pesquisa de infección tuberculosa latente en esta población previa al inicio de dichos tratamientos.
Material y método
Se realizó un estudio de cohorte retrospectiva que incluyó los tratamientos autorizados, desde el inicio de la cobertura (AR marzo 2010, EC marzo 2010, EA octubre 2013, CUC diciembre 2015) hasta el 31 de diciembre de 2016. Los datos se obtuvieron de los sistemas informáticos del FNR y del Programa Nacional de Tuberculosis (PNT). Las variables estudiadas en relación con los agentes anti- TNF( fueron: fecha de inicio del tratamiento y tipo de fármaco utilizado: adalimumab, golimumab, etanercept o infliximab. Aquellos pacientes que iniciaron tratamiento con anti- TNF( y que en algún momento cambiaron por otro fármaco no anti- TNF(, se los censuró a la fecha del cambio. Se estudiaron variables demográficas de la población y en relación con la TB: mediana de seguimiento, forma de presentación clínico-radiológica, bacteriología, complicaciones durante el tratamiento de la TB, resultado de tratamiento, métodos diagnósticos utilizados para el cribado de ITBL y tratamiento de ésta. Se tomó como caso de TB a aquel paciente en el que el médico tratante decide iniciar tratamiento anti-TB, ya sea por sospecha clínica, confirmación bacteriológica, adenosín deaminasa (ADA) positiva o histopatología compatible, o ambas. Los estudios para el diagnóstico de TB fueron: baciloscopía con técnica de Zihel Neelsen o auramina rodamina, cultivos en medios líquidos y sólidos, histopatología sugestiva de TB y ADA en líquido cefalorraquídeo (LCR) o alguna serosa positiva para TB. Para ITBL, los tests diagnósticos que se usaron fueron: prueba de Mantoux o PPD e Interferon Gamma Release Assays (IGRA).
La tasa de incidencia de TB se calculó considerando los nuevos casos en el período estudiado, dividido la sumatoria de los tiempos individuales de exposición, y se calculó su respectivo intervalo de confianza a 95%.
Para el cálculo de las respectivas medianas de seguimiento se excluyeron aquellos pacientes que tuvieron el evento (TB).
Para el análisis estadístico se utilizó el software Stata 15.0 y WinPepi 4.0 y R 3.0.3
Resultados
Características de la población estudiada
Se incluyeron 991 tratamientos para un total de 980 pacientes, 653 con AR (648 pacientes), 254 con EA (252 pacientes), 69 con EC (65 pacientes) y 15 con CUC (15 pacientes). En la (tabla 1) se describen las características demográficas de la población según la patología de base: AR, CUC, EA o EC.
Tabla 1: Características demográficas de la población estudiada según enfermedad inflamatoria sistémica.
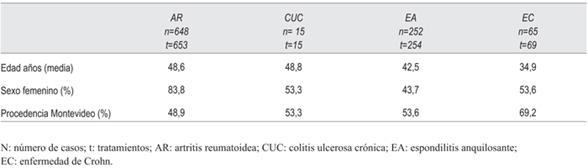
La mediana de seguimiento global fue de 22,5 meses. Para AR 24,7 meses; EC 23,7 meses; EA 20,3 meses, y el menor seguimiento correspondió a los pacientes con CUC: 2,9 meses.
Incidencia de tuberculosis en pacientes bajo tratamiento con anti-TNF(
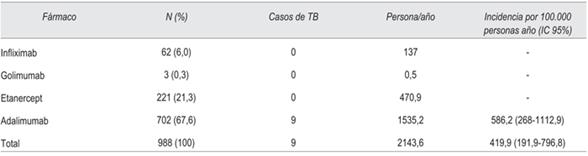
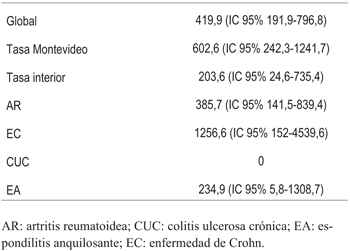
La ocurrencia de enfermedad tuberculosa fue de 9 casos en el período considerado, 6 de ellos fueron en pacientes con AR, 2 con EC, 1 con EA, y no se detectaron casos en pacientes con CUC. La incidencia global de TB para la población estudiada fue de 419,9 (IC 95% 191,9 - 591,2) por 100.000 personas/año, 16,5 veces mayor que para la población general. En Montevideo la incidencia fue de 602,6 (IC 95% 242,3 - 1241,7) y en el interior 203,6 (IC 95% 24,6- 735,4) (tabla 2). La incidencia fue mayor en los pacientes con EC (1256,6 IC 95% 152-4539,6), luego AR (385,7 IC 95% 141,5-839,4), EA (234,9 IC 95% 5,8-1308,7), no registrándose casos en pacientes con CUC.
Tabla 2: Tasa de incidencia global de tuberculosis, procedencia y separado por patologías (para 100.000 personas /año).
La incidencia acumulada global de enfermedad tuberculosa se muestra en la (figura 1) y la incidencia por patologías en la (figura 2). En cuanto a la presentación temporal de los casos, la mediana de tiempo entre el inicio del fármaco y el diagnóstico de TB fue menor o igual a 15 meses. Definiendo casos de TB de presentación precoz (=15 meses) y tardía (>15 meses) con un rango de 4 - 44 meses (tabla 4). Cuando analizamos por patología, se observa que los casos más tardíos fueron en AR, mientras que en EA y EC ocurrieron en los primeros dos años de iniciado el fármaco.
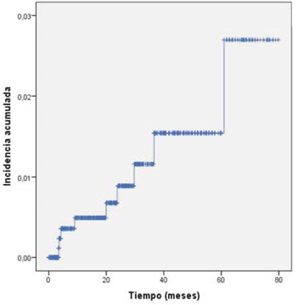
Figura 1: Incidencia acumulada global de TB en pacientes con enfermedades inflamatorias crónicas que reciben tratamiento con agentes anti-TNF(.
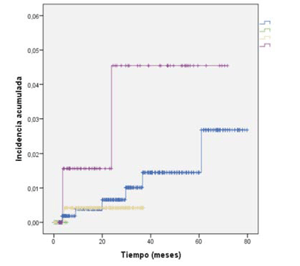
Figura 2: Incidencia acumulada de TB en pacientes con enfermedades inflamatorias crónicas que reciben tratamiento con agentes anti- TNF( según patología de base. AR: artritis reumatoidea; CUC: colitis ulcerosa crónica; EA: espondilitis anquilosante; EC: enfermedad de Crohn.
En la (tabla 3) se muestra la incidencia de TB según agente anti- TNF( recibido. En el período estudiado hubo 702 (67%) tratamientos con adalimumab, 221 (21,3%) con etanercept, 3 (0,3%) con golimumab y 62 (6%) con infliximab. Solo se registraron casos de TB en pacientes tratados con adalimumab, constituyendo una incidencia de 586,2 (IC 95% 268-1112,9) por 100.000 personas/año.
Características de la tuberculosis en pacientes bajo tratamiento con anti-TNF(
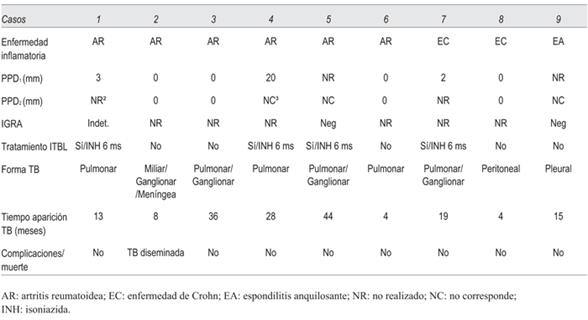
En la (tabla 4) se describe, para cada caso, el screening de ITBL, el tratamiento de ITBL y las formas de presentación de la TB. El screening de ITBL previo al inicio del agente biológico fue heterogéneo, realizando PPD IGRA, o ambos. En cuanto al tratamiento de la ITBL, cuatro casos recibieron INH por seis meses. Con respecto a la forma de TB, predominaron las formas extrapulmonares o diseminadas (6/9) sobre la afectación pulmonar aislada (3/9). En todos los casos se suspendió el anti- TNF( al diagnosticar la TB y en ninguno de los casos se retomó.
Discusión
Nuestro estudio demostró una incidencia de TB 16 veces mayor en pacientes que recibieron anti-TNF( comparando con la población general. La presentación clínica fue variada así como la aparición temporal de los casos en relación con el inicio del fármaco. La presentación de TB en pacientes que habían recibido tratamiento de ITBL plantea la importancia de un correcto estudio y tratamiento de ITBL, así como el seguimiento de los pacientes que reciben anti-TNF( para detectar en forma precoz esta complicación.
Si bien las alteraciones inmunológicas que producen estos fármacos constituyen el principal factor causal, existen otros potenciales como la epidemiología de la TB de cada país, el tipo de fármaco utilizado, la enfermedad de base y el cribado de ITBL realizado previo al inicio del tratamiento8-10.
En cuanto al factor epidemiológico, Uruguay actualmente pertenece al grupo de países con incidencia mediana-alta de TB (20-50 casos/100.000 habitantes)11, lo cual es de esperar que influya en la incidencia elevada encontrada en el grupo de pacientes con anti- TNF(. Los estudios que han publicado datos de diferentes poblaciones provienen mayoritariamente de países con bajas tasas de incidencia de TB, lo cual constituye una limitante a la hora de comparar nuestros resultados12,13. En España, país que en el año 2004 presentaba una incidencia similar a la nuestra (25/100.000), se encontró una incidencia de 514/100.00 para el grupo de pacientes con anti- TNF(. Estas cifras descendieron significativamente luego de aplicar normativas que incluyeron el cribado de ITBL en forma obligatoria8.
En relación con los fármacos, la totalidad de los casos de TB se dieron en pacientes bajo tratamiento con adalimumab; esto es acorde a lo reportado a nivel internacional, donde el mayor riesgo de TB se observó con anti- TNF( de tipo monoclonal versus etanercept6,14. Probablemente esta diferencia se relacione con el hecho de que adalimumab e infliximab bloqueen el TNF( soluble (TNFR1).
En cuanto a la enfermedad de base, dentro de las EI, la AR ha demostrado asociarse a mayor riesgo de TB15; si bien existe una predominancia de esta enfermedad en el grupo estudiado (6 de 9), el número total de casos registrados (9) impide establecer una asociación de esta EI con la TB.
Por último, en cuanto al cribado de ITBL y su tratamiento previo al inicio de los anti- TNF(, varios países han elaborado guías o recomendaciones que, si bien plantean diferentes algoritmos de estudio, coinciden en la necesidad de su aplicación sistemática como principal estrategia para disminuir el riesgo de TB en este grupo de pacientes8,16-18. Los algoritmos propuestos insisten en la importancia de descartar TB, investigar exposición previa y realizar PPD o IGRA. En relación con priorizar uno u otro test, la mayoría de los autores recomiendan realizar ambos, considerando que el resultado positivo de cualquiera de ellos permite plantear ITBL y realizar el tratamiento5,19-22. Por otro lado, el resultado negativo de ambos tests permite en principio descartar ITBL. En la población estudiada, el cribado para ITBL fue heterogéneo y en la mayoría de los casos (8/1) se realizó únicamente una de las dos pruebas; teniendo en cuenta la dificultad en la accesibilidad a los IGRA en nuestro país, por no constituir una prestación obligatoria de los prestadores de salud, y la dificultad que ha ocurrido por períodos en la disponibilidad de la prueba de PPD.
El presente trabajo significó un cambio en el algoritmo de screening de los pacientes que van a recibir anti- TNF( en Uruguay, siendo requisito por normativa del FNR la realización de ambas pruebas, acorde a lo recomendado a nivel internacional16.
En relación con el tratamiento de la ITBL, si bien hay varios posibles planes23, la mayoría de las guías coinciden en indicar INH por un período de nueve meses y es la pauta de elección en Uruguay. En la serie estudiada, cuatro de los casos habían recibido INH previamente, aun así desarrollaron TB. Esto podría deberse a dos factores. Por un lado, al breve período de tratamiento, seis meses y no nueve como lo recomendado. Por otro lado, se describe en la literatura que los pacientes que reciben anti- TNF( mantienen un riesgo elevado de desarrollar TB que requiere seguimiento estrecho para su detección precoz7,8,10.
En cuanto al tiempo de aparición de los casos de TB luego de iniciado el fármaco, se observaron casos de aparición precoz y casos de aparición tardía. Esto no coincide con los datos publicados por la mayoría de los autores, que señalan al primer año de exposición al fármaco como el período de mayor riesgo24. Sin embargo, hay otros autores que han encontrado un riesgo persistente de TB a lo largo del tratamiento con los agentes anti- TNF(, señalando la importancia de la vigilancia a largo plazo8. Una posible explicación sería la relación de los casos precoces (>15 meses) con una reactivación de una ITBL no detectada o insuficientemente tratada (casos 1, 2, 6, 8 y 9) y los casos tardíos (casos 3, 4 y 5) tratarse de una exposición nueva a M. tuberculosis (tabla 4).
Predominaron las formas de TB extrapulmonares o diseminadas, al igual que lo que sucede en otras poblaciones con inmunidad vulnerable, como es el caso de los coinfectados VIH. Sin embargo, a pesar de tratarse de un grupo de riesgo, no se registraron muertes.
Conclusiones
Encontramos una alta incidencia de TB en la población bajo cobertura con anti-TNF(, siendo 16 veces mayor que en la población general. La presentación temporal de los casos fue variada y se dieron casos en sujetos que habían recibido tratamiento de ITBL previo, sugiriendo que el riesgo persiste mientras exista exposición al fármaco. Por todo esto es de suma importancia realizar cribado de ITBL previo al inicio de los mismos, y mantener siempre un alto índice de sospecha frente a cuadros compatibles.