Introducción
Las diarreas por enteroparásitos son un grave problema mundial de salud que afecta mayormente a los niños, situación a la que no escapa Venezuela, donde se han reportado más de un millón de casos al año, siendo los principales responsables los rotavirus, las bacterias y en último lugar los enteroparásitos1. Uno de los principales elementos que contribuyen en la proliferación de agentes infecciosos es el aumento de los residuos sólidos, acompañados del aumento de productos desechables no reutilizables, conjuntamente con la disminución de los rellenos sanitarios y la polución generada por la disposición inapropiada de estos residuos2.
Una de las causas fundamentales de la diseminación de los agentes infecciosos y principalmente de las parasitosis es a través de los insectos vectores, especialmente las moscas, que es el nombre genérico que se les asigna a los insectos del orden de los dípteros. De estos insectos se han clasificado hasta el momento unas 120.000 especies distintas, tal que los biólogos consideran que una de cada diez especies del reino animal es un díptero3. De las moscas, resaltan las de interés médico que se alimentan fácilmente sobre los distintos sustratos y porque pueden desplazarse a través del vuelo a grandes distancias. Las moscas tienden a ser endófilas, lo que las hace más efectivas en la dispersión de patógenos (forentes), especialmente aquellas de la familia Calliphoridae, Sarcophagidae y Musca domestica (es polífaga), que transportan en su interior o en su superficie (pelos, setas y patas) los enteroparásitos.
Los parásitos también pueden ser eliminados con las heces de estos dípteros o cuando regurgitan la comida anterior antes de una nueva comida (Musca domestica), a esto se le agrega que en sus etapas inmaduras las moscas se desarrollan en material orgánico en descomposición, tal como las heces, cadáveres, basura, drenajes, etcétera, facilitando su contaminación o infección con patógenos. Estudios han demostrado que Musca domestica puede ser vector de más de cien agentes infecciosos, entre ellos protozoarios y helmintos intestinales, presentando una distribución mundial, ausentándose solamente en el Ártico, en el Antártico y en zonas de altitud extrema1,2,4,5,6. Es por esto que en el presente trabajo se procuró evidenciar, en esta zona de Venezuela, la posibilidad que tuvieron diversas especies de moscas (especialmente las de interés médico) de dispersar enteroparásitos de interés humano, confirmando la función de estas como vectores mecánicos.
Materiales y método
Se realizó una investigación de tipo descriptivo transversal, no probabilística a conveniencia, de tipo accidental, que tuvo como objetivo determinar la presencia de enteroparásitos en moscas de interés médico, capturadas en el municipio Palavecino del estado Lara, zona del Centroccidente de Venezuela. La zona de trabajo presentó las coordenadas geográficas LN 10°02´10´´, LO 69°15´41´´, una altitud de 450 msnm, una precipitación media anual de 757 mm, una temperatura media anual de 24,5 °C y una clasificación climática de semiárido cálido. El lugar de las capturas correspondió específicamente a la plaza Bolívar y el ambulatorio de la población de Los Rastrojos, la Caballeriza EP, la urbanización Tierra del Sol, urbanización Los Rastrojos y urbanización Villa Roca, realizando las capturas entre los meses de octubre y noviembre del año 2017 (fin del período de lluvias).
Para las capturas se utilizaron trampas hechas de botellas recicladas, transparentes de plástico, de dos litros de volumen, las cuales, previamente, eran lavadas con agua potable hervida y jabón clorado. Las botellas fueron cortadas a nivel de la unión del tercio superior con los dos tercios inferiores; luego se introducían trozos de 3 cm3 de piña, sardinas o cambur (banana), como atractantes, basado en descripciones anteriores7,8, posteriormente se unió y selló el tercio superior, de forma invertida, utilizando una engrapadora (figura 1).
Las trampas semejaban un embudo a través del cual se pretendía permitir la entrada de las moscas, más no su salida, basado en el principio de que los insectos suelen buscar las orillas de los recipientes para salir. Cada trampa se dejaba por 72 horas en cada localidad, para luego ser recogida y transportada al Laboratorio de Parasitología Médica de la Universidad Centroccidental Lisandro Alvarado, donde se congelaban por 15 minutos (para inactivar las moscas), luego se traspasaban a recolectores plásticos (de orina) estériles, para seguidamente, una a una, ser colocadas en placas de Petri, para observarlas con microscopio estereoscópico (Stemi SR, Carl Zeiss).
La determinación de la morfología se obtuvo con el uso de las respectivas claves taxonómicas6,9,10, igualmente el género y la especie (cuando aplicaba). Luego de clasificadas se colocaron en grupos máximos de diez individuos, de la misma especie, en tubos plásticos de centrífuga, los cuales se llenaban con solución salina fisiológica al 0,85% hasta completar los 13 ml, el tubo se cerraba con su tapa plástica de rosca estéril, se invertía diez veces, suavemente, para permitir el desprendimiento de los enteroparásitos de la superficie de las moscas o de su contenido intestinal, luego se retiraban las moscas del tubo, utilizando pinzas estériles, posteriormente el tubo era centrifugado durante 10 minutos a 3.000 rpm, se descartaba el sobrenadante, se agitaba el sedimento (pelet) y con cuidado se colocaban dos gotas de este sedimento en un portaobjetos (75 por 25 mm).
En la gota de la izquierda se le colocaba inmediatamente encima una laminilla cubreobjeto de 22 por 22 mm, mientras que a la gota de la derecha se le colocaba una gota de lugol antes de ponerle la laminilla cubreobjetos. El contenido de ambas gotas era observado al microscopio óptico (AxioLab, Carl Zeiss), donde se recorría la lámina primeramente con aumento de 100 X y luego con 400 X (primero objetivo de 10 X, luego objetivo de 40 X). Se anotaba en el cuaderno de protocolo las especies de enteroparásitos encontrados y se agrupaban para determinar su frecuencia4.
Resultados
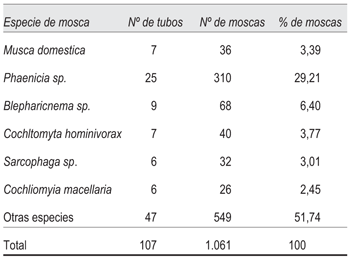
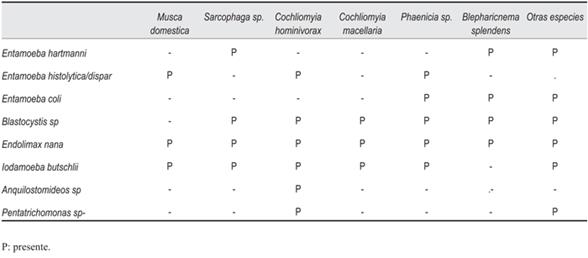
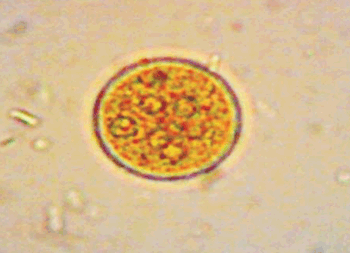
Se recolectaron un total de 1.061 especímenes de moscas (tabla 1), que correspondieron a 310 ejemplares de Phaenicia sp, lo cual representaba el 29,2% de las recolectadas, 68 ejemplares de Blepharicnema splendens (6,4%), 40 Cochliomyia hominivorax (3,8%), 36 Musca domestica (3,4%), 32 Sarcophaga sp (3%), 26 Cochliomyia macellaria (2,5%) y 549 ejemplares de otras especies no clasificadas (51,7%) (existen más de 120.000 especies de moscas descritas). En todas las especies de moscas se detectaron enteroparásitos como contaminantes, encontrando entre tres y siete especies de enteroparásitos por especie de mosca (tabla 2), siendo los protozoarios encontrados: Blastocystis sp, Endolimax nana, Entamoeba hartmanni, Entamoeba histolytica/dispar, Entamoeba coli, Iodamoeba butschlii, Pentatrichomonas sp (figura 2) , mientras que los únicos helmintos conseguidos fueron las uncinarias. También se apreciaron ooquistes de Toxoplasma gondii, que es un parásito eliminado en las heces de los félidos.
El protozoario más frecuentemente encontrado fue Endolimax nana, que se identificó en todas las especies de moscas capturadas, seguido de Blastocystis sp., que se observó en todas las especies de moscas estudiadas, menos en Musca domestica, igualmente Iodamoeba butschlii también se evidenció en todas las especies, menos en Blepharicnema splendens.
La especie de mosca que presentó contaminación con mayor diversidad de enteroparásitos fue Cochliomyia hominivorax con seis taxones de parásitos, seguido de Phaenicia sp con cinco taxones, Sarcophaga sp y Blepharicnemasplendens con cuatro y finalmente Musca domestica y Cochliomyia macellaria con tres especies de enteroparásitos.
Discusión
Por primera vez se describe para Venezuela las especies Phaenicia sp, Blepharicnema splendens, Cochliomyia hominivorax, Cochliomyia macellaria y Sarcophaga sp, como moscas contaminadas por enteroparásitos, especialmente con protozoarios, encontrándose en estas a Blastocystis sp, Endolimax nana, Entamoeba hartmanni, Entamoeba histolytica/dispar, Entamoeba coli, Iodamoeba butschlii, Pentatrichomonas sp (Trichomonas sp) y Anquilostomideos, ya que solamente se había estudiado en el estado Sucre, Venezuela, y exclusivamente en Musca domestica, su contaminación con Blastocystis sp, Entamoeba histolytica, Giardia lamblia (Giardia intestinalis), Entamoeba coli, Endolimax nana, Toxocara sp y Cyclospora cayetanensis, estas dos últimas no se detectaron en el presente trabajo1. No obstante, en otros países, por ejemplo Argentina, en especies de Calliphoridae (Phaenicia) se encontró menos diversidad que en el presente trabajo, con huevos de Taenia sp., quistes de Entamoeba coli y de Giardia lamblia (G. intestinalis)4; también en Brasil, en Musca domestica, Calliphoridae y Sarcophagidae se reportó una mayor diversidad de parásitos especialmente helmintos, a saber: Entamoeba coli, Entamoeba histolytica, Endolimax nana, Iodamoeba butschlii, Trichuris trichiura, Ascaris lumbricoides, Anquilostomideos, Hymenolepis nana y Strongyloides stercoralis2.
En el caso particular de Musca domestica, que de todas las moscas es el vector por excelencia, en el presente trabajo solamente se encontró contaminada con tres parásitos (Entamoeba histolytica, Endolimax nana y Iodamoeba butschlii), una diversidad mucho menor a lo reportado también en Musca domestica de Colombia, donde señalaron a Entamoeba histolytica, Entamoeba coli, Endolimax nana, Iodamoeba butschlii, Entamoeba hartmanni y Blastocystis sp3, menor también a investigaciones de Perú donde se consiguieron diez especies, a saber: Blastocystis sp, Giardia lamblia, Cryptosporidium sp, Cyclospora cayetanensis, Iodamoeba butschlii, Endolimax nana y Chilomastix mesnili5; e incluso Entamoeba hartmanni, Entamoeba coli y Toxocara canis6 .
Por primera vez se reporta en el estado Lara, ooquistes de Toxoplasma gondii en Musca domestica y Phaenicia sp., estos provienen del ciclo entero-epitelial del parásito en los felinos, donde se produce la ruptura de las células epiteliales con liberación de ooquistes inmaduros hacia las heces en la luz del intestino3,11.
Toxoplasma gondii es el responsable a nivel mundial de la tercera causa de hospitalización por una infección transmitida por alimentos, la cual es especialmente importante en embarazadas, ya que puede producir en el feto daños oculares, neurológicos e incluso la muerte11, igualmente se ha señalado a las moscas desempeñando un rol importante en la transmisión de Toxoplasma gondii en hospitales y su implicación en inmunodeprimidos3.
Conclusiones
La detección de diversas especies de moscas contaminadas con siete especies de enteroparásitos determinaron el importante rol que estas presentan como vectores mecánicos, tanto de protozoarios como de helmintos intestinales, por lo que su control debe ser prioritario para la disminución de enfermedades, especialmente de las diarreas.