Introducción
La hemofilia A es un desorden hemorrágico congénito caracterizado por la deficiencia del factor VIII (FVIII) de la coagulación. Las cirugías de pacientes con hemofilia exigen un encare multidisciplinario, con especialistas capacitados en esta patología, para lograr una correcta hemostasis y el éxito terapéutico.
El objetivo del presente caso es describir el abordaje perioperatorio de un paciente con hemofilia A severa a quien se le realizó una colecistectomía laparoscópica y papiloplastia transcística. Se trata de la resolución quirúrgica de una patología del adulto frecuente en un individuo con coagulopatía congénita hemorrágica grave, catalogada dentro del grupo de las enfermedades raras. A nivel nacional hay solo un trabajo publicado en relación con cirugía en esta población1. Este plantea similar estrategia terapéutica en una complicación de la propia hemofilia por hemorragia recurrente localizada que requirió cirugía.
Marco teórico
La hemofilia es una coagulopatía congénita de herencia recesiva ligada al cromosoma X, provocada por la deficiencia del FVIII de la coagulación en el caso de la hemofilia A o del factor IX (FIX) en el caso de la hemofilia B2,3. La deficiencia es el resultado de las mutaciones de los respectivos genes de los factores de la coagulación2,3. Clínicamente los dos tipos de hemofilia son indistinguibles3.
La hemofilia A tiene una frecuencia estimada de aproximadamente un caso por cada 10.000 nacimientos2. Según las estimaciones de las encuestas anuales de la Federación Mundial de Hemofilia (FMH) habría 400.000 individuos hemofílicos en el mundo. La hemofilia A es más frecuente que la hemofilia B y representa entre el 80% y el 85% de la población total de hemofílicos2,3. Por lo general, esta coagulopatía afecta a los individuos varones del lado materno. Puede clasificarse de acuerdo a su gravedad en leve, moderada y severa, según la actividad del factor sea mayor a 5%, de 1% a 5% o menor a 1% respectivamente2,3.
Actualmente el tratamiento de los episodios hemorrágicos o la profilaxis de los mismos se realizan con factores de la coagulación comerciales. Estos también permiten realizar procedimientos invasivos o quirúrgicos con mayor seguridad2.
Descripción del caso
Se trata de un paciente de sexo masculino, de raza blanca, extranjero, de 65 años de edad, portador de hemofilia A severa diagnosticada a los 6 meses de vida. El mismo padece artropatía hemofílica y ha presentado múltiples episodios de hemartrosis a nivel de tobillos, rodillas, codos y hombros. Como eventos severos en el transcurso de su patología sufrió un hematoma de psoas ilíaco y un accidente cerebrovascular (ACV) hemorrágico en 2012, en cuyo contexto se realizó diagnóstico de hipertensión arterial (HTA), para la que actualmente recibe enalapril. Hace más de 30 años presentó inhibidor de FVIII positivo a bajo título (0,5 UB), recibiendo tratamiento en ese momento con ciclofosfamida, en su país. Allí solo habría recibido tratamientos sustitutivos a demanda, no siendo en ningún momento incluido en planes de profilaxis secundaria o terciaria.
Desde el punto de vista inmunohematológico se trata de un paciente politransfundido con hemocomponentes: sangre desplasmatizada, plasma fresco congelado y crioprecipitados y hemoderivados: FVIII comercial. Presenta serología a virus de hepatitis C (VHC) reactivo en 2010, actualmente de carga viral indetectable.
Como antecedente de su enfermedad actual, podemos mencionar que desde su país de origen presentó varios episodios de cuadros agudos hepáticos interpretados como empujes de su hepatitis, no realizándose imagenología en esos momentos. Desde su residencia en Uruguay, hace seis meses, reiteró eventos de similares características, finalmente concurriendo a servicio de urgencia de Hospital de Clínicas. En dicha consulta se plantea un cuadro compatible con colangitis aguda litiásica simple en curso. De la paraclínica en puerta se destaca: bilirrubina total 1,32 mg/dl (0,0 a 1,0), fosfatasa alcalina 221 U/l (40-215), ALT/GPT 211 U/l (2-30), AST/GOT 120 U/l (2-33), GGT 437 U/l (3-48). GB 16,5 mil/mm3 (4,0-10,5). Ecografía de abdomen informa múltiples litiasis en vesícula biliar, móviles. Paredes y colédoco finos.
Ingresa a sala para tratamiento médico con buena evolución en las primeras horas. Luego, nuevo episodio de colangitis con dolor y movimiento enzimático, por lo cual se decide la realización de colangiorresonancia nuclear magnética (CRNM) evidenciando coledocolitiasis.
Visto y discutido en ateneo conjunto de clínica quirúrgica y departamento de medicina transfusional se decide la realización de colecistectomía y resolución de coledocolitiasis.
Paraclínica preoperatoria: Hb 11,1g/dl (13,4-16,6) - Hto 32,8% (37-49) - VCM 83,2 fl (81,8-95,7) - HBCM 28,1 pg (26,2-31,8) - ADE 11,1% - PLT 330 mil/mm3 (130-400) - GB 4,95 mil/mm3. FVIII 0,3% (70-150) - inhibidor de FVIII negativo. AC VHC, AC VHB CORE, AC VHB AgS reactivos.
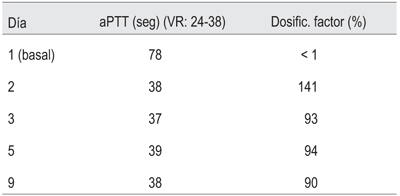
Se coordina cirugía para un lunes a primera hora con médico hemoterapeuta en block. Se realiza la indicación de un bolo inicial de FVIII de 50 UI/kg en el preoperatorio inmediato4. Seguidamente se inicia tratamiento sustitutivo en bomba de infusión continua (BIC) a dosis de 3 UI/kg/hr, con controles de aPTT y dosificación de FVIII reglado (figura 1). Bajo esta infusión se efectúa colecistectomía laparoscópica con colangiografía intraoperatoria (i/o) evidenciando dos litiasis a nivel del colédoco distal. Se realiza papiloplastia transcística sin incidentes evidenciando en colangiografía de salida colédoco sin litiasis, con buen pasaje al duodeno. Dosificación de FVIII IntraBIC 141% con un aPTT de 38 seg (24-38). Procedimiento quirúrgico sin complicaciones hemorrágicas ni de otra naturaleza (figura 2). En las primeras horas del posoperatorio se encuentra estable hemodinámicamente, sin sangrados y en apirexia. El dolor posoperatorio esperado fue manejado con ketoprofeno i/v no reglado, y rápidamente no solicitado por el paciente. Permaneció en BIC de FVIII, a igual dosis que la inicial, por 72 horas.
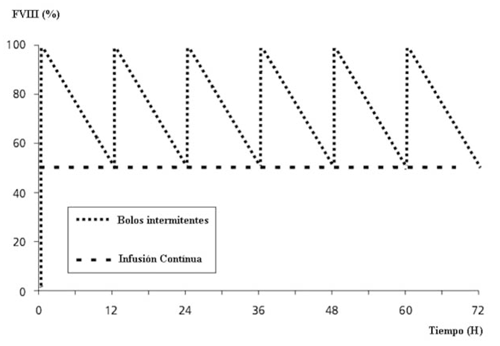
Figura 1: Gráficamente se muestran las diferencias teóricas entre la infusión continua y la inyección de bolos intermitentes. El área bajo la curva corresponde con la cantidad total de FVIII requerida. En la infusión continua es cerca de un tercio menos comparado con los bolos intermitentes.
Al tercer día del posoperatorio, permaneciendo con muy buena evolución clínica, y de alta desde el punto de vista quirúrgico, contando con aPTT 37 seg y FVIII 93% se desciende la dosis de FVIII en BIC a 2 UI/kg/hr.
Posteriormente, al séptimo día se implementa nuevo descenso de dosis de FVIII en bomba, a 1 UI/kg/hr, teniendo como control dosificación FVIII 94% y APTT 39 seg.
Tres días mas tarde contando con dosificación de FVIII 90% y APTT 38 seg, se suspende bomba de infusión continua y comienza con bolos de FVIII, 20 UI/kg/día (tabla 1) y (tabla 2).
El segundo día de tratamiento con FVIII en bolo se otorga alta a domicilio, llevándose dosis diarias para los días subsiguientes, preestableciendo un control en policlínica de hemoterapia a realizarse al 15º día del posoperatorio.
Globalmente el paciente presentó una evolución posoperatoria sin complicaciones, valorado en conjunto por clínica quirúrgica y departamento de medicina transfusional. Al alta se encontraba apirético, tolerando dieta, con tránsito digestivo y urinario conservados, y herida en buenas condiciones. Las indicaciones para el domicilio fueron dieta hepática, restricción de esfuerzo físico en los siguientes 20 días, lavados de heridas con solución jabonosa, analgésicos comunes vía oral si existe dolor, FVIII 20 UI/kg/día, debiendo consultar en el servicio de urgencia si apareciese fiebre, dolor abdominal, intolerancia digestiva o sangrados.
Al 15º día fue valorado en policlínica de hemoterapia; el paciente se encontraba asintomático, se realiza último día de tratamiento con FVIII, otorgándose alta médica definitiva.
Discusión
Como fue dicho, el trastorno hemorrágico en cuestión es de baja prevalencia en la población. En nuestro país hay cerca de 250 casos diagnosticados con hemofilia severa. Estos pacientes son pasibles de presentar patologías de resolución quirúrgica frecuentes como cualquier otro sujeto. La hemofilia no es una contraindicación para la intervención invasiva o quirúrgica, pero requiere del manejo por especialistas formados en esta patología y la corrección del factor de coagulación deficitario5. Las cirugías de pacientes hemofílicos exigen una mayor planificación y una acción interdisciplinaria direccionada por el médico hemoterapeuta.
Su manejo es seguro cuando se realiza un enfoque en equipo, como en el presente trabajo. La mejor forma de atender a un paciente con hemofilia que necesita cirugía es asistirlo en el centro de tratamiento integral de hemofilia o hacerlo en consulta con dicho centro. En este caso se realizó el procedimiento en el Hospital de Clínicas, centro de referencia del país para el manejo de hemofilia y otros desórdenes hemorrágicos de pacientes adultos.
La cirugía debe programarse para principios de la semana y al inicio del día a fin de contar con el apoyo adecuado de laboratorio y del banco de sangre, en caso de ser necesario. En el caso de nuestro paciente se realizó un día lunes a primera hora de la coordinación quirúrgica.
Es necesario contar con el laboratorio para poder llevar un control confiable con dosificaciones de factores de coagulación y hacer pruebas de inhibidores. Habiéndose establecido una correcta comunicación con el laboratorio correspondiente, pudo realizarse dosificaciones posbolo y bajo infusión continua en cada cambio de dosis de FVIII sin inconvenientes.
Se debe contar con la suficiente cantidad de concentrados de factor de coagulación para la cirugía y para mantener una cobertura adecuada en la etapa posoperatoria durante el tiempo que lleve la recuperación y rehabilitación. La dosis y duración de la cobertura del concentrado de factor de coagulación depende del tipo de cirugía y de sus potenciales complicaciones. Debe recordarse, además, que tanto para el FVIII y FIX existe una considerable variabilidad interindividual en la recuperación in vivo y la semivida terminal de los mismos entre los pacientes6.
La infusión continua de FVIII es una modalidad de tratamiento indicada para mantener un nivel constante del mismo, evitando los “picos y valles” de bolos intermitentes (figura 1). Es especialmente utilizada en contextos quirúrgicos y de hemorragias severas.
El dolor posoperatorio debe tratarse junto con el anestesiólogo. Inicialmente, y según la cirugía, puede administrarse morfina u otro analgésico narcótico por vía intravenosa y seguir con algún opioide como tramadol, codeína, entre otros, por vía oral. Cuando el dolor empieza a ceder, puede recurrirse al paracetamol, dipirona o meloxicam. Como todo paciente con coagulopatía se evitarán las inyecciones analgésicas intramusculares. En este contexto agudo pueden usarse antiinflamatorios no esteroideos (AINE). En este caso fue suficiente con algunas diluciones de ketoprofeno intravenoso a demanda. Hay poca evidencia publicada para guiar la evaluación y la gestión del dolor7.
Conclusiones
En este caso clínico se describió el abordaje perioperatorio interdisciplinario de un paciente con hemofilia A severa en el marco de una patología frecuente de la vía biliar, habiendo realizado un correcto manejo de la coagulación y logrando el objetivo por el cual fue propuesta la cirugía, la erradicación de su litiasis.
Según las guías para el tratamiento de la hemofilia de la FMH de 2012, en cuanto a la adecuación de la hemostasis en los procedimientos quirúrgicos, se pudo definir en este caso una respuesta excelente dado que la pérdida de sangre durante y después de la operación fue similar (menor a 10%) a la que tendría un paciente no hemofílico. No se requirieron dosis extra (no previstas) de FVIII y tampoco transfusiones de hemocomponentes en forma similar a lo que sucedería con un paciente no hemofílico en este contexto.