Introducción
El adecuado control del embarazo, el uso de terapia antirretroviral (TARV), la elección de la vía de nacimiento y la supresión de la lactancia materna son las estrategias más importantes para disminuir la transmisión materno infantil (TMI) del virus de inmunodeficiencia humana (VIH)1-7.
En el año 1994, Connor y colaboradores demostraron que la administración de zidovudina (AZT) a gestantes infectadas por el VIH asintomáticas durante el embarazo, parto y al recién nacido era capaz de reducir la TMI de 30% a 8% en niños no amamantados1.
En el año 2002 se logró reducir la transmisión a 1%-2% mediante la administración de tres o más antirretrovirales (ARV) a la mujer embarazada (tratamiento de alta eficacia, TAE)2-4.
Townsend y colaboradores en el año 2008 describieron una tasa global de TMI de 1,2%. Pero dentro de este grupo, la tasa era 0,1% en niños no amamantados, hijos de mujeres que recibieron TAE y cuya carga viral era indetectable al momento del parto8.
Posteriormente se demostró que el nacimiento del niño por cesárea coordinada solo disminuía la transmisión intraparto en las mujeres que llegaban a ese momento con una carga viral detectable (> 50 copias/ml)5-8).
Actualmente los objetivos principales de la TARV en la mujer embarazada son suprimir la carga viral materna para evitar la transmisión vertical (TV) y la aparición de resistencia a los ARV que limiten futuras intervenciones terapéuticas preservando la salud materna y del niño6,7,9.
La TMI es más frecuente en el momento del parto. La búsqueda del virus mediante reacción en cadena de la polimerasa (PCR) en las primeras 48 horas de nacido puede ser positiva cuando la infección se adquirió intraútero, pero es negativa cuando fue perinatal. En estos casos, el diagnóstico se realiza entre los 15 días y los 5 meses de vida7-9,11. Del total de partos asistidos o derivados al Centro Hospitalario Pereira Rossell (CHPR) entre los años 2009 y 2013, el 32,6% provenía de embarazos mal controlados o no controlados10.
De los nacimientos en el CHPR en ese mismo período, la infección materna por VIH presentó una tasa entre 7,2 y 9,2/1.000 nacidos10.
En Uruguay se ofrece la prueba de VIH a la mujer embarazada en la primera consulta y en el segundo y tercer trimestre del embarazo. En caso que la mujer conozca previamente su infección y esté en TARV con carga viral (CV) indetectable, el tratamiento se mantiene sin cambios; con CV detectable, se valora adherencia y se solicita test de resistencia y de ser necesario se cambia plan ARV sin esperar los resultados ajustándose posteriormente. Si la infección se diagnostica durante los controles, inicia el plan con AZT, lamivudina (3TC), lopinavir/ritonavir u otros, entre la semana 12 y 14 de gestación. De ser posible se utiliza un plan que contenga AZT. La vía de nacimiento dependerá de la CV materna al final del embarazo: si es indetectable se ofrece el parto a la mujer, si es detectable o desconocida se realiza cesárea. En todos los casos se administra una dosis carga de AZT intravenosa durante el trabajo de parto y luego dosis de mantenimiento hasta el clampeo del cordón umbilical. En algunos casos de diagnóstico tardío, puede asociarse una dosis de nevirapina dos horas o más previo al parto o cesárea. Luego de nacido el niño, se inhibe la lactancia y se administran fórmulas de sustitución para su alimentación6,7,9,17,18.
Las mujeres que llegan al momento del parto con una carga viral detectable o desconocida por mal control del embarazo tienen mayor riesgo de transmisión al recién nacido.
En Uruguay, la TMI alcanzó cifras de 2,9% en el año 201411.
El régimen seleccionado de profilaxis con ARV al neonato depende del riesgo teórico de transmisión vertical teniendo en cuenta la carga viral materna previa al parto6-8.
Gray y colaboradores en 2005 describieron que el riesgo de transmisión intraparto disminuye en mujeres sin tratamiento cuyos recién nacidos recibieron nevirapina en dosis única vía oral12.
Nielsen-Saines en el año 2012 demostró que la administración de zidovudina por seis semanas con tres dosis de nevirapina o la administración de zidovudina, lamivudina y nelfinavir por 15 días a recién nacidos, hijos de mujeres sin tratamiento antirretroviral en el embarazo o parto fue más eficaz que la zidovudina sola para reducir la transmisión intraparto del VIH al niño (2,2%, 2,4% y 4,8%, respectivamente, p = 0,046). Como los efectos adversos fueron más frecuentes con tres fármacos, la elección de zidovudina con nevirapina comenzó a utilizarse en los casos de mal control del embarazo13,16.
En Uruguay, la zidovudina con nevirapina comenzó a utilizarse en setiembre de 2012 como profilaxis de infección al recién nacido hijo de una mujer infectada que no controló su embarazo o que llegó al momento del parto con carga viral desconocida o mayor a 1000 copias/ml. Luego la recomendación se extendió a los hijos de mujeres con carga viral detectable (> 50 copias/ml). Al inicio, la disponibilidad de la nevirapina suspensión fue escasa y solo algunos niños en el CHPR pudieron recibirla. En los años 2013 y 2014 su uso se generalizó a todos los niños nacidos en maternidades públicas y privadas.
El tratamiento incluía AZT a 4 mg/kg vía oral cada 12 h durante 42 días en los niños ³ de 35 semanas de edad gestacional (< 35 semanas a 2 mg/kg cada 12 h) más tres dosis de NVP a 12 mg vía oral en los niños > 2 kg de peso (8 mg entre 1,5 - 2 kg) en los 7-8 primeros días de vida (primera dosis al nacer, segunda dosis a los dos días de la primera y la tercera dosis a los cuatro días de la segunda).
Si a pesar del tratamiento preventivo el niño se infecta, la resistencia que pueda aparecer a la nevirapina no influirá en el tratamiento, ya que el tratamiento de alta eficacia recomendado en esa etapa incluye inhibidores de la proteasa (IP) y no nevirapina como fármacos de primera línea7,17,18.
Es importante conocer los primeros resultados de la difusión del nuevo protocolo de tratamiento preventivo neonatal para los recién nacidos hijos de mujeres con mal control del embarazo y carga viral detectable o desconocida.
Los objetivos del siguiente trabajo fueron describir a partir del año 2012 en la maternidad del CHPR:
1. La TMI en niños y su relación con la carga viral materna.
2. Las características clínico-epidemiológicas más importantes de las mujeres infectadas.
3. El cumplimiento de la recomendación AZT-NVP para el recién nacido hijo de una mujer con carga viral detectable o desconocida y su beneficio en la TMI.
4. La aparición de resistencia a la nevirapina en caso de infección.
Material y método
Se realizó un estudio descriptivo, observacional, en el Centro de Referencia Obstétrico - Pediátrico VIH-SIDA del CHPR desde el 1° de setiembre de 2012 al 31 de diciembre de 2014.
Se incluyeron todos los recién nacidos de mujeres con carga viral detectable o desconocida (grupo 1) y carga viral indetectable (grupo 2) al momento del parto. En el primer grupo se registró si había recibido zidovudina con nevirapina o exclusivamente zidovudina. Se determinó la transmisión vertical en cada uno de ellos.
La fuente primaria de datos fue el registro de las historias clínicas obstétricas y pediátricas del centro. La extracción de datos se realizó manteniendo la confidencialidad de los mismos.
El estudio fue aprobado por el Comité de Ética del Hospital Pediátrico del CHPR.
Las variables estudiadas fueron maternas y del niño. De las primeras, edad, diagnóstico de infección por VIH previo al embarazo, tratamiento farmacológico utilizado previo al embarazo y durante el mismo, edad gestacional al inicio del tratamiento, realización y resultado de test de resistencia, CV previa al parto, uso de nevirapina como dosis única previa al parto, zidovudina intravenosa y vía de nacimiento. Del niño, amamantamiento, indicación de zidovudina más nevirapina o zidovudina en forma exclusiva, momento del diagnóstico en caso de infección y resultado de test de resistencia.
Se definió infección intraparto cuando el resultado de la PCR ADN proviral en las primeras 48 horas del nacimiento del recién nacido fue negativo y las siguientes del primer y/o cuarto mes positivas; infección intraútero, la primera PCR positiva en los primeros días de vida.
Se utilizaron medianas como medida de tendencia central y porcentajes con su respectivo intervalo de confianza del 95%. Se utilizó el test de chi cuadrado para comparar ambos grupos.
Resultados
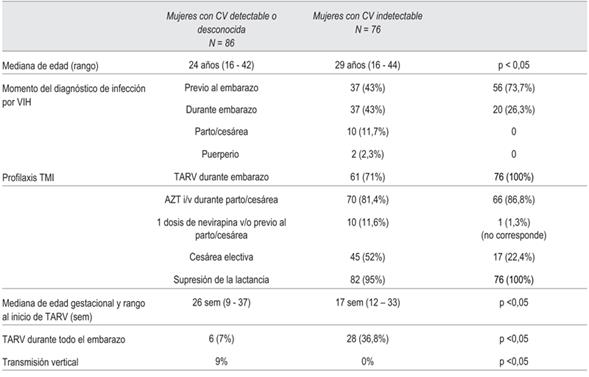
En el período de estudio, 162 mujeres infectadas con VIH tuvieron su parto o cesárea en el CHPR; 86 (53%) con carga viral detectable o desconocida y 76 (47%) con carga viral indetectable al momento del nacimiento. Las primeras tuvieron 88 hijos (dos embarazos gemelares) y las segundas, 76.
La TMI global en ese período fue de 4,9%. Al desglosarla por grupos, la TMI fue 9% (IC95%, 4-18%) (8 niños) en el grupo de mujeres con carga viral detectable o desconocida y 0 (IC 95%, 0-6%) en el grupo de mujeres con carga viral indetectable. De los ocho niños infectados, tres se infectaron en el año 2012, dos en 2013 y tres en 2014. En ese período se registró asociación entre la TMI y la CV materna (p <0,05).
La administración de AZT en el parto o cesárea y la supresión de la lactancia materna fueron similares en ambos grupos. Sin embargo, las mujeres con carga viral indetectable eran de mayor edad, conocían más el diagnóstico de infección previo al embarazo, recibieron TARV durante todo el embarazo y presentaron menor cesárea electiva (p <0,05). Los resultados se muestran en la (tabla 1).
De las 86 mujeres con carga viral detectable o desconocida, 37 (43%) conocían su infección previo al embarazo y 49 (57%) lo conocieron en el embarazo.
De las 49 mujeres, 37 se diagnosticaron durante la gestación, diez en el momento del parto o cesárea y dos se diagnosticaron en el puerperio.
La TARV recibida en el 70% fue AZT, 3TC y lopinavir/ritonavir.
En este grupo se realizó test de resistencia a seis mujeres: cinco no tuvieron mutaciones de resistencia y una, posible resistencia a un inhibidor de la proteasa. El valor de la carga viral previo al parto se obtuvo en 58 casos. El promedio de copias fue de 3.500 con un rango de 50 a 2.400.000.
De la 76 mujeres con carga viral indetectable, 56 (73,7%) conocían su infección previo al embarazo y 20 se diagnosticaron durante el mismo. De las que conocían previamente su diagnóstico (N: 56), 44 recibieron medicación en algún momento y 28 la recibían al momento de embarazarse. En ellas, la TARV recibida en el 81,6% de los casos fue AZT, 3TC y lopinavir/ritonavir.
Se realizó test de resistencia a siete de las 76 mujeres durante el embarazo, cinco no tuvieron mutaciones de resistencia, una tenía resistencia a algunos inhibidores no nucleosídicos y otra a algunos inhibidores nucleo sídicos y no nucleosídicos.
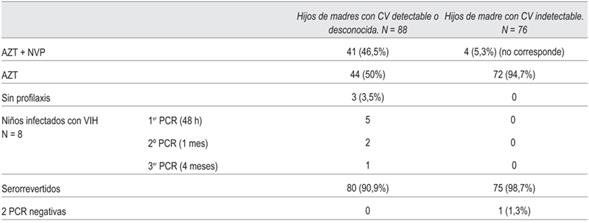
De los 88 recién nacidos cuyas madres desconocían la última CV o esta era detectable, 41 (46,5%) recibieron NVP-AZT cumpliendo con el protocolo. El resto solo AZT y en dos casos de diagnóstico luego del nacimiento, ningún tratamiento.
De los 88, la TMI fue intraútero en cinco casos. Eliminando estos casos de transmisión intraútero, de los 37 niños que recibieron AZT- NVP, ninguno se infectó y de los 46 que no recibieron este tratamiento, se infectaron tres. La quimioprofilaxis adecuada en este caso no se asoció con la infección del niño (p >0,05).
De los ocho niños infectados, cuatro nacieron por cesárea coordinada, uno por cesárea de urgencia y tres por parto vaginal. Los resultados se muestran en las (tabla 2) (tabla 3).
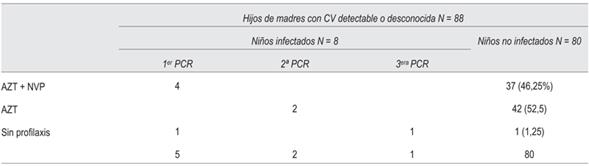
Tabla 3: Diagnóstico de infección y profilaxis recibida en hijos de madre con CV detectable o desconocida.
La utilización de la NVP a partir de su disponibilidad en Uruguay se muestra en la (figura 1).
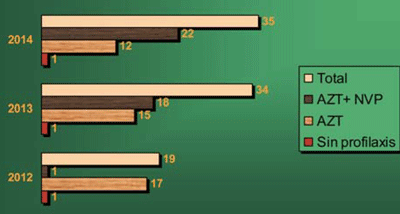
Figura 1: Profilaxis en el recién nacido por año. N = 88 (La disponibilidad de NVP en 2012 era exclusiva del CHPR).
De los ocho niños infectados, el test de resistencia no presentó mutaciones en seis casos, en uno posible resistencia a inhibidores no nucleosídicos y posible resistencia a algunos inhibidores de la proteasa (tipranavir/ritonavir) y en otro resistencia a inhibidores no nucleosídicos. En estos dos últimos casos la mujer no había recibido antirretrovirales previo al parto. Los resultados se muestran en la (tabla 4).
Discusión
En el año 2010, la Organización Panamericana de la Salud aprobó la Estrategia y plan de acción para la eliminación de la transmisión materno infantil del VIH y de la sífilis congénita. La meta es la reducción de la transmisión materno infantil del VIH a ? 2% y la incidencia de la transmisión a ? 0,3 caso por cada 1.000 nacidos vivos19.
Desde entonces, al igual que otros países, Uruguay tiene dentro de sus objetivos prioritarios la eliminación de la transmisión vertical del VIH y la sífilis congénita. Para cumplir con estos objetivos, el Ministerio de Salud priorizó la atención integral de la mujer embarazada con especial énfasis en la captación precoz del embarazo e implementó diferentes acciones complementarias y sinérgicas para el período 2010-201520-21.
Una de las acciones que comenzó en el año 2013 fue la auditoría nacional de VIH donde se analizan los diferentes factores que llevan a que un niño adquiera la infección. A partir de ella, se registró una prevalencia de infección en el embarazo de 0,26% y de TMI de 1,6% a nivel nacional en ese año y de 0,29 y 2,9, respectivamente, en 2014. Los dos casos de TV se vincularon a retardo en el diagnóstico y ausencia de intervenciones para su prevención en el subsector público11.
Las cifras globales de TMI halladas en este trabajo de 4,9% entre los años 2012 y 2014 en mujeres usuarias de la Administración de los Servicios de Salud del Estado está por encima de las cifras de los países donde la mujer controla su embarazo y de las cifras nacionales de TMI de 1,6% (2013) y 2,9% (2014). La mitad de las mujeres involucradas en este estudio no controlaron por alguna razón en forma adecuada su embarazo. Y son estas las que pueden tener niños infectados, como lo que ocurrió en este caso donde de 86 mujeres con mal control nacieron ocho niños infectados y de 76 mujeres con control adecuado y carga viral indetectable, todos los niños fueron sanos. Al observar las diferencias entre los dos grupos, es el conocimiento previo de la infección antes del embarazo y el tratamiento durante el mismo, al igual que ocurre en otros centros, los factores que se asociaron a mujeres con CV indetectable y niños sanos. En este caso, además, la mayor edad de las mujeres también se asoció a buen control del embarazo y niños sanos.
Con respecto al conocimiento previo de la infección, si bien se asocia generalmente a baja TMI, la relación no siempre existe, ya que otras condicionantes pueden influir en ese contexto. En nuestro caso, el 73,7% de las mujeres con CV indetectable conocía previamente su enfermedad, pero el 43% con enfermedad no controlada también la conocía.
En Brasil, donde la prevalencia de infección en la mujer embarazada es 0,38% superior a la nuestra, la utilización de HAART en el embarazo se incrementó en Río Grande del Sur (segundo lugar de mayor notificación de mujeres embarazadas infectadas de Brasil) a 73,3% entre los años 2005 y 2011 con cifras de TMI de 2,9%22. En un centro de referencia VIH - SIDA de Bahía, la TMI fue de 8,2% entre los años 2005 y 200823.
En el estado de Georgia, Estados Unidos, se identificaron 27 niños infectados por VIH por TMI entre los años 2005 y 2012; 20 mujeres conocían previamente su condiciónVIH24.
La TMI puede producirse in útero en un tercio de los casos, particularmente en el tercer trimestre. La infección progresiva de la placenta alcanza la circulación fetal aunque también se describen rupturas de la barrera placentaria seguidas de microtransfusiones de la madre al hijo25. Esta situación solo puede evitarse si la mujer planifica su embarazo o controla el mismo de manera precoz para obtener el diagnóstico de infección en caso que no lo supiera y el tratamiento correspondiente.
De los ocho niños infectados en el período, cinco fueron por transmisión intraútero, lo que muestra que más de la mitad de esos niños no se hubiesen beneficiado de las estrategias usadas en el momento del nacimiento para evitar la infección intraparto. Es en estas circunstancias donde el conocimiento previo de la infección puede evitar la TMI. El saber que se tiene la enfermedad lleva al tratamiento y este a la disminución de la TMI.
A partir del año 2014, se recomienda agregar raltegravir en el último mes del embarazo al TARV en las mujeres con diagnóstico tardío de infección y CV detectable o desconocida 26.
El 70% de la transmisión ocurre a nivel perinatal por el contacto del feto con las secreciones maternas infectadas cuando pasa por el canal de parto o por ascenso de la infección desde la vagina a las membranas fetales y líquido amniótico o por absorción por el tracto digestivo del neonato26. Es en este escenario donde el test rápido en caso de desconocimiento de la enfermedad, el AZT intravenoso, la utilización de AZT y nevirapina en el neonato que no amamanta serán la gran barrera para evitar la TMI. La infección en tres de los ocho niños infectados ocurrió en el período perinatal. Ninguno de los tres recibió la profilaxis neonatal con AZT y nevirapina: dos solo AZT y uno ninguna profilaxis debido a que el diagnóstico materno se hizo a los 13 días del parto (cuando se recibe el resultado solicitado en el tercer trimestre del embarazo y no se había realizado test rápido). En un país donde la atención y el tratamiento de la infección por VIH son gratuitos es difícil aceptar que no se utilice en forma adecuada el tratamiento neonatal, último pilar que se pone en marcha para evitar la TMI. Los resultados hubieran podido ser peores, ya que el 53% de los niños, hijos de mujeres con CV desconocida o detectable, tampoco recibieron la pauta que correspondía a ese escenario. En el período estudiado la infección del niño adquirida en el período perinatal no se asoció al tratamiento incompleto neonatal. Seguramente un mayor aumento del número de casos hubiera podido mostrar esta aso ciación.
En Buenos Aires, Argentina, la prevalencia de infección vertical entre los años 2003 y 2008 fue de 6,3% y los factores asociados fueron la ausencia de profilaxis prenatal, el diagnóstico tardío de infección, el bajo nivel de instrucción materno y el parto vaginal. Sin embargo, en ese mismo período, en un hospital público de complejidad terciaria de esa ciudad (Hospital Dr. Cosme Argerich), la TMI fue de 0,6% (1 de 164 niños). Los resultados son totalmente diferentes en una misma ciudad. En ese caso, todas las mujeres y neonatos recibieron tratamiento preventivo y el 82,9% de las mujeres presentaban carga viral < 1000 cp/ml, por lo que no alcanza con tener todas las herramientas disponibles, sino que se debe trabajar para aplicarlas y en caso de situaciones de vulnerabilidad social, el equipo de salud como equipo de trabajo interdisciplinario debe ser más eficiente en la captación y seguimiento de las mujeres y niños apoyado por las redes sociales existentes. En ese centro el equipo de salud interdisciplinario facilita la derivación a cada especialista, el seguimiento adecuado de la gestación minimizando las pérdidas en el seguimiento, agilizando los trámites burocráticos inherentes a la prescripción del tratamiento ARV y a la realización de estudios específicos27. El equipo de salud logró ese resultado con mucho esfuerzo.
En Uruguay también existe un equipo de salud comprometido que ha logrado llegar a cifras bajas de TMI, pero no son las deseadas como meta a alcanzar, inferiores a 2%. Siguen existiendo mujeres que no controlan o controlan poco su embarazo y existen además fallas en el equipo de salud que no utiliza todos los recursos disponibles en el neonato para evitar su infección. La utilización de AZT-nevirapina en el niño no amamantado desde las primeras horas de vida es un método utilizado por la mayoría de países que no logran descender la TMI a cifras menores de 2%. Es el último recurso del personal de salud, por lo que todas las maternidades deberían monitorear la presencia de estos fármacos en el lugar donde nacen los niños. Además se debe mejorar la estrategia en el terreno, mejorando la captación de mujeres embarazadas sin controles o que abandonan su segui miento.
Por último, de los ocho niños infectados, uno presentó posible resistencia y otro resistencia a nevirapina. En un caso la mujer había recibido la medicación previo al parto y en el otro caso el niño, causas probables de la aparición de resistencia. La nevirapina se caracteriza por una absorción y distribución rápida seguida de una vida media de eliminación lenta. Una sola dosis oral de 200 mg administrada a la mujer durante el trabajo de parto y una sola dosis administrada al recién nacido a las 48-72 horas después del nacimiento mantiene concentraciones en plasma por encima de 100 microg/L a lo largo de la primera semana de vida. Esta concentración es diez veces mayor que la dosis in vitro necesaria para alcanzar el 50% de la concentración inhibidora (IC 50) contra el VIH de tipo silvestre-1. A esta ventaja farmacocinética se contrapone una baja barrera genética, en donde el virus con una única mutación se vuelve resistente en forma rápida a este fármaco en presencia de supresión viral incompleta. Este efecto aparece cuando se utiliza por un tiempo corto, como sucede en la profilaxis 28,29. Para limitar el efecto, se utiliza poco este fármaco en la mujer embarazada previo al parto. Sin embargo, en el recién nacido la situación es diferente, ya que puede evitar la TMI y en caso de infección no figura dentro de los fármacos de primera línea para el tratamiento anti rretroviral en este grupo etario.
Conclusiones
La TMI en los años 2012 a 2014 en usuarias del CHPR fue de 4,2% y la infección de los niños se asoció con la CV materna (9% en mujeres con CV desconocida o detectable y 0% en mujeres indetectables). Se registraron ocho niños infectados a predominio de transmisión intraútero. La mayor edad de la mujer, el conocimiento previo al embarazo de la infección y su tratamiento precoz se asociaron con CV indetectable en la mujer. El protocolo AZT-NVP, última herramienta para disminuir la TMI, no está siendo utilizado en la mitad de los casos por el personal de salud. En este grupo de niños, no se encontró asociación entre infección perinatal y tratamiento incompleto neonatal. De los dos niños con resistencia a los inhibidores no nucleosídicos, una mujer recibió nevirapina en el momento del parto y, en el otro caso, el recién nacido la recibió junto al AZT, causas probables de la aparición de la resistencia.
El conocimiento de la infección, su tratamiento y la CV materna son los responsables más importantes en la TMI. La utilización de ARV durante el embarazo para lograr mujeres con CV indetectable es el objetivo sobre el que debemos seguir trabajando al igual que el cumplimiento de la profilaxis neonatal completa para lograr la eliminación de la TMI del VIH.