Introducción
Las personas con infección por el virus de inmunodeficiencia humana (VIH) se han convertido en portadoras de una enfermedad crónica cuando acceden y se mantienen en tratamiento antirretroviral (TARV), el cual también disminuye la morbilidad a través de la reducción en la incidencia de infecciones oportunistas1. En el marco de este nuevo paradigma de enfermedad crónica, evaluar la calidad de vida relacionada a la salud (CVRS) (Health Related Quality Of Life, HRQOL) se ha transformado en motivo de investigación de interés creciente.
Varias escalas que miden CVRS, explorando diferentes dimensiones, han sido validadas en diversos idiomas y utilizadas en investigaciones en personas con VIH, tanto genéricas como específicas. Las escalas específicas de VIH/Sida, WHO Quality of Life-HIV (WHOQOL-HIV) de la Organización Mundial de la Salud y Medical Outcomes Study-HIV (MOS-HIV) están entre las más utilizadas2.
Son numerosos los estudios que han evaluado CVRS en personas con VIH y factores sociodemográficos, culturales y clínicos con resultados diversos.
Se describe menor score de CVRS asociado a menor nivel de escolaridad3-9, depresión/ansiedad3,6,9-16, preocupación financiera, falta de soporte económico o social6,9,10,11,17-22, presencia de síntomas14,21-23, estigma o preocupación por la confidencialidad12,17,23,24, consumo de drogas y alcohol4,5, comorbilidades4,5,25, bajo nivel de confianza o pobre relacionamiento con el staff médico y menor accesibilidad al sistema de salud11,17,25.
En cuanto al género, predominantemente los estudios encuentran peor CVRS entre mujeres en los resultados globales o en algunos dominios de las escalas utilizadas5-8,10,11,14-16,18,22-29. Mientras que el impacto de la orientación sexual, específicamente hombres que tienen sexo con hombres (HSH), se muestra con resultados variables probablemente por influencia de los diferentes contextos culturales5,30,31. Con respecto a la edad, la mayoría reporta peor puntuación de CVRS entre personas mayores a 50 años6,13,32.
El recuento de CD4, parámetro que mide la inmunodepresión y la carga viral (CV) asociada a riesgo de progresión y a la respuesta al TARV, han sido evaluados con resultados variables respecto a su asociación con la percepción de CVRS. El espectro va desde peor score en CVRS en personas con bajo recuento de CD46,22,26,33 y mayor score entre aquellos con mejor inmunidad4,31, hasta aquellos que no encuentran asociación5,10,11,19,22,34. Son escasas las evidencias que muestran asociación de la CV indetectable con mejoría34 o peoría5 con el score de CVRS. Por el contrario, una amplia mayoría no establece asociación alguna10,11,13,15,23.
Los hallazgos respecto al uso de TARV también difieren. Se ha observado mejoría en CVRS en pacientes recibiendo TARV, especialmente cuando reciben su primer régimen3,4,10,14,27,31,33. En contraposición, se ha descrito peor CVRS en relación con efectos adversos y toxicidades vinculadas al TARV, como modificaciones corporales y lipodistrofia3,6,9,21. Los estudios longitudinales que evalúan calidad de vida basal (al inicio del TARV) y en diferentes puntos del seguimiento reportan mejoría en los scores, especialmente entre pacientes sintomáticos, mientras que este efecto se pierde cuando aumenta el tiempo de seguimiento20,28,32,35,36.
La adherencia es determinante de la efectividad del TARV y, como consecuencia, del curso clínico del VIH. Un aspecto crucial para obtener los máximos beneficios del TARV es la adherencia óptima. Si bien de lo anterior surge que es posible plantear que un buen nivel de adherencia puede influir en la percepción de la CVRS, son escasos los estudios que exploran esta relación con resultados poco concluyentes. Mientras que algunos reportan asociación entre adherencia adecuada al TARV y mejoría en la CVRS12,33,35, otros autores no han verificado este hallazgo7,37.
En nuestro país se dispone de TARV desde los primeros años de la epidemia y existe extensa experiencia clínica. Un estudio realizado en una institución del subsector privado evaluó la CVRS y su relación con factores sociodemográficos, biológicos y psicológicos a través de la aplicación de la encuesta FAHI (Functional assessment of HIV infection). Como principales resultados destacan la influencia de factores económicos en la CVRS, el impacto de la presencia de sintomatología más que de los parámetros biológicos, y una relación entre TARV y mejor bienestar funcional, aunque las mujeres presentaron una peor percepción del bienestar físico. El cuestionario utilizado de evaluación de CVRS presentó una adecuada consistencia interna y validez18).
No se encuentran estudios publicados a nivel nacional que evalúen la relación entre adherencia al TARV y CVRS, mientras que, como fue analizado, los estudios internacionales que evalúan específicamente esta asociación son escasos y sus resultados contradictorios.
Con el objetivo de evaluar CVRS en personas con VIH y variables sociodemográficas y clínicas asociados, con énfasis en la adherencia al TARV, se realizó un estudio exploratorio en una muestra no probabilística de personas con VIH recibiendo TARV en el subsector público en Montevideo, en el período julio de 2011 a agosto de 2014.
Material y método
Se realizó un estudio cuantitativo exploratorio de corte transversal y analítico en el período julio de 2011 a agosto de 2014 en el servicio de consulta ambulatoria de la Cátedra de Enfermedades Infecciosas y en el Servicio de Enfermedades Infecto-Contagiosas (SEIC, ASSE).
Los criterios de inclusión fueron: paciente con VIH, mayor de 18 años de edad, recibiendo TARV al menos en los tres meses previos.
Instrumentos
Se utilizaron como instrumentos una encuesta de datos clínicos, el cuestionario de calidad de vida MOS-HIV SF30 y el cuestionario de adherencia SMAQ (Simplified Medication Adherence Questionnaire) aplicado en sus dos modalidades (completo y abreviado).
Encuesta
Se relevaron a través de la encuesta realizada: variables sociodemográficas (edad, sexo biológico, nivel socioeconómico a través del Índice de nivel socioeconómico versión 2004*, nivel educativo) y variables clínicas (año de diagnóstico de VIH, CD4 y CV últimos, régimen de TARV autorreferido). A través de un cuestionario autoadministrado se relevó: probable vía de adquisición del VIH, consumo de drogas ilícitas y alcohol, orientación sexual, identidad de género, relaciones sexuales, uso de preservativos.
Encuesta de CVRS
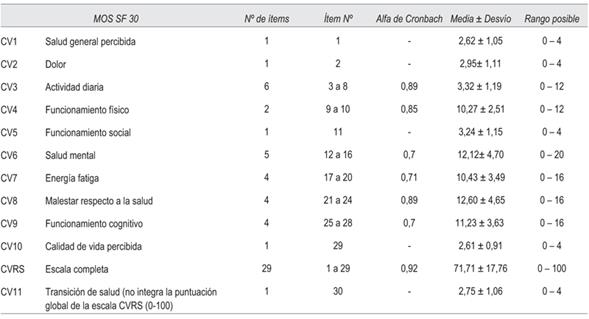
Se utilizó el cuestionario MOS-HIV SF30, versión en español, que consta de 30 preguntas en 11 dimensiones: salud general percibida, dolor, función física, función de rol, función social, salud mental, energía, problemas de salud, función cognitiva, calidad de vida y salud transitoria. Esta última no integra la puntuación global de la escala CVRS (0-100). El MOS-HIV fue validado en español en una versión que consta de 35 ítems38 y la versión corta, MOS-HIV SF30, ha sido validado en español por Remor E39.
Cuestionario de adherencia
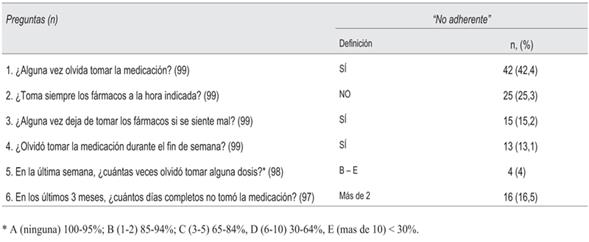
El cuestionario SMAQ es la herramienta en idioma español más ampliamente utilizada40. Consta de seis preguntas (tabla 3). Existen dos modalidades de aplicación, el cuestionario completo y el cuestionario abreviado (utilizando solamente la pregunta 5). En la versión completa del SMAQ se considera paciente no adherente cuando la respuesta a las preguntas 1, 3 y 4 es Sí; a la pregunta 2 es No; a la pregunta 5 es B, C, D o E, a la pregunta 6 es más de dos días. Cualquier respuesta en el sentido de no adherente se define como no adherente.
En la aplicación del SMAQ abreviado la pregunta 5 se puede usar como semicuantitativa (porcentaje de cumplimiento terapéutico); número de veces que olvidó tomar la medicación en la última semana: A (ninguna) 100%-95%; B (1-2) 85%-94%; C (3-5) 65%-84%, D (6-10) 30%-64%, E (más de 10) < 30%. Considera paciente adherente a aquel que tiene un cumplimiento terapéutico igual o superior a 95%.
Implementación
En la fase inicial (julio 2011 - julio 2012) se realizó la adaptación cultural al español de uso en nuestro país del cuestionario MOS-HIV SF30, la evaluación de su aplicación, selección y capacitación de encuestadores. Se contactó al autor obteniendo la autorización para realizar la adaptación del cuestionario cambiando algunos términos y expresiones a los de uso local, considerando la equivalencia semántica, idiomática y conceptual41.
Esta versión adaptada se probó en diez encuestados (cinco investigadores y cinco representantes de organizaciones de la sociedad civil), se midió el tiempo que insumió el cuestionario (en promedio 6 minutos), y se realizó una valoración cognitiva respecto a los sectores del cuestionario. La versión tiene diferencias en palabras y frases con el cuestionario adaptado en España por Remor E, lo que se muestra en el (Anexo). (Comparación de la encuesta original de CVRS con la utilizada en el estudio).
En una segunda fase se desarrolló el trabajo de campo (agosto 2012 - agosto 2014). Para esta fase se seleccionó una muestra de 100 pacientes utilizando un diseño aleatorio simple a partir de la base de datos disponible en la farmacia del Servicio. A inicios de 2012 se encontraban registrados 1.700 pacientes en TARV. El “n” de 100 elegido responde a la recomendación de Morales Vallejos P42.
A los seis meses solo se había alcanzado a 23 de las 100 personas sorteadas para la muestra debido a los repetidos cambios constatados en los datos de contacto. En este punto se cambió la estrategia realizándose la captación de individuos en la sala de espera del Servicio, implementando un muestreo no probabilístico. Al abordaje del individuo se le ofrecía participar en el estudio, contando con un consultorio que asegurara un ambiente de privacidad y tranquilidad, donde se le brindaba la información y luego de la obtención del consentimiento se procedía a la aplicación de los cuestionarios. De esta manera se llegó a una muestra de 101 pacientes, con nueve pacientes que rechazaron realizar la encuesta (tasa de rechazo < 10%). Se mantuvo la confidencialidad utilizando como identificación las iniciales del primer y segundo nombre, primer y segundo apellido, y el dígito verificador de la cédula de identidad.
Todos los datos fueron obtenidos de las encuestas, excepto resultados de CD4 y CV que fueron aportados por el médico tratante.
Aspectos éticos: el proyecto se realizó respetando las normas de Helsinki para la investigación con seres humanos. El protocolo de investigación fue aprobado por el Comité de Ética de la Investigación de la Facultad de Medicina de la Universidad de la República.
Análisis estadístico
El ingreso de los datos recogidos en el formulario se realizó en el software EpiData 3.1. Para el análisis de los datos se utilizó el programa estadístico RStudio*.
Inicialmente se realizó un análisis descriptivo de la muestra, análisis de frecuencias y porcentajes para las variables cuantitativas, y para estas se testeó la normalidad a través de gráficos y del test de Kolmogorov-Smirnov. Cuando no se rechazaba la hipótesis de normalidad la variable se expresaba en términos de media más menos un desvío estándar (DE), de lo contrario con la mediana más menos el recorrido intercuartílico (IIQ), máximo y mínimo (Mn-MX). Se realizó test de comparación de medias de la puntuación global de la escala MOS-HIV así como de sus subdimensiones, cuando no se rechazaba la hipótesis de normalidad se aplicó test de t o ANOVA, de lo contrario se utilizaron sus equivalentes no paramétricos. Para testear independencia entre variables cualitativas se utilizó test de independencia de chi cuadrado. En todos los casos se consideró un nivel de significación de 5%.
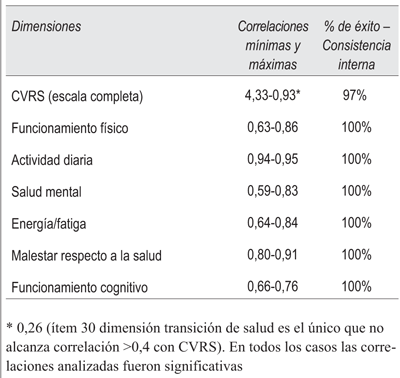
Como parte del proceso de evaluación psicométrica de la escala se valoró la reproductibilidad de la misma; a tales efectos se evaluó la fiabilidad mediante el coeficiente alfa de Cronbach, se consideró como satisfactorio cuando su valor fue igual o superior a 0,7. Para evaluar la consistencia interna, esto es el grado de correlación y coherencia que existe entre los ítems, se utilizó el coeficiente de correlación de Pearson43. Posteriormente se evaluó el porcentaje de éxito para cada dominio a partir de la siguiente fórmula:
% de éxito - consistencia interna = (Número de correlación ítem - dimensión a la que pertenece > 0,4) / (Número de correlación ítem - dimensión a la que pertenece)* 100
Analizando las correlaciones que existen entre los ítems de un instrumento y el puntaje global o entre los ítems que conforman cada dimensión se evaluó la homogeneidad entre ellos, lo cual indica que los ítems de cada dimensión miden el concepto que pretenden calibrar.
Además, para medir el poder discriminante del instrumento se testeó la diferencia de medias entre grupos en variables sociodemográficas y biológicas, especialmente adherencia y carga viral.
Resultados
Características de la población estudiada
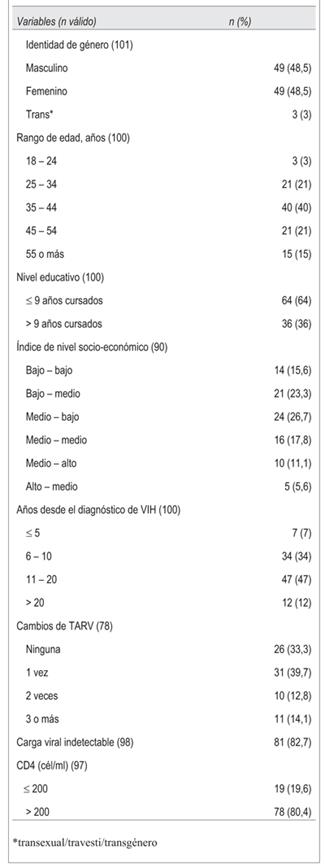
Las características generales se muestran en la (tabla 1).
La edad media y DE fue de 42,3 ± 10,8 años, con 61% en el rango de 25 a 44 años. La distribución por nivel socioeconómico muestra que 65,6% de la muestra estudiada se encontraba en un estrato bajo (bajo-bajo, bajo-medio, medio-bajo).
El 58% de la muestra tenía más de diez años de diagnóstico de VIH, con una media y DE 9,1 ± 6,6 años. De los que respondieron la pregunta acerca de cambio de TARV, 66,7% refería al menos una modificación del plan de tratamiento.
La mediana de comprimidos tomados por paciente fue de 6 (IIQ: 4 - 8; Mn-Mx: 2 - 22). No se discriminó entre antirretrovirales y otros tipo de medicamentos.
De 98 personas de las cuales se disponía del resultado de CV en los últimos seis meses, en 81 (82,6%) fue indetectable (límite de detección de la técnica 50 copias/ml). En cuanto al nivel de CD4, disponible en 97 personas, la mediana fue de 360 cél/ml (IIQ: 218,25 - 750; Mn-Mx: 56 - 2000).
Respecto al cuestionario autoadministrado los resultados que caracterizan a la muestra se presentan en la (tabla 2).
La autoidentificación respecto a la orientación sexual fue respondida por 98 personas, de las cuales 48 (64,6%) se definieron como heterosexuales. Dentro de los varones, 35,4% se identificó como gay/homo sexual/bisexual.
De 46 personas que declararon haber consumido drogas alguna vez en su vida, 15 mantenían consumo actual, y ocho lo hacían al menos 1-2 veces por semana.
De 101 encuestados, 76 manifestaron haber tenido relaciones sexuales en el último año; 53 de ellos (70%) manifestaron tener una única pareja sexual.
El cuestionario no incluyó preguntas respecto a la ocupación del encuestado, pero indagó acerca de si el encuestado era jefe de familia y su ocupación. De 99 personas que respondieron, 71 eran jefes de familia (72%). En cuanto a su actividad, 24 (34,3%) eran pensionistas, 20 (28,6%) trabajaban en changas o trabajos no especializados, 17 (24,3%) trabajaban por cuenta propia y 9 (12,8%) otras actividades.
Adherencia
En la (tabla 3) se muestran los resultados del cuestionario de adherencia SMAQ.
En la aplicación del cuestionario SMAQ completo se observó que 68 pacientes (68,7%) respondieron al menos una de las preguntas como “no adherente”, es decir, solo uno de cada tres era “adherente”. Evaluando las respuestas solo a la pregunta 5 (SMAQ abreviado) se observó que 83,7% se categorizaba como adherente (95% o más de dosis cumplidas).
De los 82 pacientes con CV indetectable se contó con información de adherencia en 79; 22 de ellos (27,8%) fueron adherentes aplicando el SMAQ completo, mientras que aplicando solo la pregunta 5 esta proporción fue de 83,3% (n = 66). No hubo asociación estadísticamente significativa.
Evaluación psicométrica de la escala MOS-HIV SF30
La escala MOS-HIV SF30 mostró una consistencia interna adecuada globalmente y en todas sus dimensiones cuando se aplicó el test alfa de Cronbach. Los resultados de evaluación de consistencia interna y de fiabilidad de la encuesta de CVRS se muestran en las (tabla 4 y tabla 5).
Calidad de vida relacionada a la salud
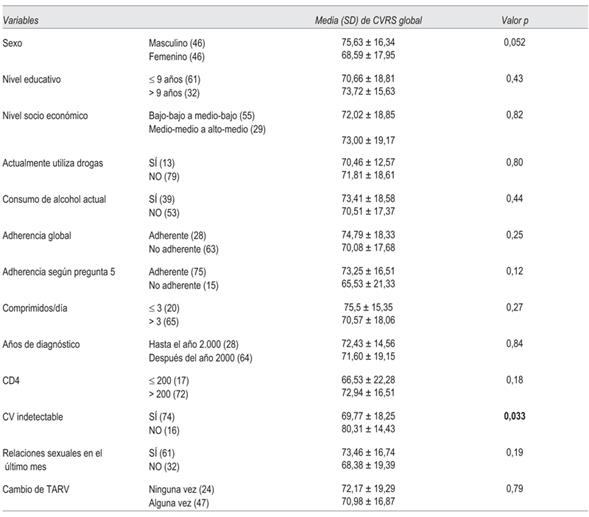
El resultado global de CVRS con la aplicación de la escala MOS-HIV SF30 fue de 71,71 ± 17,76. En la (tabla 6) se muestran los resultados de la aplicación de la escala según diferentes variables.
Se observó una peor puntuación de CVRS entre personas con CV indetectable, siendo esta diferencia estadísticamente significativa (p = 0,003). Se constató peor score de CVRS no significativo en mujeres respecto a los varones (p = 0,052). Globalmente se observó mejor CVRS, aunque sin significación estadística, entre varones, personas con nivel educativo mayor a nueve años, pacientes adherentes, pacientes recibiendo tres o menos comprimidos diarios, con mejor inmunidad (CD4 > 200 cel/mL), que mantuvieron relaciones sexuales en el último mes, y entre varones que definieron su orien tación sexual como gay o bisexual.
Respecto de la correlación entre edad y CVRS global fue de -0,075, valor p = 0,48. A medida que aumenta la edad tiende a disminuir la CVRS global percibida, pero esta correlación no es significativa.
En la (tabla 7) se muestran los resultados de las dimensiones que valora la escala de CVRS donde se encontró significación estadística en relación con diferentes variables.

Tabla 7: Dimensiones de CVRS con significación estadística y variables sexuales, adherencia y respuesta terapéutica.
En cuatro dimensiones el score de CVRS fue significativamente peor entre mujeres respecto a varones: dolor (p = 0,034), funcionamiento físico (p = 0,006), funcionamiento social (p = 0,031) y salud mental (p = 0,040).
Las personas con CV indetectable tuvieron peor score en tres dimensiones, además del score global: funcionamiento físico (p = 0,016), energía/fatiga (p = 0,008) y calidad de vida percibida (p = 0,025).
La orientación sexual gay/bisexual se asoció a un mejor score estadísticamente significativo en dos dimensiones de la escala: dolor (p = 0,025) y actividad diaria (p = 0,028). El haber mantenido relaciones sexuales en el último mes se asoció a una mejor puntuación en la dimensión de salud general percibida (p = 0,011).
Una mejor adherencia medida por SMAQ global y por cumplimiento terapéutico (pregunta 5) se relacionó a una mejor CVRS, siendo esta diferencia no significativa en la evaluación global. En dos de las dimensiones la CVRS se asoció a adherencia evaluada por la pregunta 5 (SMAQ abreviado), con mejor score en salud general percibida (p = 0,027) y funcionamiento social (p = 0,030).
No se encontró impacto significativo en las siguientes dimensiones de CVRS: malestar respecto a la salud, funcionamiento cognitivo ni transición de salud (por lo que estos resultados no se muestran en la (tabla 7).
Discusión
Los principales resultados de nuestro estudio fueron:
1) la escala de calidad de vida MOS-HIV SF30 en la muestra estudiada presentó buena fiabilidad y consistencia interna;
2) el score de CVRS en personas con VIH fue bueno, aunque se encontraron diferencias significativas en la escala global entre pacientes con CV indetectable y en algunos dominios específicos según género, carga viral, adherencia y prácticas sexuales;
3) no se verificó un impacto significativo de la adherencia en el score global de CVRS, aunque sí se constató en algunos dominios.
Características de la población estudiada
El estudio incluyó a personas con VIH del subsector público, por lo que el perfil social presumiblemente sea similar al de la población usuaria de este subsector.
La distribución etaria sitúa a la mayoría de la muestra en un rango de adulto o adulto joven, con solo 15% por encima de 55 años, característico de esta patología. La media de edad al momento del estudio era de 42,3 ± 10,8 años con un tiempo promedio de diagnóstico de nueve años. Esto es consistente con la media de diagnóstico en el período 2005-2009, situada en 34 años, momento en que la mayoría de las personas incluidas en el estudio presumiblemente adquirió la infección44.
El número de comprimidos tomados por día fue elevado en la mitad de la población (considerando TARV y otros fármacos), con una mediana de seis comprimidos. Más de 66% presentó al menos un cambio de esquema, lo que pudo contribuir a una mayor complejidad del régimen de TARV. La proporción de pacientes con CV indetectable fue elevada, casi 83%, lo que es indicativo de una muestra con buen nivel de seguimiento y retención en el sistema de salud, así como de la eficacia del TARV disponible.
La vía de adquisición del VIH fue sexual en 82%, mayor a la encontrada en el período 1983 - 2009, que correspondió a 65%44. En el presente estudio, 35,4% de los varones se autoidentificaron como HSH, mayor a lo reportado por vigilancia epidemiológica en el período, hallazgo explicable por la aplicación de una encuesta autoadministrada y anónima. El 85,3% refirió uso de preservativo en la última relación sexual, proporción más elevada respecto a la población general (67,6% en aquellos con más de una pareja sexual en el último año), HSH (68,0%), trabajadores/as sexuales (76,4%), mujeres trans (78,0%)45.
Es de destacar que la población estudiada presenta, por sus características, varias vulnerabilidades socioeconómicas y, sin embargo, tiene buenos indicadores respecto del VIH: elevada proporción con CV indetectable, aceptable nivel de inmunidad, mayoritariamente adherentes y con alto nivel de auto y mutuo cuidados en las relaciones sexuales. Más allá de la responsabilidad individual manifiesta en estos buenos resultados es preciso destacar la característica común de esta población, su vinculación continua con el sistema de salud, es decir, la etapa de retención en un enfoque continuo de atención.
Evaluación psicométrica de la escala MOS-HIV SF30
De acuerdo a los resultados obtenidos en términos de fiabilidad y consistencia interna se puede afirmar que la escala MOS-HIV SF30 es un instrumento útil desde el punto de vista estadístico para medir CVRS en personas con VIH, coincidiendo con lo reportado previamente por Remor E. Este resultado se verifica tanto en la aplicación de la escala global como en sus dimensiones.
Calidad de vida relacionada a la salud
Aún sin disponer de puntos de cortes establecidos para calificar diferentes niveles de CVRS, podríamos afirmar que el nivel promedio observado en este estudio (71,71/100) representa un score bueno o satisfactorio de CVRS.
La CV indetectable fue la única variable asociada de manera significativa a peor score global de CVRS. Esta diferencia se observó en tres dominios: funcionamiento físico, energía/fatiga y calidad de vida percibida.
La CV indetectable es resultado del TARV y la adherencia al mismo, lo que contribuye a la recuperación inmune y mantenimiento del paciente libre de síntomas. Esto debería impactar de manera positiva en la CVRS, sin embargo, los estudios que evalúan dicha relación muestran resultados disímiles. Se ha observado mejor score de CVRS en estudios transversales en pacientes que inician TARV y en estudios longitudinales con seguimiento máximo de 12 meses3,10,14,36. En oposición, otros estudios con mayor tiempo de seguimiento encuentran menor puntuación de CVRS cuanto mayor es el tiempo de exposición al TARV21. Las diferencias en el tiempo se han atribuido a la mejoría inicial que suelen tener los pacientes cuando inician TARV, especialmente si son sintomáticos, y la posterior peoría explicada por fatiga y mayor sensibilidad a los efectos adversos, así como a comorbilidades relacionadas.
Algunas hipótesis para explicar el resultado de peor score de CVRS asociado a CV indetectable son: la complejidad en los regímenes en pacientes que mayoritariamente han recibido más de un esquema (66,7% en segundo esquema o mayor), posibles efectos adversos o toxicidades no evaluados en el presente estudio, sumado a la exigencia de una rutina sistemática de toma de medicación para personas que en promedio llevan nueve años de detectadas. Asimismo, las situaciones de estigma y discriminación y su impacto en la vida cotidiana de las personas con VIH no están contempladas en la escala ni son relevadas en el estudio como una variable contex tual clave.
Un aspecto relevante encontrado es el impacto del género en la CVRS. El score global de CVRS fue peor entre mujeres respecto a varones, constatándose diferencias significativas en las siguientes dimensiones: dolor, funcionamiento físico, funcionamiento social y salud mental. Hallazgos similares han sido reportados en varios estudios internacionales6,8,10,14,23. Otros dominios específicos han sido descritos más afectados entre mujeres: psicológico, bienestar físico, de espiritualidad, preocupación por la salud, preocupación por la divulgación y relacionamiento sexual16,18,23,24. Varios estudios encuentran que el ser mujer es un factor asociado independiente a peor score de CVRS6,8,10,11,14,15,24. Un mayor impacto del estigma, la salud mental (especialmente depresión) y la falta de soporte social entre mujeres respecto a los varones son factores que explicarían el impacto negativo del género en las puntuaciones de calidad de vida12,22,24. Estas desigualdades nos alertan acerca de la necesidad de incorporar de manera sistemática la perspectiva de género en la práctica clínica, en los dispositivos psicosociales de apoyo y en las políticas de respuesta al VIH.
Otro resultado a destacar es el mejor score de CVRS en varones autoidentificados como gays o bisexuales en dos dominios: dolor y actividad diaria. Algunos estudios encuentran mejor CVRS entre HSH en los scores medios de salud mental y salud física o en algunos dominios específicos17,23,31. Mientras que otros trabajos no encuentran diferencias por orientación sexual11. Pocos estudios evalúan el impacto de la orientación sexual en la CVRS de personas con VIH, a pesar de identificarse a HSH (gay/bisexuales) como una de las poblaciones vulnerables ante la infección con mayor prevalencia de VIH (9% y 9,7% en 2008 y 2013 en Uruguay)46. Siendo esta una población que sufre variados grados de estigma y discriminación, analizar la CVRS con un enfoque de género y diversidad sexual es de importancia para comprender el impacto complejo y multidimensional del VIH en la vida de estas personas.
En la presente investigación se consideró específicamente la actividad sexual en la encuesta autoadministrada y se evaluó su impacto en CVRS. En la dimensión salud general percibida se encontró un mejor score, estadísticamente significativo, en las personas que mantuvieron relaciones sexuales en el último mes. Estudios realizados en contextos disímiles coinciden en el impacto de la actividad sexual en la percepción de la CVRS22,23. Considerando que el VIH es una infección de transmisión sexual es llamativo que la mayoría de las investigaciones no evalúen el impacto de la actividad sexual en la CVRS, y la mayoría de las escalas, como MOS-HIV SF30, tampoco incluyen esta dimensión para evaluar su afectación por el VIH.
Es preciso aclarar que la comparación de los resultados se realiza con estudios que utilizan diversas escala de CVRS.
Calidad de vida y adherencia
Si bien no hubo un impacto significativo de la adherencia en el score global de CVRS, se encontró una relación que fue estadísticamente significativa entre adherencia (medida por SMAQ abreviado) y las dimensiones salud general percibida y funcionamiento social. Algunos autores demuestran una asociación entre buena adherencia al TARV y mejor score en CVRS11,31,32,34).
La adherencia se menciona como la principal condición de éxito del TARV entendido como el logro de CV indetectable. En nuestro estudio se presentan resultados que parecen contradictorios: si bien la adherencia se asoció a mejor puntuación en CVRS, la CV indetectable se asoció a peor score en la escala. Una posible hipótesis para explicar esta aparente contradicción puede estar dada por el tipo de fármacos utilizados en el esquema de TARV, como fue analizado previamente. Los fármacos que se utilizan en pacientes a partir de un segundo esquema (66,7% de la muestra) se caracterizan por ser más potentes logrando suprimir la CV. Sin embargo, sus posologías son más complejas, requieren un elevado número de comprimidos, presentan frecuentes efectos adversos, todo lo que puede condicionar la percepción de CVRS.
Una consideración especial merece los resultados de la aplicación del cuestionario SMAQ en la evaluación de adherencia. Aplicando el cuestionario completo versus abreviado, arrojó resultados muy disímiles, 31,3% y 83,7% de adherencia respectivamente.
Si analizamos los pacientes con CV indetectable a través del SMAQ completo solo 27,8% son adherentes, mientras que con el SMAQ abreviado se llega a 83,3% de adherencia. Esta llamativa diferencia en los resultados podrían explicarse por una pérdida de vigencia de la aplicación del cuestionario SMAQ completo ante los avances logrados en TARV, como ya lo señaló Ortega-Valín L47. La potencia de los fármacos actuales y la escasa exigencia de requerimientos dietéticos proporciona mayor flexibilidad en la toma de la medicación en cuanto al cumplimiento de horarios y eventuales olvidos esporádicos. Los resultados del estudio estarían reafirmando la eficacia del TARV para alcanzar la indetectabilidad aun bajo condiciones de cumplimiento que no siguen los parámetros definidos en la grilla de medición de adherencia utilizada (SMAQ).
Las principales limitaciones de nuestra investigación consisten en que no se logró estudiar una muestra probabilística; el no relevamiento del tipo de esquemas de TARV y efectos adversos asociados; la ausencia de relevamiento del impacto del estigma y la discriminación. Los resultados contradictorios que mostró la aplicación del SMAQ en sus dos versiones puede haber contribuido a no lograr establecer una relación entre adhe rencia y CVRS.
Conclusiones
Encontramos que este grupo de personas vinculado sostenidamente a la atención, a pesar de factores sociales de vulnerabilidad, logran un buen score de CVRS, una elevada proporción de supresión viral, con elevado nivel de adherencia si se considera los resultados del SMAQ abreviado.
La carga viral indetectable mide la eficacia del TARV, pero no puede ser utilizada aislada como predictor de calidad de vida. Si bien la escala MOS-HIV SF30 mostró fiabilidad y buena consistencia interna, deja en evidencia que su aplicación debería completarse con una encuesta que releve variables centrales como la percepción de la condición de VIH positivo, del estigma, de la discriminación y de la actividad sexual, contemplando la importancia de algunas de las determinantes sociales del VIH.
Se propone también que el cuestionario SMAQ debería ajustarse solamente a la aplicación de la pregunta 5 de cumplimiento terapéutico (SMAQ abreviado), considerando la efectividad y potencia actual del TARV y la importancia del papel de la vinculación y retención en el sistema de salud.