Introducción
La resección transuretral puede erradicar completamente determinados tumores de vejiga, aunque la incidencia de recurrencia es relativamente elevada (48% a 70%)1. La terapia adyuvante intravesical con una solución de bacilo de Calmette-Guérin (BCG) ha demostrado su efectividad y está incluida en guías de práctica clínica2,3. La vacuna contra el BCG, una cepa viva atenuada de Mycobacteriumbovis, fue introducida por primera vez en humanos en 19214. La instilación intravesical de BCG fue descrita por primera vez en 1976 por Morales5 y se utiliza para el tratamiento del carcinoma de células transicionales superficial de la vejiga. El efecto antitumoral parece ser mediado por inmunidad celular dependiente de los linfocitos T; sin embargo, su modo preciso de acción no es completamente conocido6. Esta terapia ha demostrado ser eficaz en retrasar la recurrencia después de la resección transuretral, en reducir el riesgo de progresión a la enfermedad invasiva del músculo, en la erradicación de tumores residuales en algunos pacientes con carcinoma papilar y carcinoma in situ y en mejorar la supervivencia2,7. Como contrapartida, puede estar asociada a efectos secundarios importantes. Una complicación poco frecuente pero grave de esta terapia inmunológica es el desarrollo de la enfermedad diseminada por BCG que se puede manifestar por neumonitis, infecciones graves de piel y tejidos blandos, infección genito-urinaria (prostatitis y orquitis), sepsis, afectación de la médula ósea, hepatitis granulomatosa y sepsis grave con falla orgánica múltiple y muerte. También puede ocurrir una enfermedad con síntomas sistémicos de variable severidad mediada por reacción de hipersensibilidad. Los síntomas pueden presentarse unas pocas horas luego de la instilación o tan tarde como varios meses después de la terapia con BCG7,8.
Caso clínico
Presentamos el caso de un paciente de sexo masculino de 64 años con antecedentes de diabetes e hipertensión arterial. En enero del año 2007 se realizó diagnóstico anátomo-patológico de carcinoma superficial de células transicionales de vejiga, realizándose resección transuretral (RTU). En el seguimiento posterior, en julio del 2010, se diagnosticó recidiva de lesión vesical que se resecó por RTU y la anatomía patológica informó carcinoma de células transicionales, papilar (grado 2 de la Organización Mundial de la Salud), sin invasión submucosa. Luego de la RTU recibió tratamiento con BCG intravesical semanalmente durante seis semanas con buena evolución. Presentó nueva recidiva tumoral en julio de 2013 tratada con nueva RTU. Se inició nueva serie de tratamiento con instilaciones intravesicales de ampollas de 80 mg de BCG, inicialmente una instilación semanal durante seis semanas y posteriormente una instilación mensual por seis meses. Presentó buena respuesta y se indicó continuar con una instilación mensual desde julio a diciembre de 2014. Subsiguientemente a las dosis de setiembre, octubre y noviembre presentó fiebre, dolor hipogástrico, disuria y malestar general que persistieron por 24 a 72 horas. En las 24 horas siguientes a la sexta instilación (realizada el 15 de diciembre de 2014) presentó fiebre, disuria, tos y expectoración mucosa, síntomas que motivaron el ingreso hospitalario a las 24 horas de la instilación. Al examen clínico se auscultaron estertores crepitantes a nivel pulmonar y con el planteo clínico de infección respiratoria se inició tratamiento con ceftriaxona. El hemograma mostró leucocitosis periférica de 12.800 celulas/µl con neutrofilia (95%) y presentó elevación de biomarcadores inflamatorios (proteína C reactiva de 192 mg/l, velocidad de eritrosedimentación de 45 mm/h). El examen de orina presentó una densidad de 1025, pH 5,0, proteínas 0,80 mg/dL, en el sedimento abundantes leucocitos (campos cubiertos), cilindros granulosos 3/campo, prueba de esterasa leucocitaria positiva, test de nitritos negativos, el urocultivo no presentó desarrollo y la búsqueda de antígeno neumocócico en orina mediante la prueba BinaxNow® fue negativa. A las 24 horas de la internación instaló un síndrome de disfunción orgánica múltiple (DOM) con compromiso de conciencia, injuria renal aguda (creatininemia de 5 mg/dl, azoemia 1,26 g/l y oligoanuria), insuficiencia respiratoria asociada a síndrome de distrés respiratorio agudo (SDRA), disfunción hepática (bilirrubina total 4,01 mg/dl, bilirrubina directa 3,04 mg/dl, fosfatasa alcalina 602 U/l, transaminasa glutámico oxalacética 231 U/l, transaminasa glutámico pirúvica 210 U/l, gama glutamiltranspeptidasa 384 U/l, láctico deshidrogenasa 1693 U/l), hipoalbuminemia 2,3 g/dl y alteraciones en el estudio de la crasis sanguínea (trombocitopenia de 75.000/mm3, fibrinógeno 243 mg/dl, alteración de la tasa de protrombina con valor de 45% y KPTT 20 segundos). Ingresó a la unidad de cuidados intensivos, requiriendo sedación y analgesia, intubación traqueal, asistencia ventilatoria mecánica y tratamiento de reemplazo de la función renal mediante hemodiálisis. El nivel de hemoglobina (Hb) se redujo de 14,5 a 9,6 g/dl en los primeros días. La leucocitosis inicial fue de 18.000 leucocitos µ/l a predominio neutrófilos. Por la severidad de los síntomas neurológicos y la presencia de rigidez de nuca se realizó una punción lumbar, obteniéndose un líquido cefalorraquídeo (LCR) con presión de apertura elevada (50 cm de H20), con reacción de Pandy positiva, 0,94 g/L de proteínas, glóbulos blancos de 2 células/mm3 y glucosa de 1,09 g/L. No presentó desarrollo bacteriológico (medios para bacterias inespecíficas ni medios para micobacterias en el laboratorio de la Comisión Honoraria de la Lucha Antituberculosa) en los cultivos de LCR, hemocultivos ni cultivos de orina. La reacción en cadena de la polimerasa para micobacterias en secreciones traqueales y LCR fue negativo, tampoco se observó amplificación del genoma correspondiente a herpes virus tipo I, II, varicela-zóster, Epstein Barr, citomegalovirus ni adenovirus en LCR. La tomografía computarizada (TC) de cráneo evidenció aumento de la diferencia de la densidad entre la sustancia gris y blanca predominantemente en región supratentorial, con reintensificación espontánea y con contraste intravenoso de las zonas corticales cerebrales, mostró además aumento de la hipodensidadperiventricular sugestivo de edema transependimario(Figura 1).
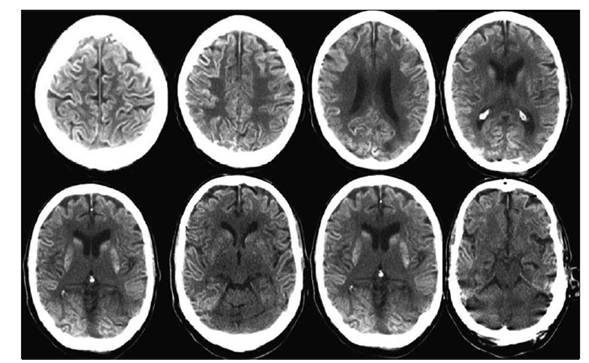
Figura 1 Tomografía computarizada de cráneo al ingreso a la unidad de cuidades intensivos. Se evidencia aumento de la diferencia de la densidad entre la sustancia gris y blanca predominantemente en región supratentorial con reintensificación espontánea y con contraste intravenoso de las zonas corticales cerebrales; aumento de la hipodensidad periventricular sugestivo de edema transe pendimario
Se evidenciaron infiltrados bilaterales de los cuatro cuadrantes en la radiografía de tórax (Figura 2) y la tomografía de tórax mostró imágenes en vidrio deslustrado bilaterales con compromiso del espacio aéreo alveolar, con derrame pleural bilateral leve. Los sectores de hígado y bazo estudiados no mostraron alteraciones de su densidad.
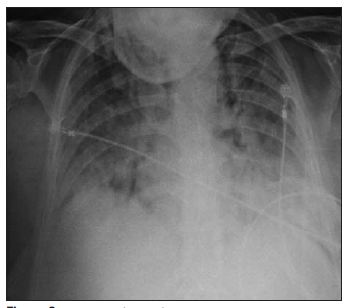
Figura 2 Radiografía de tórax al ingreso a la unidad de cuidados intensivos (18/12/2014). Infiltrados bilaterales y difusos de los cuatro cuadrantes.
El electroencefalograma (EEG) demostró características sugestivas de disfunción cerebral difusa severa, sin actividad paroxística. Por la situación clínica del paciente no fue posible el traslado para la realización de resonancia magnética. La situación neurológica y la elevada presión de apertura del LCR pudieron ser manifestaciones de hipertensión intracraneana, la que se trató mediante medidas generales tales como sedación y analgesia, alineación cefálica, cabecera elevada a 30°, se aseguró una presión arterial media mayor a 90 mm Hg para mantener una presión de perfusión cerebral estimada próxima a 70 mm de Hg, se mantuvo una PaCO2 próxima a 35 mm de Hg, se optimizó la oxigenación tisular manteniendo PaO2 y niveles de Hb en sangre adecuados y se realizó osmoterapia con suero salino hipertónico. Cabe destacar que no se realizó monitorización invasiva de presión intracraneana, asimismo con la salvedad de que la TC no es una herramienta utilizada para medir presiones, las imágenes tomográficas iniciales no evidenciaron lesiones que determinaran efecto de masas sugestivas de hipertensión intracraneana ni aparecieron en la evolución lesiones estructurales secundarias a hipertensión intracraneana persistente. El edema transependimario observado se produce por cualquier alteración patológica, grave, que afecte el circuito de producción-reabsorción del LCR; este tipo de edema cerebral es secundario, en la mayoría de los casos, a un aumento de la presión intraventricular, es transitorio y desaparece espontáneamente cuando se corrige la hipertensión intraventricular. En una segunda punción lumbar realizada a las 72 horas de tratamiento (extracción de muestras para estudio de virus por biología molecular) la presión de apertura fue normal.
Con planteo de DOM secundaria a la terapia intravesical con BCG se inició prednisona y tratamiento para micobacterias inicialmente en base a ciprofloxacina, rifampicina y amikacina, pasando luego a isoniacida, etambutol y rifampicina. Las alteraciones encontradas en el examen de orina fueron interpretadas como reacción inflamatoria a la inyección de la solución de BCG usada en el procedimiento y la ausencia de desarrollo de bacterias inespecíficas en el cultivo de orina aleja la posibilidad de una sepsis nefrourológica por entero patógenos.
El paciente presentó mejoría de las disfunciones respiratoria, renal, hepática y de la crasis, pero persistió con afectación neurológica. El coma persistió durante aproximadamente 15 días, posteriormente presentó un despertar tardío que se caracterizó por recuperación de los ciclos de sueño-vigilia, sin contenido de conciencia y con una cuadriparesia flácida sin reflejos osteo-tendinosos. El EEG luego de más de diez días de suspendida la sedoanalgesia informó elementos de sufrimiento cerebral difuso severo y las TC posteriores no mostraron cambios significativos salvo resolución del edema transependimario. Se realizó traqueostomía y se desvinculó de la ventilación mecánica, manteniendo una situación respiratoria y hemodinámica estable, recuperando la funcionalidad renal pero sin recuperar funciones encefálicas superiores, manteniendo un despertar espontáneo y a los estímulos nociceptivos, pero sin respuesta facial ni espinal y sin responder ante otros estímulos ni interactuar con el ambiente. Falleció a los 70 días de evolución en la unidad bajo directivas de adecuación del esfuerzo terapéutico, priorizando los cuidados del con fort, luego de información y resolución en conjunto con la familia.
Discusión y comentarios
La administración intravesical de BCG retrasa la progresión del tumor y se ha demostrado eficaz para erradicar tumores residuales en 60% de los pacientes con carcinoma papilar y en 70% de los pacientes con carcinoma in situ(2,7, 9-12). Esta terapia es en general bien tolerada, con poca morbilidad significativa, pero la incidencia de efectos secundarios es variable. Se ha reportado que la presencia de síntomas irritativos vesicales (disuria, polaquiuria) es muy frecuente (90% de los casos) y se acompaña algunas veces de síntomas sistémicos leves (febrícula 24%, malestar general 18%, escalofríos 8%); por el contrario, las reacciones adversas mayores ocurren en menos del 5% de los pacientes13. Se han comunicado casos excepcionales de infecciones diseminadas por M. bovis en pacientes con cáncer de vejiga luego de la inmunoterapia intravesical con BCG13-20 y se estimó una mortalidad 1/12.500 pacientes tratados13. El estudio EORTC, con más de 1.300 pacientes incluidos, puso en evidencia que en el 63% de los que iniciaron tratamiento con BCG intravesical se detectaron efectos secundarios locales y 31% presentó algún tipo de efecto secundario sistémico, a partir de un corto período frecuente de fiebre y malestar general21,22. Los efectos secundarios locales más frecuentes en el estudio fueron cistitis inducida por BCG (35%), infección bacteriana (23%) y hematuria macroscópica en 23%. Los efectos secundarios sistémicos más frecuentes fueron malestar general en 15,5% y fiebre en 8%. La sepsis por BCG fue un episodio raro, observándose solamente en cuatro pacientes (0,3%). La frecuencia fue similar en la inducción (primeras seis instilaciones) como durante el primer y los dos años siguientes21. La discontinuación del tratamiento por efectos secundarios graves se produjo entre el 8% y el 19% de los casos21,22. La mayoría de las interrupciones (75%) sucedieron en el primer año de tratamiento y su frecuencia ha disminuido en los estudios más recientes(21). Pueden ocurrir reacciones graves desde la primera instilación, lo que parece claro es que los efectos secundarios no dependen del número de instilaciones sino del huésped23. Las complicaciones que aparecen en forma precoz (en los primeros tres meses después de la instilación), como el caso que se presenta, se caracterizan por manifestaciones sistémicas tales como sepsis por BCG, DOM, compromiso pulmonar y hepático, en casi todos los casos con neumonía por micobacterias, neumonitis intersticial por hipersensibilidad y hepatitis granulomatosa, así como también complicaciones reumatológicas, nefritis y vasculitis. Las formas de presentación tardías (ocurridas incluso varios años después del primer tratamiento con BCG) son generalmente localizadas, sin manifestaciones sistémicas y la infección involucra a menudo el tracto genitourinario (prostatitis, orquio-epididimitis, balanitis), obstrucción uretral y la cicatrización con contractura de la vejiga. También se presenta con compromiso de sitios que son típicos para la reactivación de la enfermedad por micobacterias, tales como la columna vertebral o el retroperitoneo, la infección de prótesis ortopédicas y endovasculares y endocarditis. Además, se han descrito casos de osteomielitis, artritis infecciosa aguda y aneurismas micóticos18,24-27. Los mecanismos patogénicos propuestos para el desarrollo de complicaciones después de la instilación de BCG son controversiales28). Fundamentalmente se proponen: a) la estimulación inmunológica y una reacción sistémica de hipersensibilidad para algunas formas de presentación (formas sistémicas agudas), o b) la diseminación local o sistémica de la micobacteria. Se propone que los síntomas locales y sistémicos leves asociados a la inmunoterapia con BCG son el resultado de la estimulación inmunológica requerida para erradicar efectivamente las células neoplásicas29. En este sentido el aislamiento de micobacterias viables de los tejidos involucrados sugiere una infección activa en curso. Por el contrario, la ausencia de micobacterias en los cultivos, la presencia histológica de granulomas y la respuesta positiva a los corticosteroides apoyan la teoría de una respuesta de hipersensibilidad14. Algunos de los efectos secundarios sistémicos graves se correlacionan con instilaciones traumáticas o realizadas poco después de la RTU. Por ello no se recomienda (con bajo nivel de evidencia) iniciar las instilaciones dentro de los primeros 14 días después de la resección ni en las siguientes situaciones: a) cuando todavía existe hematuria macroscópica, b) después de una cateterización traumática, c) en presencia de cistitis bacteriana31. No se recomienda el uso profiláctico de agentes antituberculosos previos a la instilación de la BCG21,32. Como profilaxis de los efectos graves o cuando se presentan síntomas mínimos luego de una dosis se ha planteado la suspensión del tratamiento y la reevaluación posterior para reinstalar el tratamiento a dosis más bajas o menor número de instilaciones, las que se han mostrado efectivas en algunos casos33-36, pero este dato es aún controversial21,22,31. En cuanto al tratamiento antibacteriano, este no se plantea en los cuadros leves, de menos de 72 horas de duración. Los síntomas más frecuentes en estos casos son poliaquiuria, disuria, urgencia miccional y hematuria y solo se recomienda el tratamiento sintomático con analgésicos y antiespasmódicos cuando se prolongan o son intolerables. Un ensayo clínico aleatorizado mostró que la ofloxacina podría disminuir los efectos secundarios locales y por lo tanto algunos autores la recomiendan en caso de persistencia de cistitis grave37. La inducción de la diuresis para aumentar la eliminación de las micobacterias es una práctica habitualmente recomendada sin evidencia de su eficacia31. No hay evidencia suficiente que permita realizar una recomendación fuerte en cuanto al tratamiento tuberculostático óptimo para las infecciones graves por BCG. M. bovis es intrínsecamente resistente a pirazinamida y existe bajo nivel de resistencia a isoniazida. El tratamiento antituberculoso sugerido incluye isoniacida, rifampicina y etambutol durante dos meses, e isoniacida y rifampicina durante cuatro meses más. La continuación de las instilaciones de BCG luego de haberse suspendido por diagnóstico de infección y haber recibido el tratamiento antituberculoso podría considerarse en pacientes con fiebre persistente y sin patrón miliar en la imagen del tórax, una vez que se haya completado el tratamiento antituberculoso y solo si los beneficios esperados de la terapia con BCG exceden claramente los riesgos (es decir, carcinoma de alto grado)19,30,31,38,39. En casos de insuficiencia multiorgánica, la administración de altas dosis de corticosteroides es una parte esencial del tratamiento23,31,39,40. En la (Figura 3) se muestra una propuesta de algoritmo de manejo de las infecciones por M. bovis siguiendo a la inyección intravesical19).
Conclusiones
Hemos presentado un caso grave de complicación sistémica secundaria a la terapia inmunológica con BCG, que se agrega a los más de 280 casos reportados en la literatura. La presentación temprana de disfunción multiorgánica siguiendo a la instilación intravesical, la ausencia de otros diagnósticos alternativos y la respuesta al tratamiento antimicrobacterias asociado a corticoides son compatibles con la forma sistémica grave. No se identificó M. bovis en ninguna de las muestras estudiadas, por lo tanto nos orientamos a una forma de reacción sistémica por hipersensibilidad en un paciente con larga exposición previa. La particularidad del caso presentado radica en el compromiso del SNC con meningoencefalitis e injuria encefálica severa. Esta presentación ha sido excepcional y solamente encon tramos un caso de meningitis reportado en la literatura (19,41.