Introducción
Las vacunas son productos inmunobiológicos que ofrecen protección parcial o completa contra enfermedades infecciosas y sus complicaciones, pero además brindan beneficios a la sociedad en su conjunto debido al efecto rebaño1-3. Según la Organización Mundial de la Salud (OMS) se estima que la vacunación previene aproximadamente 2,5 millones de muertes cada año4. Se ha demostrado que es una de las intervenciones sanitarias más exitosas y rentables en salud pública4,5.
En Uruguay, en 1982 se crea el Programa Nacional de Vacunaciones (PNV), estableciendo mediante la ley 15.272 la obligatoriedad de la vacunación contra ocho enfermedades: tuberculosis, poliomielitis, difteria, tétanos, tos ferina, sarampión, rubéola y paperas. El certificado esquema de vacunación (CEV) ha presentado múltiples incorporaciones desde entonces. Actualmente incluye 13 vacunas para evitar 15 enfermedades6. Las coberturas promedio de las vacunas sistemáticas incluidas en el CEV en Uruguay son muy altas, cercanas a 95%7.
El PNV se rige por las recomendaciones de vacunación segura de la OMS. Esto implica la utilización de vacunas de calidad, aplicación de prácticas de inyección segura, vigilancia de los eventos supuestamente atribuibles a la vacunación o inmunización (ESAVI) y fortalecimiento de las alianzas con los medios de comunicación para dar mensajes claros a la población sobre estrategias, prioridades y seguridad de la vacunación8.
La mayoría de las vacunas que son parte del PNV se obtienen por medio del Fondo Rotatorio de la Organización Panamericana de la Salud/Organización Mundial de la Salud (OPS/OMS). Estas vacunas están precalificadas por este organismo y cumplen con todos los requisitos de calidad de fabricación, eficacia y seguridad exigidos a nivel internacional.
Desde el año 2010 se ha fortalecido el sistema de vigilancia de ESAVI como parte del Sistema Nacional de Farmacovigilancia en Uruguay. Esta actividad es parte central del PNV y es llevada a cabo por integrantes de la Unidad de Inmunizaciones de la División de Epidemiología y la Unidad de Farmacovigilancia de la División Evaluación Sanitaria del Ministerio de Salud Pública (MSP).
Se define como ESAVI aquellos síntomas o signos clínicos que ocurren luego de la administración de una vacuna y que pueden ser atribuidos a la vacunación o inmunización. Esta es una definición amplia, operativa, que permite iniciar la investigación de un evento clínico para identificar si el origen del mismo está relacionado causalmente a la vacunación recibida. Los ESAVI se clasifican en función de su asociación causal con la vacuna y por su severidad. En cuanto a la imputabilidad se catalogan como: relacionados con la vacunación, no concluyentes o coincidentes con la misma. Entre los ESAVI relacionados con la vacunación se distinguen dos tipos: los errores programáticos y los relacionados con el o los principios activos de la o las vacuna/s. Según su severidad, se clasifican en graves o no graves. Se define ESAVI grave como aquel que causa o prolonga la hospitalización, amenaza la vida, produce una inca pacidad parcial o permanente o determina la muerte8,10,11.
El principal objetivo de la vigilancia de ESAVI es fortalecer la confianza de la población y el personal de la salud en las vacunas incluidas en el PNV y conocer los problemas vinculados a su uso. Desde la puesta en marcha de este sistema se han recibido en promedio 63 notificaciones de ESAVI por año, realizadas más frecuentemente por personal de salud9.
Los ESAVI graves constituyen un gran desafío para los sistemas de farmacovigilancia y los programas de vacunación, ya que son los que requieren mayor análisis y resolución más rápida y oportuna. Es necesario caracterizar adecuadamente y en profundidad los ESAVI graves para contribuir a la gestión de riesgo como medida de salud pública.
El objetivo de este trabajo fue caracterizar y realizar un seguimiento de los ESAVI graves notificados al Sistema Nacional de Farmacovigilancia del MSP durante el período 2010 a 2014.
Material y método
Se realizó un estudio transversal en el que se identificaron a través de la base de datos del Sistema Nacional de Farmacovigilancia del MSP las notificaciones de individuos portadores de ESAVI graves durante el período 2010 a 2014. Se incluyeron aquellos que otorgaron el consentimiento informado para participar del estudio.
La caracterización del ESAVI se evaluó mediante la información aportada por el formulario de notificación. Para ello se utilizaron las siguientes variables: edad, sexo, procedencia (departamento), prestador de salud (público o privado) y condiciones médicas preexistentes relevantes, notificador del ESAVI, tipo de vacuna/s administrada/s, tipo de vacuna/s más probablemente impli cada/s, tipo de ESAVI, imputabilidad y motivo de grave dad.
Cuando fue necesario, para identificar el tipo de vacuna/s más probablemente implicada/s los autores realizaron un análisis post hoc con la evidencia científica disponible.
Para determinar el tipo de ESAVI se utilizaron las definiciones de la Colaboración Brighton y sus niveles de certeza11. En caso de no poder aplicar dichos criterios se utilizó el diagnóstico de ESAVI definido oportunamente en el formulario de notificación por los técnicos del MSP12. Los ESAVI se agruparon según el Sistema de Clasificación de Órganos y Sistemas (SOC) del MedDRA13. La imputabilidad del ESAVI se categorizó como coincidente, no concluyente o relacionado con la vacunación (error programático, o por el o los principios activos de la vacuna)8,14. Se analizó la gravedad del ESAVI según la presencia de alguno de los siguientes motivos: hospitalización, prolongación de la hospitalización, amenaza a la vida, incapacidad permanente o muerte8.
Los datos de la evolución de los individuos se obtuvieron mediante entrevista telefónica realizada por la primera autora. Para caracterizar las complicaciones en la evolución se utilizaron las siguientes variables: tratamiento requerido, tiempo hasta la recuperación (en días), recuperación ad integrum, recuperación parcial, incapacidad permanente y muerte. Si correspondía, se evaluó la conducta frente a la futura vacunación con la vacuna sospechada como implicada en el evento ad verso.
Aspectos éticos. La Unidad de Inmunizaciones del MSP proporcionó un listado de las notificaciones de ESAVI graves con el nombre y el teléfono de contacto a la responsable de realizar las llamadas. Se solicitó consentimiento informado para acceder a la información del formulario de notificación del ESAVI y evaluar la evolución. En los casos en que el afectado era un niño se solicitó el consentimiento a su responsable (padre, madre o tutor). Se respetó la confidencialidad de los datos. El protocolo fue aceptado por la División Epidemiología del MSP y aprobado por el Comité de Ética para Proyectos de Investigación de la Facultad de Medicina.
Análisis estadístico. Las variables discretas se expresaron como frecuencias absolutas y relativas y las continuas como media, mediana y rango. Se relacionaron las siguientes variables: tipo de ESAVI en función del nivel de certeza de la Colaboración Brighton cuando correspondía, de la imputabilidad, de la vacuna administrada, y de la recomendación realizada sobre la futura vacunación. Para el procesamiento de los datos se utilizó el programa Open Office Calc 4.0.1.
Resultados
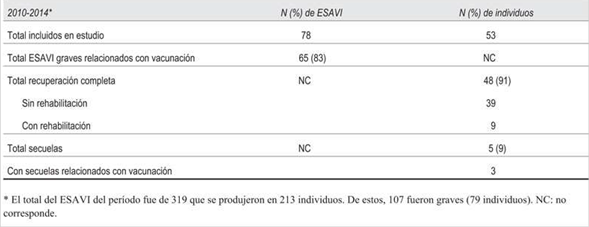
Entre 2010 y 2014 se notificaron al Sistema Nacional de Farmacovigilancia 319 ESAVI que se produjeron en 213 individuos, determinando una tasa de 28 ESAVI por millón de dosis de vacunas distribuidas. Fueron catalogados como graves 107 ESAVI (31%), correspondientes a 79 individuos, con una tasa de 9,5 ESAVI gra ves por millón de vacunas distribuidas.
Fue imposible contactar a 24 de los 79 individuos con ESAVI grave y dos al momento de la encuesta no cumplían con criterios de gravedad y se excluyeron. Se incluyeron 53 individuos (53/213, 25% del total de individuos portadores de ESAVI del período), portadores de 78 ESAVI graves (78/319, 24% del total de ESAVI del período). Ninguno se negó a participar. La distribución anual de las notificaciones analizadas fue: 8 individuos en 2010; 10 en 2011; 10 en 2012; 10 en 2013, y 15 en 2014.
De los incluidos, 32 eran de sexo femenino. La media de edad fue 9 años, mediana 2 años (rango 2 meses a 70 años). Tenían 5 o menos años, 37 individuos. Eran previamente sanos, 31. En la (Tabla 1) se resumen las características clínicas preexistentes de los individuos afectados de ESAVI grave.
Procedían de Montevideo, 34; del resto de los departamentos del país, 19. Se asistían en el subsector privado de salud, 34; el resto en el subsector público. El personal de salud (48 médicos) notificó 51 ESAVI, en los otros dos casos el notificador fue el propio usuario.
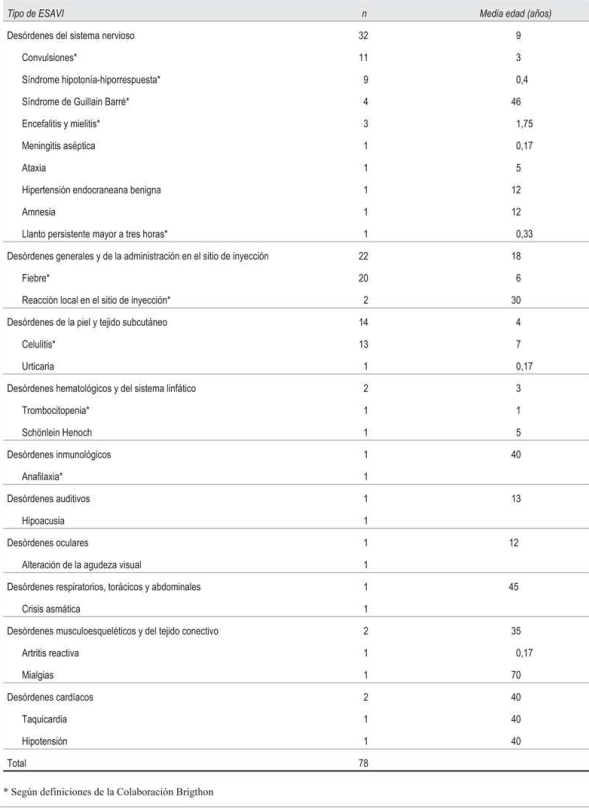
En todos los casos la severidad estuvo determinada por el requerimiento de hospitalización. La mayoría de los ESAVI graves se relacionaron con desórdenes del sistema nervioso central (n=32); el más frecuente fue convulsiones (n=11). En la (Tabla 2) se muestran los tipos de ESAVI graves.
Según el análisis de imputabilidad, 65 ESAVI (65/78, 83%) estaban relacionados con la vacunación (ninguno por error programático), 10 fueron no concluyentes y 3 coincidentes. En la (Tabla 3) se muestra el grado de imputabilidad según el tipo de ESAVI.
Se catalogaron 65 ESAVI según los niveles de certeza de la Colaboración Brighton; el resto no se pudo catalogar dado que esta clasificación no establece criterios diagnósticos para todos los eventos. La mayoría de los ESAVI tienen un nivel 1 de certeza (n=42).
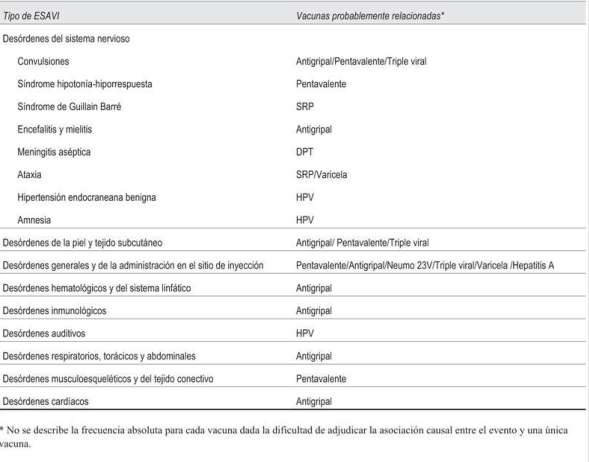
En la (Tabla 4) se describen las vacunas administradas probablemente implicadas según el tipo de ESAVI grave. La vacuna más probablemente relacionada con los eventos neurológicos fue la vacuna pentavalente.
En relación con la evolución, 48 afectados por ESAVI grave tuvieron una recuperación completa (48/53, 90%), nueve de los cuales requirieron rehabilitación (9/53, 17% del total de individuos incluidos en el análisis y 9/79, 11% del total de individuos portadores de ESAVI graves del sistema). La media del tiempo de recuperación fue de 9 días (rango 0 a 180 días). A 37 de los 48 individuos con ESAVI grave que mostraron recuperación les correspondía una nueva dosis de la/s vacuna/s posiblemente implicadas según el CEV, 24 de los cuales la recibieron (24/37, 65%) (Tabla 5).
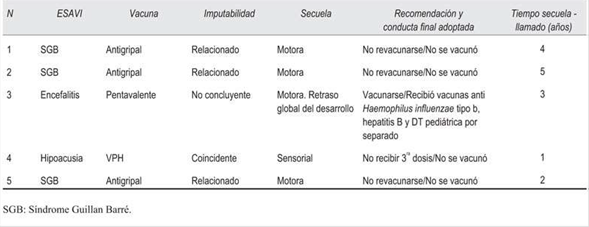
Presentaron secuelas neurológicas o sensoriales cinco individuos (5/53, 9% del total de individuos incluidos en el análisis y 5/213, 2% del total de individuos portadores de ESAVI graves del sistema), cada uno portador de un ESAVI. De estos cinco, tres fueron catalogados como relacionados con la vacunación (3/78, 4% del total de ESAVI graves analizados y 3/65, 5% del total de ESAVI graves relacionados analizados), los otros dos fueron no concluyentes o coincidentes respectivamente (Tabla 5). El tiempo transcurrido entre la presentación de la secuela y la entrevista telefónica fue de 3 años en promedio, rango entre 1 y 5 años. En la (Tabla 6) se describen los casos de ESAVI grave con secuelas y la conducta adoptada con respecto a la revacunación.
Refirieron haber sido asesorados por parte del personal de salud acerca de la importancia de la inmunización y la posibilidad de efectos adversos secundarios a la misma 13 de los 53 encuestados. La recomendación de revacunación o no posterior al evento fue realizada en 20 de los 53 casos por el médico tratante.

Tabla 1: Condiciones clínicas preexistentes a la vacunación de los individuos con ESAVI grave. (2010-2014) (N=53)
Discusión
Estos representan los primeros resultados de la evolución de los ESAVI notificados al Sistema Nacional de Farmacovigilancia en el país. Se logró contactar a la mayoría de los individuos portadores de ESAVI graves. La limitación al acceso del resto de los pacientes se explica por tratarse de un estudio retrospectivo y por la calidad de los registros del sistema de notificación, ya que en los primeros años se solicitaba solo el teléfono del notificador y no del paciente. Actualmente se incorporaron datos de contacto de ambos y del correo electrónico. Se rediseñó el formulario de notificación con esta información y se agregaron otros datos útiles para realizar el análisis de los diferentes eventos, disponible en línea*.
Todos los ESAVI se catalogaron como graves por haber requerido hospitalización. El porcentaje de ESAVI graves notificados en el período analizado fue superior al hallado en otras series internacionales. En el sistema australiano, 18% (969/5.455) de las notificaciones recibidas entre 2007 y 2013 fueron graves y en el sistema canadiense 9% (224/2.408) notificados en 201415,16. Sería importante conocer cuáles fueron los determinantes de la gravedad en estas series y comparar los criterios de hospitalización de los distintos sistemas de salud, dado que en parte esta diferencia podría deberse a una mayor tasa de hospitalización.
Los ESAVI graves analizados ocurrieron principalmente en niños. Es probable que esto se explique porque a esa edad se administra el mayor porcentaje de vacunas que el individuo recibirá a lo largo de su vida8. La mayoría de las notificaciones proceden del área metropolitana, sobre todo del departamento de Montevideo. Este hecho puede estar vinculado a la mayor densidad poblacional y a la presencia de centros de salud con actividades de formación de recursos humanos, donde se ha jerarquizado y comunicado intensivamente el reconocimiento de los ESAVI y la notificación al MSP como parte de la atención integral y de calidad de los pacientes. Desde el PNV se continúan implementando y promo viendo actividades de promoción y educación en salud en todo el país.
Los médicos fueron los que más notificaron, no obstante sería deseable que cualquier integrante del equipo de salud conozca, sienta la responsabilidad y realice este tipo de notificación. Es importante, además, que los usuarios estén informados de la posibilidad de realizar por sí mismos la notificación frente a la sospecha de un ESAVI2. Esta actitud debe ser promovida por el equipo de salud antes y durante el proceso de vacunación. Todos estos aspectos señalan la importancia de la adecuada comunicación entre autoridad sanitaria, profesionales de la salud y usuarios en el conocimiento y uso de los recursos de salud disponibles.
El análisis realizado por los sistemas de farmacovigilancia debe ser riguroso y sistematizado, utilizando herramientas especialmente diseñadas y validadas, que permitan además la comparación entre diferentes series. En este trabajo se utilizaron definiciones de la Colaboración Brighton. Esta colaboración tiene como misión mejorar la investigación en vacunas proporcionando métodos de monitorización de perfiles de seguridad estandarizados, validados y objetivos. La utilización de estos criterios permitió la categorización de mayoría de los ESAVI notificados en este estudio. Sin embargo, esta clasificación no incluye criterios para todos los posibles ESAVI, ni sirve para establecer relación causal entre los eventos y las vacunas2,17-19. También permite subcategorizar los ESAVI según niveles de certeza, lo que otorga mayor fuerza de validez diagnóstica al evento analizado. En los ESAVI en los que pudo utilizarse estas definiciones, los niveles de certeza fueron altos. Una de las metas a corto plazo del PNV y del Sistema Nacional de Farmacovigilancia es incorporar sistemáticamente a los protocolos de trabajo estas definiciones de modo de estandarizar aún más las notificaciones, optimizando su análisis e imputabilidad.
Los eventos adversos graves más frecuentemente notificados afectaron el sistema neurológico, lo que coincide con lo reportado a nivel internacional8. Estos no solo son importantes por su riesgo potencial en agudo, sino por el riesgo de secuelas e invalidez. Los ESAVI neurológicos más frecuentes en esta serie fueron las convulsiones, con o sin fiebre. La mayoría fueron catalogadas como relacionadas con la vacunación y se les otorgó el máximo nivel de certeza de la Colaboración Brighton. Las vacunas que se asocian más frecuentemente a este evento adverso son el componente pertussis celular de las vacunas pentavalentes, la triple viral y la antigripal8 y coinciden con la reportados en esta serie. Ningún paciente con convulsiones presentó secuelas en la evolución. La mayoría volvió a recibir la vacunación correspondiente según las recomendaciones recibidas por su médico tratante. A la fecha de la publicación de este estudio no hubo nuevas notificaciones de convul siones en estos niños.
El segundo evento neurológico de mayor incidencia en esta serie fue el síndrome de hipotonía hiporrespuesta (SHH). Las vacunas que más se asocian a este síndrome son las que contienen componente pertussis a células completas8, como la vacuna pentavalente, al igual que lo observado en esta serie.
La frecuencia e importancia de los ESAVI neurológicos determinó que en el año 2012 el Comité Nacional Asesor de Vacunaciones (CNAV) realizara recomendaciones sobre la conducta frente a posteriores dosis de vacuna pentavalente en casos de estos ESAVI. Las mismas incluyen adoptar medidas precautorias con observación clínica en un servicio de salud por lo menos durante 12 horas tras la administración de la siguiente dosis de vacuna*.
La fiebre fue el ESAVI encontrado con más frecuencia en esta serie. Sin embargo, en todos los casos acompañó a otros eventos que generalmente fueron los que motivaron la notificación y su gravedad. En una revisión de la Asociación Española de Pediatría se concluye que aunque las vacunas pueden ser una potencial causa de fiebre, su responsabilidad causal no está bien establecida. Por lo general, presenta escasa trascendencia clínica y no suele requerir un tratamiento especial. Varios autores postulan que es altamente probable que las causas más frecuentes de fiebre posvacunal correspondan a procesos infecciosos concurrentes20,21.
La celulitis fue el segundo ESAVI grave más frecuente en esta serie. Sin embargo, el principal motivo para catalogarlos como tales fue la necesidad de hospitalización para realizar tratamiento antibiótico intravenoso. Esto puede sobreestimar la severidad de estos eventos y contribuir al porcentaje relativamente mayor de ESAVI grave hallados en comparación con otros países15,16. A eso se le suma que en muchas ocasiones es difícil distinguir este evento de las reacciones en el sitio de la inyección más comunes, típicas y menos serias, lo que puede contribuir al sobrediagnóstico de celulitis. Sería deseable que las pautas de diagnóstico y tratamiento que utilizan los clínicos incorporen los criterios de la Colaboración Brighton para facilitar su razonamiento frente a estos eventos posvacunación. La utilización de técnicas de vacunación inseguras, que no garantizan la adecuada asepsia, también son elementos a considerar en el análisis de las sospechas de celulitis12,22,23. Sin embargo, en esta serie no se identificaron problemas de este tipo, que son denominados como errores progra máticos.
Generalmente se considera que la severidad y gravedad de un ESAVI son atributos intercambiables, sin embargo deberían ser considerados diferentes. El evento grave puede tener una severidad leve, moderada o severa. A modo de ejemplo, la celulitis puede ser clínicamente leve aunque se catalogue como grave porque se tomó la decisión de hospitalización para tratamiento. Esto ha sido recogido recientemente en los Manuales de Vigilancia de la OMS24 y será incorporado a futuro en el análisis de los ESAVI del Sistema Nacional.
Es importante realizar el seguimiento de los pacientes portadores de ESAVI grave para valorar sus probables complicaciones. En esta serie, 17% (9/53) de los individuos a los que se logró encuestar requirieron algún tipo de rehabilitación, con recuperación completa, y 9% presentaron secuelas (5/53); considerando el total de ESAVI graves notificados en el período, los porcentajes se sitúan en 8% (9/107) y 5% (5/107), respectivamente. Es necesario analizar la frecuencia de repercusiones o secuelas en el contexto general de los programas de vacunación. La mayoría de las vacunas son seguras y no se asocian a estos eventos, que resultan excepcionales. Sin embargo, es mucho más probable que se notifiquen los eventos graves que los no graves, precisamente por su implicancia clínica y la alarma que genera. Por esta razón el subregistro de notificaciones es más probable para los ESAVI leves que para los graves. Aquel usuario o profesional que atendió y sospechó un problema de salud grave vinculado a la vacunación, consultará y seguramente lo notifique. Los porcentajes de ESAVI graves con secuelas notificados se encuentran entre los hallados en otros sistemas de notificación. Según datos del sistema de notificación pasiva VAERS (Vaccine Adverse Event Reporting System) de Estados Unidos de 427 eventos graves notificados entre enero de 2010 y diciembre de 2014, 10 presentaron secuelas permanentes posteriores, que equivale a 2% de los eventos notificados25. Según datos de las notificaciones del sistema chino del National AEFI Surveillance System (NASS) entre 2008 y 2011, de los 6.265 ESAVI notificados, 652 (10,4%) fueron graves, 115 eventos que amenazaron la vida (18%), 495 hospitalizaciones (76%) y 27 secuelas permanentes (4%), si bien se establecieron como vinculados a la vacunación 72 ESAVI, de los cuales 61 requirieron hospitalización (85%), 10 amenazaron la vida (14%) y 1 (1%) determinó la muerte26.
Otro aspecto fundamental es la determinación de la imputabilidad de estos eventos graves con secuelas. En esta serie, tres de los cinco fueron catalogados como relacionados a la vacunación y correspondían a SGB por vacuna antigripal. La relación causal entre SGB y vacuna antigripal sigue siendo controvertida26-29. El Comité Consultivo Mundial de Seguridad en Vacunas considera que la investigación de esta posible relación causal requiere de estudios a gran escala con diseños adecuados, como, por ejemplo, estudios autocontrolados que analicen la incidencia del SGB antes y después de la vacunación26. La conducta adoptada frente a la imputabilidad fue interpretar como un hecho la asociación causal cuando aún persisten dudas al respecto, lo que puede sobreestimar el número de ESAVI grave con secuelas de esta serie. Asimismo, a los tres casos se les recomendó no revacunarse, sin embargo, el haber padecido SGB no es contraindicación absoluta para recibir ninguna vacuna, sino que constituye una precaución y por lo tanto debe valorarse la relación beneficio/riesgo en forma individual30 . Esto ha sido recogido tal cual como recomendación por el CNAV*.
Independientemente del grado de imputabilidad, la aparición de una secuela ante la inmunización debe ser reconocida y poner en alerta a los sistemas de farmacovigilancia por las potenciales repercusiones que genera, tanto en lo individual como en la confianza y solidez de los programas de vacunaciones a nivel colectivo. Es fundamental la realización de análisis y el seguimiento exhaustivo de estos casos y que los resultados del mismo sean transmitidos de forma sensible y acorde a los usuarios y a la comunidad en su conjunto.
No siempre que ocurre un ESAVI grave es necesario no vacunar. Por el contrario, la mayoría de las veces no existen verdaderas contraindicaciones que lo justifiquen y el beneficio de la vacunación supera los potenciales riesgos. Este concepto debe ser promovido por todo el sistema de salud y así debe ser entendido por los usuarios. Los programas nacionales de vacunación deben actuar como una herramienta de protección primaria efectiva y de bajo riesgo para la población, como ocurre con la mayoría de las vacunas incluidas sistemáticamente en estos programas. La farmacovigilancia y la gestión de riesgo contribuyen a la mejor atención en salud tanto a nivel individual como colectivo. Es de destacar las recomendaciones que han podido elaborarse en conjunto con la CNAV a partir de algunos de estos ESAVI graves notificados al Sistema Nacional de Farmacovigilancia y las recomendaciones brindadas en cada uno de los casos graves con secuelas.
Es importante resaltar que la mayoría de los usuarios refirieron no estar informados acerca de la posibilidad de la aparición de eventos adversos posteriores a la vacunación. Es responsabilidad de todos los profesionales de la salud informar a los usuarios estos aspectos, haciéndolos partícipes de las decisiones y recomendaciones ante eventuales problemas y futuras vacunaciones. Esto también refuerza la confianza en los programas de vacunación.
Conclusiones
Los resultados de este trabajo son los primeros que analizan la evolución de los ESAVI graves notificados al Sistema Nacional de Farmacovigilancia en nuestro país. La mayoría de los ESAVI graves notificados se relacionaron a desórdenes del sistema nervioso central, y la vacuna más implicada fue el componente pertussis de la vacuna pentavalente o DPT. La mayoría de los individuos de esta serie presentó recuperación completa. El seguimiento de los ESAVI graves aportó información útil para optimizar y fortalecer el Sistema Nacional de Farmacovigilancia en vacunas y el PNV en general. Es importante sensibilizar al equipo de salud para aumentar el número de notificaciones a través de actividades de promoción en salud y promover el desarrollo y el fortalecimiento de protocolos nacionales de segui miento de ESAVI y el desarrollo de futuras inves tigaciones en el tema