Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Médica del Uruguay
versión impresa ISSN 0303-3295versión On-line ISSN 1688-0390
Rev. Méd. Urug. vol.32 no.3 Montevideo set. 2016
Epidemiología, diagnóstico y tratamiento de la sepsis severa en Uruguay: un estudio multicéntrico prospectivo
Mauricio Bertullo*, Nicolás Carbone†, Martin Brandes‡, Mario Silva§, Helena Meiss¶, Darwin Tejera*, Alberto Deicas‡, María Buroni†, Jorge Gerez¶, Gino Limongi§, Mario Cancela*, Javier Hurtado†
Resumen
Objetivo: conocer las características epidemiológicas de pacientes que ingresan por sepsis severa (SS) y shock séptico (ShS); valorar la implementación de recomendaciones de la campaña Sobrevivir a las Sepsis (CSS) y determinar variables asociadas con mal pronóstico vital. Diseño: estudio prospectivo, observacional, cohorte única, multicéntrico, durante un año (setiembre 2011 - agosto 2012). Ámbito: cinco centros de Montevideo, del subsector público y privado con cobertura de 800.000 habitantes. Pacientes y métodos: 153 pacientes que ingresaron con diagnóstico de SS y ShS a las unidades de cuidados intensivos (UCI) de forma consecutiva. Variables de interés principales: aquellas relacionadas con características del paciente y episodio de sepsis, medidas diagnósticas y terapéuticas según la CSS en las primeras 48 horas, y pronósticas en UCI, hospital y a los seis meses. Resultados: se incluyeron 153 pacientes, la mediana de edad fue 68 años, la de Acute Physiology and Chronic Health Evaluation (APACHE II) fue de 24; 73,9% recibieron asistencia respiratoria mecánica (ARM), con una mediana de 8 días. La mediana de estadía en CTI fue de 12 y la de estadía hospitalaria fue de 19 días. De los episodios de SS, ShS, 69,3% de los casos fue comunitario; 77,8% presentó shock, y 37,9% inmunodebilidad-inmunocompromiso. Predominó la sepsis de origen respiratorio en 30,1%, se aisló microorganismos en 64,1%, siendo bacterianas 95,9%. La mortalidad en CTI fue 49,7%, hospitalaria 54,9% y a seis meses 58,8%. Se asociaron a mayor mortalidad hospitalaria: edad, APACHE II, inmunodebilidad-compromiso, demoras de ingreso a UCI e inicio de antimicrobianos y balance positivo. Conclusiones: los pacientes ingresan a UCI con formas severas o estado biológico comprometido. Existen demoras y limitaciones en el diagnóstico y terapéutica inicial, situaciones que se asocian a mayor mortalidad hospitalaria.
* Centro de Tratamiento Intensivo del Hospital de Clínicas. Montevideo, Uruguay.
† Centro de Tratamiento Intensivo del Hospital Español. Montevideo, Uruguay.
‡ Centro de Tratamiento Intensivo del CASMU - IAMPP. Montevideo, Uruguay.
§ Centro de Tratamiento Intensivo de la Asociación Española. Montevideo, Uruguay.
¶ Centro de Tratamiento Intensivo del Hospital Policial. Montevideo, Uruguay.Hospital de Clínicas “Dr. Manuel Quintela”. Av. Italia s/n, Montevideo, Uruguay.Correspondencia: Dr. Mauricio Bertullo. Verdi 4339, apto 402, Montevideo, Uruguay. Correo electrónico: mauriciobertullo@gmail.com.
Los autores declaran que no existe conlicto de intereses.
Recibido: 23/11/15 Aprobado: 29/2/16.
Introducción
La sepsis severa (SS) y el shock séptico (ShS) constituyen una alteración fisiológica extremadamente compleja que resulta de la interacción de una infección inicial, la respuesta del huésped y las subsecuentes intervenciones médicas(1). La transición de SS a ShS ocurre sobre todo en las primeras 24 horas de hospitalización, asociándose a un aumento en la morbimortalidad(2,3). Existen escasas publicaciones sobre esta patología en Uruguay y en su mayoría fueron realizadas a pequeña escala como para tener un diagnóstico de situación adecuado(4,5).
La incidencia de la sepsis se ha incrementado de forma dramática en las últimas décadas. Esto se le atribuye a la combinación de múltiples factores, como la edad avanzada de los pacientes, el aumento en número y complejidad de procedimientos diagnósticos y terapéuticos, el mayor uso de drogas inmunosupresoras y el creciente número de infecciones por bacterias multirresistentes, especialmente relacionado al ambiente hospitalario(6). El ShS junto con la SS son responsables de 2,9% de los ingresos hospitalarios y de 10% de los ingresos a unidades de cuidados intensivos (UCI)(2). Presentan en países desarrollados una tasa de mortalidad mayor a 30% para ambas patologías asociadas, siendo aproximadamente de 40% para el ShS, con cifras mayores a nivel regional(2,4,7-13). En nuestro medio destacamos el estudio realizado por Rieppi G y colaboradores(4) en el 2006, en el cual participaron 31 UCI de todo el territorio nacional, incluyéndose 160 pacientes, constituyendo 8,8% del total de los ingresos a UCI con una mortalidad global de 55%, lo cual se aproxima a lo observado en algunos países de la región(9-13).
Al costo en vidas antes mencionado, debemos sumar los costos sociales y económicos por los cuales existe cada vez mayor preocupación. Se estima un costo de U$S 22.000 por paciente con sepsis en Estados Unidos, el cual sería aún mayor para paciente de UCI(2). En España se ha estimado un costo por episodio de 10.000 euros(14), siendo aún mayor en otros países de Europa (23.000 a 29.000 euros)(15). En el trabajo de Iñigo J y colaboradores(14) se estimaron para la Comunidad de Madrid costos muy superiores a aquellos generados por el infarto agudo de miocardio. Un estudio realizado en Brasil estima un costo de U$S 9.630 por paciente durante la estadía en UCI(11). A su vez, los sobrevivientes de SS y ShS presentan mayores tasas de mortalidad tardía y una significativa caída en su calidad de vida tras el alta(16).
A fines de la década de 1990 y principios del nuevo milenio se produjeron avances significativos en este campo de conocimiento que generaron cambios sustanciales en cuanto al manejo de esta enfermedad(17-22). Tras la Declaración de Barcelona de octubre de 2002 y posterior lanzamiento de la Campaña Sobrevivir a las Sepsis (CSS), surge una iniciativa por parte de las principales sociedades científicas mundiales involucradas en vistas a unificar criterios diagnósticos y terapéuticos con el fin de aumentar la sobrevida. La infusión de fluidos intravenosos, junto con el adecuado empleo de antimicrobianos, control del foco y la optimización de la ventilación mecánica constituyen componentes claves en el manejo temprano de esta entidad como se desarrolla en las guías de CSS publicadas en 2008 en que se basa este trabajo(23).
En los últimos años comienzan a aparecer en la literatura publicaciones que reúnen y analizan la enorme fuente de datos generados. La mayoría demuestra un aumento de la sobrevida tras la implementación de protocolos diagnósticos y terapéuticos, no siendo claro si su resultado se debe a la implementación de estos en sí mismo o al proceso educacional vinculado(24,25). Debemos mencionar igualmente que existen algunas opiniones encontradas a nivel internacional(26-28) y que muchos de estos resultados se han obtenido en centros con mayores recursos que con los que contamos en nuestro medio, siendo esto último lo que hace necesario realizar un diagnóstico de situación actual de nuestra realidad.
En el presente estudio nos proponemos obtener una aproximación a la epidemiología de la SS y el ShS en el Uruguay, así como de la implementación de algunas de las medidas diagnósticas y terapéuticas asociadas a una mejora en la morbimortalidad, según recomendaciones de la CSS, y determinar variables asociadas con mal pronóstico vital.
Pacientes y método
Diseño: se realizó un estudio prospectivo, descriptivo, de cohorte única, en cinco UCI medico/quirúrgicas (70 camas operativas) pertenecientes a cinco centros hospitalarios del tercer nivel, todos ubicados en Montevideo, representando tres al subsector público (Hospital de Clínicas, Hospital Español y Hospital Policial) y dos al subsector privado (Asociación Española y Centro de Asistencia del Sindicato Médico del Uruguay). El protocolo del estudio fue aprobado por el Comité de Ética del centro de referencia (Hospital de Clínicas), donde se obtuvo consentimiento informado escrito, siendo para el resto de los centros solicitado de forma oral. La negativa a participar por parte del paciente o su representante legal fue motivo de exclusión.
El diagnóstico de síndrome de respuesta inflamatoria sistémica (SIRS), sepsis, SS y ShS se hizo de acuerdo con los criterios del Colegio Americano de los Médicos del Tórax/Sociedad de Cuidados Críticos de Estados Unidos (ACCP/SCCM)(29). Para el diagnóstico de las disfunciones inducidas por sepsis se utilizaron las definiciones de las guías de la CSS de 2008(23). Para la valoración de comorbilidades y definición del estado inmunitario se utilizó el score de McCabe y Jackson(30).
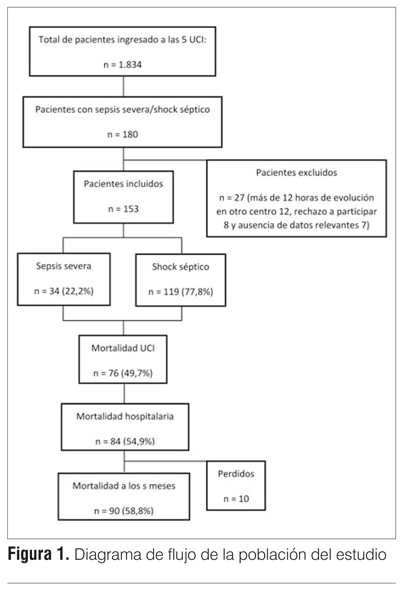
Población: se incluyeron todos los pacientes con 18 o más años que ingresaban a UCI, cuyo motivo de ingreso fue finalmente definido como SS o ShS, tomándose en consideración únicamente el primer episodio. Los pacientes ingresaban directamente a la UCI, o procedían de otros servicios de los centros participantes, o eran derivados de otros centros con una estadía menor a 12 horas en estos, lo cual se consideró criterio de exclusión de no cumplirse. En el período de un año (setiembre de 2011 a agosto de 2012) se valoraron 1.834 ingresos consecutivos, de los cuales 180 se diagnosticaron como SS o ShS, se incluyeron finalmente 153 pacientes y se excluyeron 27 por presentar estadía mayor a 12 horas previo al ingreso(12), rechazo a participar(8) o ausencia de datos y/o incongruencia de estos(7) (figura 1).
Variables analizadas
- Variables demográficas: edad, sexo, estado inmunitario(30), Acute Physiology and Chronic Health Evaluation II (APACHE II) en todos los pacientes, excepto en los fallecidos en las primeras 24 horas del ingreso a UCI.
- Variables relacionadas al episodio de sepsis: diagnóstico definitivo (foco de la sepsis), diagnóstico de origen según definición de Centros para el Control y la Prevención de Enfermedades (CDC)(31), microorganismo identificado, bacteriemia, presencia de shock(23).
- Variables asistenciales en las primeras 48 horas de evolución: demora de ingreso a UCI, diagnóstico inicial (primer planteo diagnóstico registrado en la historia clínica), valor de lactato a las 6-24-48 horas tras ingreso a UCI, demora en extracción de hemocultivos y otros cultivos relevantes (según foco), de acuerdo a las recomendaciones de CSS y documento de consenso de la Sociedad Española de Medicina de Urgencias y Emergencias (SEMES) y la Sociedad Española de Medicina Intensiva Crítica y Unidades Coronarias (SEMICYUC)(20,32,33), adecuación de la extracción de cultivos (si no existió demora en el envío de la muestra según lo establecido por guías de la CSS o se relevaron insuficiente cantidad de sitios según foco)(20,32,33), demora en inicio de antimicrobianos(20,33), adecuación de la indicación de antimicrobianos iniciales (si se adecuó a recomendación de guías sobre antiboticoterapia preestablecidas de cada centro para el foco identificado o planteado), demora de drenaje del foco responsable(20), adecuación del drenaje del foco (si se realizó el procedimiento adecuado para el tipo de foco y severidad del paciente)(20,32). Presión arterial media (PAM) a las seis horas, presión venosa central (PVC) a las seis horas, saturación venosa central de oxígeno (SvcO2) a las seis horas, gasto urinario a las seis horas, indicación de glucocorticoides, realización de glicemias seriadas, objetivo de control de glicemia, todos estos objetivos en base a recomendación de guías de la CSS 2008(20,33,34). Tiempo desde el ingreso al inicio de la asistencia respiratoria mecánica (ARM), ARM adecuada (presión plateau mantenida <30 cm H2O) para todos los pacientes en ARM y en caso de síndrome de distrés respiratorio del adulto (SDRA) cumplir con las recomendaciones de la SSC(20,34), tipo de vasopresor/inotrópico utilizado, balance hídrico en las primeras 48 horas, tipo de valoración hemodinámica realizada.
- Variables sobre estadía y pronóstico: duración de la ARM, estadía en la UCI y hospitalaria, mortalidad en UCI, hospitalaria y a los seis meses.
Captación y seguimiento: la recolección de datos se realizó en un formulario especialmente diseñado y estuvo a cargo de uno o dos médicos por centro pertenecientes a la UCI. Se realizó en el servicio que se encontraba internado el paciente tras ingresar o al inicio de los signos o síntomas de sepsis, de considerarse los registros confiables y completos. El seguimiento se realizó hasta el fallecimiento del paciente o alta hospitalaria, con una segunda instancia de revaloración de la historia clínica y de ser posible contacto telefónico con el paciente o familiares para completar datos sobre variables pronósticas.
Análisis estadístico: se contó con una base de datos individual para cada centro y otra general con información de los cinco centros, habiéndose diseñado para el estudio en el sistema estadístico SPSS® versión 17.0, que también será empleado en el análisis. Para el análisis descriptivo se utilizó la mediana y rango intecuartílico (RIQ) a menos que sea señalado. Para el análisis estadístico univariado para factores de riesgo de muerte hospitalaria se utilizaron en la comparación de variables cualitativas el test de chi cuadrado y el test de Fisher cuando esto fue necesario. En tanto que para las variables cuantitativas se utilizó el método t de Student o test no paramétrico de Mann-Whitney U en función de si se cumplían los criterios de normalidad (Kolmogorov-Smirnov y Shapiro-Wilk). La asociación de las variables se expuso como riesgo relativo, con un intervalo de confianza de 95%, considerándose como estadísticamente significativo un valor de p menor a 0,05.
Para determinar la contribución independiente de cada variable se efectuó un análisis multivariado por regresión logística. La selección de las variables se realizó en base a los resultados del análisis univariado, incluyendo aquellas variables que presentaban un p < 0,10, así como variables de control relevantes según la bibliografía. Se realizó inicialmente introducción manual de las variables para valorar interacciones y variables confundentes y posteriormente un procedimiento automático por técnica de Wald hacia atrás. La calibración del modelo se realizó con la prueba de bondad de ajuste de Hosmer-Lemeshow.
Resultados
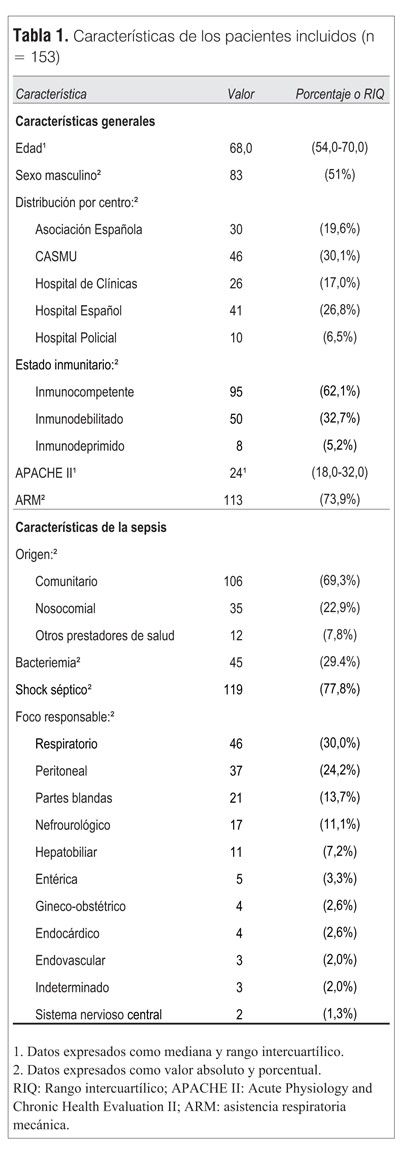
Características demográficas: se identificaron 153 pacientes con una mediana de edad de 68,0 (54,0-70,0), presentando 89 pacientes (58,2%) 65 o más años (adulto mayor), 51% fueron de sexo masculino. El 62,1% se consideraron inmunocompetentes (95/153), inmunodebilitados 32,7% (50/153) e inmunodeprimidos o comprometidos 5,2% (8/153). La mediana de APACHE II fue de 24,0 (18,0-32,0), 77,8% (119/153) presentaron durante las primeras 48 horas shock catalogado como de origen séptico y 73,9% (113/153) requirieron ARM.
Características de los episodios de sepsis: se catalogaron como de origen comunitario el 69,3% (106), nosocomiales el 22,9% (35) y de otros prestadores de salud (principalmente casa de salud y centros de diálisis) el 7,8%(12). Predominó el origen respiratorio 30,1%; peritoneal 24,2%; de partes blandas 13,7%, y nefrourológico 11,1%, lo cual se representa junto con datos demográficos en la tabla 1.
Se aislaron los microorganismos responsables en 64,1% (98/153) de los pacientes, siendo de origen bacteriano 95,9% (94/98), fúngico 2% (2/98), virales 1% y bacteriano/viral 1%. El 16,3% de los episodios fueron catalogados como polimicrobianos y 29,4% (45/153) presentaron bacteriemia, solo se identificó un episodio de fungemia (tabla 2). La distribución de los distintos microorganismos aislados en función del foco responsable y origen de este se resumen en la tabla 3.
Asistencia inicial y durante las primeras 48 horas: la mediana de demora en ingresar a UCI desde el inicio de la asistencia del paciente en el centro fue de 15,0 (5,0-42,0) horas. Se planteó sepsis como diagnóstico inicial por el equipo que asistió inicialmente al paciente en 37,9% (58/153), un proceso infeccioso localizado en 52,9% (81) y patología no infecciosa en 9,2% (14).
La mediana del tiempo de toma del primer hemocultivo (HC) fue 4,0 (1,5-17,0) horas y para otros cultivos relevantes según foco en 4,0 (1,4-4,0) horas. Se consideró adecuada la toma de cultivos según guías de la CSS(23) y el documento de consenso de SEMES-SEMICYUC(32) en 47,1%. La mediana de inicio de antibióticos desde el contacto con el paciente fue 3,0 (2,0-6,5) horas, siendo adecuado el plan inicial en 64,1% de acuerdo a guías de antibioticoterapia de referencia de cada centro. La mediana de tiempo para drenaje del foco en aquellos casos que se realizó fue 15,0 (6,8-40,5) horas, en 44,6% (33/78) se realizó antes de 12 horas, considerándose adecuado el control inicial de este en 30,8% (24/78) de los pacientes que lo requirieron según documento de consenso de SEMES-SEMICYUC(32).
En cuanto a las medidas vinculadas a la reposición hemodinámica, en 10,5% de los pacientes no se contó con valores de lactato en sangre en las primeras 48 horas; en 5,9% solo con uno y en el resto se obtuvieron dos o más. Las medianas del nivel de lactato en mmol/l fueron 2,3 (1,5-3,8) a las 6 horas; 2,0 (1,3-3,2) a las 24 horas, y 1,5 (RIQ 1,1-2,8) a las 48 horas. Se alcanzó el objetivo según la CSS incluidos en sus paquetes de medidas (bundles) de reanimación y manejo (23,33) para PAM en 71,9% (120/153); PVC 37,5% (57/153); SatvcO2 19,6% (30/153); diuresis 54,6% (84/153), y de control de glicemia en 31,3% para los pacientes que desarrollaron hiperglicemia de estrés (15/48). Se realizó un adecuado monitoreo de glicemia en las primeras 48 horas en 67,3% (103/153) de los pacientes.
Todos los pacientes fueron repuestos con cristaloides; 15,7% recibieron coloides en las primeras 48 horas (24/153), excepto un solo paciente que no recibió reposición durante el acto anestésico-quirúrgico; 28,8% (44/153) recibió concentrados de glóbulos rojos en este período (en su totalidad por anemia severa o durante el acto anestésico quirúrgico). Se utilizaron drogas inotrópicas o vasopresoras durante las primeras 48 horas en 110 pacientes (77,8%), siendo las más utilizadas: noradrenalina en 55,5% (61/110); la combinación noradrenalina/dobutamina 31,8% (35/110), y dopamina 9,1% (10/110). Se utilizaron glucocorticoides en 92,0% (58/63) de los pacientes que tenían indicación de hacerlo. Se realizó ARM adecuada en 89,6% de los pacientes con ventilación invasiva. Se valoró la hemodinamia mediante ecocardiografía en 71,2% (109/153) de los pacientes, con catéter de Swan Ganz en 1,3%(2) y técnicas que analizan la onda de pulso en 2,6%(4). Al 25,5% no se le realizó ninguna de estas.
Evolución y pronóstico: la estadía en UCI fue de 12,0 (5,0-22,0) y hospitalaria de 19,0 (11,0-31,5) días, con una mediana de ARM de 8,0 (3,0-16,0) días. La mortalidad en UCI fue de 49,7% (76/153), a nivel hospitalario de 54,9% (84/153) y a los seis meses de 58,8% (90/143).
Análisis del riesgo y asociación con mortalidad hospitalaria
Presentaron mayor mortalidad cuanto más elevada era la edad de los pacientes en años (p=0,001) con un riesgo relativo (RR) de 1,03 (1,02-1,06); los mayores de 65 años (adultos mayores) (p=0,0002) con un RR de 3,45 (1,76-6,78); los que presentaron algún tipo de inmunodebilidad o compromiso (p=0,016) RR 3,56 (1,27-9,99); aquellos que requirieron ARM (p=0,028) con un RR de 2,27 (1,09-4,73); cuanto mayor fue el APACHE II (p=0,0004) con RR 1,3 (1,08-1,18), y los que presentaron shock durante las primeras 48 horas (p=0,009) RR 2,81 (1,27-6,21).
Dentro de las medidas diagnósticas y terapéuticas, presentaron una mortalidad hospitalaria aumentada cuanto mayor fue la demora de ingreso a UCI en horas (p=0,002) RR 1,01 (1,00-1,02); del inicio de antimicrobianos en horas (p=0,048) RR 1,05 (1,00-1,09); inadecuación de la terapia antimicrobiana (p=0,021) RR 2,23 (1,12-4,44); aquellos que mantuvieron valores de lactato más elevados a las 48 horas (mmol/l) (p=0,0001) RR 1,53 (1,13-2,07); no alcanzar objetivos de PAM (p=0,021) RR 2,39 (1,13-5,07); no alcanzar objetivo de diuresis (p=0,008) RR 2,41 (1,25-4,68); en los que se utilizó patrón ventilatorio inadecuado (p=0,001) con RR 1,83 (1,56-2,16); presentaron mayor balance positivo en litros en las primeras 48 horas (p=0,002) RR 1,19 (1,05-1,34), y mayor duración de la ARM en días (p=0,028) RR 1,19 (1,05-1,34) (tabla 4).
Para el análisis multivariado de asociación de distintas variables con muerte hospitalaria se incluyeron las siguientes variables: la edad en años, presencia de inmunocompromiso o debilidad, APACHE II al ingreso a UCI, necesidad de ARM, presencia de shock, tiempo de demora de ingreso a UCI desde el inicio de la asistencia en horas, tiempo de demora de inicio de antimicrobianos en horas, drenaje de foco luego de 12 horas del inicio de la asistencia, nivel de lactato a las 6 y 48 horas, patrón ventilatorio inadecuado y el balance hídrico en litros durante las primeras 48 horas de asistencia, descartándose otras variables por considerarse factores de confusión. Se asociaron finalmente como factores de riesgo de mayor mortalidad hospitalaria la edad (p=0,016), APACHE II (p=0,003), inmunocompromiso/debilidad (p=0,0004), demora de ingreso a UCI (p=0,046), demora de inicio de antimicrobianos (p=0,025) y balance en las primeras 48 horas (p=0,01) (tabla 5).
Discusión
Creemos que las principales virtudes de este estudio son las siguientes: ser el primer estudio prospectivo y multicéntrico de Uruguay en publicarse con datos sobre la realidad epidemiológica de esta patología en el país; valorar la implementación de distintas medidas diagnósticas y terapéuticas recomendadas por la CSS como punto de partida para establecer mejoras en la asistencia a futuro; determinar variables asociadas con mal pronóstico vital (mortalidad hospitalaria) en nuestra población.
Los procesos infecciosos responsables tuvieron su origen predominantemente a nivel respiratorio, intraabdominal y nefrourológico al igual que se observa en distintas series internacionales, siendo las partes blandas un origen con frecuencia variable en estas publicaciones(2,8-13,35). Estos cuatro focos representaron en conjunto 79% de las sepsis. Hallazgos similares se encontraron en las otras dos series publicadas en nuestro medio(4,5), donde a pesar de las diferencias metodológicas existentes entre estos artículos, se evidencia el descenso progresivo del foco gineco-obstétrico, pensamos que vinculado a políticas sanitarias adoptadas en el país en este período. Se identificó el patógeno responsable en 64,1% de los pacientes, lo cual es similar a lo evidenciado en series de países desarrollados(2,8-10,35) y en las series nacionales ya mencionadas(4,5). Se mantiene un perfil con predominio de los BGN como principales patógenos, con menos frecuencia de participación de CGP y hongos comparado a lo observado en estas(2,6,8-10,35). La mayoría de los autores coinciden en un aumento progresivo de episodios causados por CGP, que se atribuye al incremento del uso de procedimientos invasivos y estadías hospitalarias más prolongadas. Desde este punto de vista podemos considerar que la epidemiología observada en este estudio represente una etapa previa de la transición epidemiológica a este fenómeno o que pueda estar vinculado a los criterios de selección del estudio, ya que al limitarse únicamente al episodio que motiva el ingreso a la UCI, disminuyen los episodios de origen nosocomial donde los CGP y hongos constituyen patógenos más frecuentes. Existen, a su vez, grandes series de reciente publicación, como el European Prevalence of Infection in Intensive Care (EPIC II) Study(9), donde se obtuvo un perfil microbiológico similar al de este estudio. La baja frecuencia de identificación de agentes fúngicos y también para los virales puede atribuirse en parte a limitaciones aún presentes en los laboratorios de microbiología en nuestro medio, con escaso o nulo acceso a técnicas diagnósticas moleculares, así como detección de antígenos virales o fúngico, que afortunadamente se han introducido progresivamente en los últimos años. Es de destacar además la ausencia o bajo cumplimento de protocolos para la toma de hemocultivos, lo cual creemos se ve reflejado en el bajo porcentaje de bacteriemias y de fungemias identificadas(9,10,12), lo cual no fue evaluado en este estudio.
Existe un descenso progresivo de la mortalidad en UCI con respecto a los estudios publicados previamente en nuestro país, siendo de 71,4%, 55% y 49,7% para los estudios de Correa Rivero H y colaboradores (1975)(5), Rieppi G y colaboradores (2006)(4) y el presente trabajo, respectivamente. La mortalidad observada es similar que en otros países de la región, siendo algo más elevada que la reportada actualmente en los países desarrollados tras la implementación de las estrategias para el manejo de la sepsis ya mencionadas(2,6,8-13,35). En el estudio PROGRESS(10) se reportó una mortalidad para SS y ShS, para Brasil y Argentina, de 56,1% y 46,6% a nivel de la UCI, y 67,4% y 56,6% hospitalaria, respectivamente. Rodríguez F y colaboradores(12), en un estudio que incluyó 10 UCI en Colombia, constataron una mortalidad de 22,3% para SS y 45,6% para el ShS a los 28 días. Debemos tener en cuenta que existe una gran variabilidad entre las distintas series en cuanto al tipo de pacientes incluidos (severidad, críticos en general o poblaciones específicas, definición de sepsis utilizada, etcétera), presentando la población incluida en este trabajo una elevada edad promedio, predominio de focos con mayor mortalidad asociada como son el respiratorio (30,0%) y peritoneal (24,2%), con un importante porcentaje de inmunodebilitados o comprometidos (37,9%), elevado APACHE II, y en la cual 77,8% presentaron shock séptico. Esto probablemente se relacione con la característica de los centros participantes, siendo hospitales de referencia nacional donde se manejan pacientes de alta complejidad y con importante comorbilidad. Se incluyeron además solo pacientes que ingresaron a UCI con este diagnóstico, lo que genera un sesgo de selección, tratándose de los pacientes con mayor severidad inicial o que presentaron una evolución desfavorable.
Relacionado a esto último, se observaron tiempos promedios prolongados para el ingreso de los pacientes a la UCI (15,0, 5,0-42,0 horas), donde en general los pacientes tienen su primer contacto con médicos intensivistas, existiendo grandes diferencias entre los distintos centros. La falta de reconocimiento inicial de la SS y ShS (62,1%) como tal puede estar relacionado a este mismo aspecto. Múltiples trabajos han demostrado que el retraso en el ingreso a UCI aumenta la morbimortalidad de los pacientes críticos(36,37), y en particular de los pacientes sépticos(3,25,38).
El bajo nivel de cumplimiento de los paquetes de medidas de resucitación (primeras 6 horas) y manejo de la sepsis (primeras 48 horas) no sorprende, ya que se han obtenido resultados similares en estudios internacionales de países que cuentan con mayores recursos(25,39). En éstos, la implementación de programas basados en las guías de la CSS se asoció a una mejora continua y sostenida de los cuidados de este tipo de pacientes, con disminución de la mortalidad(24,25,39,40) e incluso resultan costo/efectivas(40). Similares resultados se observaron en la serie de Rieppi G y colaboradores(4), lo cual puede interpretarse como el fracaso en nuestro medio en implementar estas mejoras.
Los resultados obtenidos en este trabajo intentan reflejar la situación epidemiológica de la sepsis en Uruguay en vistas a la implementación de estrategias a futuro, tratando de implicar al personal dentro y fuera de las áreas de cuidados intensivos, siendo en estos últimos donde en general encontramos las mayores limitaciones para el abordaje de esta patología. En base a estos datos sería posible evaluar cambios tras intervenir en el proceso asistencial, ya sea a nivel general o puntos específicos del proceso identificados, como son el tiempo de administración de antibióticos y la adecuación del empleo de estos, en los cuales existe mayor evidencia sobre su impacto en la sobrevida (21). Por otro lado, debemos considerar importantes críticas existentes hacia las guías de la CSS, principalmente por la calidad de la evidencia en que se basan para realizar sus recomendaciones, así como el grado que en base a esta se les adjudica, y la necesidad de cambios organizativos profundos para su aplicación adecuada y obtención de estos resultados favorables mencionados(28,29).
Pensamos que otra virtud del trabajo es el haber identificado variables asociadas a una mayor mortalidad de estos pacientes en nuestro medio (tabla 5). Algunas como la edad, APACHE II e inmunocompromiso o debilidad se relacionan a características propias de la población analizada y nos permiten identificar grupos de mayor riesgo vital dentro de esta. Otras, como la demora en el inicio de antimicrobianos, ingreso a UCI y el balance positivo acumulado en las primeras 48 horas, identifican áreas donde implementar mejoras asistenciales que generen a su vez mejoras en el pronóstico de este grupo de pacientes, como lo demuestran los trabajos de Barochia y colaboradores(24) y Boyd y colaboradores(1), respectivamente.
Entre las limitaciones de este estudio podemos resaltar el bajo número de centros que se incluyeron (a pesar de brindar una cobertura para aproximadamente 800.000 habitantes), que estos se concentran en la capital del país y que la inclusión fue de forma voluntaria, todo lo cual genera una limitación para la generalización de los resultados obtenidos. Se decidió incluir solo a los pacientes que ingresaban a las UCI con dicho diagnóstico, por lo que quedan excluidos del trabajo aquellos episodios de origen nosocomial propios de la UCI, a diferencia de otras series publicadas.
Conclusiones
El presente estudio prospectivo realiza una aproximación a la epidemiología de pacientes que ingresan con SS y ShS en nuestro medio, valorando cinco UCI de centros terciarios de Montevideo. Se presenta como una patología con elevada mortalidad, con formas severas, predominando en una población envejecida y con compromiso inmunitario. Se identificaron la edad, el APACHE II al ingreso, la presencia de inmunocompromiso o debilidad, la demora de ingreso a UCI, la demora en el inicio de antimicrobianos y el balance positivo en las primeras 48 horas como variables predictoras de mayor mortalidad hospitalaria, así como factores a considerar para desarrollar una adecuada estrategia terapéutica. Creemos que estas observaciones serán útiles para implementar mejoras en la asistencia de este grupo de pacientes, así como para el diseño futuro de nuevos estudios en este campo.
Abstract
Objective: to learn about the epidemiological characteristics of patients who are admitted for severe sepsis (SS) and septic shock (Ssh); to assess the implementation of recommendations in the Surviving Sepsis Campaign and to determine variables associated to a bad vital prognosis.
Design: prospective, observational study, single cohort, multi-center, conducted in five centers in Montevideo, the public and private sub-sector with coverage for 800,000 inhabitants during one year (September 2011- August 2012).
Method: 153 patients who were consecutively admitted with a SS and Ssh diagnosis in the intensive care units.
Main relevant variables: those related to characteristics of patients themselves and the sepsis episode, diagnostic and therapeutic measures according to the Surviving Sepsis Campaign in the first 48 hours, and prognostic in the ICU, the hospital and six months later.
Results: 153 patients were included, average age was 68 years old and APACHE II 24; 73.9 % of patients needed mechanic ventilation during an average of 8 days. Median length of stay in the ICU was 12 and median hospital stay was 19 days.
69.3% of sepsis were community acquired, 77.8% evidenced shock and 37.9% presented immune deficiency were immunocompromised. Respiratory origin prevailed in 30.2% of patients and in 64.1% of patients the microorganism was identified, bacteria being 95.9% of cases.
Mortality in the ICU was 49.7%, in the hospital it was 54.9% and 58.8%. The following were associated to a greater hospital mortality: APACHE II, immune-deficiency, delays in admittance to the ICU and initiation of antimicrobial, and positive balance.
Conclusions: patients were admitted to the ICU with severe forms and/or compromised biological condition. There are delays and limitations in the diagnosis and initial treatment, situations that are associated to a greater mortality in hospital.
Resumo
Objetivo: conhecer as características epidemiológicas dos pacientes admitidos por Sepse Severa (SS) e Choque Séptico (ShS); avaliar a implementação das recomendações da Campanha Sobreviver à Sepse (CSS) e determinar variáveis associadas com mal prognóstico vital.
Estudo: prospectivo, observacional, coorte única, multicêntrico, realizado em cinco centros, dos setores público e privado, de Montevidéu, com cobertura de 800.000 habitantes, no período setembro 2011 - agosto 2012.
Pacientes e métodos: pacientes com diagnóstico de SS e ShS admitidos, em forma consecutiva, nas Unidades de Cuidados Intensivos (UCI).
Foram estudadas as variáveis relacionadas com as características do paciente e com o episódio de sepse, as medidas diagnósticas e terapêuticas segundo a CSS nas primeiras 48 horas, e as prognósticas na UCI, no hospital e aos 6 meses.
Resultados: foram incluídos 153 pacientes; a mediana de idade foi 68 anos e de APACHE II 24; em 73,9% dos pacientes foi feita assistência respiratória mecânica - ARM, com uma mediana de 8 dias. As medianas de dias de permanência foram 12 dias na UCI e 9 no hospital.
69.3% das Sepses foram comunitárias, 77,8% apresentaram choque e 37,9% imunodebilidade-imunocompromisso. Na maioria dos pacientes a origem foi respiratória (30,1%) e foi possível isolar o microrganismo em 64,1%, sendo bactérias em 95,9% dos casos.
A mortalidade na UCI foi de 49,7%, a hospitalar 54,9% e aos 6 meses 58,8%. Estavam associados a maior mortalidade hospitalar: idade, APACHE II, imunodebilidade-compromisso, demora na admissão a UCI e início de antimicrobianos, e balance positivo.
Conclusões: os pacientes foram admitidos nas UCI com formas severas de sepse e/ou estado biológico comprometido. Existem demoras e limitações no diagnóstico e na terapêutica inicial, situações que estão associadas a maior mortalidade hospitalar.
Bibliografía
1. Boyd JH, Forbes J, Nakada TA, Walley KR, Russell JA. Fluid resuscitation in septic shock: a positive fluid balance and elevated central venous pressure are associated with increased mortality. Crit Care Med 2011; 39(2):259-65.
2. Angus DC, Linde-Zwirble WT, Lidicker J, Clermont G, Carcillo J, Pinsky MR. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care. Crit Care Med 2001; 29(7):1303-10.
3. Estenssoro E, González F, Laffaire E, Canales H, Sáenz G, Reina R, et al. Shock on admission day is the best predictor of prolonged mechanical ventilation in the ICU. Chest 2005; 127(2):598-603.
4. Rieppi G, Nin N, Lombardi R. Primer estudio epidemiológico de sepsis severa en Uruguay. Paciente Crít (Uruguay) 2006; 17:52-3.
5. Correa H, Bagnulo H, Hiriart JC, Bagattini JC. Sepsis: análisis de 80 casos en un Centro de Tratamiento Intensivo. Tórax. 1975; 24:168-81.
6. Martin GS, Mannino DM, Eaton S, Moss M. The epidemiology of sepsis in the United States from 1979 through 2000. N Engl J Med 2003; 348(16):1546-54.
7. Wang HE, Shapiro NI, Angus DC, Yealy DM. National estimates of severe sepsis in United States emergency departments. Crit Care Med 2007; 35(8):1928-36.
8. Levy MM, Artigas A, Phillips GS, Rhodes A, Beale R, Osborn T, et al. Outcomes of the Surviving Sepsis Campaign in intensive care units in the USA and Europe: a prospective cohort study. Lancet Infect Dis 2012; 12(12):919-24.
9. Vincent JL, Rello J, Marshall J, Silva E, Anzueto A, Martin CD, et al; EPIC II Group of Investigators. International study of the prevalence and outcomes of infection in intensive care units. JAMA 2009; 302(21):2323-9.
10. Beale R, Reinhart K, Brunkhorst FM, Dobb G, Levy M, Martin G, et al; PROGRESS Advisory Board. Promoting Global Research Excellence in Severe Sepsis (PROGRESS): lessons from an international sepsis registry. Infection 2009; 37(3):222-32.
11. Machado FR, Mazza BF. Improving mortality in sepsis: analysis of clinical trials. Shock 2010; 34(Suppl 1):54-8.
12. Rodríguez F, Barrera L, De La Rosa G, Dennis R, Dueñas C, Granados M, et al. The epidemiology of sepsis in Colombia: a prospective multicenter cohort study in ten university hospitals. Crit Care Med 2011; 39(7):1675-82.
13. Dougnac A, Mercado M, Cornejo R, Cariaga M, Hernández G, Andresen M, et al; Grupo Chileno del Estudio de la Sepsis. Prevalencia de sepsis grave en las Unidades de Cuidado Intensivo: primer estudio nacional multicéntrico. Rev Méd Chile 2007; 135(5):620-30.
14. Iñigo J, Sendra J.M, Díaz R, Bouza C, Sarría-Santamera A. Epidemiología y costes de la sepsis grave en Madrid: estudio de altas hospitalarias. Med Intensiva 2006; 30(5):197- 203.
15. Burchardi H, Schneider H. Economic aspects of severe sepsis: a review of intensive care unit costs, cost of illness and cost effectiveness of therapy. Pharmacoeconomics 2004; 22(12):793-813.
16. Heyland DK, Hopman W, Coo H, Tranmer J, McColl MA. Long-term health-related quality of life in survivors of sepsis. Short Form 36: a valid and reliable measure of health-related quality of life. Crit Care Med 2000; 28(11) :3599-605.
17. Kollef MH, Sherman G, Ward S, Fraser VJ. Inadequate antimicrobial treatment of infections: a risk factor for hospital mortality among critically ill patients. Chest 1999; 115(2):462-74.
18. The Acute Respiratory Distress Syndrome Network. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med 2000; 342(18):1301-8.
19. Rivers E, Nguyen B, Havstad S, Ressler J, Muzzin A, Knoblich B, et al; Early Goal-Directed Therapy Collaborative Group. Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med 2001; 345(19):1368-77.
20. van den Berghe G, Wouters P, Weekers F, Verwaest C, Bruyninckx F, Schetz M, et al. Intensive insulin therapy in critically ill patients. N Engl J Med 2001; 345(19):1359-67.
21. Bernard GR, Vincent JL, Laterre PF, LaRosa SP, Dhainaut JF, Lopez-Rodriguez A, et al; Recombinant human protein C Worldwide Evaluation in Severe Sepsis (PROWESS) study group. Efficacy and safety of recombinant human activated protein C for severe sepsis. N Engl J Med 2001; 344(10):699-709.
22. Annane D, Sébille V, Charpentier C, Bollaert PE, François B, Korach JM, et al. Effect of treatment with low doses of hydrocortisone and fludrocortisone on mortality in patients with septic shock. JAMA 2002; 288(7):862-71.
23. Dellinger RP, Levy MM, Carlet JM, Bion J, Parker MM, Jaeschke R, et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock: 2008. Crit Care Med 2008; 36(1):296-327.
24. Barochia AV, Cui X, Vitberg D, Suffredini AF, O’Grady NP, Banks SM, et al. Bundled care for septic shock: an analysis of clinical trials. Crit Care Med 2010; 38(2):668-78.
25. Levy MM, Dellinger RP, Townsend SR, Linde-Zwirble WT, Marshall JC, Bion J, et al; Surviving Sepsis Campaign. The Surviving Sepsis Campaign: results of an international guideline-based performance improvement program targeting severe sepsis. Crit Care Med 2010; 38(2):367-74.
26. Eichacker PQ, Natanson C, Danner RL. Surviving sepsis: practice guidelines, marketing campaigns, and Eli Lilly. N Engl J Med 2006; 355(16):1640-2.
27. Marik PE. Early management of severe sepsis: concepts and controversies. Chest 2014; 145(6):1407-18.
28. Palencia Herrejón E, Bueno García B. Nuevas guías de práctica clínica de la «Campaña sobrevivir a la sepsis»: lectura crítica. Med Intensiva 2013; 37(9):600-4.
29. American College of Chest Physicians. Society of Critical Care Medicine Consensus Conference: definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. Crit Care Med 1992; 20(6):864-74.
30. McCabe WR, Jackson GG. Gram negative bacteriemia I: etiology and ecology. Arch Intern Med 1962; 110(6):847-55.
31. Horan TC, Andrus M, Dudeck MA. CDC/NHSN surveillance definition of health care-associated infection and criteria for specific types of infections in the acute care setting. Am J Infect Control 2008; 36(5):309-32.
32. León Gil C, García-Castrillo Riesgo L, Moya Mir MS, Artigas Raventós A, Borges Sa M, Candel González FJ, et al. Documento de consenso (SEMES-SEMICYUC): recomendaciones del manejo diagnóstico-terapéutico inicial y multidisciplinario de la sepsis grave en los servicios de urgencias hospitalarios. Emergencias 2007; 19(5):260-72.
33. Society of Critical Care Medicine, Surviving Sepsis Campaign Executive Committee. Severe sepsis bundles. Disponible en: http://www.survivingsepsis.org/Bundles/Pages/default.aspx. (Consulta: 15 diciembre 2010).
34. Blanco J, Muriel-Bombín A, Sagredo V, Taboada F, Gandía F, Tamayo L, et al; Grupo de Estudios y Análisis en Cuidados Intensivos. Incidence, organ dysfunction and mortality in severe sepsis: a Spanish multicentre study. Crit Care 2008; 12(6):R158.
35. Young MP, Gooder VJ, McBride K, James B, Fisher ES. Inpatient transfers to the intensive care unit: delays are associated with increased mortality and morbidity. J Gen Intern Med 2003; 18(2):77-83.
36. Chalfin DB, Trzeciak S, Likourezos A, Baumann BM, Dellinger RP; DELAY-ED study group. Impact of delayed transfer of critically ill patients from the emergency department to the intensive care unit. Crit Care Med 2007; 35(6):1477-83.
37. Esteban A, Frutos-Vivar F, Ferguson ND, Peñuelas O, Lorente JA, Gordo F, et al. Sepsis incidence and outcome: contrasting the intensive care unit with the hospital ward. Crit Care Med 2007; 35(5):1284-9.
38. Ferrer R, Artigas A, Levy MM, Blanco J, González-Díaz G, Garnacho-Montero J, et al; Edusepsis Study Group. Improvement in process of care and outcome after a multicenter severe sepsis educational program in Spain. JAMA 2008; 299(19):2294-303.
39. Noritomi DT, Ranzani OT, Monteiro MB, Ferreira EM, Santos SR, Leibel F, et al. Implementation of a multifaceted sepsis education program in an emerging country setting: clinical outcomes and cost-effectiveness in a long-term follow-up study. Intensive Care Med 2014; 40(2):182-91.














