Services on Demand
Journal
Article
Related links
Share
Revista Médica del Uruguay
Print version ISSN 0303-3295On-line version ISSN 1688-0390
Rev. Méd. Urug. vol.32 no.3 Montevideo Sept. 2016
Estudio del ratio de FLT3-ITD como factor pronóstico en leucemias agudas mieloides: primeros casos estudiados en Uruguay
Msc. Evangelina González*, Dras. Sofía Grille†, Valeria Vales‡, Matilde Boada§, Bq. Clínica Lorena M. Zanella¶, Dr. Daniel Leal**, Bq. Clínico Nehuen P. Gasparini¶, Dras. Cecilia Guillermo††, Evangelina E. Agriello‡‡, Mariana Stevenazzi††, Daniela Lens§§
Resumen
Introducción: en los últimos años ha existido un avance significativo en el conocimiento biológico de la leucemia aguda mieloide (LAM) que se ha traducido en que el tratamiento de los pacientes afectados se realice guiado por el perfil citogenético y molecular. Las duplicaciones internas en tándem del gen FLT3 (FLT3-ITD) representan las mutaciones más frecuentes en LAM y confieren un mal pronóstico en pacientes con riesgo citogenético intermedio. Se ha reportado que la presencia de un ratio FLT3-ITD elevado (relación entre cantidad de alelo portador de ITD y de alelo salvaje) confiere un mayor pronóstico adverso. Objetivo: estandarizar una técnica, no disponible en Uruguay, para determinar el ratio de FLT3-ITD en pacientes portadores de LAM de riesgo citogenético intermedio. Discutir los primeros casos de LAM FLT3+ a los que se realizó el ratio. Material y método: para la detección de FLT3-ITD se amplificó un fragmento correspondiente a los exones 14 y 15 del gen en muestras de médula ósea al debut de la enfermedad. En los casos positivos se determinó el ratio de FLT3-ITD mediante análisis de fragmentos por electroforesis capilar. Resultados: en este trabajo mostramos la estandarización de un método para la determinación del ratio de FLT3-ITD y los primeros casos analizados en nuestro país. Se estudiaron 12 pacientes y se detectó la presencia de FLT3-ITD en tres de ellos. El ratio de FLT3-ITD encontrado fue en dos casos menor a 0,8 y en un caso mayor o igual a 0,8. Conclusiones: disponemos de una técnica de determinación del ratio de FLT3-ITD con importante valor pronóstico para pacientes portadores de LAM.
Palabras clave: LEUCEMIA MIELOIDE AGUDA
FLT3-ITD
ANÁLISIS CITOGENÉTICO
Key words: ACUTE MYELOID LEUKEMIA
FLT3-ITD
CYTOGENETIC ANALYSIS
* Licenciada en Bioquímica. Laboratorio de Citometría y Biología Molecular. Departamento Básico de Medicina. Hospital de Clínicas. Facultad de Medicina. Universidad de la República. Montevideo, Uruguay.
† Prof. Adjunta Departamento Básico de Medicina. Hospital de Clínicas. Facultad de Medicina. Universidad de la República. Montevideo, Uruguay.
‡ Posgrado de Hematología. Cátedra de Hematología. Hospital de Clínicas. Facultad de Medicina. Universidad de la República. Montevideo, Uruguay.
§ Asistente. Departamento Básico de Medicina. Hospital de Clínicas. Facultad de Medicina. Universidad de la República. Montevideo, Uruguay.
¶ Lic. en Bioquímica, LEB laboratorio. Bahía Blanca, Argentina.
** Asistente. Cátedra de Hematología. Hospital de Clínicas. Facultad de Medicina. Universidad de la República. Montevideo, Uruguay.
†† Prof. Agregada Cátedra de Hematología. Hospital de Clínicas. Facultad de Medicina. Universidad de la República. Montevideo, Uruguay.
‡‡ Prof. Agregada. Directora LEB laboratorio. Docente en Cátedra de Hematología Clínica, Universidad Nacional del Sur. Bahía Blanca, Argentina.
§§ Prof. Agregado. Laboratorio de Citometría y Biología Molecular. Departamento Básico de Medicina. Hospital de Clínicas. Facultad de Medicina. Universidad de la República. Montevideo, Uruguay.
Correspondencia: Dra. Daniela Lens. Laboratorio de Citometría y Biología Molecular. Departamento Básico de Medicina. Hospital de Clínicas. Av. Italia s/n. Piso 15. CP 11600. Montevideo, Uruguay. Correo electrónico: daniela.lens @gmail.com.
Los autores declaran que han participado en el trabajo están de acuerdo con el contenido del manuscrito y declaran no tener conflicto de intereses.
Recibido: 10/10/15 Aprobado: 6/1/16
Introducción
En los últimos años ha existido un avance vertiginoso en el conocimiento biológico de la leucemia aguda mieloide (LAM), que se ha traducido en que el tratamiento de los pacientes afectados se realice adaptado al riesgo, guiado por el perfil citogenético y molecular de las clonas leucémicas(1). La incorporación de marcadores moleculares ha permitido mejorar la estratificación pronóstica de los pacientes con cariotipo de riesgo intermedio y es esencial en la actualidad para el manejo clínico de este subgrupo de enfermos(2). Las mutaciones en el gen FLT3 (FMS-like tyrosine kinase 3) representan las mutaciones más frecuentemente halladas en LAM y dentro de ellas las duplicaciones internas en tándem (FT3-ITD) son las de mayor importancia pronóstica(3). FLT3-ITD se observa en la LAM con un prevalencia entre 20% y 27%(4-6). Las mutaciones de FLT3-ITD y las mutaciones de NPM1 o CEBP? condicionan de manera importante el pronóstico de los pacientes con cariotipo de riesgo intermedio y su estudio permite discriminar diferentes grupos de riesgo con diferencias en recaída y sobrevida libre de enfermedad (SLE)(2). La mayoría de los estudios publicados hasta la fecha coinciden en que el FLT3-ITD determina un pronóstico adverso(2,4-7). Esta mutación determina mayores tasas de recaída, menor SLE y en algunos trabajos menor sobrevida global (SG)(2,4-7). Thiede y colaboradores, utilizando un análisis por electroforesis capilar y determinando el ratio entre la cantidad del alelo mutado y la cantidad del alelo salvaje, reportaron que no todos los pacientes con FLT3-ITD tenían el mismo pronóstico adverso(6). Ellos publicaron que la mediana de este ratio fue de 0,78 (rango 0,03-32,56) e identificaron una menor SLE y SG en los pacientes con un ratio mayor a 0,78 con respecto a los pacientes sin mutaciones de FLT3-ITD. Para los pacientes con un ratio menor a 0,78, la SLE y SG fue similar a la observada en pacientes sin mutaciones de FLT3-ITD. En el análisis multivariante, el cociente entre el alelo mutado y el alelo salvaje resultó ser un factor pronóstico independiente para SLE y SG(6). Estos resultados están de acuerdo con lo publicado por el grupo Cancer And Leukemia Group B (CALGB), en que se reporta una incidencia de 10% de pérdida completa del alelo salvaje en los pacientes con mutaciones de FLT3-ITD, siendo este el principal factor pronóstico(8). En este mismo sentido, Schlenk y colaboradores reportaron recientemente que la tasa de remisiones completas con la quimioterapia de inducción disminuye con el incremento del ratio de FLT3-ITD y que los pacientes con un ratio mayor a 0,5 tienen peor SLE y SG independientemente de si se realiza consolidación con trasplante de progenitores hematopoyéticos alogénicos (allo-TPH). En pacientes con ratio FLT3-ITD mayor a 0,5 la realización de allo-TPH se asoció con mejores resultados, mientras que en los de ratio menor a 0,5, el allo-TPH no modificó los resultados con respecto a la quimioterapia intensiva o trasplante autólogo(9). Este trabajo demuestra la importancia de realizar una adecuada valoración pronóstica para decidir la mejor estrategia de consolidación.
Teniendo en cuenta estos antecedentes, nuestro objetivo fue estandarizar e introducir en nuestro medio una técnica para la valoración del ratio de FLT3-ITD en pacientes con LAM. Se presentan aquí los resultados de los primeros casos estudiados en nuestro país.
Pacientes, material y método
Pacientes
Se incluyeron 12 pacientes diagnosticados en la Cátedra de Hematología del Hospital de Clínicas que presentaban una LAM de riesgo citogenético intermedio. En el apartado de resultados se exponen en forma resumida los casos clínicos de los tres pacientes que resultaron positivos para FLT3-ITD y para los cuales se determinó el ratio de FLT3-ITD.
Extracción de ácido desoxirribonucleico
La extracción de ácido desoxirribonucleico genómico (ADNg) se realizó a partir de 150 ?L de médula ósea anticoagulada con EDTA obtenida al debut de la enfermedad, utilizando el kit comercial Quick gDNA Miniprep (Zymo Research) y siguiendo el protocolo indicado por el fabricante. Las muestras de ADNg fueron conservadas a -20 ºC hasta su utilización.
Detección de la mutación de FLT3-ITD
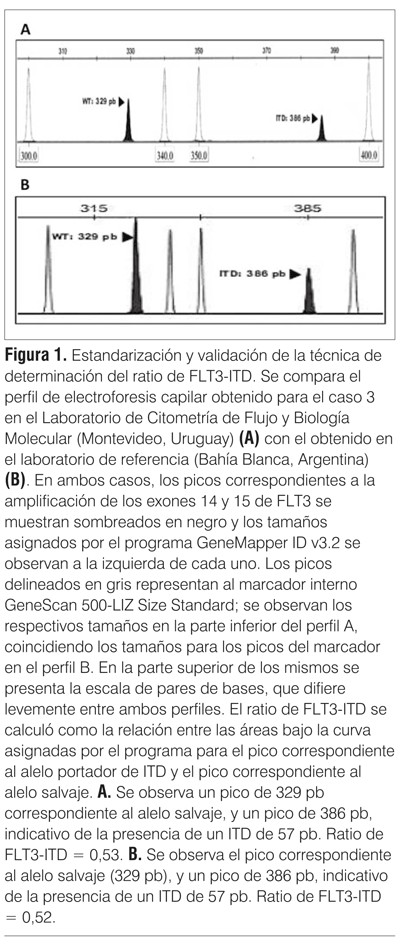
Se estudió la presencia de ITD en el dominio yuxtamembrana (JM) de FLT3 (exones 14 y 15) a partir de ADNg mediante técnica de PCR (reacción en cadena de la polimerasa) según el método publicado por Kiyoi y colaboradores con algunas modificaciones(7). Se utilizaron cebadores específicos FLT3-11F y FLT3-12R (tabla 1) que flaquean la región donde recaen las ITD. La amplificación de la secuencia salvaje determina un producto de 329 pares de bases (pb), mientras que los pacientes que posean ITD presentarán también productos de tamaños mayores. El control de las reacciones de PCR se realizó en un gel de agarosa al 2,5% en buffer TAE 1x, teñido con GoodView DNA Stain (SBS Genetech).
Estudio del ratio de FLT3-ITD
La determinación del ratio de FLT3-ITD, dado por la relación entre la cantidad del alelo portador de ITD y la cantidad del alelo salvaje, se realizó mediante análisis de fragmentos por electroforesis capilar, según el método publicado por Thiede y colaboradores con leves modificaciones(6). Para ello, se amplificó mediante PCR la región del dominio JM empleando cebadores con las mismas secuencias que los utilizados para la detección de ITD, pero encontrándose el cebador directo, FLT3-11F, marcado con el fluorocromo 6-FAM. La amplificación fue realizada en un volumen final de 25 ?L utilizando 1 ?L de ADN, 200 ?M de cada dNTP, 1 U de Taq DNA Polimerase Recombinant (Invitrogen), 1X de Buffer Taq, 1,5 mM MgCl2 y 0,5 ?M de cada cebador.
El programa de PCR utilizado consta de una desnaturalización inicial de 11 minutos a 95 ºC, seguida de 27 ciclos de 30 segundos a 94 ºC, 30 segundos a 57 ºC y 1 minuto a 72 ºC, finalizando con una extensión de 45 minutos a 60 ºC para favorecer la adición cuantitativa de +A en todas las moléculas amplificadas. Se incluyó siempre en todas las reacciones un control negativo. Para la verificación de la presencia de los productos esperados se utilizó un gel de agarosa al 2,5% en buffer TAE 1x, teñido con GoodView DNA Stain (SBS Genetech).
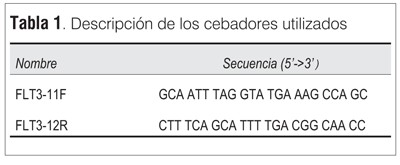
Para realizar la electroforesis capilar, los productos de PCR fueron diluidos a 1:5 con agua, agregando luego a 1 µL de esta dilución, 10 µL de formamida y 0,5 µL del marcador interno GeneScan 500-LIZ Size Standard (Applied Biosystems). Las muestras se desnaturalizaron mediante incubación a 98 ºC por cinco minutos, se colocaron durante un minuto en hielo, y finalmente se migraron en el equipo ABI Prism 3130 Genetic Analyzer (Applied Biosystems) del Instituto Nacional de Donación y Trasplante de Células, Tejidos y Órganos (INDT) del Hospital de Clínicas en las condiciones establecidas por el programa Fragment Analysis 36_POP4. Los resultados se analizaron utilizando el programa GeneMapper ID v3.2 (Applied Biosystems). El ratio de FLT3-ITD se calculó como la relación entre el área bajo la curva del pico correspondiente al alelo portador de ITD y el área bajo la curva del pico correspondiente al alelo salvaje.
Resultados
Se realizó la estandarización de la técnica de estudio del ratio de FLT3-ITD de acuerdo a lo establecido en material y método. Para la validación de los resultados se envió una muestra de ADN del caso 3 a un laboratorio de referencia, el Laboratorio de Especialidades Bioquímica LEB de Bahía Blanca, Argentina. Se compararon los valores de FLT3 ratio logrados en ambos laboratorios obteniéndose valores muy similares (0,52 versus 0,53) (figura 1).
A continuación se detallan los casos clínicos de los pacientes FLT3-ITD.
Caso 1
Paciente de sexo femenino de 49 años, sin antecedentes personales. ECOG (escala de performance status) = 0. Cinco hermanos consanguíneos.
Consultó por cuadro de una semana evolución de fiebre sin foco clínico evidente y sangrado mucoso (gingivorragia). De la paraclínica al debut presentaba hemograma con Hb 11,2 gr/dl, PLT 123 mil/mm3, leucocitos de 81.500, con una lámina periférica que evidenciaba 80% de blastos. El mielograma mostró una infiltración por blastos tipo monoblastos, el estudio de inmunofenotipo de medula ósea presentaba infiltración de 80% compatible con una leucemia monoblástica aguda.
Se realiza estudio citogenético, no mostrando alteraciones cromosómicas con cariotipo 46XX. El estudio molecular mostró la presencia de una ITD de 39 pb en FLT3 (figuras 2 y 3). El estudio del ratio fue de 0,82 (figura 3).
Se clasificó como una LAM sin anormalidades citogenéticas recurrentes, tipo monoblástica, de riesgo intermedio 1, según la European LeukemiaNet.
Se inicia tratamiento de inducción con daunorrubicina + citarabina (3+7). En la valoración posinducción se comprueba una remisión parcial con 6% de blastos mieloides por citología e inmunofenotipo. Procediendo a realizar un ciclo de reinducción con altas dosis de citarabina, quedando en remisión citomorfológica con enfermedad mínima residual (EMR) de 0,09%. Posteriormente, consolidación con altas dosis de citarabina y luego allo-TPH de hermano HLA idéntico. Instala GVHD (enfermedad de injerto versus huésped) aguda y luego crónica cutánea, digestiva y hepática de grado moderado. Fallece por sepsis a punto partida enteral en contexto de GVHD.
Caso 2
Paciente de sexo masculino de 66 años, con antecedentes personales de hipertensión arterial (HTA) sin tratamiento, diabetes mellitus tipo 2 en tratamiento con antidiabéticos orales con regular control metabólico, sin repercusiones de órgano blanco. ECOG 0. Sin hermanos consanguíneos.
Consulta en emergencia por síndrome febril de 20 días de evolución. Del hemograma al ingreso GB 700/mm3, PLT 16 mil/mm3, Hb 9,1g/dl. El mielograma muestra infiltración de 30% por blastos mieloides con finas granulaciones compatible con clasificación FAB M1. Inmunofenotipo compatible con LAM sin maduración.
En el estudio citogenético de medula ósea no se obtuvieron cultivos. El estudio molecular para la detección de la mutación FLT3 ITD fue positivo de 39 pb (figuras 2 y 3). El estudio del ratio fue de 0,37 (figura 3). No se detectó mutación de NPM1.
Se clasificó como LAM sin maduración, FLT3 positivo con riesgo intermedio 1, según la clasificación de la European LeukemiaNet.
Se realizó tratamiento con antibióticos dirigido al germen y su sensibilidad en paciente con neutropenia profunda. Luego de controlado el proceso infeccioso se comienza inducción con daunorrubicina + citarabina (3+7). Al séptimo día de inducción, fallece por disfunción orgánica múltiple en contexto de sepsis.
Caso 3
Paciente de sexo masculino, 65 años con antecedentes personales de HTA en tratamiento con inhibidores de la enzima conversora de angiotensina (IECA), hiperuricemia en tratamiento con allopurinol, y tabaquista. ECOG 0. Sin donante emparentado.
Consulta por síntomas de un mes de evolución dado por elementos de síndrome funcional anémico y odontalgia. Al examen físico evidenciaba lesión ulceronecrótica a nivel de arcada dentaria. Sin sangrados cutáneo-mucosos. Del hemograma al ingreso GB 64.900/mm3 sin fórmula, Hb 12g/dl, PLT 29 mil/mm3, en la lámina periférica presentaba 73% de blastos con citoplasma granular y algún bastón de Auer. Mielograma: sustitución de medula ósea por 84% de blastos mieloides con gránulos escasos. El inmunofenotipo de médula ósea informa 94% de blastos comprendiendo una LAM sin maduración.
Se realizó estudio citogenético de médula ósea que mostró un cariotipo normal, 46XY sin anormalidades citogenéticas. El estudio molecular evidenció la presencia de una ITD de 57 pb de FLT3 (figuras 2 y 3). El estudio del ratio fue de 0,53 (figura 3). El estudio de la mutación A en NPM1 fue positivo.
Se clasificó como una LAM sin anormalidades genéticas recurrentes, sin maduración, FLT3 positiva. Riesgo intermedio 1, según la European LeukemiaNet.
Se realiza tratamiento antibiótico dirigido a microbiología local de paciente neutropénico. Luego de control del proceso infeccioso se realizó inducción en base a idarrubicina + citarabina (3+7). Remisión completa citomorfológica, EMR de 0,01%. Se realizó consolidación con otro ciclo de 3+7 y con altas dosis de citarabina y trasplante autólogo de progenitores hematopoyéticos (auto TPH).
En suma: de los 12 pacientes con diagnóstico de LAM estudiados, tres presentaban la mutación de FLT3-ITD. Según el valor de corte utilizado por Thiede y colaboradores(6) para el ratio de FLT3 (mayor a 0,78) obtuvimos dos pacientes con un ratio FLT3 bajo y un paciente con ratio FLT3 elevado.
Discusión y conclusiones
En el presente trabajo hemos mostrado los primeros casos de estudio del ratio de FLT3-ITD utilizando análisis de fragmentos por electroforesis capilar en pacientes con LAM en nuestro país. Este trabajo se enmarca en un proyecto multidisciplinario del Laboratorio de Citometría y Biología Molecular del Departamento Básico de Medicina y la Unidad de Síndromes Mielodisplásicos y Leucemias Agudas de la Cátedra de Hematología del Hospital de Clínicas con el objetivo de mejorar las herramientas diagnósticas y pronósticas en pacientes con LAM en nuestro país.
El ratio de FLT3-ITD está influenciado por la cantidad de células malignas en relación con las normales en la muestra estudiada y por el porcentaje de células con 0, 1 o los 2 alelos mutados del gen FLT3. Varios estudios en los cuales el análisis genético se ha realizado empleando bancos de ADN de ensayos clínicos han concluido que la presencia de un ratio de FLT3-ITD elevado determina peor pronóstico en términos de tasa de recaída, SLE y SG. En el contexto de que la LAM es una enfermedad policlonal desde su inicio, el ratio de FLT3-ITD refleja en alguna medida la carga clonal de células portadoras de ITD en FLT3 en la población leucémica.
Disponer de esta técnica en nuestro país es de especial utilidad, ya que nos permite realizar una mejor terapéutica adaptada al riesgo de forma de ofrecer tratamientos más intensivos con mayor morbimortalidad solo en aquellos pacientes que son de alto riesgo.
En conclusión: disponemos de una técnica de determinación del ratio de FLT3-ITD en LAM utilizando tecnología especializada y con importante valor pronóstico para pacientes portadores de LAM.
Conflicto de intereses
Los autores declaran no tener conflicto de interés.
Agradecimientos
A todo el personal del Laboratorio del Instituto Nacional de Donación y Trasplante de Células, Tejidos y Órganos (INDT); especialmente a la Dra. Mariana Lorenzo, donde se realizaron las determinaciones por electroforesis capilar.
Abstract
Introduction: In recent years, significant progress has been made in the biological knowledge of acute myeloid leukemia (AML), which has been reflected on treatment of affected patients being guided by cytogenetics and molecular profiling. FLT3 internal tandem duplications (FLT3/ITDs) represent the most frequent mutations in AML and confer a bad prognosis in patients with intermediate cytogenetic risk. It has been reported that the presence of a high FLT3-ITD ratio (relationship between number of ITD carrier allele and wild type allele).
Objective: To standardize a technique, still not available in Uruguay, to determine the FLT3-ITD ratio in patients carriers of AML of intermediate cytogenetic risk. To discuss the first cases of AML FLT3+ who underwent ratio analysis.
Methods: In order to identify FLT3-ITD, the fragment corresponding to exons 14 and 15 of the gene was amplified in bone marrow samples upon debut of the disease. In the cases it was positive, the FLT3-ITD ratio was determined by the analysis of fragments with capillary electrophoresis.
Results: This study presented the standardization of a method to determine the FLT3-ITD ratio and the first cases analysed in our country. Twelve patients were studied and the presence of FLT3-ITD was detected in three of them. In two cases, the FLT3-ITD ratio found was below 0.8 and in one case it was greater than or equal to 0.8.
Conclusions: We have a technique to determine the FLT3-ITD ratio with an important prognostic value for patients carriers of AML.
Resumo
Introdução: nos últimos anos observou-se um avanço significativo do conhecimento biológico da leucemia aguda mieloide (LAM) que fez com que o tratamento destes pacientes seja orientado por seus perfis citogenético e molecular. As duplicações internas no tandem do gen FLT3 (FLT3-ITD) são as mutações mais frequentes na LAM e conferem um mal prognóstico em pacientes com risco citogenético intermediário. Foi descrito que uma proporção de FLT3-ITD elevada (relação entre a quantidade do alelo portador de ITD e do alelo selvagem) está vinculada com um maior prognóstico adverso.
Objetivo: padronizar uma técnica, não disponível no Uruguai, para determinar a proporção de FLT3-ITD em pacientes portadores de LAM com risco citogenético intermediário. Discutir os primeiros casos de LAM FLT3+ cuja proporção foi calculada.
Materiais e métodos: para a detecção de FLT3-ITD, foi realizada a ampliação de um fragmento correspondente aos exons 14 e 15 do gen em amostras de medula óssea no inicio da doença. Nos casos positivos, a proporção de FLT3-ITD foi determinada usando análise de fragmentos por eletroforese capilar.
Resultados: neste trabalho mostramos a padronização de um método para a determinação da proporção de FLT3-ITD e os primeiros casos estudados no nosso país. Foram estudados 12 pacientes e a presença de FLT3-ITD foi determinada em 3. Em dois casos a proporção de FLT3-ITD era menor que 0,8 e em 1 caso maior ou igual a 0,8.
Conclusões: contamos com uma técnica de determinação da proporção de FLT3-ITD com importante valor prognóstico para pacientes portadores de LAM.
Bibliografía
1. Döhner H, Estey EH, Amadori S, Appelbaum FR, Büchner T, Burnett AK, et al; European LeukemiaNet. Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European LeukemiaNet. Blood 2010; 115(3): 453-74.
2. Schlenk RF, Döhner K, Krauter J, Fröhling S, Corbacioglu A, Bullinger L, et al; German-Austrian Acute Myeloid Leukemia Study Group. Mutations and treatment outcome in cytogenetically normal acute myeloid leukemia. N Engl J Med 2008; 358(18):1909-18.
3. Levis M, Small D. FLT3: ITDoes matter in leukemia. Leukemia 2003; 17(9):1738-52.
4. Fröhling S, Schlenk RF, Breitruck J, Benner A, Kreitmeier S, Tobis K, et al; AML Study Group Ulm. Acute myeloid leukemia. Prognostic significance of activating FLT3 mutations in younger adults (16 to 60 years) with acute myeloid leukemia and normal cytogenetics: a study of the AML Study Group Ulm. Blood 2002; 100(13):4372-80.
5. Kottaridis PD, Gale RE, Frew ME, Harrison G, Langabeer SE, Belton AA, et al. The presence of a FLT3 internal tandem duplication in patients with acute myeloid leukemia (AML) adds important prognostic information to cytogenetic risk group and response to the first cycle of chemotherapy: analysis of 854 patients from the United Kingdom Medical Research Council AML 10 and 12 trials. Blood 2001; 98(6):1752-9.
6. Thiede C, Steudel C, Mohr B, Schaich M, Schäkel U, Platzbecker U, et al. FLT3-activating mutations in 979 patients with acute myelogenous leukemia: association with FAB subtypes and identification of subgroups with poor prognosis. Blood 2002; 99(12):4326-35.
7. Kiyoi H, Naoe T, Nakano Y, Yokota S, Minami S, Miyawaki S, et al. Prognostic implication of FLT3 and N-RAS gene mutations in acute myeloid leukemia. Blood 1999; 93(9):3074-80.
8. Whitman SP, Archer KJ, Feng L, Baldus C, Becknell B, Carlson BD, et al. Absence of the wild-type allele predicts poor prognosis in adult de novo acute myeloid leukemia with normal cytogenetics and the internal tandem duplication of FLT3: a cancer and leukemia group B study. Cancer Res 2001; 61(19):7233-9.
9. Schlenk RF, Kayser S, Bullinger L, Kobbe G, Casper J, Ringhoffer M, et al; German-Austrian AML Study Group. Differential impact of allelic ratio and insertion site in FLT3-ITD-positive AML with respect to allogeneic transplantation. Blood 2014; 124(23):3441-9.














