Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Médica del Uruguay
versión impresa ISSN 0303-3295versión On-line ISSN 1688-0390
Rev. Méd. Urug. vol.31 no.4 Montevideo dic. 2015
Cambios en la densidad mineral ósea en pacientes que reciben terapia de deprivación androgénica para el cáncer de próstata
Sonia Acuña Tapia*, Rodrigo Fresco†, William Acosta Naranjo‡
Resumen
Introducción: el cáncer de próstata (CP) es el tumor maligno más frecuente en hombres en Uruguay. La terapia de deprivación androgénica (TDA) es una herramienta valiosa para su tratamiento. Si bien es altamente eficaz, este tratamiento tiene diversos efectos no deseados, entre los que se encuentra la disminución de la densidad mineral ósea. Material y método: realizamos un estudio longitudinal, observacional y prospectivo cuyo objetivo fue determinar si existe disminución de la densidad mineral ósea en los pacientes que reciben TDA para el CP. Se incluyeron pacientes portadores de CP en cualquier estadio que iniciarían tratamiento con TDA en el Servicio de Oncología del Hospital de Clínicas de Montevideo, Uruguay, en el período setiembre de 2012 a agosto de 2013, en quienes se realizó una densitometría ósea (DMO) previo al inicio de la TDA (DMO1) y se repitió a los seis meses de recibir la primera dosis de tratamiento hormonal (DMO2). Para cada región analizada se compararon las medias de densidad ósea medida en g/cm2 en la DMO1 vs DMO2. Resultados: se hizo seguimiento a diez pacientes con una edad mediana de 77 años. Se observó disminución significativa de la densidad mineral ósea en vértebras L3 y L4 (L3: 1.268 g/cm2 a 1.225 g/cm2 p=0,01; L4: 1.247 g/cm2 a 1.227g/cm2 p=0,005), mientras que en los otros puntos evaluados (L1, L2, cuello de fémur y cadera total) también hubo una disminución pero sin alcanzar significancia estadística. Conclusiones: confirmamos que la TDA disminuye la densidad mineral ósea por lo menos en vértebras lumbares 3 y 4 en un relativamente corto plazo (seis meses). Este efecto adverso debe evaluarse, identificarse y prevenirse oportunamente para evitar complicaciones mayores.
Palabras clave: NEOPLASIAS DE LA PRÓSTATA ANTAGONISTAS DE ANDRÓGENOS OSTEOPOROSIS
Key words: PROSTATIC NEOPLASMS ANDROGEN ANTAGONISTS OSTEOPOROSIS
* Médica oncóloga. Hospital de Especialidades Eugenio Espejo. Quito, Ecuador.
† Médico oncólogo, Ex Profesor Adjunto, Servicio de Oncología Clínica del Hospital de Clínicas, Facultad de Medicina, Universidad de la República, Uruguay.
‡ Médico endocrinólogo. Hospital de Especialidades Eugenio Espejo. Quito, Ecuador. Docente de Endocrinología, Universidad Central del Ecuador. Docente de Fisiología, Pontificia Universidad Católica del Ecuador.
Correspondencia: Dra. Sonia Acuña, Alonso de Jerez E1 - 104 y Pasaje A. Quito, Ecuador.
Correo electrónico: sonia.valeria@live.com
Conflicto de intereses: los autores del presente artículo declaran que no existe conflicto de intereses. Recibido: 3/1/15 Aceptado: 18/9/15
Introducción
El cáncer de próstata (CP) es el tumor maligno más frecuente y el segundo en mortalidad en hombres en Uruguay con una incidencia de 59,74 por 100.000 hab/año y mortalidad de 22,13 por 100.000 hab/año, según datos de la Comisión Honoraria de Lucha contra el Cáncer correspondientes al período 2004-2008(1). Existen varias estrategias terapéuticas médicas y quirúrgicas para su manejo, dependiendo de las características de la enfermedad y del paciente(2). La hormonoterapia (HT) es la principal modalidad de tratamiento sistémico dado que las células epiteliales de la próstata, tanto benignas como malignas, son dependientes de andrógenos y responden a la inhibición del eje de las hormonas sexuales masculinas(3).
En aquellos pacientes que por su CP requieren de tratamientos médicos o quirúrgicos que causan hipogonadismo, la disminución de la densidad mineral ósea puede transformarse en un problema clínico relevante, especialmente si consideramos la larga sobrevida de los pacientes aún en estadios avanzados, y el uso creciente y en etapas más tempranas de la HT para esta patología.
Se ha demostrado que la terapia de deprivación androgénica (TDA), al inducir un hipogonadismo severo, lleva a un riesgo incrementado de disminución de la densidad mineral ósea y fracturas por osteoporosis, además de otros efectos del hipoandrogenismo como astenia, aumento de riesgo cardiovascular y disminución de la calidad de vida(4). El aumento de la mortalidad debido a fracturas está ampliamente demostrado en pacientes con osteoporosis, pero en pacientes sometidos a TDA es difícil de determinar, ya que se intrinca con la mortalidad propia por el CP especialmente en estadios avanzados.
Con el objetivo de evaluar el efecto sobre la densidad ósea de la TDA en el CP, condujimos el primer estudio en el país evaluando prospectivamente la pérdida de masa ósea en este grupo de pacientes. El objetivo primario de este estudio fue determinar si existe disminución de la densidad mineral ósea y la magnitud de la misma en los pacientes que se someten a TDA para CP en el Servicio de Oncología del Hospital de Clínicas.
Revisión de la literatura
Los andrógenos son los esteroides sexuales responsables del desarrollo fenotípico masculino, la maduración sexual desde la pubertad y el inicio y mantenimiento de la capacidad reproductora en el hombre. También ejercen efectos en múltiples tejidos y órganos como músculo, hueso, cerebro, entre otros(5). Se producen principalmente en los testículos, no obstante en pequeñas cantidades se producen en las glándulas suprarrenales y en las mujeres en tejido ovárico(6). El andrógeno más abundante es la testosterona, pero el más activo es su metabolito, la dihidrotestosterona (DHT).
La síntesis de los andrógenos está regulada por el eje hipotálamo-hipófiso-gonadal, donde la hormona liberadora de la hormona luteinizante (LHRH), producida en el hipotálamo y liberada en pulsos, actúa sobre las células de la adenohipófisis estimulando la secreción pulsátil de la hormona luteinizante (LH), la cual, a su vez, estimula las células de Leydig para inducir la síntesis de andrógenos en los testículos. Esta síntesis final es regulada por retroalimentación negativa para reducir los pulsos de LHRH y en consecuencia disminuir la liberación de LH; también actúa directamente sobre la hipófisis con el mismo efecto. Ya liberada, la testosterona pasa a la circulación sanguínea, unida a la albúmina o a la globulina transportadora de hormonas sexuales (SHBG), y en su forma libre alcanza sus órganos blancos y ejerce sus efectos, mediados por el receptor de andrógenos (RA) a nivel intracelular.
El RA activado por los andrógenos tiene efectos importantes durante el transcurso de la vida del hombre, que van desde su función fisiológica en el desarrollo de caracteres sexuales secundarios en la pubertad hasta alteraciones en su regulación que conllevan a efectos como la calvicie o al desarrollo de patologías en la próstata como la hiperplasia prostática benigna (HPB). Las células prostáticas benignas y malignas dependen de la estimulación androgénica para su crecimiento y supervivencia(7,8).
El tratamiento del CP está determinado principalmente por su estadio y en aquellas etapas tempranas también por el riesgo de recidiva, entre otros factores.
En los casos con CP localizado la decisión de agregar un tratamiento hormonal a los tratamientos locales depende fundamentalmente de la modalidad local empleada y del riesgo de recidiva.
En los pacientes con CP temprano que reciben HT, existen varias opciones que han sido evaluadas, tanto en la oportunidad ya sea adyuvante o neoadyuvante, así como en su duración y tipo. En lo referido al tipo de HT, se ha evaluado el bloqueo androgénico completo en base a goserelina combinada con flutamida(9,10) y otras opciones como goserelina sola(11,12).
El CP metastásico es definido por el compromiso ganglionar o de órganos a distancia, siendo el tejido óseo el más frecuentemente afectado. Para pacientes con enfermedad metastásica se puede optar por castración quirúrgica o farmacológica, u otras opciones farmacológicas que no conducen a una castración. Se considera TDA a aquellos tratamientos que interfieren con la acción del RA, sea reduciendo la concentración del ligando o bloqueando la unión de los andrógenos al RA. Dentro de ellos tenemos la orquiectomía bilateral, agonistas y antagonistas de hormona liberadora de gonadotropinas (GnRH), antagonistas del RA e inhibidores de síntesis adrenal de andrógenos(11).
Terapias farmacológicas de deprivación androgénica en el cáncer de próstata
- Los agonistas GnRH provocan castración médica a través de la estimulación constante, con alta afinidad, de los receptores de GnRH evitando los pulsos fisiológicos de LH, lo que finalmente inhibe la producción de testosterona. La administración prolongada provoca una profunda inhibición del eje hipotálamo-hipófiso-gonadal. Pertenecen a este grupo de medicamentos: leuprolide, goserelina, y otros menos empleados como buserelina, histarelina, nafarelina, triptorelina, etcétera(11).
- Los antagonistas de GnRH se unen a los receptores de GnRH de forma competitiva, sin activarlos, produciendo una rápida disminución de los niveles de LH y FSH, observándose una disminución inmediata y pronunciada de los niveles de testosterona. Dentro de este grupo se encuentra el degarelix.
- Los antagonistas de andrógenos ejercen su efecto compitiendo con los andrógenos endógenos en su unión al RA, produciendo un cambio conformacional del RA que impide su actividad transcripcional óptima. Se clasifican en: a) no esteroideos como flutamida, bicalutamida, enzalutamida y nilutamida; y b) esteroideos como ciproterona y espironolactona, los cuales son utilizados con menor frecuencia que los no esteroideos debido principalmente a su perfil de eventos adversos.
El mecanismo de acción de los tratamientos para el CP es inhibir la proliferación de células malignas prostáticas; por otra parte, también producen efectos sobre aquellas células que fisiológicamente requieren de la presencia de andrógenos para cumplir su función. Por este motivo, los principales efectos adversos del bloqueo androgénico son sofocos, sudoración, anemia, alteraciones metabólicas, pérdida de masa muscular, disfunción sexual eréctil (DSE), pérdida de la libido y osteoporosis (OP).
Los agentes anteriormente referidos, así como la orquiectomía bilateral, se caracterizan por producir en mayor o menor medida una disminución de la masa ósea fundamentalmente en casos de tratamientos prolongados.
La OP es un trastorno esquelético caracterizado por alteraciones de la masa y la microarquitectura óseas, con la consiguiente reducción en la resistencia, incremento de fragilidad y aumento del riesgo de fracturas óseas(11).
La medida de la densidad mineral ósea por DMO es el método oro para el diagnóstico de OP. La falta de herramientas clínicas disponibles para medir la calidad del hueso hace que a efectos prácticos el diagnóstico de OP se base en el compromiso de la densidad mineral ósea, de acuerdo a la clasificación de la Organización Mundial de la Salud. Se considera normal un valor de hasta un T-score de -0,99, baja masa ósea entre -1 a -2,49 y OP cuando es menor a -2,5; se denomina severa cuando agrega fractura por fragilidad independientemente del T-score.
El efecto adverso de la TDA sobre el hueso es ampliamente conocido y referenciado en revisiones bibliográficas(11) y varios estudios que demuestran disminución de la densidad mineral ósea. Se ha descrito, además, subdiagnóstico y subtratamiento, ya que menos de la mitad de pacientes sometidos a TDA recibe alguna medida terapéutica y menos de 10% recibe bifosfonatos(11,12).
En una revisión sistemática reciente que incluyó 13 estudios que valoraron los cambios en la densidad mineral ósea en pacientes con TDA para CP, se reportó una significativa disminución de los valores densitométricos, además de un aumento en la tasa de fracturas(11). En este sentido existen revisiones bibliográficas y opiniones de expertos que recomiendan no solo la valoración densitométrica en estos pacientes, considerados de riesgo para OP, sino su tratamiento preventivo y seguimiento estrecho(20). A pesar de esto, la evaluación de la densidad mineral ósea previa o durante la TDA por CP es una estrategia subutilizada.
A pesar de que varios estudios han mostrado que la máxima declinación en la densidad mineral ósea toma lugar en el primer año de tratamiento, este deterioro ya puede ser evidente aun dentro de los primeros meses de iniciada la TDA(21) y lleva a un subsecuente incremento en la tasa de fracturas(22) que es acumulativo en el tiempo(23,24).
Material y método
Se realizó un estudio longitudinal, observacional y prospectivo con el objetivo de determinar si existe disminución de la densidad mineral ósea en los pacientes que reciben TDA. El protocolo y consentimiento informado fueron aprobados por el Comité de Ética de la Investigación del Hospital de Clínicas “Dr. Manuel Quintela” (Montevideo, Uruguay). Entre setiembre de 2012 y agosto de 2013 se reclutaron pacientes asistidos en el Servicio de Oncología que cumplieran con los siguientes principales criterios de elegibilidad: edad mayor de 18 años, firma del formulario de consentimiento informado, diagnóstico histológico (o en ausencia del mismo, clínico-serológico) de carcinoma de próstata en estadios TNM I a IV, ECOG performance estatus de 0 a 2 y con indicación de inicio de TDA. Se incluyeron pacientes que fueran a iniciar una de las siguientes terapias hormonales: agonistas LHRH en monoterapia o combinados con antiandrógenos esteroideos/no esteroideos, orquitectomía bilateral o antiandrógenos esteroideos/no esteroideos exclusivos. Se excluyeron pacientes que hubieran recibido TDA previa a la firma del consentimiento informado, tuvieran imposibilidad o contraindicación para realizarse DMO, que estuvieran recibiendo tratamiento farmacológico con agentes modificadores del hueso o con diagnóstico conocido de OP.
En los pacientes incluidos se revisaron las historias clínicas recolectando datos patronímicos y de su patología en una planilla diseñada con este fin. En estos pacientes se realizó una DMO previo al inicio del tratamiento hormonal (DMO1 o DMO basal) y otra a los seis meses de recibir la primera dosis del mismo (DMO2). Para asegurar la comparabilidad de los resultados entre la DMO1 y DMO2, todas las DMO se realizaron en el Instituto Nacional de Reumatología (Montevideo, Uruguay) con el mismo equipo (Lunar Prodigy, GE Healthcare, USA). Se consideraron los reportes de DMO en g/cm2 para columna lumbar (L1, L2, L3, L4) y cadera (cuello de fémur y cadera total). Respecto al T-score, si bien el mismo se empleó para el diagnóstico de la pérdida de masa ósea en las DMO, el mismo no se consideró para la evaluación del objetivo principal (determinar si existe disminución de la densidad mineral ósea en los pacientes que reciben TDA), dado que dificultaría la comparación interindividual por ser una comparación indirecta para un mismo individuo. Por lo tanto, se utilizó el valor absoluto de densidad mineral ósea para cada individuo en g/cm2 y se utilizó su porcentaje de variación que será comparable entre los individuos.
Para cada región analizada se compararon las medias de densidad ósea medida en g/cm2 en la DMO1 vs DMO2. Para el análisis estadístico se utilizó el software EpiData análisis (versión 2.2.2.1.8.2, The EpiData Association, Denmark), se aplicó el test de Wilcoxon y prueba t de student para diferencia de medias de densidad mineral ósea en cada sitio evaluado (L1, L2, L3, L4, cuello de fémur y cadera total), considerándose significativa una p < 0,05.
El informe de la densitometría se incorporó a la historia clínica de cada paciente y fue informado al médico tratante en caso que el mismo quisiera iniciar medidas terapéuticas o profilácticas consecuentes.
Resultados
Se reclutó un total de 13 pacientes que firmaron el consentimiento informado, con una mediana de edad de 77 años (rango: 55-84). Las principales características de los pacientes se incluyen en la tabla 1. De los seis casos con CP estadio I-III de alto riesgo, cuatro recibieron tratamiento de HT asociado a radioterapia (RT) y dos pacientes recibieron HT exclusiva, dado que uno se negó a hacer RT y en el otro no pudo realizarse por presentar patología que contraindicaba esta terapia (síndrome mielodisplásico). Un paciente con cáncer localizado de bajo riesgo recibió solo HT por cinco meses. Los tres pacientes con CP metastásico recibieron HT en base a goserelina sola en un caso y en dos asociada a flutamida.
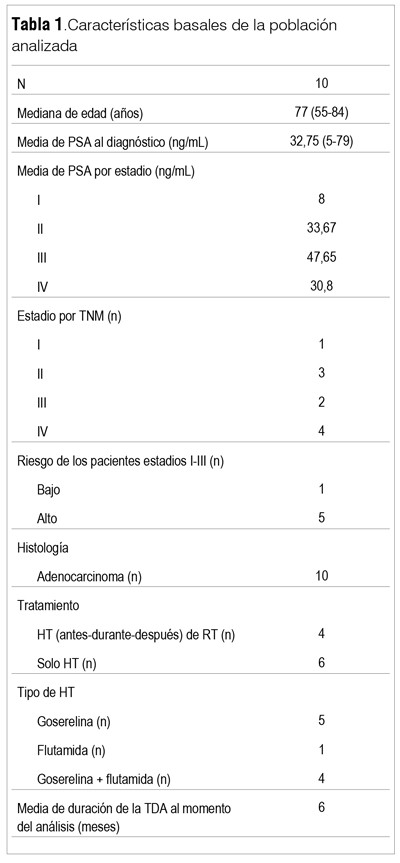
De los 13 pacientes incluidos, 11 se realizaron las dos DMO según protocolo (DMO1 y DMO2), mientras que en dos pacientes no pudo realizarse la DMO2 por fallas técnicas del equipo. Otro paciente fue excluido del análisis por haber recibido ácido zoledrónico luego de la DMO1. Por lo tanto, nuestra población de análisis la constituyen los diez pacientes que completaron las DMO1 y DMO2 y no recibieron terapias dirigidas al hueso luego de su inclusión y hasta la realización de la DMO2.
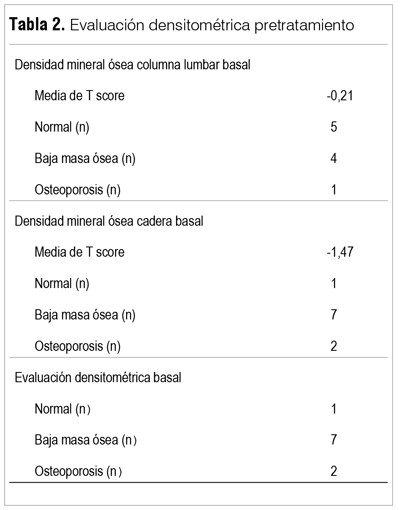
Los resultados densitométricos se reportan en las tablas 2 y 3. Los datos basales (DMO1) muestran que solo un paciente presentaba una DMO normal, siete presentaron una baja masa ósea y dos tenían criterios diagnósticos de OP. La media del T-score fue de -0,21 en columna lumbar y a nivel de cadera de -1.47. En las figuras 1 y 2 se observa la disminución en la media de la densidad ósea en las localizaciones analizadas, si bien solo fue estadísticamente significativa en L3 y L4 (L1: pretratamiento 1.126 g/cm2 versus postratamiento 1.096 g/cm2 p=0,17; L2: 1.193 g/cm2 versus 1.164 g/cm2 p=0,14; L3: 1.268 g/cm2 versus 1.225 g/cm2 p=0,01; L4: 1.247g/cm2 versus 1.227 g/cm2 p=0,005). Las medias en cadera fueron: cuello de fémur 0,869 g/cm2 versus 0,857 g/cm2 postratamiento, p=0,20; cadera total 0,963 g/cm2 versus 0,947 g/cm2, p=0,09. Esta diferencia se mantiene aun estratificando según el diagnóstico densitométrico inicial (normal, baja masa ósea u OP).
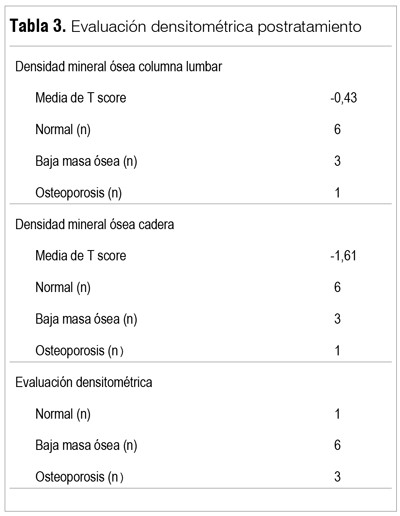
Discusión
Reportamos el primer estudio que evalúa los cambios en la densidad mineral ósea en pacientes con CP tratados con HT en Uruguay. Demostramos una disminución de la densidad mineral ósea en estos pacientes, objetivable tan solo a los seis meses de iniciada la TDA y en todas las localizaciones analizadas, alcanzando significación estadística en las vértebras L3 y L4. Resultados similares fueron obtenidos en el estudio de Wadwha y colaboradores, que encontró una disminución persistente por año de la densidad mineral ósea en los pacientes tratados con TDA en un período de siete años reportado en porcentaje de decremento al año de 1,2%; dos años, 3,7%; tres años, 6,5%; cuatro años, 8,9%; cinco años, 9,9%, y seis años, 12,7%(25). Si bien este estudio tuvo un seguimiento más prolongado que el nuestro y se realizó un mayor número de DMO por paciente, otros estudios también reportan una disminución de la densidad mineral ósea a los seis meses de iniciada la TDA, lo cual se asoció en el trabajo de Alibhai y colaboradores con un incremento en la tasa de fracturas dentro de los cinco años de tratamiento(26).
Esta rápida disminución observada en nuestro estudio, dado el corto tiempo de instalación y ausencia de otros factores coadyuvantes, sería explicada primariamente por el inicio de la HT. Puede hipotetizarse que con un seguimiento más prolongado la disminución en la densidad ósea pudiera alcanzar significación estadística en más localizaciones, si bien esto no puede demostrarse a través de nuestro estudio.
En el análisis intraindividual, en todos los pacientes se observó disminución de la densidad mineral ósea (si bien en uno se mantuvo en el rango de la normalidad), lo que fue suficiente para que uno de los siete pacientes cambiase de categoría de baja masa ósea a OP. Esto fue observado en un período inter-DMO de seis meses, mucho mayor a lo que sucede en condiciones habituales en hombres, en quienes una disminución de 10% en la densidad mineral ósea tomaría entre cinco a diez años partiendo de una edad (75-80 años) similar a la mediana de nuestro estudio(27).
Esta rápida disminución del capital óseo sería comparable a la observada en mujeres en edad de posmenopausia(27). Se debe realizar una DMO en mujeres después de la menopausia por la rápida pérdida ósea; sería similar el razonamiento para consensuar la valoración densitométrica en pacientes que reciben TDA por CP, como lo sugieren algunos grupos (28). Por ejemplo, la International Society for Clinical Densitometry recomienda para mayores de 70 años u hombres menores de 70 años con bajo peso, fractura previa, uso de medicación de alto riesgo y enfermedad o condición asociada con pérdida ósea(29).
Identificar oportunamente a los individuos con OP o baja masa ósea es imperativo, ya que varios estudios, como el de Shahinian y colaboradores(28), han demostrado que la TDA es un factor de riesgo independiente para incremento de la incidencia de fractura por OP en alrededor de 7% a los cinco años del diagnóstico de CP.
En nuestra población, 9/10 pacientes tenían alteraciones de la densidad mineral ósea aun antes del inicio de la TDA, lo que constituye una mayor frecuencia que lo reportado en otros estudios que evidencian entre 25% - 50% de prevalencia de baja masa ósea y OP para hombres mayores de 55 años(30,31).
Este hecho es particularmente relevante ya que es conocido que las fracturas por OP son factores que impactan en la mortalidad, especialmente en hombres, siendo mayor comparado a mujeres con sobrevida menor a 63% a los dos años(32). La alta prevalencia de alteraciones de la densidad mineral ósea en nuestro grupo de estudio previo a la TDA podría deberse a la escasa ingesta láctea observada en la población uruguaya(33), deficiencia e insuficiencia de vitamina D que se suele observar en la población general de esta edad y latitud(34), si bien no podemos descartar que nuestra observación sea fruto del bajo número de pacientes incluidos en nuestro estudio.
La mayoría de los pacientes de nuestro estudio (6/10) fueron categorizados como portadores de CP en estadios tempranos. Este hecho pronosticaría una larga sobrevida, lo que aumenta la relevancia del diagnóstico, la prevención y el tratamiento de otras patologías de desarrollo relativamente rápido que deterioren y pongan en riesgo la vida de estos pacientes, como es el caso de la OP y su riesgo incrementado de fracturas.
Todos nuestros pacientes tuvieron diagnóstico histológico de adenocarcinoma. En un medio donde aún es frecuente encontrar pacientes con un diagnóstico basado solo en la clínica y serología, encontramos este hecho como positivo dado que el diagnóstico histológico es fundamental para la evaluación completa y el adecuado tratamiento del paciente.
Los pacientes del presente estudio recibieron tratamiento siguiendo las Pautas de Oncología Médica para el Diagnóstico, Tratamiento Sistémico y Seguimiento de la Cátedra de Oncología Clínica de la Facultad de Medicina de Montevideo, Uruguay(35).
Este estudio no está exento de limitaciones, siendo la mayor de ellas el bajo número de sujetos que fueron incluidos. A pesar de esto, la significancia estadística obtenida en los resultados de vértebras L3 y L4 demuestra el alto impacto de la TDA por lo menos sobre estas vértebras, apoyando nuestra premisa inicial e impulso de nuestro estudio.
Futuros trabajos podrían analizar un mayor número de pacientes y períodos más prolongados de seguimiento para ratificar o rectificar nuestra hipótesis de que en los puntos densitométricos evaluados una exposición más larga a la TDA llevaría a la disminución de la densidad mineral ósea de significancia estadística. Por otra parte, dado el bajo número de pacientes, no nos es posible analizar las posibles diferencias en la pérdida de masa ósea en función de características de los pacientes (por ejemplo, edad, presencia o ausencia de factores de riesgo de OP, etcétera) o del tratamiento recibido.
Podemos resumir que nuestros principales hallazgos fueron: (a) la alta frecuencia de compromiso de la densidad mineral ósea antes del comienzo de la TDA, y (b) la importante y rápida disminución de la misma luego del inicio de la HT, especialmente significativa a nivel de dos vértebas.
En base a nuestros resultados y los estudios ya mencionados en los antecedentes y discusión de este trabajo, recomendamos que a los pacientes que vayan a ser sometidos a TDA para el tratamiento de CP se integre a su valoración general la evaluación del metabolismo fosfocálcico, lo que incluye: determinación de concentración sérica de calcio y fósforo, dosificación de vitamina D y realización de densitometría(36).
Inmediatamente a ello y de ser posible antes de la TDA, sin retrasar su inicio, asegurarse de ingesta dietaria adecuada de calcio (1.500 - 2.000 mg)(37), lo que se debe lograr mediante aporte alimenticio y eventualmente con suplementos, aunque estos últimos tengan serios cuestionamientos ya que existe evidencia reciente en población general que los ha vinculado con aumento de la mortalidad(38). No evaluamos en nuestro estudio la ingesta de calcio de los pacientes incluidos y consideramos que podría ser de utilidad en futuros estudios de esta naturaleza para conocer mejor la ingesta cálcica en hombres uruguayos y su posible impacto en la densidad mineral ósea. Otro eje fundamental es la dosificación y suplementación de vitamina D, como tratamiento para su frecuente insuficiencia y deficiencia de prevalencia global y local en Uruguay(34). Las recomendaciones internacionales señalan suplementos entre 2.000 a 5.000 UI por día39), que además de prevenir y ser parte del tratamiento para la OP(40), aumentan la sobrevida global en población general(41). El uso de bifosfonatos en pacientes sometidos a TDA para CP ha sido evaluado en varios estudios con resultados satisfactorios en los que sus autores consideran su uso razonable y recomendable en esta población(43,44).
Conclusiones
Nuestro trabajo evidenció una disminución de la densidad mineral ósea en las vértebras L3 y L4 luego de seis meses del inicio de la terapia de deprivación androgénica por CP. En el resto de vértebras y en cadera, aunque el resultado no fue estadísticamente significativo, se observó en todas una tendencia a la disminución, lo que refuerza nuestra teoría acerca de que nuestros resultados se deben al pequeño tamaño muestral.
Se observó, como resultado no esperado, una frecuencia elevada de baja masa ósea y OP en los hombres reclutados antes del tratamiento con TDA, con una prevalencia mayor a la de estudios en otros centros y países.
Abstract
Introduction: prostate cancer is the most frequent malignant tumor in men in Uruguay. Androgenic deprivation therapy (ADT) is a valuable tool to treat this condition. In spite of it being highly effective, this treatment has several non-desirable effects, a reduction in bone mineral density being among them.
Material: we conducted a longitudinal, observational and prospective study whose objective was to determine whether there is a reduction in bone mineral density in patients who receive ADT for prostate cancer. Patients who were carriers of prostate cancer undergoing any stage who would start their ADT treatment at the Oncology Unit of the University Hospital of Montevideo from September 2012 through August 2013 were included in the study. All of them underwent a bone densitometry prior to the initiation of ADT (BD1) treatment and it was repeated six months after they received the first dose of hormone treatment (BD2). Measurements of bone density were compared for every region analysed in g/ cm2 in BD1 versus BD2.
Results: Ten patients with an average age of 77 years old were followed-up. A significant reduction in bone mineral density was observed in the L3-L4 spinal segment (L3: 1.268 g/cm2 at 1.225 g/cm2 p=0.01; L4: 1.247g/cm2 at 1.227g/cm2 p=0.005), whereas in the other points assessed (L1, L2, femoral neck and total hip) there was a reduction as well, although it did not represent any statistical significance.
Conclusions: we confirmed ADT reduces the bone mineral density in lumbar vertebrae L3 and L4 in a relatively short time (six minths). This negative effect needs to be timely assessed, identified and prevented to avoid greater complications.
Resumo
Introdução: o câncer de próstata (CP) é o tumor maligno mais frequente em homens no Uruguai. A terapia de deprivação androgênica (TDA) é uma ferramenta valiosa para seu tratamento. Embora seja altamente eficaz, este tratamento apresenta diversos efeitos não desejados, entre eles a diminuição da densidade mineral óssea.
Material e método: realizamos um estudo longitudinal, observacional e prospectivo cujo objetivo foi detectar uma possível redução da densidade mineral óssea em pacientes que recebem TDA para CP. Foram incluídos pacientes portadores de CP em qualquer estadio que iniciaram tratamento com TDA no Serviço de Oncologia do Hospital de Clínicas de Montevidéu, Uruguai, no período setembro de 2012 a agosto de 2013; antes do inicio do tratamento foi realizada una densitometria óssea (DMO1) e uma segunda seis meses depois da primeira dose de tratamento hormonal (DMO2). Para cada região analisada foram comparadas as medias de densidade óssea medida en g/cm2 na DM1 versus DMO2.
Resultados: dez pacientes com um mediana de idade de 77 anos foram estudados. Observamos uma diminuição significativa da densidade mineral óssea nas vértebras L3 e L4 (L3: 1.268 g/cm2 a 1.225 g/cm2 p=0,01; L4: 1.247g/cm2 a 1.227g/cm2 p=0,005); em outros pontos avaliados (L1, L2, colo de fêmur e quadril total) também houve diminuição porém não era estatisticamente significativa.
Conclusões: confirmamos que a TDA diminui a densidade mineral óssea pelo menos nas vértebras lombares 3 e 4 em um prazo relativamente curto (seis meses). Este efeito adverso deve ser avaliado, identificado e prevenido oportunamente para evitar maiores complicações.
Bibliografía
1. Comisión Honoraria de Lucha Contra el Cáncer (período 2004-2008). Registro Nacional del Cáncer. Montevideo 2009. Disponible en: www.comisioncancer.org.uy/ [Consulta: 20 setiembre 2012].
2. Heidenreich A, Bastian PJ, Bellmunt J, Bolla M, Joniau S, van der Kwast T, et al; European Association of Urology. EAU guidelines on prostate cancer. Part II: Treatment of advanced, relapsing, and castration-resistant prostate cancer. Eur Urol 2014; 65(2):467-79.
3. Arroyo J, Soto E, Muñoz M, Contreras J, Varela J. Bloqueo androgénico en cáncer de próstata: revisión de la literatura. Rev Mex Urol 2012; 72(4):182-96.
4. Lee, R, Saylor P, Smith M. Treatment and prevention of bone complications from prostate. Bone 2011; 48(1):88-95.
5. Heemers HV, Tindall DJ. Androgen receptor (AR) coregulators: a diversity of functions converging on and regulating the AR transcriptional complex. Endocr Rev 2007; 28(7):778-808.
6. Guyton A, Hall J. Tratado de fisiología médica. 12 ed. Madrid: Elsevier, 2011:955-72.
7. Feldman BJ, Feldman D. The development of androgen-independent prostate cancer. Nat Rev Cancer 2001; 1(1):34-45.
8. Chen Y, Sawyers CL, Scher HI. Targeting the androgen receptor pathway in prostate cancer. Curr Opin Pharmacol 2008; 8(4):440-8.
9. Roach M 3rd, Bae K, Speight J, Wolkov HB, Rubin P, Lee RJ, et al. Short-term neoadjuvant androgen deprivation therapy and external-beam radiotherapy for locally advanced prostate cancer: long-term results of RTOG 8610. J Clin Oncol 2008; 26(4):585-91.
10. Jones CU, Hunt D, McGowan DG, Amin MB, Chetner MP, Bruner DW, et al. Radiotherapy and short-term androgen deprivation for localized prostate cancer. N Engl J Med 2011; 365(2):107-18.
11. Bolla M, Collette L, Blank L, Warde P, Dubois JB, Mirimanoff RO, et al. Long-term results with immediate androgen suppression and external irradiation in patients with locally advanced prostate cancer (an EORTC study): a phase III randomised trial. Lancet 2002; 360(9327):103-6.
12. Bolla M, Van Tienhoven G, Warde P, Dubois JB, Mirimanoff RO, Storme G, et al. External irradiation with or without long-term androgen suppression for prostate cancer with high metastatic risk: 10-year results of an EORTC randomised study. Lancet Oncol 2010; 11(11):1066-73.
13. Chen Y, Clegg NJ, Scher HI. Anti-androgens and androgen-depleting therapies in prostate cancer: new agents for an established target. Lancet Oncol 2009; 10(10):981-91.
14. Chillik C, Acosta A. The role of LHRH agonists and antagonists. Reprod Biomed Online 2001; 2(2):120-8.
15. NIH Consensus Development Panel on Osteoporosis Prevention, Diagnosis, and Therapy, March 7-29, 2000: highlights of the conference. South Med J 2001; 94(6):569-73.
16. Wirth MP, Hakenberg OW, Froehner M. Antiandrogens in the treatment of prostate cancer. Eur Urol 2007; 51(2):306-13.
17. Al-Shamsi HO, Lau AN, Malik K, Alamri A, Ioannidis G, Corbett T, et al. The current practice of screening, prevention, and treatment of androgen-deprivation-therapy induced osteoporosis in patients with prostate cancer. J Oncol 2012; 2012:958596.
18. Yee EF, White RE, Murata GH, Handanos C, Hoffman RM. Osteoporosis management in prostate cancer patients treated with androgen deprivation therapy. J Gen Intern Med 2007; 22(9):1305-10.
19. Sullivan S, Wagner J, Resnick NM, Nelson J, Perera SK, Greenspan SL. Vertebral fractures and the misclassification of osteoporosis in men with prostate cancer. J Clin Densitom 2011; 14(3):348-53.
20. Drnovsek M, Echín M, Ercolano M, Rubín Z. Prevención y tratamiento de la osteoporosis en cáncer de próstata. Rev Argent Endocrinol Metab 2011; 48(4):225-34.
21. Kabir S, Mancuso P, Rashid P. Androgen deprivation therapy—managing side effects. Aust Fam Physician 2008; 37(8):641-6.
22. McLeod N, Huynh CC, Rashid P. Osteoporosis from androgen deprivation therapy in prostate cancer treatment. Aust Fam Physician 2006; 35(4):243-5.
23. VanderWalde A, Hurria A. Aging and osteoporosis in breast and prostate cancer. CA Cancer J Clin 2011; 61(3): 139-56.
24. Morote J, Planas J. Pérdida de masa ósea en pacientes con cáncer de próstata sometidos a deprivación androgénica. Actas Urol Esp 2011; 35(4):232-9.
25. Abrahamsen B, Nielsen MF, Eskildsen P, Andersen JT, Walter S, Brixen K. Fracture risk in Danish men with prostate cancer: a nationwide register study. BJU Int 2007; 100(4):749-54.
26. Wadhwa VK, Weston R, Mistry R, Parr NJ. Long-term changes in bone mineral density and predicted fracture risk in patients receiving androgen-deprivation therapy for prostate cancer, with stratification of treatment based on presenting values. BJU Int 2009; 104(6):800-5.
27. Alibhai SM, Gogov S, Allibhai Z. Long-term side effects of androgen deprivation therapy in men with non-metastatic prostate cancer: a systematic literature review. Crit Rev Oncol Hematol 2006; 60(3):201-15.
28. European Prospective Osteoporosis Study (EPOS) Group. Incidence of vertebral fracture in Europe: results from the European Prospective Osteoporosis Study (EPOS). J Bone Miner Res 2002; 17(4):716-24.
29. Shahinian VB, Kuo YF, Freeman JL, Goodwin JS. Risk of fracture after androgen deprivation for prostate cancer. N Engl J Med 2005; 352(2):154-64.
30. The International Society for Clinical Densitometry. 2015 ISCD Adult Official Positions. Middletown, CT: ISCD, 2015. Disponible en: http://www.iscd.org/official-positions/6th-iscd-position-development-conference-adult/. [Consulta: 19 mayo 2015].
31. Tenenhouse A, Joseph L, Kreiger N, Poliquin S, Murray TM, Blondeau L, et al; CaMos Research Group. Canadian Multicentre Osteoporosis Study. Estimation of the prevalence of low bone density in Canadian women and men using a population-specific DXA reference standard: the Canadian Multicentre Osteoporosis Study (CaMos). Osteoporos Int 2000; 11(10):897-904.
32. El-Desouki MI, Sulimani RA. High prevalence of osteoporosis in Saudi men. Saudi Med J 2007; 28(5):774-7.
33. Jiang HX, Majumdar SR, Dick DA, Moreau M, Raso J, Otto DD, et al. Development and initial validation of a risk score for predicting in-hospital and 1-year mortality in patients with hip fractures. J Bone Miner Res 2005; 20(3):494-500.
34. Aldabe M. Márquez M. Primer encuesta nacional de consumo de lácteos en niños de 1º, 3º y 6º año de las escuelas públicas uruguayas. Montevideo: ANEP, 2006.
35. Mendoza B. Deficiencia de Vitamina D: guías clínicas para su diagnóstico y tratamiento. Tendencias Med 2013; 21(42): 149-58.
36. Uruguay. Universidad de la República. Facultad de Medicina. Hospital de Clínicas. Cátedra de Oncología Clínica. Servicio de Oncología Clínica. Pautas de oncologia médica para el diagnóstico, tratamiento sistémico y seguimiento. Montevideo: Facultad de Medicina, 2012.
37. Kanis JA. World Health Organization Scientific Group. Assessment of osteoporosis at the primary health-care level: technical report. Geneva: WHO; 2007.
38. Food and Drugs Administration. Food and Nutrition Board. Dietary reference intakes for calcium, phosphorous, magnesium, vitamin D, and fluoride. Washington, DC: National Academy Press, 2010.
39. Michaëlsson K, Melhus H, Warensjö Lemming E, Wolk A, Byberg L. Long term calcium intake and rates of all cause and cardiovascular mortality: community based prospective longitudinal cohort study. BMJ 2013; 346:f228.
40. Holick MF, Binkley NC, Bischoff-Ferrari HA, Gordon CM, Hanley DA, Heaney RP, et al; Endocrine Society. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2011; 96(7):1911-30.
41. Bischoff-Ferrari HA, Willett WC, Wong JB, Giovannucci E, Dietrich T, et al. Fracture prevention with vitamin D supplementation: a meta-analysis of randomized controlled trials. JAMA 2005; 293(18):2257-64.
42. Zheng Y, Zhu J, Zhou M, Cui L, Yao W, Liu Y. Meta-analysis of long-term vitamin D supplementation on overall mortality. PLoS One 2013; 8(12):e82109.
43. Smith MR, McGovern FJ, Zietman AL, Fallon MA, Hayden DL, Schoenfeld DA, et al. Pamidronate to prevent bone loss during androgen-deprivation therapy for prostate cancer. N Engl J Med 2001; 345(13):948-55.
44. Smith MR, Eastham J, Gleason DM, Shasha D, Tchekmedyian S, Zinner N. Randomized controlled trial of zoledronic acid to prevent bone loss in men receiving androgen deprivation therapy for nonmetastatic prostate cancer. J Urol 2003; 169(6):2008-12.














