Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Médica del Uruguay
versión On-line ISSN 1688-0390
Rev. Méd. Urug. vol.30 no.1 Montevideo mar. 2014
Utilidad del ensayo de cadenas livianas libres en suero en el manejo de gammapatías monoclonales: diagnóstico, pronóstico y monitoreo
Dra. María Florencia Delgado*
* Scientific Affairs Manager – Latin America. The Binding Site Group Ltd. 8 Calthorpe Road, Birmingham, B15 1QT, UK Corresponding author: María Florencia Delgado
Correspondencia: florencia.delgado@bindingsite.com
Recibido: 16/9/13 Aceptado: 24/3/14
Resumen
El ensayo de cadenas livianas libres en suero cuantifica los niveles de κ y λ libres. Existen tres indicaciones principales para la medición de cadenas livianas libres en el manejo de pacientes con mieloma múltiple y enfermedades relacionadas. Primero, en el contexto del diagnóstico, donde en combinación con la electroforesis de proteínas en suero y la inmunofijación en suero proporcionan el esquema de tamizaje de mayor sensibilidad, eliminando la necesidad de analizar la orina de 24 horas. Segundo, los valores basales de cadenas livianas libres en suero han mostrado tener valor pronóstico para la mayoría de las gammapatías monoclonales. Tercero, el ensayo de cadenas livianas libres en suero permite un monitoreo cuantitativo y sensible en pacientes con presentación oligosecretora de la enfermedad, incluyendo la AL amiloidosis y cerca del 70% de los pacientes históricamente denominados no secretores. Esta revisión tiene por objeto actualizar la información sobre las aplicaciones de esta importante prueba.
Palabras clave: CADENAS LIGERAS DE INMUNOGLOBULINA – análisis
PARAPROTEINEMIAS
MIELOMA MÚLTIPLE
AMILOIDOSIS
Keywords: IMMUNOGLOBULIN LIGHT CHAINS - analysis
PARAPROTEINEMIAS
MULTIPLE MYELOMA
AMYLOIDOSIS
Introducción
Las gammapatías monoclonales comprenden un conjunto de condiciones patológicas en las que cantidades excesivas de inmunoglobulinas homogéneas monoclonales son producidas por clones anómalos de células plasmáticas. Estos desórdenes incluyen enfermedades malignas como mieloma múltiple (MM), plasmocitoma solitario, leucemia de células plasmáticas, macroglobulinemia de Waldenström (MW), amiloidosis AL, enfermedad de depósito de cadenas livianas y estadios premalignos tales como gammapatía monoclonal de significado incierto (GMSI, MGUS por sus siglas en inglés), y MM asintomático o indolente (MMA, SMM, por sus siglas en inglés)(1). Las inmunoglobulinas comparten una estructura simétrica semejante constituida por dos cadenas pesadas (γ, α, μ, ε o δ) idénticas unidas a dos cadenas livianas (κ y λ) también idénticas. Además de secretar inmunoglobulinas completas y funcionales, las células plasmáticas secretan diariamente un exceso de cadena liviana libre. Este exceso de producción es de aproximadamente un 40% y se cree que aseguraría la correcta conformación de la inmunoglobulina(2). En las discrasias de células B, la inmunoglobulina monoclonal secretada puede tratarse de una proteína intacta (inmunoglobulina entera, las cuatro cadenas que forman el anticuerpo) o las cadenas livianas solamente (monómeros o dímeros de κ o λ). En el 80% de los casos de MM, la proteína monoclonal (proteína M), principal secretada, corresponde a la forma intacta de la inmunoglobulina, denominándose MM de inmunoglobulina intacta (MMII). En el 15% a 20% de los casos la secreción de la proteína monoclonal está asociada solo a las cadenas livianas, generando un MM de cadenas livianas (MMCL) o MM de Bence Jones, y en 1% a 2% de los casos de mieloma, la proteína monoclonal resulta indetectable por los métodos electroforéticos tradicionales, lo que ha llevado a su denominación de MM no secretor (MMNS).
Debido a sus diversas formas de presentación, la identificación de la proteína-M suele ser la primera clave para el diagnóstico. Tradicionalmente el panel diagnóstico establecido para pacientes bajo sospecha de gammapatía monoclonal comprende electroforesis de proteínas en suero como herramienta de tamizaje seguido por una inmunofijación en suero para tipificar la proteína-M producida. Este esquema histórico también incluye la evaluación de proteínas en orina por ambas técnicas(3) y la cuantificación nefelométrica de las inmunoglobulinas en suero. En la última década, el desarrollo del test en suero para las cadenas livianas κ libre λ libre ha abierto un amplio abanico de aproximaciones diagnósticas mejorando la sensibilidad y la precisión en la identificación de estas patologías. La introducción de este inmunoensayo cuantitativo en suero permite la evaluación de la relación kappa/lambda libres, logrando distinguir elevaciones policlonales de otras monoclonales con gran sensibilidad.
Para esta revisión, que tiene por objeto actualizar la información sobre las aplicaciones de esta importante prueba, se han realizado búsquedas en bases de datos de publicaciones científicas (MEDLINE/PubMed, Lilacs, SciELO, etcétera) utilizando las palabras claves antes citadas y la base de datos de publicaciones de The Binding Site Groups, Birmingham, Inglaterra.
Producción de cadenas livianas libres y su cuantificación
Las concentraciones séricas de las cadenas livianas libres son el resultado del balance entre la producción por las células plasmáticas (existen dos células productoras de κ por cada una productora de λ) y la metabolización renal. Debido a su bajo peso molecular (25-50 kDa aproximadamente) las cadenas livianas filtran fácilmente por el glomérulo para luego ser inmediatamente reabsorbidas en el túbulo contorneado proximal, lo que hace que su vida media en suero sea muy breve, de dos a seis horas. Teniendo en cuenta que la producción fisiológica de cadenas livianas libres es de aproximadamente 0,5 g por día(4) y que el riñón humano es capaz de reabsorber hasta 30 g/día de proteínas pequeñas, en condiciones normales la gran mayoría de estas proteínas serán metabolizadas y solo pequeñas cantidades se encontrarán en orina. Únicamente cuando los mecanismos de reabsorción renal se vean superados por una masiva producción, las cadenas livianas libres podrán ser detectadas por métodos electroforéticos tradicionales en una muestra de orina concentrada(5,6).
Distintas situaciones clínicas pueden derivar en concentraciones anormales de κ y λ en suero, tales como supresión inmune, estimulación inmune por un proceso infeccioso, disminución del índice de filtrado glomerular debido a una afectación renal o desórdenes proliferativos de células plasmáticas. Los sueros de individuos cursando patologías con elevación policlonal de inmunoglobulinas o pacientes con enfermedad renal suelen presentar niveles séricos elevados de κ y λ debido al aumento de la producción o a la disminución del metabolismo. Sin embargo, la relación κ/λ permanece normal en estas condiciones (con la excepción de pacientes con enfermedad renal severa, como se discutirá más adelante[7]). Una relación alterada solo podría estar relacionada a un desorden linfoproliferativo que produzca un exceso de cadena liviana libre que perturbe el balance normal de secreción de κ y λ. La capacidad de evaluar los niveles de κ y λ y de analizar su relación en suero ha permitido distinguir patologías con producción policlonal de proteínas de aquellas con producción monoclonal. De este modo, la relación de cadenas livianas libres κ/λ (rCLL) en suero es un marcador de la existencia de una gammapatía monoclonal. Los individuos que presenten valores de rCLL >1,65 tendrán un componente monoclonal de tipo λ, mientras que aquellos que presenten valores rCLL <0,26 tendrán un componente monoclonal de tipo λ. Por otro lado, la insuficiencia renal implica una filtración renal de cadenas livianas libres disminuida y se observó que los individuos en estas situaciones clínicas presentan valores de rCLL al límite o fuera del rango de normalidad, sin presentar ningún tipo de gammapatía monoclonal. Diversos estudios verificaron que la alteración de los valores de rCLL es proporcional a la progresión de la insuficiencia renal y se estableció un rango de valores normales para estas situaciones. El rango de normalidad rCLL (0,37-3,1) fue validado clínicamente y permite mejorar la especificidad de detección para los casos de insuficiencia renal de 93% a 98% manteniendo la sensibilidad de identificación en 100%(7).
Técnicas para la detección de cadenas livianas libres de inmunoglobulinas
Las cadenas livianas libres, también conocidas como proteínas de Bence Jones, fueron consideradas el primer marcador tumoral y utilizadas para identificar y monitorear pacientes con tumores de las células B. La técnica original fue publicada por Henry Bence Jones en el año 1847(8) y, desde aquel momento, la orina ha sido el medio habitualmente utilizado para su determinación. Actualmente, la muestra de orina tiene un protagonismo relativo, recomendándose su análisis por electroforesis o inmunofijación(9) solo en algunos puntos concretos del algoritmo analítico. La sensibilidad de la electroforesis de proteínas en suero ronda los 500-2000 mg/L(9), estos niveles son 50 veces superiores a las concentraciones normales de κ y λ presentes en suero (κ: 3,30-19,40 mg/L y λ: 5,71-26,30 mg/L)(10). Debido a su escasa sensibilidad, la electroforesis resulta negativa para todos los pacientes con MM no secretor, para la mayoría de los pacientes con amiloidosis AL y para más del 50% de los pacientes con MM de cadena liviana. Esto tiene un impacto directo sobre el tiempo al diagnóstico generándose retrasos que repercuten en forma negativa en la calidad de vida del paciente(11). Teniendo en cuenta además que 20% de todos los pacientes con mieloma serán productores exclusivos de cadena liviana como proteína monoclonal y que la excreción de estas proteínas se produce a nivel urinario, es comprensible que con la intención de aumentar la sensibilidad de detección se haya establecido históricamente el análisis de proteínas en muestras pareadas de suero y orina para evitar falsos negativos. Sin embargo, los métodos electroforéticos en orina concentrada (hasta 200 veces) cumplen parcialmente con el objetivo. A la menor sensibilidad analítica se le suma la sensibilidad “fisiológica”. Un clon de células neoplásicas debe secretar más de 20 g de cadena liviana libre por día para saturar la absorción en los túbulos proximales renales de un riñón sano para ser detectables en orina(12). Por esto, las cadenas livianas libres urinarias no necesariamente correlacionan con las concentraciones séricas y no están, por lo tanto, directamente asociadas a la actividad y masa de las células tumorales(7). Muchos pacientes con gammapatía monoclonal tendrán cadenas livianas libres indetectables en orina(13). Por otro lado, el ensayo conlleva diversas dificultades técnicas en el laboratorio y de recolección y cumplimiento de la muestra por parte del paciente. Solo 20% a 40% de los individuos proporcionan una muestra de orina de 24 horas pareada a la toma de muestra de sangre, llegando a ser este cumplimiento tan bajo como 4,6% en algunos estudios(14-16). Las guías internacionales desaconsejan la determinación por nefelometría en esta muestra, estableciendo que “la medición de niveles de cadena liviana libre urinaria no está recomendada”(17). Los ensayos de cadenas livianas libres urinarias no resuelven ninguno de los inconvenientes relacionados al umbral renal, a la recolección de la muestra de orina ni a los relacionados a la menor sensibilidad de medición con este tipo de técnica, como se ha indicado anteriormente. Más aún, la sensibilidad diagnóstica de la determinación de cadenas livianas libres en suero es superior a la urinaria, y las concentraciones del rango normal y la relación κ/λ en suero son más reducidas que en orina, haciendo a la determinación en suero clínicamente más confiable.
Ensayo de cadenas livianas libres en suero
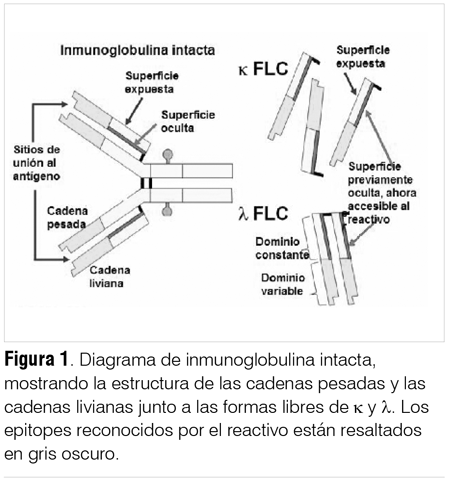
El ensayo de cadenas livianas libres en suero (Freelite®) es un inmunoensayo específico para la cuantificación de κ y de λ libres que utiliza anticuerpos policlonales, potenciados con látex, cuya reacción puede ser evidenciada por nefelometría o turbidimetría(9). Dos características esenciales lo diferencian de los ensayos previamente mencionados, la especificidad y la sensibilidad. Este inmunoensayo permite la identificación de la cadena liviana de la inmunoglobulina únicamente cuando esta se presenta en su forma libre (figura 1), es decir, no reacciona con la cadena liviana unida a la inmunoglobulina intacta. Esta gran especificidad se debe a que los epitopes reconocidos por los anticuerpos policlonales del reactivo quedan ocultos tras la cadena pesada, cuando la molécula está ensamblada como un anticuerpo y solo quedan accesibles cuando se encuentran en las formas libres. El ensayo permite cuantificar ambas estructuras monomérica y dimérica a concentraciones muy bajas(10) (<1 mg/L) y ha sido utilizado para determinar los niveles normales de cadenas livianas libres en individuos sanos, lo que hasta el momento no se había podido realizar(10). La detección de ambas proteínas séricas permite calcular la relación κ/λ, cuya alteración identifica monoclonalidad y tiene un papel crítico en el diagnóstico de discrasias de células B(10).
Aplicación del ensayo de cadenas livianas libres en suero
Para cada una de las distintas entidades de gammapatía monoclonal la determinación de inmunoglobulinas circulantes ha sido el pilar del diagnóstico de estos pacientes, dado el amplio espectro de sus distintas presentaciones tanto biológicas como clínicas. Identificar una proteína monoclonal puede ser trivial en algunos casos, pero puede requerir complejas aproximaciones en otros.
Recientemente, el Grupo Internacional de Trabajo para el Mieloma (International Myeloma Working Group, IMWG) ha recomendado incluir la medición de cadenas livianas libres en suero para individuos con gammapatías monoclonales, dada su gran utilidad en el manejo de estos pacientes, durante la etapa diagnóstica, en el monitoreo de la respuesta al tratamiento y por su valor pronóstico de progresión desde la presentación(18).
Utilización del test de cadenas livianas libres en suero en el cribado de GM
Es indiscutible que un exceso en suero de κ, de λ o una relación κ/λ alterada es común a casi todos los trastornos plasmaproliferativos (tabla 1). Durante los últimos años, varios estudios han reevaluado los esquemas históricos de diagnóstico. El análisis de las sensibilidades de detección de distintas combinaciones de pruebas para el tamizaje de gammapatías monoclonales ha mostrado que la incorporación de la determinación de cadenas livianas libres en suero a la electroforesis de proteínas y a la inmunofijación (todas pruebas realizadas en suero) aumenta significativamente la cantidad de pacientes detectados. Esto no es llamativo debido a que las técnicas electroforéticas solo detectan cantidades de proteína monoclonal suficientemente grandes como para quedar en evidencia sobre un fondo de proteínas normales o policlonales. La electroforesis no debe considerarse suficiente cuando tiene por objeto el diagnóstico de un desorden de células plasmáticas, ya que es necesario considerar los pacientes que se presentan con secreción exclusiva de cadenas livianas (circulan en el orden de los mg/L), pacientes con amiloidosis AL, pacientes con enfermedad de depósito de cadenas livianas, etcétera. A estas patologías se suman también aquellos pacientes oligosecretores (proteína monoclonal en suero <10 g/L), todas situaciones clínicas para las cuales se requieren técnicas diagnósticas de mayor sensibilidad(3). En muchos casos la electroforesis de proteínas en orina resulta más sensible que la electroforesis en suero y permite la detección de cadenas livianas en niveles entre 10 y 20 mg/L (aunque en la práctica los laboratorios suelen reportar valores límites de detección de 40 a 50 mg/L)(7). Sin embargo, para muchos casos de pacientes esto es insuficiente aun cuando se concentre la muestra (100 a 200 veces). La posibilidad de cuantificar cadenas livianas libres en suero, con una sensibilidad que ronda 1 mg/L, llevó a muchos autores a plantear la posibilidad de prescindir de la muestra de orina de 24 horas para el tamizaje. La eliminación de la orina como medio de análisis ha generado alguna controversia inicialmente, sin embargo varios estudios han validado su sustitución(1,3,7,18,19), estando actualmente recomendada su sustitución para el tamizaje y el diagnóstico de gammapatías monoclonales también por el IMWG, con la excepción de casos de amiloidosis AL(18). Uno de los trabajos más relevantes llevados a cabo para dilucidar la posibilidad de reemplazar las pruebas en orina en el diagnóstico de gammapatías monoclonales fue realizado por Katzmann y colaboradores(1). En este estudio, realizado sobre 1.877 muestras de pacientes, se han practicado las cuatro pruebas estándares –electroforesis de proteínas e inmunofijación en suero, electroforesis de proteínas e inmunofijación en orina– con el agregado de la determinación de κ y λ en suero. Se comprobó la sensibilidad de cada una de las pruebas para la detección de gammapatías monoclonales en 1.851 casos y ninguna de las cinco técnicas de laboratorio realizadas mostró utilidad como única herramienta de diagnóstico(1). La combinación de las cinco técnicas logró identificar 1.851 pacientes (98,6% de los casos), existiendo 26 pacientes para los cuales no fue registrada ninguna alteración con ninguna de las cinco técnicas utilizadas. Los 26 pacientes corresponden a 11 casos de amiloidosis AL (1,9% de la totalidad de pacientes con amiloidosis del estudio); 8 casos de plasmocitoma extramedular (80% de la totalidad de estos pacientes); 3 casos de plasmocitoma (10,3% de todos los pacientes con esta patología); 3 casos de enfermedad de depósito de cadena liviana (10,3% del total de estos pacientes) y un caso de síndrome de POEMS (3% de los casos totales de POEMS).
Utilizando una estrategia basada en electroforesis en suero más cadenas livianas libres en suero, los autores logran identificar el 100% de pacientes con MM y 99,5% de los pacientes con MM asintomático. Aunque no se hayan identificado 41 pacientes GMSI utilizando esta combinación como técnica de tamizaje, estos pacientes presentaban una proteína monoclonal < 15 g/L y una relación κ/λ normal, lo que significa que se encuentran en el estrato de bajo riesgo de progresión y, por lo tanto, no requieren intervención médica(1,20) (ver sección pronóstico).
La actual recomendación del IMWG establece que la combinación de las pruebas de cadenas livianas libres en suero conjuntamente con la electroforesis (sumando la inmunofijación cuando una o ambas pruebas arroje un resultado positivo) es suficiente para identificar todos los trastornos linfoproliferativos monoclonales patológicos distintos de amiloidosis AL(18,21). Para el tamizaje de pacientes con amiloidosis AL, se ha observado que 1,9% a 4% de casos pueden dar resultados negativos en todas las pruebas en suero y, en estos casos, es también necesario el estudio inmunofijación en orina de 24 horas(1,21) (tabla 2). Para finalizar un diagnóstico de gammapatía monoclonal, las actuales recomendaciones del IMWG postulan que sigue siendo esencial solicitar también la cuantificación de la proteína monoclonal en orina de 24 horas en todos los pacientes(18).
Utilización del test de cadenas livianas libres en suero en el pronóstico de gammapatía monoclonal
El valor predictivo de las cadenas livianas libres en suero se extiende a la mayoría de las gammapatías monoclonales, y aunque todavía no esté clara la relación entre cadenas livianas y patogenicidad hay indicios de que los niveles elevados de κ y λ pueden estar relacionados con translocaciones IgH(22) y a una carga tumoral elevada(23,24). La GMSI es la gammapatía monoclonal más común, con una prevalencia de 3,2% en individuos con más de 50 años y con un riesgo de progresión a enfermedad maligna de 1% anual(25). Entre 33% a 44% de los pacientes presentan valores alterados de cadenas livianas libres en suero en el momento del diagnóstico, y se ha demostrado que estos individuos tienen un mayor riesgo de progresión a mieloma(20). El modelo clásico de estratificación de riesgo para estos pacientes utiliza como parámetros el tamaño de la proteína monoclonal (>15 g/L) y el tipo de cadena pesada de la inmunoglobulina (diferente de IgG)(26). Desde hace algunos años se ha incorporado un tercer factor del riesgo, presentar una relación κ/λ alterada. Dado que la estratificación del grado de riesgo por grupos contribuye al mejor seguimiento de estos pacientes, recientemente el consenso del grupo internacional para los factores de riesgo de progresión recomiendan que los pacientes de bajo riesgo (ningún factor de riesgo presente) sean seguidos a los seis meses después del diagnóstico, y posteriormente, si permanecen estables, cada dos o tres años o cuando exista alguna sintomatología relacionada(11,27). Pacientes de riesgo intermedio o alto (uno o más factores de riesgo) deberán ser seguidos a los seis meses y, posteriormente, de forma anual a lo largo de su vida(11) (tabla 3).
El MM asintomático o indolente se caracteriza por presentar todos los criterios diagnósticos del MM pero sin presentar sintomatología. Es, tal y como la GMSI, una entidad premaligna que se diferencia en el riesgo de progresión a mieloma sintomático o a amiloidosis, que es de 10% al año durante los cinco primeros años(27). Pacientes con una relación κ/λ marcadamente alterada presentan un mayor riesgo de progresión (8,1% anual) y este es un marcador independiente a los parámetros hasta ahora utilizados para clasificar a estos pacientes (componente monoclonal >30 g/L y células plasmáticas en médula ósea >10%)(27,28). El mejor punto de corte para predicción del riesgo de progresión se logró con una relación κ/λ <0,125 o >8, dando un riesgo de progresión a mieloma 2,3 veces más alto que para aquellos pacientes que presentan relación κ/λ entre 0,125 y 8. La incorporación de la relación κ/λ en el modelo de riesgo, utilizando los tres factores, se traduce en una progresión en cinco años de 76%, 51% y 25% para los grupos de alto, medio y bajo riesgo, respectivamente(28). Para esta entidad, las actuales guías recomiendan su seguimiento a los 2-3 meses de su diagnóstico inicial, si permanece estable, a cada 4-6 meses durante un año, y posteriormente de mantenerse la estabilidad, se pueden alargar a intervalos de 6 a 12 meses(29). Recientemente, Larsen y colaboradores identificaron un grupo de pacientes con MM asintomático de “alto riesgo”. Estos pacientes presentaban una relación κ/λ en suero >100 o <0,01 y mostraron una progresión temprana a mieloma activo, requiriendo tratamiento. Los autores concluyen que las cadenas livianas libres pueden ser utilizadas como un biomarcador independiente, altamente específico para identificar pacientes con mieloma asintomático con mayor riesgo de desarrollo de daño orgánico debido dentro de un período de dos años(30).
En pacientes con MM activo de nuevo diagnóstico son varios los estudios que han demostrado que los valores basales séricos de cadenas livianas libres tiene valor pronóstico para la sobrevida(11,31,32). El mieloma activo se caracteriza por la existencia de sintomatología (daño orgánico, criterios CRAB) y es independiente de la cantidad de la proteína monoclonal o de la infiltración de células plasmáticas en médula ósea(33). En el momento del diagnóstico, 95% a 97% de los pacientes presentan un cociente κ/λ alterado(1,31,33), y se ha confirmado que los pacientes con una relación inferior a 0,03 o superior a 32 presentan peor pronóstico. Por este motivo se ha sugerido que este parámetro sea añadido al sistema de clasificación del ISS (International Staging System) que actualmente usa como parámetros la ⓸2microglobulina y la albúmina(1,11,26-29,32).
En amiloidosis AL, 88% a 98% de los pacientes presentan una relación κ/λ libre alterada al momento del diagnóstico(1,34). La evaluación de los niveles basales proporciona información de valor pronóstico en amiloidosis AL y está recomendado por las guías del IMWG(18). Los niveles basales de la cadena liviana libre involucrada, es decir la cadena monoclonal, en la enfermedad, se han relacionado con una mayor afectación orgánica y, en consecuencia, con estadios más avanzados de la enfermedad(21,23). Los pacientes con amiloidosis AL con alta carga de cadena liviana libre evidenciada como una diferencia entre el valor de la cadena involucrada y la no involucrada (iCLL-niCLL=dCLL) dCLL >196 mg/L presentan con mayor frecuencia compromiso cardíaco severo, con mayores niveles de los marcadores cardíacos troponina T y péptido natriurético tipo-B (NT-ProBNP)(35). Sin embargo, en un análisis multivariado que incluía los marcadores cardíacos, número de órganos involucrados, grosor del septum ventricular, fracción de eyección, células plasmáticas circulantes, niveles séricos de ácido úrico, la dCLL basal permaneció como predictor independiente de sobrevida(35).
Utilización del test de cadenas livianas libres en suero en la monitorización de gammapatías monoclonales
La utilidad de la medición de cadenas livianas libres en suero en el monitoreo está recomendada en pacientes con amiloidosis AL, MM oligosecretor/no secretor y en todos los pacientes al momento de determinar la respuesta completa estricta, añadida en el año 2006 a los criterios de respuesta para el mieloma por el IMWG(36).
En pacientes con amiloidosis AL se recomienda la realización de mediciones seriadas de κ o κ en suero, las cuales se correlacionan con la sobrevida libre de progresión de la enfermedad, sobrevida global y con la respuesta orgánica y hematológica(21,23,34). Por estos motivos el test de cadenas livianas libres en suero ha sido incorporado a los criterios de respuesta para amiloidosis AL(37) que están validados por trabajos de Lachman, Sanchorawala y Palladini, entre otros. Lachman y colaboradores fueron los primeros en correlacionar cambios en los niveles séricos de estas proteínas monoclonales con la sobrevida global, demostrando que aquellos pacientes que alcanzan una reducción >50% en la cadena libre involucrada (iCLL) tenían mayor probabilidad de vivir durante más tiempo(21,23). Dispenzieri y colaboradores han verificado posteriormente que una reducción de 50% en la iCLL producía una mejora en la tasa de respuesta tanto hematológica como orgánica(23). En un estudio reciente de Palladini y colaboradores(38) se mostró que para pacientes con amiloidosis AL la calidad de la respuesta de cadena liviana libre está estricta y directamente relacionada con la sobrevida. De este modo, los pacientes que muestran una relación normal de κ/λ junto a una inmunofijación negativa tanto en suero como en orina pueden ser clasificados en respuesta completa; se encontrarán en una muy buena respuesta parcial (MBRP, VGPR por sus siglas en inglés) aquellos pacientes que presenten una dCLL < 40 mg/L y en respuesta parcial (RP) cuando la disminución de dCLL sea menor a 50%(38). Debido a su corta vida media κ y λ son usualmente marcadores más efectivos para evaluar los efectos tempranos de la quimioterapia en pacientes con amiloidosis AL. Las guías internacionales recomiendan el análisis de cadenas livianas libres en suero para el monitoreo cuantitativo de pacientes con amiloidosis AL(18).
En cuanto al MM no secretor u oligosecretor, dado que las técnicas electroforéticas tradicionalmente utilizadas en laboratorio, tanto en suero como en orina, no permiten la detección de tan bajos niveles de proteína monoclonal producida, la determinación de cadenas livianas libres en suero es crucial para el seguimiento de estos pacientes. Hasta hace muy poco tiempo, el aspirado de médula ósea era un requisito para el monitoreo de los “no secretores”, con todos los inconvenientes asociados al tratarse de una técnica invasiva. Sin embargo, la introducción del ensayo de cadenas livianas libres en suero permite que por lo menos en 70% de los pacientes “no secretores” se pueda hacer un seguimiento riguroso de la respuesta al tratamiento sin recurrir a aspirados de medula ósea frecuentes(39).
Por último, se recomienda la cuantificación de κy λ libres en suero en todos los pacientes para la evaluación y clasificación en respuesta completa estricta. Este concepto de respuesta exige, aparte de la negativización de la inmunofijación en suero y orina y de la ausencia de células plasmáticas monoclonales en médula ósea, la normalización de la relación κ/λ(36) en suero (tabla 4) y fue introducido en el año 2006 por consenso del IMWG en las guías sobre criterios de respuesta uniforme para el MM.
Uso del ensayo de cadenas livianas libres en suero en el contexto de la insuficiencia renal
La incorporación del rango renal ha colaborado en lograr un diagnóstico de mayor sensibilidad y especificidad para los pacientes con compromiso renal(17). Se han publicado varios estudios sobre la necesidad de determinar los niveles de κ y λ en suero en pacientes con insuficiencia renal aguda (IRA) de forma de orientar el diagnóstico de riñón de mieloma, una patología renal provocada por la precipitación de las cadenas livianas con las proteínas de Tamm-Horsfall a nivel del túbulo distal. Esta lesión renal aparece en 10% a 20% de los pacientes con mieloma recién diagnosticados, y la rápida remoción de las cadenas livianas es un requisito para revertir la enfemedad y evitar la pérdida funcional del riñón. Es por esto que se hace imprescindible lograr una rápida identificación de las cadenas livianas como agentes responsables de una IRA sin causa aparente. En este contexto, Hutchison y colaboradores han publicado recientemente las sugerencias del Grupo Internacional de Investigación de Riñón y Gammapatías Monoclonales (IKMGRG, por su sigla en inglés) para el tamizaje de pacientes con IRA sin causa aparente. En estas recomendaciones se establece que ante esta situación clínica y con el fin de excluir el riñón de mieloma como causa de la IRA, es necesario realizar una evaluación de los niveles en suero de las cadenas livianas. De encontrarse una producción clonal de κ o λ es importante hacer la distinción en el valor de la cadena involucrada, siendo 500 mg/L el punto de corte establecido para el riesgo de nefrotoxicidad e inmediato inicio del tratamiento de reducción de estas proteínas monoclonales circulantes(40).
Discusión
El ensayo de cadenas livianas libres en suero tiene un papel importante en la práctica clínica en diferentes fases del desarrollo de una gammapatía monoclonal. A nivel diagnóstico este ensayo permitió simplificar los protocolos de tamizaje siendo al momento suficiente una serie de análisis utilizando una única muestra de suero, confiable y fácil de obtener, para la identificación de una gammapatía monoclonal, con la única excepción de una fuerte sospecha de amiloidosis AL, situación que requiere un análisis por inmunofijación de orina de 24 horas. Un retraso en el diagnóstico puede acarrear consecuencias graves para los pacientes con MM, como progresión a insuficiencia renal o fracturas óseas severas. Es, por lo tanto, una ventaja incuestionable disponer de un protocolo simple y sensible que permita la rápida identificación de una gammapatía monoclonal relevante. Igualmente importante es la posibilidad de estratificar a los pacientes con GMSI (MGUS), que pueden ser seguidos de acuerdo con una probabilidad individual de progresión a mieloma o amiloidosis AL, librando el estrés causado por el diagnóstico a pacientes de bajo riesgo y permitiendo una mayor atención e intervención en pacientes de alto riesgo. Además de las GMSI, la determinación de cadenas livianas libres en suero tiene valor pronóstico para todas las entidades de gammapatía monoclonal. El monitoreo de los pacientes puede realizarse más eficazmente gracias a su elevada sensibilidad y su corta vida media permite una evaluación rigurosa, detectando recaídas en forma temprana así como presencia de enfermedad residual. El control periódico de los niveles de κ y λ permitirá no solo evaluar la eficacia de la terapia sino también detectar tempranamente un potencial escape de la cadena liviana; esta recaída clínica a expensas de elevaciones en la producción monoclonal de la cadena liviana solamente es un fenómeno que se presenta con una frecuencia de 10% a 15% en los pacientes con MM de inmunoglobulina intacta (en general pacientes originalmente con producción de IgG o IgA) en tratamiento.
Hoy día la utilidad del ensayo de cadenas livianas libres en suero está bien establecida en diversas guías internacionales (IMWG, BCSH & UKMF, NCCN, ESMO, etcétera) en el contexto de las gammapatías monoclonales, pero su aplicación podría ser también muy relevante en otras áreas clínicas. Este ensayo ha mostrado tener un papel en patologías neoplásicas como linfomas y leucemias, en patologías autoinmunes como artritis reumatoidea, lupus eritematoso sistémico o esclerosis múltiple. Las aplicaciones se amplían a la vez que se potencian los usos de herramientas más actuales y eficientes, tales como esta prueba.
Conclusiones
En resumen, son cuatro las principales aplicaciones para el ensayo de cadenas livianas libres en suero en la evaluación y el manejo del MM y trastornos relacionados (tabla 5):
1. En el tamizaje y diagnóstico: recomendado conjuntamente con electroforesis de proteínas en suero e inmunofijación en suero para todas las gammapatías monoclonales distintas de amiloidosis AL.
2. Por su valor pronóstico de todas las gammapatías monoclonales.
3. En el monitoreo de la respuesta al tratamiento, especialmente en pacientes con MM “no secretor”, MM de cadena liviana, amiloidosis AL y pacientes oligosecretores (tanto de inmunoglobulina intacta como de cadena liviana exclusiva).
4. En todos los pacientes que hayan alcanzado una respuesta completa al tratamiento para definir la respuesta completa estricta.
Abstract
The serum free light chain testing quantifies levels of free κ and λ. There are three main indications for the measurement of free light chains in the handling of patients with multiple myeloma and associated diseases. First, within the context of diagnosis, they provide the most sensitive pattern for screening together with serum protein electrophoresis and immunifixation electrophoresis, resulting in it not being necessary to perform 24-hour urine collection. Second, basal values of free light chains have proved their prognostic value for most monoclonal gammapathies. Third, serum free light chain testing enables a quantitative and sensitive monitoring in patients with an oligosecretory presentation of the disease, including AL amyloidosis, and in almost 70% of patients who were historically considered to be non-secretory. This review aims to update the information on the application of this testing.
Resumo
O exame para detecção de cadeias leves livres no soro mede os níveis de κ e λ livres. Existem três indicações principais para realizar a quantificação das cadeias leves livres no manejo de pacientes com mieloma múltiplo e outras doenças relacionadas. Primero, no contexto do diagnóstico onde, combinada com a eletroforese de proteínas no soro e a imunofixação no soro, constituem o esquema de triagem com maior sensibilidade, eliminando a necessidade de analisar a urina de 24 horas. Segundo, os valores basais das cadeias leves livres no soro mostraram ter valor prognóstico na maioria das gamapatias monoclonais. Terceiro, a técnica de cadeias leves libres no soro permite monitorar de maneira quantitativa e sensível os pacientes com apresentação oligossecretora da patologia inclusive da amiloidose AL e de aproximadamente 70% dos pacientes habitualmente denominados não secretores. O objetivo desta revisão é atualizar a informação sobre as aplicações desta importante técnica.
Bibliografía
1. Katzmann JA, Kyle RA, Benson J, Larson DR, Snyder MR, Lust JA, et al. Screening panels for detection of monoclonal gammopathies. Clin Chem 2009 Aug; 55(8):1517-22.
2. Bradwell AR. Serum free light chain analysis. 6th edition. 2010. Capítulo 3, 10-17. Capítulo 4, 18-35.
3. Hill PG, Forsyth JM, Rai B, Mayne S. Serum free light chains: an alternative to the urine Bence Jones proteins screening test for monoclonal gammopathies. Clin Chem 2006; 52(9):1743-8.
4. Solomon A. Light chains of human immunoglobulins. Methods Enzymol 1985; 116:101-21.
5. Waldmann TA, Strober W, Mogielnicki RP. The renal handling of low molecular weight proteins. II. Disorders of serum protein catabolism in patients with tubular proteinuria, the nephrotic syndrome, or uremia. J Clin Invest 1972; 51(8):2162-74.
6. Russo LM, Bakris GL, Comper WD. Renal handling of albumin: a critical review of basic concepts and perspective. Am J Kidney Dis 2002; 39(5):899-919.
7. Katzmann JA. Screening panels for monoclonal gammopathies: time to change. Clin Biochem Rev 2009; 30(3):105-11.
8. Bence Jones H. Papers ON CHEMICAL PATHOLOGY: prefaced by the Gulstonian Lectures, read at the Royal College of Physicians, 1846. Lancet 1847; 50(1247):88-92.
9. Bradwell AR, Carr-Smith HD, Mead GP, Tang LX, Showell PJ, Drayson MT, Drew R. Highly sensitive, automated immunoassay for immunoglobulin free light chains in serum and urine. Clin Chem 2001; 47(4):673-80.
10. Katzmann JA, Clark RJ, Abraham RS, Bryant S, Lymp JF, Bradwell AR, Kyle RA. Serum reference intervals and diagnostic ranges for free kappa and free lambda immunoglobulin light chains: relative sensitivity for detection of monoclonal light chains. Clin. Chem 2002 Sep;48(9):1437-44.
11. Kariyawasan CC, Hughes DA, Jayatillake MM, Mehta AB. Multiple myeloma: causes and consequences of delay in diagnosis. QJM 2007; 100(10):635-40.
12. Drayson MT. Using single protein biomarkers to predict health and disease in diverse patient populations: a new role for assessment of immunoglobulin free light chains. Mayo Clin Proc 2012; 87(6):505-7.
13. Lindstedt G, Lundberg PA. Loss of tubular proteinuria pattern during urine concentration with a commercial membrane filter cell (Minicon® B-15 system). Clin Chim Acta 1974; 56(1):125-6.
14. Piehler AP, Gulbrandsen N, Kierulf P, Urdal P. Quantitation of serum free light chains in combination with protein electrophoresis and clinical information for diagnosing multiple myeloma in a general hospital population. Clin Chem 2008; 54(11):1823-30.
15. Holding S, Spradbery D, Hoole R, Wilmot R, Shields ML, Levoguer AM, et al. Use of serum free light chain analysis and urine protein electrophoresis for detection of monoclonal gammopathies. Clin Chem Lab Med 2011; 49(1):83-8.
16. Robson EJD, Taylor J, Beardsmorre C, Basu S, Mead G, Lovatt T. Utility of serum free light chain analysis when screening for lymphoproliferative disorders. Lab Med 2009; 40:325-9.
17. Hutchison CA, Plant T, Drayson M, Cockwell P, Kountouri M, Basnayake K, et al. Serum free light chain measurement aids the diagnosis of myeloma in patients with severe renal failure. BMC Nephrol 2008; 9:11.
18. Dispenzieri A, Kyle R, Merlini G, Miguel JS, Ludwig H, Hajek R, et al. International Myeloma Working Group guidelines for serum-free light chain analysis in multiple myeloma and related disorders. Leukemia 2009; 23(2):215-24.
19. Katzmann JA, Dispenzieri A, Kyle RA, Snyder MR, Plevak MF, Larson DR, et al. Elimination of the need for urine studies in the screening algorithm for monoclonal gammopathies by using serum immunofixation and free light chain assays. Mayo Clin Proc 2006; 81(12):1575-8.
20. Rajkumar SV, Kyle RA, Therneau TM, Melton LJ 3rd, Bradwell AR, Clark RJ, et al. Serum free light chain ratio is an independent risk factor for progression in monoclonal gammopathy of undetermined significance. Blood 2005; 106(3):812-7.
21. Palladini G, Russo P, Bosoni T, Verga L, Sarais G, Lavatelli F, et al. Identification of amyloidogenic light chains requires the combination of serum-free light chain assay with immunofixation of serum and urine. Clin Chem 2009; 55(3):499-504.
22. Kumar S, Fonseca R, Dispenzieri A, Katzmann JA, Kyle RA, Clark R, et al. High Incidence of IgH Translocations in Monoclonal Gammopathies with Abnormal Free Light Chain Levels. ASH Annual Meeting Abstracts 2006; 108(11):3514.
23. Dispenzieri A, Lacy MQ, Katzmann JA, Rajkumar SV, Abraham RS, Hayman SR, et al. Absolute values of immunoglobulin free light chains are prognostic in patients with primary systemic amyloidosis undergoing peripheral blood stem cell transplantation. Blood 2006; 107(8):3378-83.
24. van Rhee F, Bolejack V, Hollmig K, Pineda-Roman M, Anaissie E, Epstein J, et al. High serum-free light chain levels and their rapid reduction in response to therapy define an aggressive multiple myeloma subtype with poor prognosis. Blood 2007; 110(3):827-32.
25. Kyle RA, Therneau TM, Rajkumar SV, Larson DR, Plevak MF, Offord JR et al. Prevalence of monoclonal gammopathy of undetermined significance. N Engl J Med 2006; 354(13):1362-9.
26. Kyle RA, Rajkumar SV. Monoclonal gammopathy of undetermined significance. Br. J. Haematol 2006; 134(6):573-89.
27. Kyle RA, Remstein ED, Therneau TM, Dispenzieri A, Kurtin PJ, Hodnefield JM, et al. Clinical course and prognosis of smoldering (asymptomatic) multiple myeloma. N Engl J Med 2007; 356(25):2582-90.
28. Dispenzieri A, Kyle RA, Katzmann JA, Therneau TM, Larson D, Benson J, et al. Immunoglobulin free light chain ratio is an independent risk factor for progression of smoldering (asymptomatic) multiple myeloma. Blood 2008; 111(2):785-9.
29. Kyle RA, Durie BG, Rajkumar SV, Landgren O, Blade J, Merlini G, et al; International Myeloma Working Group. Monoclonal gammopathy of undetermined significance (MGUS) and smoldering (asymptomatic) multiple myeloma: IMWG consensus perspectives risk factors for progression and guidelines for monitoring and management. Leukemia 2010; 24(6):1121-7.
30. Larsen JT, Kumar SK, Dispenzieri A, Kyle RA, Katzmann JA, Rajkumar SV. Serum free light chain ratio as a biomarker for high-risk smoldering multiple myeloma. Leukemia 2013; 27(4):941–6.
31. Snozek CL, Katzmann JA, Kyle RA, Dispenzieri A, Larson DR, Therneau TM, et al. Prognostic value of the serum free light chain ratio in newly diagnosed myeloma: proposed incorporation into the international staging system. Leukemia 2008; 22(10):1933-7.
32. Kyrtsonis M, Maltezas D, Tzenou T, Koulieris E, Bradwell AR. Staging Systems and Prognostic Factors as a Guide to Therapeutic Decisions in Multiple Myeloma. Semin Hematol 2009; 46(2):110-7.
33. International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Br J Haematol 2003; 121(5):749-57.
34. Lachmann HJ, Gallimore R, Gillmore JD, Carr-Smith HD, Bradwell AR, Pepys MB, et al. Outcome in systemic AL amyloidosis in relation to changes in concentration of circulating free immunoglobulin light chains following chemotherapy. Br J Haematol 2003; 122(1):78-84.
35. Kumar S, Dispenzieri A, Katzmann JA, Larson DR, Colby CL, Lacy MQ, et al. Serum immunoglobulin free light-chain measurement in primary amyloidosis: prognostic value and correlations with clinical features. Blood 2010; 116(24):5126-9.
36. Durie BG, Harousseau JL, Miguel JS, Bladé J, Barlogie B, Anderson K, et al; International Myeloma Working Group. International uniform response criteria for multiple myeloma. Leukemia 2006; 20(9):1467-73.
37. Gertz MA, Comenzo R, Falk RH, Fermand JP, Hazenberg BP, Hawkins PN, et al. Definition of organ involvement and treatment response in immunoglobulin light chain amyloidosis (AL): a consensus opinion from the 10th International Symposium on Amyloid and Amyloidosis, Tours, France, 18-22 April 2004. Am J Hematol 2005; 79(4):319-28.
38. Palladini G, Dispenzieri A, Gertz MA, Kumar S, Wechalekar A, Hawkins PN, et al. New criteria for response to treatment in immunoglobulin light chain amyloidosis based on free light chain measurement and cardiac biomarkers: impact on survival outcomes. J Clin Oncol 2012; 30(36): 4541-9.
39. Drayson M, Tang LX, Drew R, Mead GP, Carr-Smith H, Bradwell AR. Serum free light-chain measurements for identifying and monitoring patients with nonsecretory multiple myeloma. Blood 2001; 97(9):2900-2.
40. Hutchison CA, Batuman V, Behrens J, Bridoux F, Sirac C, Dispenzieri A, et al. International Kidney and Monoclonal Gammopathy Research Group. The pathogenesis and diagnosis of acute kidney injury in multiple myeloma. Nat Rev Nephrol 2011; 8(1):43-51.














