Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Revista Médica del Uruguay
versão On-line ISSN 1688-0390
Rev. Méd. Urug. vol.28 no.4 Montevideo dez. 2012
Análisis de sobrevida según perfil biológico de pacientes uruguayas con cáncer de mama
Dres. Cecilia Castillo*, Natalia Camejo†, Lucía Delgado‡, Rodrigo Fresco§, Guianeya Santander¶, Sergio Aguiar**, Valeria González‡‡, Silvina Heinzen§§, Andrea Martínez†, Carlos Meyer‡‡, Gustavo Sena§§, Gonzalo Spera†, Luis Ubillos*, Franco Xavier†, Hugo Deneo¶¶, Marta Aghazarian***, Robinson Rodríguez†††, Graciela Sabini‡‡‡
Servicio de Oncología Clínica. Hospital de Clínicas "Dr. Manuel Quintela". Universidad detabla la República. Montevideo, Uruguay
Resumen
Introducción: el cáncer de mama (CM) constituye una enfermedad heterogénea reconociéndose subtipos con diferentes características mediante, entre otras técnicas, el estudio del nivel de expresión tumoral de los receptores hormonales (RRHH) y del HER2. Previamente reportamos la relación entre estos subtipos y características clínico-patológicas en pacientes uruguayas. Objetivo: analizar la sobrevida libre de enfermedad (SVLE) de pacientes uruguayas con cáncer de mama de acuerdo a su subtipo biológico, definido en base a la expresión tumoral de HER2 y RRHH evaluada mediante inmunohistoquímica. Material y método: se revisaron historias clínicas de pacientes intervenidas quirúrgicamente por CM estadios I-III en un período de dos años, realizándose el cálculo de SVLE para todas las pacientes y según subtipo biológico. Resultados: con seguimiento mediano de 40 meses, la SVLE a dos años para el total de las pacientes fue de 92,3%; 94% para las pacientes RRHH+/HER2-, 91% para las triple negativas (TN) y 71,4% para las HER2+. La comparación de las curvas de SVLE, según los diferentes subtipos, mostró menor SVLE para las pacientes HER2+ (p = 0,03) y similar SVLE de las pacientes RRHH+/HER2- y TN (p = 0,86). Conclusiones: las pacientes uruguayas con CM presentan una SVLE a dos años acorde a los reportes internacionales. Las pacientes HER2+ presentan una mayor tasa de recidivas, lo cual también es coincidente a lo reportado. La similar SVLE a dos años de las pacientes RRHH+/HER 2- y de las TN no se explicaría por diferencias en características clínico-patológicas, planteándose como hipótesis una mayor proporción de pacientes del subtipo luminal B entre las pacientes RRHH+/ HER 2-.
Palabras clave: ANÁLISIS DE SUPERVIVENCIA PRONÓSTICO NEOPLASIAS DE LA MAMA RECEPTORES ESTRÓGÉNICOS RECEPTORES DE PROGESTERONA RECEPTOR erbB-2
Keywords: SURVIVAL ANALYSIS PROGNOSIS BREAST NEOPLASMS RECEPTORS, STROGEN RECEPTORS, PROGESTERONE RECEPTOR, erbB-2
* Asistente del Servicio de Oncología Clínica, Hospital de Clínicas, Facultad de Medicina, Universidad de la República. Uruguay.† Ex Residente del Servicio de Oncología Clínica, Hospital de Clínicas, Facultad de Medicina, Universidad de la República. Uruguay.‡ Prof. del Servicio de Oncología Clínica, Hospital de Clínicas, Facultad de Medicina, Universidad de la República. Uruguay.§ Prof. Adj. del Servicio de Oncología Clínica, Hospital de Clínicas, Facultad de Medicina, Universidad de la República. Uruguay.¶ Asistente del Servicio de Oncología Clínica, Hospital de Clínicas, Facultad de Medicina, Universidad de la República. Servicio de Oncología del Hospital Central de las Fuerzas Armadas. Uruguay.** Ex Prof. Adj. del Servicio de Oncología Radioterápica, Hospital de Clínicas, Facultad de Medicina, Universidad de la República. Uruguay.‡‡ Ex Residente del Departamento de Oncología Clínica del CASMU. Uruguay.§§ Asistente del Departamento Básico de Medicina, Hospital de Clínicas, Facultad de Medicina, Universidad de la República. Uruguay.¶¶ Prof. Agdo. Cátedra de Anatomía Patológica, Hospital de Clínicas, Facultad de Medicina, Universidad de la República. Uruguay.*** Jefe del Departamento de Oncología Médica del Instituto Nacional del Cáncer, ASSE. Uruguay.††† Jefe del Servicio de Oncología del Hospital Central de las Fuerzas Armadas. Médico especializado, colaborador honorario del Servicio de Oncología Clínica, Hospital de Clínicas, Facultad de Medicina, Universidad de la República. Uruguay.‡‡‡ Ex Prof. Directora del Servicio de Oncología Clínica, Hospital de Clínicas, Facultad de Medicina, Universidad de la República. Uruguay.
Correspondencia: Dra. Cecilia Castillo. Servicio de Oncología Clínica. Hospital de Clínicas, Avda. Italia s/n CP 11600. Montevideo, Uruguay. Correo electrónico: castillocecilia@hotmail.com. Recibido: 8/6/12 Aprobado: 30/11/12.Conflictos de intereses: los autores declaran que no existen conflictos de intereses.
Introducción
El cáncer de mama (CM) es el cáncer más frecuente en la mujer uruguaya, responsable de 26,5% de los cánceres diagnosticados en mujeres (período 2002- 2006)(1). Ocupa además el primer lugar en mortalidad, con un promedio anual de 663 muertes por año (período 2004-2008)(2), si bien la curva de mortalidad muestra en los últimos años una tendencia al descenso(3). Al igual que lo observado en otros países, se estima que esto es resultado de diagnósticos en etapas más tempranas y tratamientos más efectivos del CM temprano. Si bien los carcinomas mamarios pueden ser similares desde el punto de vista anatomopatológico, se sabe que constituyen una enfermedad heterogénea, con diferentes características clínicas, evolución y respuesta a los tratamientos. El perfil de expresión génica evaluado mediante microarreglos de ácido desoxirribonucleico (ADN) ha llevado al reconocimiento de subtipos moleculares de CM con características diferentes en cuanto a incidencia, etnicidad/raza, distribución de los factores de riesgo, pronóstico, respuesta a tratamientos y sobrevida(4,5). Los tipos moleculares identificados originalmente son: luminal A, luminal B, HER 2 símil, basal símil, y normal símil mamario, con la identificación de un nuevo subtipo a partir de estudios más recientes denominado claudin-low(6).
Las técnicas empleadas para la identificación de los subtipos moleculares son complejas, costosas y no disponibles ampliamente. Por tal motivo se han buscado alternativas que permitan obtener un nivel similar de información a través de técnicas fácilmente disponibles. Diversos estudios han demostrado que el CM puede ser clasificado de forma similar a lo definido por el perfil de expresión génica en subtipos que resultan de la combinación de HER2, RE y RP mediante inmunohistoquímica (IHQ), representando una alternativa válida para el manejo clínico y menos costosa y compleja que los estudios moleculares(7-9).
Previamente nuestro grupo reportó en pacientes uruguayas la frecuencia de los subtipos de CM resultantes de la combinación de la expresión tumoral por IHQ de HER2, RE y RP y la relación de dichos subtipos con las características clínico patológicas(10).
Objetivos
Analizar la sobrevida libre de enfermedad de los subtipos de cáncer mamario en pacientes uruguayas con CM operable, definidos en base a la expresión tumoral de HER2, RE y RP evaluada mediante IHQ. Según nuestro conocimiento se trata del primer estudio en Uruguay y Latinoamérica en analizar la sobrevida de pacientes con CM de acuerdo al perfil biológico, lo cual le confiere especial interés
Material y método
Se analizaron las historias clínicas de pacientes de sexo femenino intervenidas quirúrgicamente por CM invasivo estadio I-III, entre marzo de 2006 y marzo de 2008, en los servicios/departamentos de oncología de cuatro instituciones de Montevideo: Hospital de Clínicas, Hospital Central de las Fuerzas Armadas, Centro de Asistencia del Sindicato Médico del Uruguay (CASMU) e Instituto Nacional del Cáncer (INCA).
Se incluyeron en el estudio aquellas pacientes con determinación disponible de RE, RP y HER2 en el tumor primario por IHQ, y con un seguimiento mínimo de 30 meses desde el momento de la cirugía.
De las historias clínicas se obtuvieron datos de: edad, tipo histológico, grado histológico, tamaño tumoral, estatus ganglionar axilar, estadio, según la clasificación TNM(11), estatus de HER2, RE y RP mediante IHQ, y evolución clínica para el cálculo de la sobrevida libre de enfermedad (SVLE). Para el análisis y reporte de estos datos se mantuvo el anonimato de las pacientes.
Los estudios de IHQ para la determinación del estatus del RE y RP se realizaron con anticuerpos monoclonales y sistema de detección provisto por el fabricante, considerándose positivos aquellos con inmunotinción > 1% de RE y/o RP a nivel nuclear de las células tumorales.
Para analizar la presencia de sobreexpresión del HER2 se utilizó Herceptest. Se consideró positivo el resultado con inmunotinción de membrana 3+, definido como la tinción de membrana completa e intensa en más de 10% de las células cancerosas, según las recomendaciones vigentes en el período de estudio de las pacientes.
Se definieron tres subtipos en base a la expresión tumoral positiva o negativa por IHQ de HER2, RE y RP:
- 1) RRHH+, HER2- : RE+ y/o RP+, HER2-; RE-/RP+, HER2-; RE+/RP-, HER2-
- 2) HER2+: RE/RP+ o -, HER2+
- 3) RE-, RP-, HER2- (triple negativo).
La SVLE fue medida desde el momento de la cirugía hasta el último seguimiento, o hasta que ocurriera uno de los siguientes eventos: recidiva local, regional o recidiva a distancia.
Para el análisis estadístico se utilizó el método de Kaplan Meier y la diferencia de sobrevida entre los subtipos se evaluó mediante el test de log rank. Se usó un nivel de significancia estadística de p <0,05. El paquete estadístico usado fue el SPSS 15.0 (SPSS Inc., Chicago IL, EEUU, 2006).
Resultados
Se incluyeron 169 pacientes, 44 de ellas fueron del Departamento de Oncología Clínica del CASMU, 27 del Servicio de Oncología Clínica del Hospital de Clínicas, 52 del INCA y 46 del Servicio de Oncología del Hospital Central de las Fuerzas Armadas. La edad mediana de las pacientes fue de 55 años (rango 30-85).
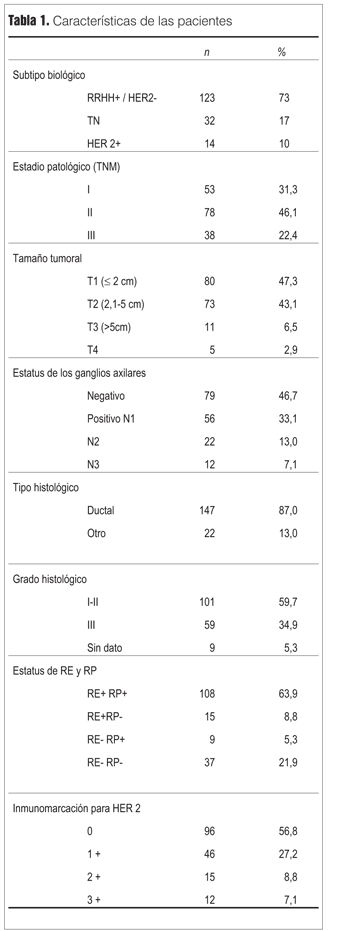
De las 169 pacientes, 123 fueron RRHH+/HER 2- (73 %), 32 triple negativas (TN) (19 %) y 14 HER2+ (8%) (tabla 1).
El resto de las características clínico-patológicas para el total de las pacientes se muestra en la tabla 1, donde se aprecia que eran favorables desde el punto de vista clínico-patológico para aproximadamente la mitad de las pacientes: tumores pequeños T1 (47%), ganglios axilares negativos (47%), grado histológico I o II (60%). Luego de un seguimiento mediano de 39,9 meses se detectaron 28 recidivas, falleciendo nueve de estas pacientes. Un total de 141 pacientes estaban vivas sin enfermedad al final del período de seguimiento.
La SVLE a dos años fue de 92,3% para todas las pacientes (figura 1). La SVLE a dos años según subtipo biológico fue de 94% para las RRHH +/HER2-, 91% para las TN y 71,4%para las HER2+ (figura 2). El análisis de las curvas de sobrevida evidencia que las pacientes HER2+ presentaron una SVLE significativamente más breve que las pacientes RRHH+/HER2- (p = 0,03) (figura 3) sin evidenciarse diferencias significativas estadísticamente en la SVLE en comparación con las pacientes TN (p = 0,11) (figura 4).
Se constató una superposición de las curvas de SVLE de las pacientes TN y RRHH+/HER2- (p = 0,86) (figura 5).
La sobrevida mediana no fue alcanzada globalmente ni por subgrupo.
Discusión
Con respecto a la prevalencia de los subtipos, los hallazgos son coincidentes con nuestra publicación anterior, con una frecuencia de tumores HER2+ por IHQ con inmunotinción 3+ inferior a la reportada en la literatura (habitualmente mayor o igual a 20%), mientras que la frecuencia del subtipo RRHH+/HER2- y TN fue algo superior a la reportada en población caucásica e hispana(10).
Similar a lo reportado en la literatura internacional, la SVLE a dos años estimada para todas las pacientes fue de 92,3% , registrándose diferencias en el pronóstico según el subtipo determinado por la expresión mediante IHQ de RE, RP y HER2(12).
Se demostró que las pacientes con tumores HER2+ tienen peor pronóstico que las pacientes con tumores RRHH+/ HER2-, coincidente con lo reportado en otros estudios(12).
Debemos considerar que del subgrupo de pacientes HER2+, menos de 50% recibió tratamiento adyuvante con trastuzumab, hecho que sabemos empeora su pronóstico, ya que se ha demostrado que su administración asociada a la quimioterapia reduce significativamente el riesgo de metástasis a distancia y muerte en estas pacientes(13-20). La no indicación del tratamiento con trastuzumab en muchos de estos casos fue consecuencia de que al momento de este estudio recién se incorporaba su uso a la práctica clínica estándar en nuestro medio.
Si bien las pacientes con tumores HER2+ también mostraron menor SVLE a dos años con respecto a las TN y curvas de sobrevida separadas, esta diferencia no alcanzó niveles de significación estadística, lo cual podría ser explicado por el bajo número de pacientes.
Las pacientes con RRHH+/HER2-, que habitualmente tienen el mejor pronóstico, presentaron llamativamente similar SVLE a dos años que las pacientes TN con curvas de sobrevida superpuestas.
Nuestros resultados difieren de los publicados por otros estudios, ya que el subtipo TN se caracteriza por ser un subtipo agresivo y de mal pronóstico(21).
A fin de explicar el comportamiento similar de ambos subgrupos se analizaron si las pacientes TN presentaban características clínico-patológicas favorables como, por ejemplo, estadios más precoces al diagnóstico con respecto a las pacientes RRHH+/HER2-.
La tabla 2 muestra que si bien los tumores TN presentaron un grado histológico mayor versus los tumores RRHH+/HER2- (p = 0,003) al igual con lo reportado en otros estudios, no se evidenciaron otras diferencias significativas entre estos subgrupos, tales como tamaño tumoral y número de ganglios comprometidos.
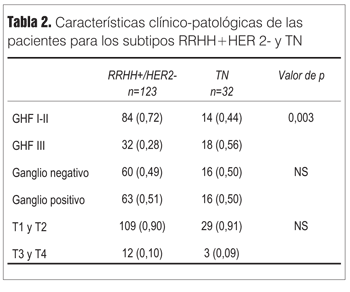
Podríamos entonces inferir a partir de estos datos que la similar SVLE a dos años y la superposición de las curvas de SVLE de las pacientes RRHH+/HER2- y TN, no se explicaría por diferencias en las características clínico-patológicas.
Una de las hipótesis que podría explicar este comportamiento sería la presencia de una mayor proporción de pacientes de peor pronóstico dentro del subgrupo de pacientes con RRHH+/HER2-, que correspondería a los tumores luminal B de la clasificación molecular, que se diferencian del luminal A por una mayor expresión de genes de proliferación, como el MK167 (que codifica Ki-67) y ciclina B1, y menor nivel de expresión de los RRHH(22). Si fuera posible confirmar esta hipótesis con la determinación del Ki-67 por IHQ a nivel tumoral (con valores > 14% en la mayor parte de este subgrupo) podríamos explicar así una similar evolución de este subgrupo con la del subgrupo TN, habitualmente de peor pronóstico.
Pensamos que nuestro estudio cuenta con algunas limitaciones, ya que se trata de un estudio retrospectivo y no se ha considerado si existió o no variabilidad en el tratamiento adyuvante administrado. Otra de las limitantes sería el tiempo mediano de seguimiento, ya que quizá un tiempo de seguimiento más prolongado podría ser necesario para mostrar mejor la relación entre los subtipos de CM y el pronóstico, sobre todo para pacientes con tumores RRHH+/HER2- cuyo riesgo de recaída se extiende más allá de los cinco años(23).
Otra limitante sería que el estatus del HER2 fue analizado únicamente por IHQ y no validado por la técnica de hibridación in situ fluorescente (FISH), que se considera el método estándar para determinación del estatus del HER2, ya que hay variabilidad en las tasas de falsos positivos y negativos(24).
Además, nuestro estudio no incluyó a pacientes con inmunotinción 2+ para HER2 por la posibilidad de no contar en todos los casos con resultados del FISH.
Conclusiones
La SVLE a dos años de nuestras pacientes con CM es similar a la reportada en la literatura. Hemos investigado el valor pronóstico de los subtipos de CM determinados mediante la expresión por IHQ del RE, RP y HER2.
Al igual que lo reportado en otros estudios, las pacientes HER2+ tienen mayor tasa de recidivas, que en nuestras pacientes puede explicarse, no sólo por la mayor agresividad biológica de este subtipo, sino también por la no indicación en muchos de los casos del trastuzumab adyuvante dada su reciente incorporación al momento del estudio, hecho que sabemos empeora significativamente el pronóstico de estas pacientes.
Para explicar una evolución clínica similar de las pacientes RRHH+/HER2- y TN hemos planteado como hipótesis una mayor proporción de pacientes del subtipo luminal B dentro del primer subgrupo, que podríamos confirmar si contáramos con la determinación por IHQ del Ki-67.
Creemos que sería necesario contar con estudios con un mayor número de pacientes, un seguimiento más prolongado y determinación del Ki-67 para confirmar estos resultados que pueden ser útiles para la mejor determinación del pronóstico de las pacientes uruguayas portadoras de CM.
Abstract
Introduction: breast cancer constitutes an heterogeneous disease. Two sub-types have been distinguished through the study of the tumor expression level of hormone receptors tumors, and level of HER2 expression, among other techniques. We previously reported the relation between these sub-types and the clinical and pathological characteristics of Uruguayan women.
Objective: to analyse the disease-free survival (DFS) of Uruguayan patients with breast cancer, according to their biological sub-type, defined based on the tumor expression of hormone receptors and HER2 expression which were assessed by immune-histological chemistry staining.
Method: all clinical records of patients who had undergone breast cancer surgery (Stages I-III) during a two year period were reviewed. The disease-free survival rate was calculated for all patients and according to their biological profile.
Results: forty months follow up revealed disease-free survival upon two years of 92.3% for all patients; 94% for hormone receptor positive /HER2 negative patients, 91% for triple negative patients, and 71.4% for hormone receptor positive patients.
Comparing the DFS curves, for the different sub-types, evidenced a lower DFS for HER2+ patients (p = 0.03), and similar DFS for hormone receptor positive/HER2 negative and triple negative (p = 0.86).
Conclusions: uruguayan patients with breast cancer show a two-year-DFS that matches international reports. HER2+ patients evidence a higher relapse rate, also consistent with international reports. Similar DFS upon two years, between hormone receptor positive/HER2 negative patients and triple negative patients cannot be due to differences in the clinical-pathological characteristics, thus a hypothesis is considered: there is a larger proportion of patients of the luminal B breast cancer sub-type among hormone receptor positive/HER2 negative patients.
Resumo
Introdução: o câncer de mama (CM) é uma patologia heterogênea, apresentando subtipos com diferentes características determinadas, entre outras técnicas, pelo estudo do nível de expressão tumoral dos receptores hormonais (RRHH) e do HER2. Em um artigo anterior descrevemos a relação entre esses subtipos e as características clínico-patológicas em pacientes uruguaias.
Objetivo: analisar a sobrevida livre de enfermidade (SVLE) de pacientes uruguaias com CM de acordo a seu subtipo biológico, definido pela expressão tumoral de HER2 e RRHH avaliada por imunohistoquímica.
Material e método: foram revisados os prontuários de pacientes operadas por cirurgia por CM estadios I-III em um período de dois anos; realizou-se o cálculo de SVLE de todas as pacientes e de acordo com o subtipo biológico.
Resultados: o seguimento com uma mediana de 40 meses mostrou uma SVLE aos dois anos para todas as pacientes de 92,3%; 94% para as pacientes RRHH+/HER2-, 91% para a triple negativa (TN) e 71,4% para as HER2+.
A comparação das curvas de SVLE, segundo os diferentes subtipos, mostrou uma menor SVLE para as pacientes HER2+ (p = 0,03) e similar SVLE para as pacientes RRHH+/HER2- y TN (p = 0,86).
Conclusões: as pacientes uruguaias com CM apresentam uma SVLE a dois anos compatível com resultados internacionais. As pacientes HER2+ apresentaram uma taxa maior de recidivas, resultados que coincidem com resultados internacionais. A SVLE aos dois anos similar para pacientes RRHH+/HER2- e TN não pode ser explicada pelas diferenças nas características clínico-patológicas, considerando-se como hipótese uma proporção maior de pacientes do subtipo luminal B entre as pacientes RRHH+/HER2-.
Bibliografía
1. Barrios E, Vasallos JA, Alonso R, Garau M, Musetti C. III Atlas de incidencia del cáncer en el Uruguay 2002-2006. Montevideo: Comisión Honoraria de Lucha Contra el Cáncer, Registro Nacional de Cáncer, 2010.
2. Barrios E, Vasallos JA, Alonso R, Garau M, Musetti C. IV Atlas de mortalidad por cáncer en el Uruguay 2004-2008. Montevideo: Comisión Honoraria de Lucha Contra el Cáncer, Registro Nacional de Cáncer, 2012. [En prensa].
3. Uruguay. Comisión Honoraria de Lucha Contra el Cáncer. Mortalidad en Uruguay 1990-2008: tendencias. Montevideo: CHLCC, 2009. p. 15. Disponible en: http://www.urucan.org.uy/uilayer/ve/Mortalidad_1990_2008_Tendencias.pdf [Consulta: 29 de noviembre de 2011].
4. Perou CM, Sørlie T, Eisen MB, van de Rijn M, Jeffrey SS, Rees CA, et al. Molecular portraits of human breast tumours. Nature 2000; 406(6797):747-52.
5. Sørlie T, Perou CM, Tibshirani R, Aas T, Geisler S, Johnsen H, et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc Natl Acad Sci U S A 2001; 98(19):10869-74.
6. Prat A, Parker JS, Karginova O, Fan C, Livasy C, Herschkowitz JI, et al. Phenotypic and molecular characterization of the claudin-low intrinsic subtype of breast cancer. Breast Cancer Res 2010; 12(5):R68.
7. van de Vijver MJ, He YD, van't Veer LJ, Dai H, Hart AA, Voskuil DW, et al. A gene-expression signature as a predictor of survival in breast cancer. N Engl J Med 2002; 347(25):1999-2009.
8. Huber KE, Carey LA, Wazer DE. Breast cancer molecular subtypes in patients with locally advanced disease: impact on prognosis, patterns of recurrence, and response to therapy. Semin Radiat Oncol 2009; 19(4):204-10.
9. Carey LA, Dees EC, Sawyer L, Gatti L, Moore DT, Collichio F, et al. The triple negative paradox: primary tumor chemosensitivity of breast cancer subtypes. Clin Cancer Res 2007; 13(8):2329-34.
10. Delgado L, Fresco R, Santander G, Aguiar S, Camejo N, Ferrero L, et al. Expresión tumoral de HER-2, receptores de estrógenos y de progesterona y su relación con características clínico-patológicas en pacientes uruguayas con cáncer de mama. Rev Med Urug 2010; 26(3):145-53.
11. American Joint Committee on Cancer. AJCC Cancer Stading Manual. 7th ed. New York: Springer, 2010. p. 347-76.
12. Harris JR, Lippman ME, Morrow M, Osborne CK. Enfermedades de la mama. 4 ed. Madrid: Lippincott Williams & Wilkins, 2011. Cap. 31, 48.
13. Piccart-Gebhart MJ, Procter M, Leyland-Jones B, Goldhirsch A, Untch M, Smith I, et al. Herceptin Adjuvant (HERA) Trial Study Team. Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer. N Engl J Med 2005; 353(16):1659-72.
14. Gianni L, Dafni U, Gelber RD, Azambuja E, Muehlbauer S, Goldhirsch A, et al. Treatment with trastuzumab for 1 year after adjuvant chemotherapy in patients with HER2-positive early breast cancer: a 4-year follow-up of a randomised controlled trial. Lancet Oncol 2011; 12(3):236-44.
15. Smith I, Procter M, Gelber RD, Guillaume S, Feyereislova A, Dowsett M, et al. 2-year follow-up of trastuzumab afteradjuvant chemotherapy in HER2-positive breast cancer: a randomised controlled trial. Lancet 2007; 369(9555):29-36.
16. Romond EH, Perez EA, Bryant J, Suman VJ, Geyer CE Jr, Davidson NE, et al. Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer. N Engl J Med 2005; 353(16):1673-84.
17. Perez EA, Romond EH, Suman VJ, Jeong JH, Davidson NE, Geyer CE Jr, et al. Four-year follow-up of trastuzumab plus adjuvant chemotherapy for operable human epidermal growth factor receptor 2-positive breast cancer: joint analysis of data from NCCTG N9831 and NSABP B-31. J Clin Oncol 2011; 29(25):3366-73.
18. Slamon D, Eiermann W, Robert N, Pienkowski T, Martin M, Rolski J, et al. Phase III randomized trial comparing doxorubicin and cyclophosphamide followed by docetaxel (ACT) with doxorubicin and cyclophosphamide followed by docetaxel and trastuzumab (ACTH) with docetaxel, carboplatin and trastuzumab (TCH) in Her2neu positive early breast cancer patients: BCIRG 006 study. Proceedings of the San Antonio Breast Cancer Symposium 2005. Cancer Res 2009; 69(24 Suppl):abstract 62. Disponible en: http://www.bcirg.org/NR/rdonlyres/euynx4wi7wx6yq4qenuxw5ok6bbclmm5ckfz5vyo7kdkrbg5iq4ketb23g4epbwzpld5vhqbsiolga72y2itf7plpqb/BCIRG+006+-+Final+Abstract+SABCS.pdf [Consulta: 10 dic 2011].
19. Slamon D, Eiermann W, Robert N, Pienkowski T, Martin M, Press M, et al. Breast Cancer International Research Group. Adjuvant trastuzumab in HER2-positive breast cancer. N Engl J Med 2011; 365(14):1273-83.
20. Joensuu H, Kellokumpu-Lehtinen PL, Bono P, Alanko T, Kataja V, Asola R, et al. Adjuvant docetaxel or vinorelbine with or without trastuzumab for breast cancer. N Engl J Med 2006; 354(8):809-20.
21. Dent R, Trudeau M, Pritchard KI, Hanna WM, Kahn HK, Sawka CA, et al. Triple negative breast cancer: clinical features and patterns of recurrence. Clin Cancer Res 2007; 13(15 Pt 1):4429-34.
22. Cheang MC, Chia SK, Voduc D, Gao D, Leung S, Snider J, et al. Ki67 index, HER2 status, and prognosis of patients with luminal B breast cancer. J Natl Cancer Inst. 2009; 101(10):736-50.
23. Dignam JJ, Dukic V, Anderson SJ, Mamounas EP, Wickerham DL, Wolmark N. Hazard of recurrence and adjuvant treatment effects over time in lymph node-negative breast cancer. Breast Cancer Res Treat 2009; 116(3):595-602.
24. Sauter G, Lee J, Bartlett JM, Slamon DJ, Press MF. Guidelines for human epidermal growth factor receptor 2 testing: biologic and methodologic considerations. J Clin Oncol 2009; 27(8):1323-33.














