Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Médica del Uruguay
versión On-line ISSN 1688-0390
Rev. Méd. Urug. vol.28 no.3 Montevideo set. 2012
Síndrome de reconstitución inmune relacionado con meningitis por Cryptococco en una adolescente infectada con el virus de inmunodeficiencia humana
Dres. Jorge Quian *, Stella Gutiérrez †, Virginia González ‡
Centro Nacional de Referencia Obstétrico Pediátrico VIH-SIDA.Centro Hospitalario Pereira Rossell. ASSE. Uruguay.
* Profesor Agregado de Pediatría. Facultad de Medicina, Universidad de la República. Director del Centro Nacional de Referencia. Uruguay.
† Profesora Agregada de Pediatría, Facultad de Medicina, Universidad de la República. Co-Directora del Centro Nacional de Referencia. Uruguay.
‡ Asistente de Clínica Pediátrica, Facultad de Medicina, Universidad de la República. Pediatra del Centro Nacional de Referencia. Uruguay.
Correspondencia: Dr. Jorge Quian. Pilcomayo 5163. Montevideo, Uruguay. Correo electrónico: jorgeq@internet.com.uy
Recibido: 24/1/12. Aceptado: 15/6/12
Resumen
El síndrome de reconstitución inmune (SIRI) es una complicación del tratamiento del virus de inmunodeficiencia humana (VIH) en pacientes que tenían previamente una alteración profunda de su sistema inmunitario. Se puede presentar bajo dos formas: como SIRI desenmascardor (unmasking syndrom) o paradójico. Se presenta el caso de una adolescente de 13 años en la que se hace diagnóstico de infección por VIH y no se pudo establecer la fuente de contagio. Al momento del diagnóstico, con una inmunosupresión severa se inicia el tratamiento con antirretrovirales y dentro de los dos meses de iniciado es hospitalizada por una meningitis criptocócica. Tratada con anfotericina, evoluciona favorablemente y se logra esterilizar el líquido cefalorraquídeo. Instala nuevamente síndrome de hipertensión endocraneana con elementos de irritación meníngea y convulsiones. Enviada a terapia intensiva se realizan corticoides a altas dosis y mejora, siendo dada de alta. Se interpreta el primer episodio de meningitis criptocócica como un SIRI desenmascarador. Esto es que se pusieron de relieve gérmenes viables pero que su presencia era desconocida. El segundo episodio se interpreta como SIRI paradójico; el hecho de que previamente tuviera el líquido cefalorraquídeo estéril y que mejorara con corticoides y sin antifúngicos corrobora el diagnóstico. El SIRI es un diagnóstico de presunción y no hay elementos de diagnóstico de certeza. Son los datos de la clínica en un paciente VIH inmunosuprimido y en el que se inicia el tratamiento de alta eficacia los que permiten el diagnóstico.
Palabras clave: SÍNDROME INFLAMATORIO DE RECONSTITUCIÓN INMUNE MENINGITIS CRIPTOCÓCICA VIH
Keywords: IMMUNE RECONSTITUTION INFLAMMATORY SYNDROME MENINGITIS, CRYPTOCOCCAL HIV
Introducción
El tratamiento de alta eficacia (TAE) con antirretrovirales (ARV) disminuye las enfermedades producidas por gérmenes oportunistas y reduce la mortalidad de pacientes infectados con el virus de inmunodeficiencia humana(VIH)(1).
Estos efectos benéficos resultan de una restauración gradual de la respuesta inmune debida a una supresión de la replicación viral y cuantificada a través de un incremento de los linfocitos CD4(2,3).
La reconstitución del sistema inmune, empero, puede presentarse con complicaciones que pueden deberse al agravamiento de infecciones por gérmenes oportunistas ya tratadas en el pasado, o a la aparición de infecciones que previamente eran subclínicas y, por tanto, no diagnosticadas ni tratadas. Esta respuesta se denomina síndrome inflamatorio de reconstitución inmune (SIRI)(4-6). No hay definición exacta del síndrome ni test confirmatorio y permanece como un diagnóstico de exclusión. Una de las primeras descripciones se efectuó en 1992 y se relacionó con el uso de zidovudina (AZT) en pacientes inmunosuprimidos que desarrollaban, una vez tratados con el ARV, sintomatología relacionada con mycobacterias(7).
El SIRI es la consecuencia de una exagerada activación del sistema inmune contra antígenos persistentes (SIRI paradójico) o de patógenos viables, pero que su presencia era desconocida (SIRI unmasking o desenmascarador, o revelador) pudiendo también desarrollarse como una proliferación de la enfermedad en pacientes con cáncer(8). El SIRI también puede presentarse en huéspedes inmunocomprometidos por otras causas que el VIH y se ha descrito también en inmunocompetentes(9-11).
La proporción de pacientes infectados con VIH que desarrollan SIRI no es bien conocida; las estimaciones oscilan entre menos de 10% a más de 50%(12-15).
Varios estudios han reportado un incremento del riesgo de SIRI en pacientes que inician el TAE con una inmunodeficiencia muy avanzada(16-18).
El objetivo de esta presentación es comunicar el primer caso descrito de SIRI en una adolescente infectada con VIH, describir su presentación clínica, el tratamiento realizado y revisar la bibliografía existente.
Caso clínico
Adolescente de 13 años, oriental, sin antecedentes a destacar, que en junio de 2009 consultó por adenomegalias generalizadas mayores de 1 cm de diámetro, realizándose un hemograma que evidenció leucopenia con linfopenia y un mielograma normal. En esta oportunidad no se investigó VIH y no hubo un diagnóstico definitivo.
En enero de 2011 fue hospitalizada por un síndrome febril de un mes de evolución, lesiones cutáneas no bien catalogadas, celulitis en tercio inferior de pierna izquierda y repercusión nutricional severa, índice de masa corporal de 14.1 (Z <-2).
Se realizó en ese momento diagnóstico de infección por VIH (ELISA y Western Blot positivos). Los exudados de piel cultivaron Streptococcus pyogenes y Staphylococcus aureus meticilino-sensible. El informe anatomopatológico de la biopsia de piel fue compatible con proceso inflamatorio crónico. La búsqueda de tuberculosis fue negativa lo mismo que la búsqueda del antígeno criptocócico en sangre.
Los padres y los hermanos de la paciente resultaron VIH negativos. No se encontraron antecedentes de hospitalizaciones ni transfusiones. No se comprobó abuso sexual (familia que resultó continente) y el examen ginecológico fue normal.
Se inició antibioticoterapia para la celulitis y quimioprofilaxis con trimetoprim-sulfametoxazol y claritromicina. Al mes (febrero) se comenzó tratamiento con ARV: AZT, lamivudina (3TC) y lopinavir/ritonavir. A las 24 horas fiebre y exantema morbiliforme pruriginoso en tronco, cara y miembros. Se interpretó como reacción de hipersensibilidad al trimetoprim-sulfametoxazol. Se retiró este medicamento con mejoría progresiva. Es dada de alta a la semana.
Días más tarde reaparece la fiebre junto con lesiones de piel máculo-papulosas. Se diagnosticó hipersensibilidad a alguno de los fármacos utilizados. Se suspenden los ARV prescriptos y la claritromicina y se inidicó clorfeniramina y prednisona. Los síntomas desaparecen a los 3-5 días.
El 10 de marzo se reinstalaron los mismos ARV manteniendo la prednisona. A las seis horas, instaló nuevamente erupción cutánea, edema y fiebre. Se suspenden otra vez los ARV y desaparecen los síntomas.
El 17 de mayo se inició tratamiento con AZT, 3TC y efavirenz.
El test de genotipificación no mostró mutaciones asociadas a resistencia.
El 30 de abril fue hospitalizada por fiebre, diplopia, cefaleas y vómitos. Se diagnosticó meningitis con severa hipertensión endocraneana. El líquido céfalo raquídeo (LCR) presentó un examen de tinta china positiva para Cryptococco y el cultivo desarrolló Cryptococco neoformans.
Se trató con anfotericina B durante los primeros diez días. Posteriormente, al desarrollar elementos biológicos de insuficiencia renal se utilizó anfotericina liposomal.
La resonancia magnética fue normal. El fondo de ojo demostró edema bilateral de papila.
El 13 de mayo se repite el LCR que cultivó Cryptococco; el 1º de junio fue estéril. La evolución del LCR en sus aspectos citoquímicos se observa en la tabla 1.
El 15 de junio intensificó la cefalea, vómitos reiterados que impiden la medicación oral, convulsiones que requieren medicación endovenosa y es trasladada a terapia intensiva. El fondo de ojo mantiene edema de papila bilateral.
Se decidió iniciar hidrocortisona intravenosa con mejoría de los síntomas en cuatro días. Se reinstalaron ARV junto a prednisona 60 mg/día.
Se inició descenso gradual de corticoides a 5 mg/semana. En el proceso de disminución de los corticoides reiteró un nuevo episodio de cefaleas intensas y diplopia; se aumentaron nuevamente los corticoides a 60 mg.
Se mantuvo prednisona hasta la mejoría de los CD4 y CV indetectable, luego de lo cual se inició descenso progresivo.
En enero de 2012, la paciente está clínicamente con síndrome de Cushing (facies de luna llena) y notorio incremento de peso, sin otras alteraciones a destacar.
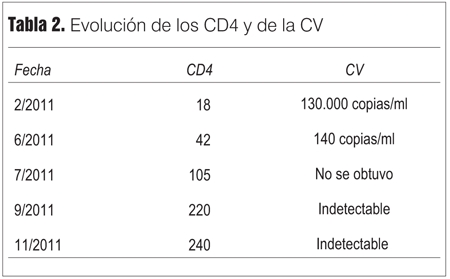
La evolución de los CD4 y de la carga viral (CV) se observa en la tabla 2.
Discusión
El SIRI se relaciona con la infección por VIH y en pacientes que tienen generalmente la inmunidad profundamente alterada. Los órganos afectados por el SIRI son, en general, los mismos que afectó la enfermedad original. La meningitis por Cryiptococco es una de las enfermedades por oportunistas que más se asocian a este síndrome.
Las cifras reportadas de SIRI en los pacientes con VIH son muy variables. Para algunos autores afectaría de 20% a 35% de los pacientes tratados con ARV(19), de los cuales aproximadamente 1% desarrollará SIRI relacionado con el sistema nervioso central (SNC)(20). Se han descrito complicaciones neurológicas por SIRI tan altas como en 28% de pacientes que inician el TAE en países de recursos limitados(21).
La información sobre la incidencia y el espectro de SIRI en niños es limitado y la mayor parte de la información proviene de estudios hechos en Tailandia, donde se reporta una incidencia de 11.5% a 19% en niños que comienzan TAE(22,23).
El SIRI que compromete el SNC representa la forma más severa del síndrome, ya que habitualmente provoca secuelas permanentes o muerte(24). Se menciona que alrededor de 4% de los pacientes con SIRI fallecen, pero la proporción es más alta si el síndrome se asocia con meningitis criptocócica(25).
Dentro de los factores de riesgo para desarrollar el SIRI con repercusión en el SNC se citan(24): a) bajo nivel de CD4 (<50/mm³); b) rápida declinación de la carga viral luego del comienzo de los ARV; c) infección subyacente por oportunistas; d) factores genéticos. Los tres primeros son claros en el caso presentado; el restante es objeto de estudios inmunológicos no realizados en la paciente y que sugieren una predisposición genética(26,27).
El SIRI suele presentarse dentro de los primeros dos meses del inicio de los ARV, tal como sucedió en esta paciente, y otra característica es que el SIRI asociado a infecciones por oportunistas en general se observa luego de la iniciación del tratamiento ARV en pacientes "naive", como lo era la adolescente(28).
Es el primer caso de SIRI en pacientes con VIH y meningitis criptocócica observado en la población asistida. Los autores creen que una de las razones es que el inicio del tratamiento en pacientes infectados por vía vertical en general se hace en las primeras etapas de la enfermedad cuando aún no se ha producido la alteración del sistema inmune. Esta paciente, en la que no se pudo constatar la vía de contagio, fue diagnosticada cuando ya presentaba inmunidad muy alterada.
Las descripciones del SIRI son bajo dos formas:
a) unmasking o SIRI desenmascarador o revelador. Esta forma de presentación en general se da en un paciente inmunosuprimido, portador de una enfermedad por oportunista no diagnosticada y en el que al iniciar el TAE, se activa el sistema inmune y se presenta la enfermedad.
b) SIRI paradójico. Es aquel que se presenta cuando la enfermedad por oportunista ya estaba tratada y dominada y se presentan signos al iniciar el TAE que remedan la enfermedad primitiva.
En general, el SIRI desenmascarador cursa con el oportunista presente y el paradójico habitualmente no permite obtener el germen.
Los autores plantean que en el caso analizado se presentaron las dos formas de SIRI.
En efecto, a los pocos días de iniciar el TAE, se presentó la meningitis criptocócica en la que se cultivó el germen del LCR; fue tratada, se obtuvo una mejora clínica y se logró esterilizar. Previo al alta, con LCR estéril y en fase de prevención con fluconazol, instala nuevamente los signos de hipertensión endocraneana, que mejoraron con la utilización de corticoides endovenosos.
El cuadro se repitió en la evolución y fue rápidamente dominado con el aumento de los corticoides por vía oral. No se encontraron en la bibliografía analizada descripciones con la coincidencia de ambas formas de SIRI en un mismo paciente.
La resonancia nuclear magnética (RNM) fue normal. Se menciona en la bibliografía que los hallazgos pueden ser microabscesos difusos y edema así como anomalías en el medio de contraste en los espacios de Virchow-Robin o en las meninges, o como en el presente caso normal(29).
El tratamiento realizado fue en base a anfotericina común y liposomal. No se pudo asociar flucytosina, que es la asociación ideal, ya que no se cuenta con este fármaco en el país. La asociación anfotericina-fluconazol es discutida en su efectividad(30,31).
Otras formas de SIRI se hallan asociadas con mycobacterias.
En Uruguay, la tuberculosis no constituye un gran problema de salud pública y no se aplica la vacuna BCG a los pacientes infectados con VIH. Puede ser esa una razón por la cual no se han presentado casos de SIRI relacionados con TBC y BCG pese a que se han visto formas graves de la enfermedad(32-34).
En suma, se presenta el caso de una adolescente infectada por el VIH cuya vía de transmisión es desconocida, de diagnóstico tardío con gran repercusión inmunológica y que presentó al iniciar el tratamiento ARV una meningitis criptocócica (SIRI desenmascador) y posteriormente un SIRI paradójico que mejoró con corticoterapia manteniéndose el tratamiento ARV.
Summary
Immune reconstitution inflammatory syndrome (IRIS) is a complication of HIV (Human Immunodeficiency Virus) in patients who previously had a deep alteration in their immune system.
Two forms of clinical presentation are recognized: unmasking and paradoxical IRIS.
We present the case of a 13 year old adolescent who is diagnosed with HIV and whose source of infection transmission could not be established.
At the time of diagnosis, antiretroviral treatment is initiated under severe immunosuppression, and within two months she is admitted to hospital for a cryptococcal meningitis.
Treated with amphotericin, the patient evidences a positive evolution and it was possible to sterilize the spinal fluid. Once again, the patient presents intracranial hypertension with signs of meningeal irritation and seizures. She is transferred to the ICU and treated with high dose corticoids. Upon improvement, the patient is discharged from hospital.
The first episode is interpreted as unmasking IRIS cryptococcal meningitis. That is, viable germs stood out in spite of failure to recognize their presence.
The second episode is interpreted as a paradoxical IRIS. The fact that it previously had sterile spinal fluid and improved with corticoids and without antifungal treatment confirms diagnosis.
Presumed IRIS is diagnosed upon absence of certain diagnostic elements. The clinical data correspond to an immunosuppressed HIV patient, who is treated with high efficacy, what enables diagnosis.
Resumo
A síndrome inflamatória de reconstituição imune (SIRI) é uma complicação do tratamento do vírus da imunodeficiência humana (VIH) em pacientes com graves alterações de seu sistema imunitário.
Pode apresentar-se sob duas formas: como SIRI desmascarada (unmasking syndrom) ou paradoxal.
Apresenta-se o caso de uma adolescente de 13 anos com diagnóstico de infecção por VIH, mas sem definição da origem do contágio.
No momento do diagnóstico, com uma imunossupressão severa, foi iniciado o tratamento com antirretrovirais; dois meses depois a paciente foi hospitalizada com meningite criptocócica.
O tratamento com anfotericina possibilitou uma evolução favorável e a esterilização do líquido cefalorraquidiano.
Observa-se novamente síndrome de hipertensao endocraniana com elementos de irritaçao meníngea e convulsões. A paciente é transferida para uma unidade de terapia intensiva aonde é tratada com altas doses de corticoides, melhora e recebe alta.
O primeiro episódio de meningite criptocócica foi interpretado como uma SIRI desmascarada, pois se observou a manifestação de germens viáveis cuja presença não era conhecida.
O segundo como SIRI paradoxal; o diagnóstico foi confirmado pois previamente o líquido cefalorraquidiano estava estéril e melhorou com corticoides sem antimicóticos.
A SIRI é um diagnóstico presuntivo e não há elementos para um diagnóstico de certeza. Este é obtido pela análise dos dados clínicos de um paciente VIH imunosuprimido que recebe tratamento de alta eficácia.
Bibliografía
1. Sterne J, Hernan M, Ledergerber B, Tilling K, Weber R, Pedran M. Long-term effectiveness of potent antiretroviral therapy in preventing AIDS and death: a prospective cohort study. Lancet 2005; 366(9483):378-84.
2. Autran B, Carcelain G, Li T, Blanc C, Mathez B, Tubiana R. Positive effects of combined antiretroviral therapy on CD4+T cell homeostasis and function in advanced HIV disease. Science 1997; 277(5322):112-6.
3. Battegay M, Nüesch R, Hirschel B, Kaufmann G. Immunological recovery and antiretroviral therapy in HIV-1 infection. Lancet Infect Dis 2006; 6(5):280-7.
4. Singh N, Perfect J. Immune reconstitution syndrome associated with opportunistic mycoses. Lancet Infect Dis 2007; 7(6):395-401.
5. Shelburne SA 3rd, Hamill RJ, Rodriguez-Barradas MC, Greenberg SB, Atmar RL, Musher DW, et al. Immune reconstitution inflammatory syndrome: emergence of a unique syndrome during highly active antiretroviral therapy. Medicine (Baltimore) 2002; 81(3):213-27.
6. French M, Price P, Stone S. Immune restoration disease after antiretroviral therapy. AIDS 2004; 18(12):1615-27.
7. French MA, Mallal SA, Dawkins RL. Zidovudine-induced restoration of cell-mediated immunity to mycobacteria in immunodeficient HIV infected patients. AIDS 1992; 6(11):1293-7.
8. French M. HIV/AIDS: immune reconstitution inflammatory syndrome: a repraisal Clin Infect Dis 2009; 48(1):101-7.
9. Singh N, Lortholary O, Alexander BD, Gupta KL, John GT, Pursell K, et al. An immune reconstitution syndrome-like illness associated with Cryptococcus neoformans infection infection in organ transplant recipients. Clin Infect Dis 2005; 40(12):1756-61.
10. Cheng VC, Yuen KY, Wong SS, Woo PC, Ho PL, Lee R, et al. Immunorestitution diseases in patients no infected with HIV. Eur J Clin Microbiol Infect Dis 2001; 20(6):402-6.
11. Einsiedel L, Gordon DL, Dyer JR. Paradoxical inflammatory reaction during treatment of Cryptococcus neoformans var.gatii meningitis in an HIV- seronegative woman. Clin Infect Dis 2004; 39(8):e78-82.
12. Bower M, Nelson M, Young AM, Thirlwell C, Newsom-Davis T, Mandalia S, et al. Immune reconstitution syndrome associated with Kaposi`s sarcoma. J Clin Oncol 2005; 23(22):5224-8.
13. Kumarasamy N, Chaguturu S, Mayer KH, Solomon S, Yepthomi HT, Balakrishnan P, et al. Incidence of immune reconstitution syndrome in HIV/tuberculosis-coinfected patients after initiation of generic antiretroviral therapy in India. J Acquir Immune Defic Syndr 2004; 37(5):1574-6.
14. Narita M, Ashkin D, Hollender ES, Pitchenik AE. Paradoxical worsening of tuberculosis following therapy in patients with AIDS. Am J Respir Crit Care Med 1998; 158(1):157-61.
15. John L, Baalwa J, Kalimugogo P, Nabankema E, Castelnuovo B, Muhindo G, et al. Response to "Does immune reconstitution promote active tuberculosis in patients receiving highly active antiretroviral therapy?". AIDS 2005; 19(17):2049-50.
16. French MA, Lenzo N, John M, Mallal SA, McKinnon EJ, James IR, et al. Immune restoration disease after the treatment of immunodeficient HIV- infected patients with highly active antiretroviral therapy. HIV Med 2000; 1(2):107-15.
17. Jevtoviæ DJ, Salemoviæ D, Ranin J, Pesiæ I, Zerjav S, Djurkoviæ-Djakoviæ O. The prevalence and risk of immune restoration disease in HIV-infected patients treated with highly active antiretroviral therapy. HIV Med 2005; 6(2):140-5.
18. Bourgarit A, Carcelain G, Martinez V, Lascoux C, Delcey V, Gicquel B, et al. Explosion of tuberculin-specific Th1-responses induces immune restoration syndrome in tuberculosis and HIV co-infected patients. AIDS 2006; 20(2):F1-7.
19. Shelburne SA 3rd, Darcourt J, White AC Jr, Greenberg SB, Hamill RJ, Atmar RL, et al. The role of immune reconstitution inflammatory syndrome in AIDS-related Cryptococcus Neoformans disease in the era of highly active antiretroviral therapy. Clin Infect Dis 2005; 40(7):1049-52.
20. McCombe JA, Auer RN, Maingat FG, Houston S, Gill MJ, Power C. Neurologic immune reconstitution inflammatory syndrome in HIV/AIDS: outcome and epidemiology. Neurology 2009; 72(9):835-41.
21. Asselman V, Thienemann F, Pepper DJ, Boulle A, Wilkinson RJ, Meintjes G, et al. Central nervous system disorders after starting antiretroviral therapy in South Africa. AIDS 2010; 24(18):2871-6.
22. Puthanakit T, Oberdorfer P, Akarathum N, Wannarit P, Sirisanthana T, Sirisanthana V. Immune reconstitution syndrome after highly active antiretroviral therapy in HIV-infected thai children. Pediatr Infect Dis J 2006; 25(1):53-8.
23. Tangsinmankong N, Kamchaisatian W, Lujan-Zilbermann J, Brown CL, Sleasman JW, Emmanuel PJ. Varicella zoster as a manifestation of immune restoration disease in HIV-infected children. J Allergy Clin Immunol 2004; 113(4):742-6.
24. Johnson T, Nath A. Immune reconstitution inflammatory syndrome and the central nervous system. Curr Opin Neurol 2011; 24(3):284-90.
25. Müller M, Wandel S, Colebunders R, Attia S, Furrer H, Egger M, et al. Immune reconstitution inflamatory syndrom in patients starting antiretroviral therapy for HIV infection: a systematic review and meta-analysis. Lancet Infect Dis 2010; 10(4):251-61.
26. Price P, Morahan G, Huang D, Stone E, Cheong KY, Castley A, et al. Polymorphisms in cytokine genes define subpopulations of HIV-1 patients who experienced immune restoration diseases. AIDS 2002; 16(15):2043-7.
27. Price P, Keane NM, Stone SF, Cheong KY, French MA. MHC haplotyoes affect the expression of opportunistic infections in HIV patients. Hum Immunol 2001; 62(2):157-64.
28. Singh N, Perfect JR. Immune reconstitution syndrome associated with opportunistic mycoses. Lancet Infect Dis 2007; 7(6):395-401.
29. Lortholary O, Fontanet A, Mémain N, Martin A, Sitbon K, Dromer F, et al. Incidence and risk factors of immune reconstitution inflamatory syndrome complicating HIV-associated cryptococcosis in France. AIDS 2005; 19(10):1043-9.
30. Mofenson LM, Brady MT, Danner SP, Dominguez KL, Hazra R, Handelsman E, et al. Guidelines for the Prevention and Treatment of Opportunistic Infections among HIV-exposed and HIV-infected children: recommendations from CDC, the National Institutes of Health, the HIV Medicine Association of the Infectious Diseases Society of America, the Pediatric Infectious Diseases Society, and the American Academy of Pediatrics. MMWR Recomm Rep 2009; 58(RR-11):1-166.
31. World Health Organization. Rapid advice: diagnosis, prevention and management of cryptococcal disease in HIV-infected adults, adolescents and children. Geneva: WHO, 2011. Disponible en: http://www.who.int/hiv/pub/cryptococcal_disease2011/en/. [Consulta: 13 de dic de 2011]
32. Quian J, Picón T, Galazka J, Gutiérrez S, Cafferata ML, Rodríguez I, et al. Síndrome de Inmunodeficiencia Adquirida en niños. Formas graves de enfermedad por BCG. Rev enfermedades infecc ped 2000; 14(54):62-7.
33. Hesseling AC, Marais BJ, Gie RP, Schaaf HS, Fine PE, Godfrey-Faussett P, et al. The risk of disseminated Bacille Calmette-Guérin (BCG) disease in HIV-infected children. Vaccine 2007; 25(1):14-8.
34. Hesseling AC, Rabie H, Marais BJ, Manders M, Lips M, Schaaf HS, et al. Bacille Calmette-Guérin vaccine-induced disease in HIV-infected an HIV- uninfected children. Clin Infect Dis 2006; 42(4):548-58.














