Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Médica del Uruguay
versión On-line ISSN 1688-0390
Rev. Méd. Urug. vol.28 no.2 Montevideo jul. 2012
Capilaroscopía en el diagnóstico de las enfermedades autoinmunes sistémicas
Verónica Garra *, Natalia Danese †, Martín Rebella ‡, Ernesto Cairoli §
Unidad de Enfermedades Autoinmunes Sistémicas, Clínica Médica "C", Dr. Juan Alonso Bao, Hospital de Clínicas, Facultad de Medicina, Universidad de la República, Uruguay
Resumen
Introducción: la capilaroscopía del pliegue ungueal (CPU) consiste en la observación in vivo de la microcirculación capilar, donde habitualmente pueden describirse tres patrones (tortuoso, esclerodermiforme y normal). Objetivo: describir las alteraciones capilares en pacientes que consultaron en la Unidad de Enfermedades Autoinmunes Sistémicas del Hospital de Clínicas entre agosto de 2009 y octubre de 2010. Pacientes, materiales y métodos: realizamos un estudio descriptivo, retrospectivo, cualitativo de los patrones capilaroscópicos. Resultados: se revisaron historias clínicas y CPU de 110 pacientes (102 mujeres), con una media de edad 46,6 ± 17,5 años siendo el grupo mayoritario representado por 34 (31%) pacientes con esclerosis sistémica. Los patrones en la CPU hallados fueron normales en 38% y patológicos en 62% de los pacientes. El 88% de los pacientes con esclerosis sistémica presentaron una CPU patológica, de estos, 74% correspondió a un patrón esclerodermiforme. En pacientes con enfermedades autoinmunes (exceptuando la esclerosis sistémica) encontramos un patrón patológico en 66% (27% correspondieron a un patrón esclerodermiforme). Conclusiones: la CPU contribuyó en distintos aspectos en el estudio del fenómeno de Raynaud y de enfermedades autoinmunes. La detección de un patrón esclerodermiforme fue altamente sugestiva de la presencia de una enfermedad autoinmune sistémica. La CPU, junto a los hallazgos clínicos y marcadores biológicos adecuados, adquiere valor y especificidad en el diagnóstico, debiendo formar parte de la valoración clínica de pacientes con fenómeno de Raynaud y sospecha clínica o analítica de enfermedades autoinmunes sistémicas.
Palabras clave: ANGIOSCOPÍA MICROSCÓPICA ENFERMEDADES AUTOINMUNES - diagnóstico
Keywords: MICROSCOPIC ANGIOSCOPY AUTOIMMUNE DISEASES - diagnosis
* Asistente, Unidad Docente Asistencial, Clínica Médica "C", Hospital de Clínicas, Facultad de Medicina, Universidad de la República. Uruguay.
† Asistente, Unidad Docente Asistencial, Clínica Médica "C", Hospital de Clínicas, Facultad de Medicina, Universidad de la República. Uruguay.
‡ Asistente, Clínica Médica "C", Hospital de Clínicas, Facultad de Medicina, Universidad de la República. Uruguay.
§ Profesor Agregado, Clínica Médica "C", Hospital de Clínicas, Facultad de Medicina, Universidad de la República. Uruguay.
El Dr. Ernesto Cairoli participó en el marco de trabajo del Programa para la Investigación Biomédica (PROINBIO), Facultad de Medicina, Universidad de la República; Comisión Sectorial de Investigación Científica (CSIC), Universidad de la República; Agencia Nacional de Investigación e Innovación (ANII), Montevideo, Uruguay.
Correspondencia: Dr. Ernesto Cairoli, Unidad de Enfermedades Autoinmunes Sistémicas, Clínica Médica "C", Hospital de Clínicas, Av. Italia s/n, piso 1.
Correo electrónico: ecairoli@hc.edu.uy
Recibido: 23/12/11. Aceptado: 2/3/12
Conflicto de intereses: los autores del presente trabajo declaran que no existe conflicto de intereses.
Introducción
El diagnóstico de las enfermedades autoinmunes sistémicas (EAS) se realiza combinando datos clínicos, paraclínicos, imagenológicos y anatomopatológicos. Sin embargo, en muchas ocasiones, algunos de estos datos no son suficientes y es necesario acceder a otro tipo de parámetros orientadores. En los últimos años, la capilaroscopía del pliegue ungueal (CPU) ha sido utilizada como herramienta diagnóstica complementaria, permitiendo detectar el daño microvascular precoz mediante el análisis de la arquitectura y funcionalidad de la microcirculación. La CPU es una técnica que consiste en la observación in vivo de la microcirculación capilar en el pliegue ungueal proximal de las manos. Dependiendo del tipo de instrumento con que se realice, se podrán obtener datos anatómicos o funcionales. Métodos altamente sofisticados como la videocapilaroscopía (microscopía estereoscópica) permiten caracterizar alteraciones en la arquitectura vascular y al mismo tiempo del flujo en la microcirculación. En la práctica clínica, el dermatoscopio manual (microscopía de epiluminiscencia) es el utilizado con mayor frecuencia. La CPU tiene la ventaja de ser una técnica no invasiva, inocua, de fácil realización y bajo costo, presentando como desventajas la falta de estandarización del método así como la larga curva de aprendizaje(1,2).
Historia
El estudio de la microcirculación comenzó en 1661 con la caracterización realizada por Malpighi, describiendo Maurice Raynaud, 200 años después, el fenómeno que lleva su nombre(3). En la década de 1970, Hildegard Maricq describe alteraciones capilares en pacientes con enfermedades autoinmunes, encontrando en la esclerosis sistémica un patrón característico. Las contribuciones recientes más significativas fueron realizadas por Ariane Herrick en las alteraciones funcionales y por Maurizio Cutolo en la descripción de las diferentes fases evolutivas del daño microvascular en la esclerosis sistémica(4,5).
Técnica
Para la CPU se recomienda que el paciente permanezca en reposo 15 minutos, en un ambiente tranquilo y a una temperatura entre 20 ºC y 23 ºC. El estudio puede realizarse en la conjuntiva ocular, semimucosa labial, zona periareolar mamaria o en los pliegues ungueales proximales de los pies y manos. El sitio de realización más práctico es en pliegues ungueales proximales de los dedos de las manos, que deben estar limpios, sin perionixis y sin esmalte de uñas. Estas zonas se caracterizan por presentar una disposición capilar paralela a la superficie cutánea permitiendo la visualización completa del asa capilar (figura 1)(6). Se examinan del segundo al quinto dedo de cada mano, siendo los pliegues del cuarto y quinto dedo los que permiten la mejor visualización (dada la mayor transparencia de la piel).
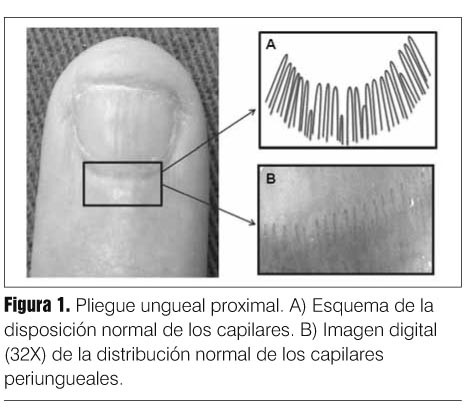
Alteraciones detectadas en la capilaroscopía
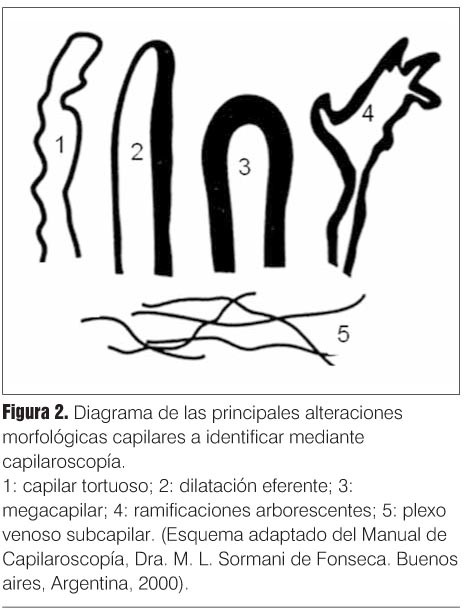
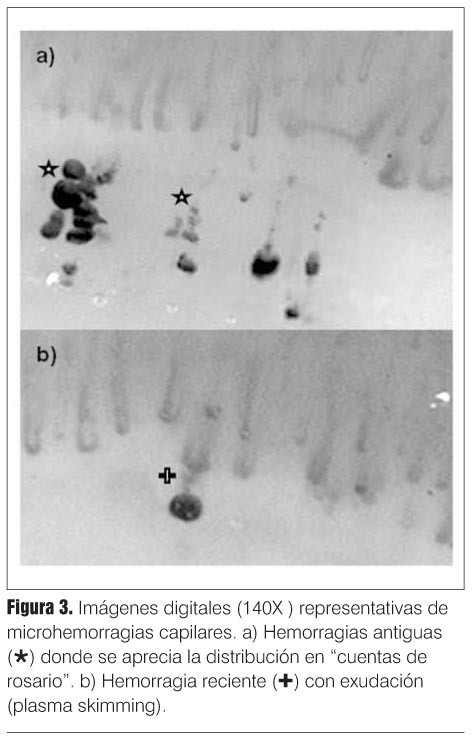
Su análisis dependerá del instrumento utilizado y de las limitaciones que este ofrezca, obteniendo amplificaciones desde 10x a más de 200x con el dermatoscopio manual o videocapilaroscopio, respectivamente. La caracterización de los capilares puede ser funcional (dinámica) o morfológica, ya sea cualitativa o semicuantitativa. La cuantificación se realiza considerando la densidad capilar por milímetro lineal (normal en adultos de 9 a 12 capilares/mm) y el tamaño capilar, determinado por medición transversal, describiendo como normal los menores a 25 micras, dilatados entre 25 y 50 micras y megacapilares a los mayores de 50 micras(7). Las variables cualitativas a determinar, esquematizadas en la figura 2, son las siguientes: 1) densidad capilar, referida como grado 0 (sin áreas avasculares); grado 1 (leve) con una o dos áreas avasculares por campo; grado 2 (moderada) con más de dos áreas avasculares, y grado 3 (severo) con grandes áreas avasculares confluentes(3); 2) dilatación capilar (agrandamiento capilar transversal, comparando con capilares adyacentes normales), descripta como sin dilatación, dilatación moderada (cuatro a diez veces lo normal) y dilatación extrema o megacapilar (mayor a 10 veces)(3); 3) deformidades capilares: describiendo la tortuosidad, que puede ser simple, en ocho, tirabuzón, espiral (o sacacorchos) y en ovillo; 4) ramificaciones, las cuales pueden ser simples, en trébol o en almena; 5) la visibilidad del plexo venoso subpapilar depende de la edad y transparencia epidérmica (mayor en el quinto dedo) estando presente en 60% de la población normal(8); 6) tejidos pericapilares, donde es importante describir la presencia de microhemorragias, dispuestas en forma de "cuentas de rosario",
pudiendo ser clasificadas en diferentes grados (figura 3)(3). También puede valorarse la presencia de exudados pericapilares (plasma skimming) y edema pericapilar dando un aspecto de imagen difuminada (en vidrio esmerilado)(9). Las alteraciones dinámicas se analizan con equipos de alta definición, detectando flujos enlentecidos (sluggish flow), flujo agregado (aggregate flow), escurrimiento de plasma (plasma skimming), estasis y extravasación eritrocitaria por ruptura de pared capilar(10).
Patrones capilaroscópicos
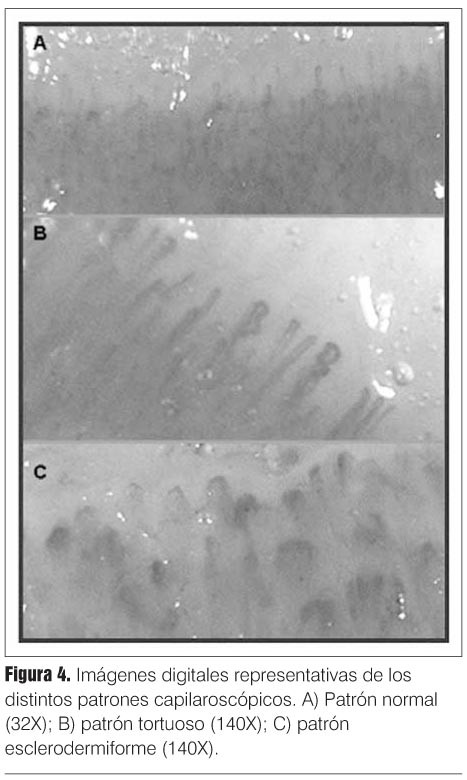
Se describen tres patrones en base a la presencia de las alteraciones arriba mencionadas (figura 4), los cuales siempre deben ser contemplados en el contexto clínico de cada paciente. Patrón normal: hasta 10% de los sujetos normales presentan alguna alteración, de manera que la presencia de alteraciones aisladas no indica enfermedad(6,11). Los capilares se disponen con una densidad normal (en empalizada), paralelos entre sí, finos con forma de horquilla o de "u", con escasos entrecruzamientos y tortuosidad. Patrón tortuoso: predomina la tortuosidad capilar donde si bien se trata de un patrón inespecífico, ha sido reportado en el lupus eritematoso sistémico como el más característico(1,12). Patrón esclerodermiforme (SD): se caracteriza por la presencia de capilares dilatados, destrucción capilar con formación de espacios avasculares y microhemorragias. Las ramificaciones y la pérdida de la polaridad capilar aparecen en etapas evolucionadas de la enfermedad. Este patrón es el mejor caracterizado, descripto inicialmente para la esclerosis sistémica (ES), observado también en la dermatomiositis y en la enfermedad mixta del tejido conectivo. En la ES se describen tres fases evolutivas dentro del patrón SD, a saber, las fases temprana, activa y tardía (figura 5)(4).
La capilaroscopía y el diagnóstico
Al momento de establecer qué tipo de patrón presenta el paciente, es pertinente considerar que los cambios en capilares aislados o en un solo pliegue ungueal son de poco valor, debiendo tomarse en cuenta las alteraciones de forma global en el contexto clínico del paciente. En algunas ocasiones, los hallazgos de la CPU no pueden ser incluidos dentro de los patrones antes mencionados, pudiendo en estos casos referirlo como patrón indeterminado o inespecífico. Existe evidencia donde se demuestra una correlación mayor a 90% entre la valoración a ciegas de la capilaroscopía con el diagnóstico clínico(11,13). Sin embargo, y de conceptual importancia, debemos remarcar que la CPU debe ser considerada como una herramienta complementaria en el diagnóstico y no como una técnica diagnóstica per se.
Aplicabilidad clínica
Las alteraciones en la CPU se han descripto en diferentes patologías, siendo mejor caracterizadas en las enfermedades autoinmunes sistémicas (EAS), particularmente en las colagenopatías.
Fenómeno de Raynaud
La CPU integra el algoritmo diagnóstico del fenómeno de Raynaud. Una CPU normal es altamente sugestiva de la presencia de un Raynaud primario. En 2008, se propuso la aplicación de un índice pronóstico (PRINCE - Prognostic Index Nailfold Capillaroscopic Examination), que estima el riesgo a cinco años de desarrollar una ES en pacientes con fenómeno de Raynaud, encontrando que los hallazgos que tienen mayor valor predictivo positivo son la pérdida de capilares, la presencia de microhemorragias y de megacapilares(2).
Esclerosis sistémica
En la ES más de 80% de los pacientes presentan un patrón SD. Las alteraciones en la CPU son dinámicas y acompañan los estadios evolutivos de la enfermedad. Inicialmente se describe una microangiopatía dada por dilatación capilar con formación de megacapilares, evolucionando hacia el daño microvascular con microhemorragias "en rosario" y pérdida de capilares, progresando hacia una fase final de fibrosis con extensa pérdida de vasos (espacios avasculares) intercaladas con áreas de regeneración (neoangiogénesis) que llevan a la desestructuración del lecho capilar figura 5(14). En los hallazgos característicos del patrón SD en la ES, pueden identificarse distintas fases evolutivas: 1) fase temprana, donde predominan megacapilares con escasas hemorragias y densidad capilar conservada; 2) fase activa, donde ha comenzado la destrucción capilar, llevando a grandes áreas hemorrágicas, desorganización leve y espacios avasculares, y 3) fase tardía, caracterizada por la presencia de escasos megacapilares, grandes áreas avasculares y ramificaciones capilares (bushy o en candelabro), reflejando el intento de neovascularización. Estas tres fases se vinculan al tiempo de evolución de la enfermedad, la forma de progresión y al perfil de anticuerpos(4). Recientemente ha sido demostrado que la sensibilidad de los criterios diagnósticos del Colegio Americano de Reumatología para ES se incrementa desde 67% a 99% cuando se adicionan las anormalidades encontradas en la CPU(15). El patrón SD no es patognomónico de la ES, ya que puede ser encontrado en otras patologías autoinmunes como la dermatomiositis y la enfermedad mixta del tejido conectivo además de otras enfermedades de patogenia no inmunitaria(1).
Dermatomiositis
El 70% de los pacientes con dermatomiositis presentan alteraciones en la CPU. Las alteraciones halladas son similares a las de la ES, siendo característica la coexistencia de megacapilares con vasos de neoformación y múltiples microhemorragias (estas últimas asociadas a la actividad de la enfermedad)(11).
Lupus eritematoso sistémico
En 25% a 30% de los pacientes con lupus eritematoso sistémico (LES) se describe un patrón normal. Las alteraciones capilaroscópicas son más frecuentes en pacientes con LES que asocian fenómeno de Raynaud, anticuerpos anti U1-RNP o anticuerpos anticardiolipinas(16). La alteración característica (pero infrecuente) es la presencia de un patrón tortuoso (capilares en sacacorcho o tirabuzón), si bien se han descripto alteraciones tales como dilataciones capilares discretas y plexo venoso subpapilar prominente(12).
Enfermedad mixta del tejido conectivo
Aproximadamente, 50% de los pacientes presentan anomalías capilares conformando un patrón SD y entre 15% a 20% un patrón tortuoso. La presencia de patrón SD se ha correlacionado con mayor agresividad de la enfermedad(11).
Síndrome antifosfolipídico
El hallazgo más característico es la trombosis intravascular, pudiendo coexistir con microhemorragias simétricas.
Las alteraciones descriptas en otras EAS son variables e inconstantes, pudiendo tener menor aplicabilidad clínica ya que estarían condicionadas por la presencia y duración del fenómeno de Raynaud. En el siguiente trabajo planteamos como objetivo describir las alteraciones capilaroscópicas en pacientes asistidos en la Unidad de Enfermedades Autoinmunes Sistémicas, Clínica Médica "C", Hospital de Clínicas, Facultad de Medicina, Universidad de la República, Uruguay.
Pacientes, materiales y métodos
Realizamos un estudio observacional, descriptivo y retrospectivo de las alteraciones cualitativas a nivel capilar encontradas en la CPU de pacientes que consultaron en el período comprendido entre agosto de 2009 y octubre de 2010.
Pacientes
Fueron analizadas las historias clínicas y las respectivas CPU de pacientes con diagnóstico definitivo o presuntivo de EAS. Criterios de inclusión: fueron incluidos pacientes que cumplieran criterios diagnósticos validados por grupos de trabajo internacionales. Las EAS incluidas fueron LES, ES, dermatomiositis, enfermedad mixta del tejido conectivo, síndromes de superposición y vasculitis sistémicas primarias. Los casos de LES incluidos fueron aquellos con historia de fenómeno de Raynaud. También fueron incluidos pacientes que sin cumplir criterios diagnósticos de manera definitiva presentaran cuadros clínicos con elevada sospecha de enfermedad autoinmune, fenómeno de Raynaud, acrocianosis, morfea, cirrosis biliar primaria o presencia de estudios inmunológicos indicadores de autoinmunidad.
Técnica
Previamente a la realización de la CPU, los pacientes permanecieron en reposo (sentados durante 15 minutos), a temperatura ambiente (entre 20 ºC - 23 ºC), colocando el antebrazo y la mano sobre la mesa a la altura del tórax. Se examinaron cuatro dedos de cada mano, excluyendo el pulgar, aplicando vaselina sólida sobre cada pliegue ungueal para mejorar la transparencia epidérmica. Se adquirieron tres imágenes digitales por cada dedo, contando con dos magnificaciones distintas (32x y 140x), siendo posteriormente analizadas por el mismo observador. Las CPU fueron realizadas utilizando el equipo Hense Microscope: HVS-CM500 PC (USBType) (http://www.hanseelec.com), procesando y analizando las imágenes con el software Picasa 3 (http://picasa.google.com).
Definiciones operativas
Para la clasificación de los patrones en la CPU se utilizaron variables cualitativas antes mencionadas, estableciendo cuatro patrones.
1) Patrón normal caracterizado por la ausencia de anomalías en la densidad, distribución y morfología de los capilares.
2) Patrón tortuoso, caracterizado por el predominio de capilares tortuosos, hallados en al menos seis de los ocho pliegues ungueales examinados.
3) Patrón esclerodermiforme (SD) caracterizado por la presencia de: a) capilares dilatados (al menos dos por pliegue en al menos cuatro pliegues; b) microhemorragias (más de dos por pliegue); c) espacios avasculares (en al menos dos papilas dérmicas consecutivas y en al menos dos pliegues); d) capilares ramificados.
4) Patrón indeterminado, considerando como tal el conjunto de alteraciones observadas en la CPU, donde los hallazgos son patológicos pero no cumplen criterios para ser incluidos en ninguno de los patrones antes referidos. Cuando se hace mención a la presencia de un patrón patológico estamos haciendo referencia a todos aquellos que no son clasificables dentro del patrón normal.
Análisis estadístico
Los resultados se expresaron en número absoluto, porcentajes, medias y sus respectivos desvíos estándar.
Resultados
Características clínicas de la muestra. Fueron analizados 110 pacientes, 102 mujeres y 8 hombres, con una media de edad 46,6 ± 17,5 años. El grupo mayoritario quedó representado por 34 (31%) pacientes con ES, seguido de 21 (19%) pacientes con LES, 11 (10%) pacientes con fenómeno de Raynaud sin evidencia clínica de EAS, 10 (9%) pacientes con vasculitis sistémica (granulomatosis con poliangeitis, uno; Churg-Strauss, dos; crioglobulinemia mixta, dos; tromboangeitis obliterante, uno; enfermedad de Behçet, cuatro); seis (5,5%) pacientes con dermatomiositis; cuatro (3,5%) pacientes con síndrome de superposición, y tres (2,5%) pacientes con enfermedad mixta del tejido conectivo. Por otra parte describimos un grupo misceláneo, donde quedaron incluidos siete (6,5%) pacientes con cirrosis biliar primaria y otros 14 (13%) pacientes, incluyendo tres con morfea generalizada, dos con acrocianosis y un paciente con cada una de las siguientes alteraciones clínicas y/o analíticas: anticuerpos antinucleares positivos, anticuerpos anticardiolipina positivos, factor reumatoide positivo, livedo reticularis, artralgias, úlceras orales, hepatitis autoinmune, fiebre prolongada de origen desconocido y escleritis, respectivamente.
En el total de la muestra estudiada observamos en la capilaroscopía que 62% de los pacientes presentaron patrón patológico, siendo normal en el 38% restante.
Alteraciones capilaroscópicas en las enfermedades autoinmunes
Los pacientes fueron analizados en cuatro grupos, grupo A: 34 pacientes con diagnóstico de ES limitada y difusa; grupo B: 44 pacientes con EAS excluyendo la ES; grupo C: 11 pacientes con fenómeno de Raynaud sin evidencia clínica de EAS, y grupo D: 21 pacientes con otras patologías inmunomediadas (tabla 1).
En el grupo A encontramos que 88% de los pacientes presentaron un patrón patológico en la CPU, siendo el patrón SD el más frecuente (73,5%, total 25 pacientes). Al subclasificarlos en las fases evolutivas capilaroscópicas, encontramos que 56% (total 14) se encontraban en fase tardía y 44% (total 11) en fase precoz. El 16% (total 4) de los pacientes mostraron evidencias de enfermedad activa (microhemorragias). De esta forma, podemos estimar que nueve de cada diez pacientes con ES presentaron daño microvascular, siendo el patrón capilarosocópico SD tardío el más frecuente.
En el grupo B encontramos un patrón patológico en 66% de los casos. De estos, 25% presentó un patrón SD a expensas de los casos de dermatomiositis (los cinco pacientes con DM), enfermedad mixta del tejido conectivo (dos de tres pacientes) y síndrome de superposición con esclerodermia. En el caso de los pacientes con LES (total 21), 52,4% presentó un patrón capilaroscópico patológico (cinco pacientes, patrón tortuoso; cinco pacientes, patrón indeterminado, y un paciente, patrón SD) mientras que el 47,6% restante mostró un patrón normal. En el caso de las vasculitis sistémicas (total 10), encontramos que en la mitad de las CPU el patrón fue patológico (a expensas del indeterminado), siendo las restantes capilaroscopías normales. Podemos decir que se detectaron alteraciones en la CPU en dos de cada tres pacientes con EAS, excluyendo a los pacientes con ES.
Si consideramos como variable la presencia del patrón SD, encontramos que todos los pacientes (total 36) que presentaron dicho patrón se encontraban dentro del grupo A o B (25, esclerodermia; cinco, dermatomiositis; dos, enfermedad mixta; tres, síndromes de superposición, y un paciente con LES). En base a estos hallazgos podemos decir que siempre que se detectó el patrón SD, el paciente presentaba una enfermedad autoinmune claramente definida, ya sea esclerodermia u otra entidad que cumplía criterios clínico-inmunológicos definitivos internacionalmente consensuados.
En el grupo C, de los 11 pacientes con fenómeno de Raynaud, 36% (cuatro pacientes) presentaron un patrón patológico, tres indeterminado y uno de tipo tortuoso. En este último caso, a la paciente le fue diagnosticada una artritis reumatoide en la evolución inmediata. Los tres pacientes con patrón indeterminado se encuentran aún en seguimiento (semestral) clínico y capilaroscópico. El 64% restante (siete pacientes) mostró una capilaroscopía normal.
En el grupo D, debido a su heterogeneidad, destacamos los hallazgos más relevantes de las patologías más representadas. En el grupo de pacientes con cirrosis biliar primaria (total nueve), en cinco el patrón fue normal y en cuatro patológico. En dos de las pacientes existía una concomitancia con una EAS, una configurando un síndrome de Reynolds por superposición con esclerodermia (patrón SD) y otra con un síndrome de superposición con LES (patrón indeterminado), siendo estas pacientes incluidas en los grupos A y B, respectivamente. De las siete pacientes restantes con cirrosis biliar primaria como única enfermedad autoinmune, cinco presentaron un patrón normal y dos un patrón indeterminado. En el caso de las tres pacientes con esclerodermia localizada (morfea en placas generalizada), en ningún caso se hallaron alteraciones esclerodermiformes en la CPU, mostrando dos pacientes un patrón normal y una paciente un patrón indeterminado.
De forma complementaria, presentamos los datos describiendo el tipo de patrón encontrado en cada una de las patologías estudiadas (figura 6).
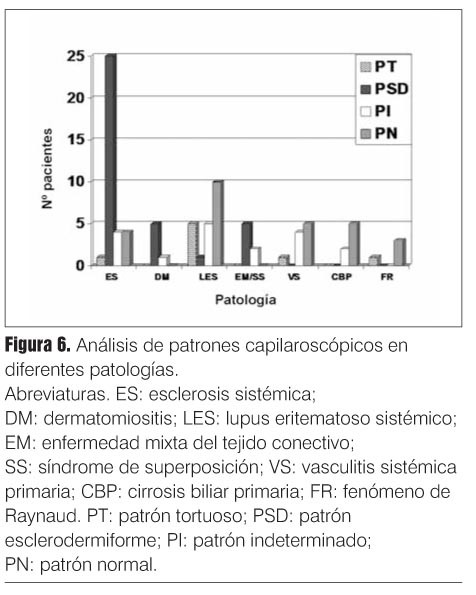
Discusión
La CPU es una técnica no invasiva, de fácil realización y bajo costo que permite observar la microcirculación in vivo. Tiene como desventaja la falta de estandarización del método y la larga curva de aprendizaje que conlleva(1,2).
Capilaroscopía en el estudio del fenómeno de Raynaud
En el estudio del fenómeno de Raynaud su utilidad está bien establecida. Ofrece orientación en la dirección del algoritmo diagnóstico, contribuyendo en la diferenciación entre una etiología primaria de una secundaria, como, por ejemplo, por asociación a una EAS. Cuando en la CPU el hallazgo es un patrón normal, probablemente se esté frente a un fenómeno de Raynaud de origen primario, si bien la presencia de pruebas inmunológicas negativas (como los anticuerpos antinucleares) aumenta la sensibilidad. Se han descripto casos de Raynaud primarios de larga evolución (más de diez años) en quienes la detección de anomalías morfológicas (principalmente ectasia capilar), sugieren el seguimiento periódico(8). En el presente trabajo, 64% de los pacientes con fenómeno de Raynaud sin sospecha clínica de EAS presentaron una capilaroscopía normal, pudiendo considerar este resultado como un fuerte predictor negativo para el desarrollo de una EAS, tal como lo avalan estudios a largo plazo(17). Más allá del bajo número de pacientes analizados en este grupo, vale destacar que los pacientes incluidos son casos seleccionados, ya que trabajamos en un centro terciario de referencia, por lo que la normalidad en la capilaroscopía en personas con fenómeno de Raynaud primario sea probablemente mayor (cercana a 90%).
Existen hallazgos en la CPU que se asocian a mayor riesgo de fenómeno de Raynaud secundario, como son el número de capilares por milímetro lineal, la presencia de microhemorragias y megacapilares(2). En casos de fenómeno de Raynaud con patrón SD en la capilaroscopía, el riesgo de desarrollar una ES en los años siguientes es elevado. Dos estudios(17,18) mostraron que la incidencia de la progresión desde un fenómeno de Raynaud aislado hacia una EAS fue de 12,6%. Los factores predictores independientes de progresión hacia una ES más fuertes fueron: a) el patrón SD en la CPU; b) los ANA positivos, y c) la presencia de anticuerpos específicos para la ES(17-19). Los pacientes con fenómeno de Raynaud que presentan en su etapa inicial un patrón SD en la capilaroscopía junto con anticuerpos específicos de ES, tienen un riesgo 60 veces mayor de progresar hacia una ES definitiva en los siguientes 20 años, con una sensibilidad y especificidad de 89% y 85%, respectivamente, exhibiendo un valor predictivo positivo de 47% y negativo de 98%(17). Por tanto, la realización de la CPU en el estudio del fenómeno de Raynaud aporta información en tres aspectos: 1) obtener orientación diagnóstica en la definición de Raynaud primario versus secundario; 2) la normalidad de la arquitectura vascular tiene alto valor predictivo negativo para el diagnóstico de EAS, y 3) la detección de un patrón SD incrementa la sospecha de una enfermedad sistémica de base posibilitando (junto a otros marcadores) el diagnóstico de ES temprana(20).
Capilaroscopía en el estudio de la esclerosis sistémica
El grupo mayoritario estudiado en este trabajo fue el de pacientes con ES. En esta entidad es donde la capilaroscopía ofrece los mayores aportes dentro del grupo de las EAS. La existencia del fenómeno de Raynaud puede observarse en 95% de los pacientes y su ausencia debe cuestionar el diagnóstico de dicha enfermedad(21). En la serie analizada encontramos que 88% de los pacientes presentaron alteraciones en la CPU, principalmente a expensas del patrón SD. Si bien el diagnóstico de esclerodermia puede ser claro en casos de enfermedad de larga evolución, en pacientes con enfermedad precoz o temprana los hallazgos de la capilaroscopía contribuyeron con un elemento más que fortaleció el diagnóstico. La CPU posibilitó, además, la categorización en las fases evolutivas capilaroscópicas de la esclerodermia, donde 56% se encontraba en una fase tardía y 44% en una fase temprana. Este dato fue de utilidad, ya que la combinación del cuadro clínico y el hallazgo de una fase temprana en la capilaroscopía condujeron a iniciar tratamiento con metotrexate(22). Al mismo tiempo, la CPU posibilitó en 16% de los casos detectar hallazgos compatibles con actividad de la esclerodermia, lo que combinado a otros indicadores de actividad nos llevó a mantener una vigilancia clínica más estrecha. En el diagnóstico de ES, el rol de la CPU ha sido recientemente propuesto, con especial aplicación al diagnóstico de ES precoz. Se proponen tres pilares en la definición diagnóstica: 1) alteraciones cutáneas dadas por dedos "puffy" o por esclerodactilia; 2) alteraciones vasculares representadas por el fenómeno de Raynaud con patrón SD en la capilaroscopía; 3) presencia de marcadores inmunológicos, como anticuerpos antinucleares, anticentrómero y antitopoisomerasa I(20). Por tanto, la CPU en el paciente con ES posibilita: 1) la caracterización evolutiva, orientando a la presencia de una enfermedad tardía o precoz; 2) la detección de hallazgos sugestivos de actividad de la enfermedad; 3) la definición diagnóstica en los casos de ES precoz.
Presunción diagnóstica basada en el patrón de la capilaroscopía
Como regla general, puede decirse que no se debe establecer el diagnóstico de una entidad nosológica basado únicamente en los hallazgos de la capilaroscopía. No obstante y partiendo de esta base, la detección de un patrón SD en la capilaroscopía es una evidencia muy sugestiva de un fenómeno Raynaud secundario y/o de la existencia de una enfermedad sistémica. Si bien el patrón SD es el mejor caracterizado, su poder discriminatorio para el diagnóstico de una EAS específica, no es categórico. La dermatomiositis y la enfermedad mixta del tejido conectivo comparten con la ES el patrón SD con diferentes matices, siendo útiles en el diagnóstico, seguimiento y control de la respuesta al tratamiento(23,24). En la serie analizada, la existencia de un patrón SD fue exclusivamente detectada en pacientes con EAS tales como ES, dermatomiositis, enfermedad mixta del tejido conectivo y síndrome de superposición con esclerodermia.
El rol de la CPU en otras enfermedades autoinmunes es controvertido y se dispone de menos evidencia, siendo los hallazgos generalmente inespecíficos e inclasificables dentro de los patrones clásicos. En el caso del LES, las alteraciones capilares son más frecuentes en pacientes con fenómeno de Raynaud y anticuerpos anti U1 RNP positivos. El patrón tortuoso, considerado el más específico y frecuente en otras series, fue observado en 24% de los pacientes incluidos en este trabajo(12). Con respecto a las vasculitis sistémicas, los hallazgos descriptos en la literatura son inconstantes e inespecíficos, similares a los encontrados en nuestra serie(25). En el caso de pacientes con diagnóstico de cirrosis biliar primaria, dos presentaban superposición con otra enfermedad autoinmune, en tanto el resto no presentó alteraciones significativas en la arquitectura vascular capilar.
Conclusiones
De los resultados presentados y de la bibliografía analizada podemos afirmar que la CPU contribuye en diversos aspectos en el estudio de las EAS, pudiendo remarcar su valor en la orientación etiológica del fenómeno de Raynaud, en la definición diagnóstica de la ES precoz, en la identificación de las formas evolutivas de la esclerodermia así como en la actividad de dicha enfermedad. Especial énfasis debe ponerse en la identificación de un patrón SD, ya que en el contexto de patologías autoinmunes su detección está relacionada con la presencia de ES, dermatomiositis, enfermedad mixta del tejido conectivo o síndromes de superposición con esclerodermia. La CPU es una técnica complementaria que de forma aislada o por sí sola puede tener bajo impacto en la toma de decisiones en la clínica; sin embargo, la CPU, junto a los hallazgos clínicos y marcadores biológicos adecuados, adquiere valor y especificidad en el diagnóstico y pronóstico, debiendo formar parte de la valoración clínica de pacientes con fenómeno de Raynaud y sospecha clínica o analítica de enfermedades autoinmunes sistémicas.
Summary
Introduction: nailfold capillaroscopy (NC) consists of the in vivo observation of capillary microcirculation, which usually presents three patterns (tortuos, sclerodermiform and normal).
Objective: to describe capillary alterations in patients who consulted at the Systemic Autoimmune Diseases Unit of the Clínicas Hospital, between August 2009 and October 2010.
Patients, material and methods: we conducted a descriptive, retrospective and qualitative study of capillaroscopy patterns.
Results: the medical records and NC of 110 patients were reviewed (102 women), average age was 46.6 ± 17.5 years old, being the largest group represented by 34 (31%) patients with systemic sclerosis. Patterns found in the NC were normal in 38% of cases and pathological in 62% of them. Eighty eight per cent of patients with systemic sclerosis presented a pathological NC, and 74% of the latter corresponded to a sclerodermiform pattern. We found a pathololgical pattern in 66% of patients with autoimmune diseases (except for systemic sclerosis), where 27% corresponded to a sclerodermiform pattern.
Conclusions: NC contributed to the study of the Raynaud phenomenon and autoinmune diseases in different ways. Identifying a sclerodermiform pattern highly suggested the presence of a systemic autoimmune disease. The NC, together with clinical findings and the appropriate biological markers gains value and specificity in the diagnosis, and it thus should be a part of the clinical assessment of patients with the Raynaud's disease and a clinical or analytical suspicion of systemic autoimmune disease.
Resumo
Introdução: a capilaroscopia periungueal (CPU) consiste na observaçao in vivo da rede microvascular da região periungueal, onde habitualmente se podem descrever três padrões: tortuoso, esclerodermiforme e normal.
Objetivo: descrever as alterações capilares em pacientes que consultaram na Unidade de Doenças Auto-imunes Sistêmicas do Hospital de Clínicas entre agosto de 2009 e outubro de 2010.
Pacientes, materiais e métodos: realizamos um estudio descritivo, retrospectivo, qualitativo dos padrões capilaroscópicos.
Resultados: revisamos o prontuário médico e CPU de 110 pacientes (102 mulheres), com idade média de 46.6 ± 17.5 anos; 34 (31%) eram pacientes com esclerose sistêmica. Os padrões encontrados na CPU foram normais em 38% e patológicos em 62% dos pacientes. 88% dos pacientes com esclerose sistêmica apresentaram CPU patológica; destes, 74% correspondeu a um padrão esclerodermiforme. En pacientes com doenças auto-imunes (excluindo a esclerose sistêmica) encontramos um padrão patológico em 66% (27% correspondeu a um padrão esclerodermiforme).
Conclusões: a CPU contribuiu em diferentes aspectos ao estudo do fenômeno de Raynaud e de doenças auto-imunes. A detecção de um padrão esclerodermiforme foi um forte indicio da presença de uma enfermedad auto-imune sistêmica. A CPU, juntamente com outros aspectos clínicos e marcadores biológicos adequados, tem valor e especificidade no diagnóstico, devendo formar parte da avaliação clínica de pacientes com fenômeno de Raynaud e suspeita clínica ou analítica de doenças auto-imunes sistêmicas.
Bibliografía
1. Restrepo JP, Gutiérrez M, De Angelis R, Bertolazzi Ch, Grassi W. Utilidad de la videocapilaroscopía de lecho ungular en el diagnóstico de enfermedades reumáticas. Rev Asoc Colomb Dermatol 2009; 17(3): 154-61.
2. Ingegnoli F, Boracchi P, Gualtierotti R, Lubatti Ch, Meani L, Zahalkova L, et al. Prognostic model based on nailfold capillaroscopy for identifying Raynaud's phenomenon patients at high risk for the development of a scleroderma spectrum disorder: PRINCE (prognostic index for nailfold capillaroscopic examination). Arthritis Rheum 2008; 58(7): 2174-82.
3. Juanola X, Sirvent E, Reina D. Capilaroscopía en las unidades de reumatología: usos y aplicaciones. Rev Esp Reumatol 2004; 31(9): 514-20.
4. Cutolo M, Pizzorni C, Tuccio M, Burroni A, Craviotto C, Basso M, et al. Nailfold videocapillaroscopic patterns and serum autoantibodies in systemic sclerosis. Rheumatology (Oxford) 2004; 43(6): 719-26.
5. Herrick AL, Cutolo M. Clinical implications from capillaroscopic analysis in patients with Raynaud's phenomenon and systemic sclerosis. Arthritis Rheum 2010; 62(9): 2595-604.
6. Andrade LE, Gabriel Júnior A, Assad RL, Ferrari AJ, Atra E. Panoramic nailfold capillaroscopy: a new reading method and normal range. Semin Arthritis Rheum 1990; 20(1): 21-31.
7. Cutolo M. Atlas of capillaroscopy in rheumatic diseases. Milan: Elsevier, 2010. Capítulo 5: 33.
8. Da Silva L, Lima M, Pucinelli E, Atra E, Andrade L. Capilaroscopia panorâmica periungueal e sua aplicação em doenças reumáticas. Rev Ass Med Brasil 1997; 43(1): 69-73.
9. Cutolo M, Pizzorni C, Secchi ME, Sulli A. Capillaroscopy. Best Pract Res Clin Rheumatol 2008; 22 (6): 1093-108.
10. Sormani de Fonseca ML. Manual de Capilaroscopía. Buenos Aires: Mc Dowell, 2000. Capítulo 1: 35.
11. García-Patos Briones V, Fonollosa Plá V. Utilidad de la capilaroscopía del lecho ungueal. Jano 2002; 60(1388): 64-8.
12. Facina Anamaria da Silva, Pucinelli Mario Luiz Cardoso, Vasconcellos Mônica Ribeiro Azevedo, Ferraz Luci Biaggi, Almeida Fernando Augusto de. Achados capilaroscópicos no lúpus eritematoso. An Bras Dermatol 2006; 81(6): 527-32.
13. Kenik JG, Maricq HR, Bole GG. Blind evaluation of the diagnostic specificity of nailfold capillary microscopy in the connective tissue diseases. Arthritis Rheum 1981; 24(7): 885-91.
14. Cutolo M, Sulli A, Secchi ME, Olivieri M, Pizzorni C. The contribution of capillaroscopy to the differential diagnosis of connective autoimmune diseases. Best Pract Res Clin Rheumatol 2007; 21(6): 1093-108.
15. Hudson M, Taillefer S, Steele R, Dunne J, Johnson SR, Jones N, et al. Improving the sensitivity of the American College of Rheumatology classification criteria for systemic sclerosis. Clin Exp Rheumatol 2007; 25(5): 754-7.
16. Furtado RN, Pucinelli ML, Cristo VV, Andrade LE, Sato EI. Scleroderma-like nailfold capillaroscopic abnormalities are associated with anti-U1-RNP antibodies and Raynaud's phenomenon in SLE patients. Lupus 2002; 11(1): 35-41.
17. Koenig M, Joyal F, Fritzler MJ, Roussin A, Abrahamowicz M, Boire G, et al. Autoantibodies and microvascular damage are independent predictive factors for the progression of Raynaud's phenomenon to systemic sclerosis: a twenty-year prospective study of 586 patients, with validation of proposed criteria for early systemic sclerosis. Arthritis Rheum 2008; 58(12): 3902-12.
18. Spencer-Green G. Outcomes in primary Raynaud phenomenon: a meta-analysis of the frequency, rates, and predictors of transition to secondary diseases. Arch Intern Med 1998; 158(6): 595-600.
19. LeRoy EC, Medsger TA Jr. Criteria for the classification of early systemic sclerosis. J Rheumatol 2001; 28(7): 1573-6.
20. Avouac J, Fransen J, Walker UA, Riccieri V, Smith V, Muller C, et al. Preliminary criteria for the very early diagnosis of systemic sclerosis: results of a Delphi Consensus Study from EULAR Scleroderma Trials and Research Group. Ann Rheum Dis 2011; 70(3): 476-81.
21. Silvariño R, Rebella M, Alonso J, Cairoli E. Manifestaciones clínicas en pacientes con esclerosis sistémica. Rev Med Urug 2009; 25(2): 84-91.
22. Kowal-Bielecka O, Landewé R, Avouac J, Chwiesko S, Miniati I, Czirjak L, Clements P, et al. EULAR recommendations for the treatment of systemic sclerosis: a report from the EULAR Scleroderma Trials and Research group (EUSTAR). Ann Rheum Dis 2009; 68(5): 620-8.
23. Silver RM, Maricq HR. Childhood dermatomyositis: serial microvascular studies. Pediatrics1989; 83(2): 278-83.
24. Nussbaum AI, Silver RM, Maricq HR. Serial changes in nailfold capillary morphology in childhood dermatomyositis. Arthritis Rheum 1983; 26(9): 1169-72.
25. Sendino Revuelta A, Barbado Hernández FJ, Torrijos Eslava A, González Anglada I, Pena Sánchez de Rivera JM, et al. Capilaroscopía en las vasculitis. An Med Interna 1991; 8(5): 217-20.














