Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Médica del Uruguay
versión On-line ISSN 1688-0390
Rev. Méd. Urug. vol.26 no.4 Montevideo dic. 2010
Banco de tejido ovárico para jóvenes con cáncer de mama: informe preliminar de los primeros casos
Dres. Francisco Cóppola*, Álvaro Domínguez†,Macarena Oliveras‡ , Ps. Teresa Ibarra¶
Clínicas Ginecotocológicas A y C de la Facultad de Medicina, Universidad de la República. Programa Preservación de la Función Ovárica ante el Cáncer, Centro Hemato-Oncológico Pediátrico del Centro Hospitalario Pereira Rossell. Financiado por la Fundación Peluffo Giguens. Montevideo, Uruguay
Resumen
Introducción: el número de pacientes jóvenes con cáncer de mama parece ser mayor en Uruguay que en los promedios internacionales. Muchas de estas jóvenes no tienen hijos y la consejería en reproducción es actualmente recomendada por las sociedades científicas de referencia. En nuestro país funciona desde 2005 un programa de Preservación de la Función Ovárica ante el Cáncer, en el ámbito del Centro Hemato-Oncológico Pediátrico del Centro Hospitalario Pereira Rossell, que realiza consejería y técnicas de criopreservación de tejido ovárico destinadas a pacientes de todos los ámbitos y en forma gratuita.
Objetivos: el objetivo principal de este trabajo es presentar los primeros casos de cáncer de mama en pacientes jóvenes que ingresaron en el protocolo de criopreservación de tejido ovárico.
El objetivo secundario es difundir y lograr incorporar en la práctica clínica la derivación de las pacientes jóvenes sin hijos que reciban este diagnóstico a una consejería en reproducción.
Material y método: en el marco del protocolo previamente aprobado por la Facultad de Medicina se tomaron los primeros cinco casos de pacientes que ingresaron con diagnóstico de cáncer de mama, sin hijos jóvenes y en estadios iniciales. La extracción de tejido ovárico se realizó luego de la cirugía oncológica y antes del tratamiento complementario mediante laparoscopía. El tejido se almacenó en el Instituto Nacional de Donación y Trasplantes de Células, Tejidos y Órganos (INDYT).
Resultados: cinco pacientes de entre 26 y 35 años ingresaron al protocolo en el período mayo de 2006 a enero de 2009. Una de las pacientes falleció, comprobándose que era un estadio superior al planteado inicialmente. Las cuatro pacientes restantes están en tratamiento complementario con buena evolución y en amenorrea. Por lo tanto, no están planteados procedimientos de reimplante al momento.
Discusión y conclusiones: Uruguay cuenta, con carácter gratuito y universal, con una de las opciones disponibles para preservar tejido ovárico indemne. Procedimiento, no obstante, de carácter experimental. Sin embargo, se reciben pocas derivaciones de pacientes con cáncer de mama. La consejería en fertilidad y la derivación correspondiente es un aspecto básico y fundamental.
Palabras clave: CRIOPRESERVACIÓN.
OVARIO.
NEOPLASIAS DE LA MAMA.
Keywords: CRYOPRESERVATION.
OVARY.
BREAST NEOPLASMS.
* Prof. Adjunto de Clínica Ginecotocológica. Facultad de Medicina. Universidad de la República. Uruguay.
† Especialista en Reproducción. Prof. Adjunto de Clínica Ginecotocológica. Facultad de Medicina. Universidad de la República. Uruguay.
‡ Policlínica de Secuelas Reproductivas. Centro Hemato-Oncológico del Centro Hospitalario Pereira Rossell. Ministerio de Salud Pública. Uruguay.
¶ Policlínica de Secuelas Reproductivas. Centro Hemato-Oncológico del Centro Hospitalario Pereira Rossell. Ministerio de Salud Pública. Uruguay.
Correspondencia: Dr. Francisco Coppola
Cuareim 2117 Ap. 712. Montevideo, Uruguay
Correo electrónico: Fracopp60@yahoo.es
Recibido: 3/10/10.
Aceptado: 27/12/10.
Introducción
Con los avances terapéuticos, 85% de las pacientes con estadios tempranos y operables de cáncer de mama están libres de enfermedad a los cinco años (1) . Muchas pacientes, al momento del diagnóstico, son jóvenes y no tienen hijos. La literatura internacional informa que aproximadamente 25% ocurren antes de la menopausia (2), 2% en mujeres muy jóvenes de entre 20 y 34 años (3); en Uruguay se informa de un mayor porcentaje (36%) de pacientes premenopáusicas (4).
Recientemente se ha revisado el concepto de la influencia de un embarazo en sobrevivientes de cáncer de mama, de hecho, en estos casos no está aumentado el riesgo de recurrencia (5,6) y hay quienes hasta plantean que luego de un embarazo se reducen las recurrencias (7) (datos obtenidos de estudios con posibles sesgos y con bajo tamaño de muestra).
Consejería sobre reproducción
En las pacientes jóvenes, especialmente en las que no tienen hijos, debería realizarse rutinariamente una consejería por parte de especialistas en el tema (como se recomienda a nivel internacional por la American Society of Clinical Oncology ( 8)), que incluya información sobre la eventual repercusión de los tratamientos en la función de la reproducción y las posibilidades de preservarla. El cáncer de mama puede tener repercusiones múltiples en la reproducción, no sólo por la quimioterapia, sino por la necesidad de postergar el subsiguiente embarazo por el tratamiento hormonal (9) y la eventual necesidad de ablación de la función ovárica. En nuestro medio este tipo de consejería es excepcional y para realizarla se deben tener los siguientes conceptos presentes.
1) Gonadotoxicidad . En un grupo con perfil favorable de enfermedad, estadio I (tumores de 1 cm o menos, nodo negativo, receptores de progesterona y estrógenos positivo, "epidermal growth factor receptor" tipo 2 negativo), puede no necesitarse tratamiento mediante quimioterapia y, en cambio, solamente radioterapia más tamoxifeno. No obstante, en las pacientes jóvenes que no reúnan ese perfil (tumores mayores de 1 cm, nodo positivo, metástasis o receptores de estrógeno progesterona negativo), se indica radio y quimioterapia basada en agentes alquilantes (10), CMF (ciclofosfamida, metotrexate y 5-fluorouracilo) y FAC (5-fluorouracilo, Adriamycina(r), ciclofosfamida) o sus variantes, y actualmente paclitaxel o docetaxel (11). La afectación ovárica en estos protocolos es muy elevada (alrededor de 80%) (11-13). Los agentes alquilantes son citotóxicos no específicos y dañan los folículos primordiales (14). Tamoxifeno es un modulador negativo del receptor de estrógenos usado para consolidar el tratamiento por cinco años, lo que reduce las recurrencias. No es citotóxico, pero es eventualmente teratogénico. La postergación de la maternidad por cinco años contribuye con la depleción natural del capital folicular por el factor edad, lo que empeora las posibilidades de un embarazo. Por encima de los 25 años, con estos tratamientos, la falla ovárica alcanza a 90%. El uso de recursos para predecir con mayor exactitud la posibilidad de recurrencias o no, puede optimizar el uso de quimioterapia y evitar sobre-tratamientos, lo que evitará una repercusión negativa innecesaria. El Oncotype DX test estudia un perfil de 21 genes para este fin y ya está en uso clínico (15,16).
2) Métodos para preservar la fertilidad ovárica. Los métodos disponibles para preservar la fertilidad están resumidos en la tabla 1.
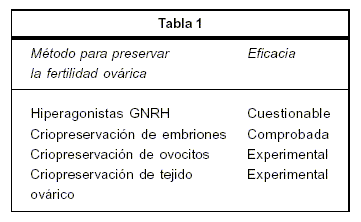
a. Hiperagonistas GNRH. La supresión del estímulo gonadotrófico del ovario es postulado como uno de los mecanismos de protección a los efectos de la quimioterapia, basado en estudios en animales (17,18). Este supuesto efecto protector ha sido muy cuestionado, principalmente porque los folículos primordiales no dependen de gonadotrofinas y no hay receptores de GNRH en el ovario (19,20). Los estudios en humanos son también controvertidos, ya que no son controlados, retrospectivos y con series en las que se mezclan edades, tipos de tumores y diferentes tratamientos (21). El único estudio prospectivo randomizado se realizó en 20 hombres y 8 mujeres y no mostró diferencias, pero el número de casos lo invalida (22). Actualmente está en curso un estudio randomizado y controlado multicéntrico en el Reino Unido: Ovarian Protection Trial in Oestrogen Non-Responsive Premenopausal Breast Cancer Patients Receiving Adjuvant or Neo-Adjuvant Chemotherapy: 'OPTION' Scottish Cancer Network, que dará respuesta definitiva sobre este punto.
b. Criopreservación de embriones. Al momento, la preservación de embriones es la forma más efectiva de preservar la fertilidad en pacientes jóvenes con cáncer. La transferencia de dos o tres embriones criopreservados resulta en una tasa de embarazos de entre 20% y 30% y una tasa de 27% de nacido vivo por embrión transferido (23). Sin embargo, pocas veces practicable, las pacientes, o no tienen pareja, o, si la tienen, no están en condiciones psico-sociales de decidir si almacenar un embrión para el futuro o no. Por otra parte, la necesidad de estímulo ovárico ofrece un problema adicional, que es el de demorar uno o dos ciclos, lo que retarda el tratamiento de la patología de base. En el caso del cáncer de mama, frecuentemente se trata de tumores estrógenos dependientes, lo que haría peligroso el estímulo ovárico por el pico de estradiol que éste provoca (24,25). Se han diseñado protocolos de estímulo alternativos para estos casos en los que es necesario retardar el tratamiento un mes y aplicar el protocolo de estímulo ovárico con lestrozol o tamoxifeno (26), lo que evita el pico de estradiol. El tamoxifeno también es capaz de estimular el ovario con iguales resultados que el citrato de clomifeno, que habitualmente se usa con ese fin (27). El letrozol es un inhibidor de la enzima aromatasa que bloquea la esteroido-génesis folicular (28), pero además aumenta la acción de gonadotrofinas estimulando el ovario (29). El letrozole en combinación con gonadotrofinas produce significativamente más ovocitos que el tamoxifeno solo. En caso de que el cáncer de mama sea receptor de estrógeno negativo, si se va a hacer estímulo ovárico mediante gonadotrofinas, es necesario tomar iguales precauciones (30).
c. Criopreservación de ovocitos. Otras de las opciones es inducir la maduración de los ovocitos mediante estímulo ovárico y criopreservarlos. No obstante, esta tecnología tiene los mismos inconvenientes en lo que se refiere a la demora del inicio de la terapia para la patología de base. Por otra parte, es ineficiente en comparación a la criopreservación de embriones; en la actualidad se ha obtenido un número limitado de nacidos vivos. Los ovocitos maduros, por tener una gran cantidad de agua, son muy sensibles al daño por congelación. Se ha informado que el daño cromosómico por congelación es el responsable de los pobres resultados. La visualización directa mediante el Polscope (31), previo y después de la congelación, confirma daño en la mayoría de los ovocitos (32,33). Si bien los protocolos se perfeccionan, en los mejores centros se puede lograr llegar a una sobrevivencia de 27% de los ovocitos obtenidos (34) y de 2% de nacidos vivos por cada inyección intracitoplasmática (35), menos de 1.000 nacidos han sido reportados por este método (36). Por lo tanto se puede estimar que el número de ovocitos necesarios a preservar (para ofrecer una chance real) es alto, por lo que se necesita más de una estimulación ovárica. Pese a las dificultades es una técnica en progreso que en muchos centros se hace en forma simultánea a otras (por ejemplo, asociada a criopreservación de tejido ovárico), según el caso clínico. La criopreservación de ovocitos es considerada experimental (37,38). La American Society of Reproductive Medicine se ha pronunciado al respecto: ''La preservación de ovocitos al momento actual debe ser considerada una técnica experimental sólo aplicable sobre protocolo de investigación" (39).
d. Criopreservación de tejido ovárico. Los primeros trabajos relacionados con el ovario se recogen en la literatura y fueron realizados en ratas y ratones (40,41). La corteza ovárica alberga una población de folículos primordiales que son poco dañadas por los procedimientos criopreservantes (42). El estudio de la cortical ovárica criopreservada y descongelada utilizando DMSO (dimetil-sulfóxido) mostró la normalidad morfológica de sus folículos (43). Estos folículos criopreservados, y luego descongelados, al ser aislados enzimáticamente muestran al microscopio electrónico integridad estructural y viabilidad al usar técnicas específicas de tinción vital (44). El éxito funcional del modelo de criopreservación ovárica se ha demostrado por la restitución de la función reproductiva que se ha observado en protocolos experimentales de ratón con implantes ortotópicos. La criopreservación y el autoimplante de tejido ovárico humano generan una sustancial reducción en el tamaño de la población folicular recuperada en el descongelamiento(42). La criopreservación de tejido ovárico a veces es la única opción en pacientes sin pareja, en las que no se puede retardar el tratamiento. Un protocolo al respecto se viene llevando a cabo desde el 2005 para pacientes jóvenes con cáncer, que incluye el cáncer de mama. Un informe preliminar fue publicado por nuestro equipo (45), una serie mayor obtuvo el Premio de Honor de la Academia Nacional de Medicina 2009 en Uruguay.
Objetivo
El objetivo principal de este trabajo es presentar los primeros cinco casos de cáncer de mama en pacientes jóvenes que ingresaron en el protocolo de criopreservación de tejido ovárico.
El objetivo secundario es difundir y lograr incorporar en la práctica clínica la derivación de las pacientes jóvenes sin hijos que reciban este diagnóstico, a una consejería en reproducción.
Material y método
Se presentan los primeros cinco casos de pacientes jóvenes con cáncer de mama incluidas en el protocolo de preservación de tejido ovárico para pacientes oncológicas.
a. Aspectos éticos y legales
El protocolo fue sometido a consideración y finalmente aprobado por el Comité de Ética de la Facultad de Medicina de la Universidad de la República (expediente N° 071140-000442-05) y por el Instituto Nacional de Donación y Trasplantes de Células, Tejidos y Órganos (INDYT). De esta forma quedan contemplados los requerimientos éticos, de registros y legales necesarios a nivel nacional. Pero este programa contempla las recomendaciones internacionales previas a su inicio (Royal College of Obstetricians and Gynaecologists (46) 2000, British Fertility Society 2003 (47), The Practice Committee of the American Society for Reproductive Medicine 2004 (48), como los posteriores (FIGO Committee for the Ethical Aspects of Human Reproduction and Women's Health 2006 (49). Estas recomendaciones ponen énfasis en el carácter experimental y en la incertidumbre sobre los resultados.
b. Extracción del material y criopreservación
La extracción se realiza mediante laparoscopía quirúrgica o en algunos casos mediante minilaparotomía suprapúbica, con maniobras, dentro de lo posible, a-traumáticas. Existe discusión sobre aspectos técnicos (extraer un ovario o parte de él). Como veremos más adelante, en nuestra serie comenzamos con la extracción total unilateral como lo recomiendan algunos autores (50,51), y luego cambiamos al criterio de Wallace y otros que recomiendan la extracción parcial favoreciendo la posibilidad de la recuperación espontánea de la fertilidad luego del tratamiento (52,53). La elección del ovario a extraer se realiza en base a la facilidad técnica y comodidad del laparoscopista. En los casos en que se coloca un catéter subcutáneo para inyección de quimioterápicos, se efectúa la resección del ovario en el mismo acto anestésico. Dificultades anestésicas de realizar una laparoscopía las encontramos en algunos casos de grandes masas mediastinales. El ovario es sumergido luego en líquido para transporte de órganos: RPMI 1640 (59), más albúmina humana al 10% a efectos de preservar al máximo las condiciones de nutrición del tejido. Luego es conservado a 0 ºC y transportado al INDYT en un lapso promedio de 15 minutos.
El protocolo de criopreservación ya fue publicado con anterioridad por nuestro grupo(45).
Resultados
La tabla 2 sintetiza los procedimientos de criopreservación realizados hasta el momento en pacientes con cáncer de mama.
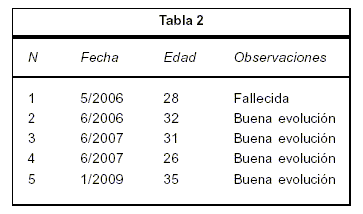
La paciente número 1 presentó un cáncer de mama bilateral que no era el estadio primariamente planteado, con una mala evolución falleció en los meses siguientes. En el total de procedimientos (cinco) constituye un porcentaje de 14% del total de pacientes incluidas en el Programa de Criopreservación de Tejido Ovárico en cinco años (2005-2009). Todas sin hijos.
Oncotype se realizó en dos pacientes (2 y 5) con score 9 y 18, respectivamente. Las pacientes (excepto una) solicitaron por iniciativa propia asesoramiento sobre reproducción. El asesoramiento sugerido por el equipo oncológico para pacientes adultas pero jóvenes en nuestra casuística es casi nulo. Al momento todas continúan con tratamiento, motivo por el cual el tejido permanece criopreservado y no se han realizado procedimientos de reimplantes.
Las pacientes permanecen en amenorrea en parte por supresión de la función ovárica con hiperagonistas GNRH como parte de la consolidación de su tratamiento.
En ninguna de ellas era posible, por diferentes razones, la criopreservación de embriones.
Discusión
El carácter experimental
La preservación de tejido ovárico es aún experimental, algo fundamental a tener en cuenta. Se aplica en un grupo de pacientes en las que por el tratamiento que van a recibir, por la edad y por su situación psicosocial, no tenemos alternativas para ofrecer. Sin alternativas mejores para aplicar, la falla ovárica sucederá casi con certeza. Esta deducción se realiza mediante estimación clínica, ya que no hay exámenes capaces de determinarlo. Por esa razón es de primordial importancia la estimación multidisciplinaria de cada caso clínico. En segundo lugar, no se pueden prometer resultados, sabemos exactamente el porcentaje de éxitos de la criopreservación de embriones, pero en este caso la técnica está en pleno desarrollo, puede asimilarse a la criopreservación de los primeros embriones. Se trata de un procedimiento en vista al futuro y el tiempo es importante para la optimización de esta tecnología.
El problema de la metástasis ovárica
Un problema adicional es la posibilidad latente de reimplantar células tumorales con el tejido ovárico. El riesgo depende de la biología tumoral y el estadio. Debe considerarse especialmente en el cáncer de mama. Si bien el tejido es biopsiado previo a la criopreservación, y se vuelve a estudiar otro fragmento antes del reimplante, siempre existe la posibilidad de que en otro segmento ovárico sí existan células tumorales (54). Este riesgo no debe ser exagerado ni ignorado. Nuevas técnicas están disponibles para evitar este riesgo (55), deben utilizarse técnicas moleculares como "polymerase chain reaction", hibridación in situ, estudios cito- genéticos, etcétera. Se ha discutido el caso especial del cáncer de mama. En primer lugar, en estadios iniciales la metástasis ovárica es un evento muy raro (56). Por otra parte, esta posibilidad se da en los carcinomas lobulillares, que son la minoría (15%), en oposición a los más comunes ductales (57). En la actualidad se considera que en estadios iniciales y carcinomas ductales no está contraindicada la criopreservación del tejido ovárico (58). No hay que olvidar que algunas pacientes con cáncer de mama son BRCA positivo, lo que implica un riesgo muy elevado de cáncer de ovario, en estas pacientes no es recomendable el reimplante de tejido ovárico.
Conclusiones
a. En Uruguay funciona en el ámbito público un programa de criopreservación de tejido ovárico en forma gratuita.
b. Si bien el cáncer de mama no es muy frecuente en pacientes jóvenes, en nuestro país cobra relevancia por sus cifras elevadas.
c. A pesar de que la consejería en reproducción debería formar parte de la práctica clínica, por desconocimiento o conceptos erróneos, raramente se lleva a cabo.
No obstante, es una preocupación real de las pacientes y está demostrado que no contemplar este aspecto conspira con la adherencia global al tratamiento, ya que el fuerte deseo de mantener la fertilidad puede afectar las decisiones (59).
d. En el período 2005-2009, en cinco pacientes se realizaron procedimientos de criopreservación de tejido ovárico. En estas cinco pacientes, por las condiciones clínicas, no era posible realizar otras alternativas.
e. Hoy existen procedimientos más seguros de estímulo ovárico para una criopreservación de embriones, que es la técnica con mayor porcentaje de "exitosos".
f. Para finalizar, dos conceptos de los autores más prestigiosos en el tema.
Jacques Donnez: "Almacenar tejido ovárico en un banco debe ser ofrecido previo a la quimioterapia en todos los casos en los que la fertilización in vitro no sea posible" (60).
Kim SS: "Uno de los problemas éticos más importantes es asegurar que la intervención no provoque daño a la paciente por retrasar peligrosamente el tratamiento del cáncer y que no se restablezca la enfermedad por remanentes de células al ser trasplantadas" (61).
Summary
Introduction: the number of young patients with breast cancer seems to be higher in Uruguay than international averages. Many of these young women have no children and reproductive counseling is currently recommended by the reference scientific societies. In Uruguay, an ovarian function preservation program for cancer patients has been operative since 2005, at the Pereira Rossell Hosital Pediatrics Hemato-Oncologic Center. The program provides for counseling and ovarian tissue cryopreservation techniques for all patients, for free.
Objectives: the main objective of this study is to present the first breast cancer cases in young patients who entered into the ovarian tissue cryopreservation protocol.
The secondary objective is to disseminate the reference of young patients with no children who are diagnosed with breast cancer to reproductive counseling, and to include this into clinical practice.
Method: within the framework of the protocol previously approved by the School of Medicine, the first five cases of patients admitted with a diagnosis of early stage breast cancer who had no children were included in the study. Extraction of ovarian tissue was performed after the oncologic surgery and before the laparoscopic complementary treatment.
Ovarian tissue was stored in the National Institute of Donation and Cell, Tissue and Organ Transplant.
Results: five patients between 26 and 35 years old entered into the protocol from May 2006 through January 2009. One of the patients died and thus, it was proved that the disesae stage was more advanced than initially diagnosed. The four remaining patients are undergoing complementary treatment and evidence a good evolution and amenorrhea. Therefore, no reimplantation procedures have been defined so far.
Discussion and conclusions: Uruguay offers an option to preserve harmless ovarian tissue through a procedure that is free and universal, although this procedure is experimental. However, only a few referrals of patients with breast cancer are received. Fertility counseling and the corresponding referral are basic and fundamental.
Résumé
Introduction: le nombre de jeunes patientes ayant un cancer du sein semble être plus élevé en Uruguay que les moyennes internationales. Plusieurs de ces jeunes n'ont pas d'enfants et l'assistance en reproduction est actuellement recommandée par les sociétés scientifiques de référence.
Dans notre pays, depuis 2005, il existe un programme de Préservation de la Fonction Ovarienne face au cancer dans le cadre du Centre Hémato-Oncologique Pédiatrique de l'Hôpital Pereira Rossell qui fait l'assistance et réalise des techniques de cryo-préservation de tissu ovarien, destinées à des patientes de tous les centres médicaux et ceci de façon gratuite.
Objectifs: l'objectif principal du présent travail, c'est de présenter les premiers cas de cancer du sein chez des jeunes patientes qui sont rentrées au protocole de cryo-préservation de tissu ovarien.
L'objectif secondaire, c'est de diffuser et de réussir à incorporer dans la pratique clinique, la dérivation des jeunes patientes sans enfant qui aient eu ce diagnostic vers une assistance en reproduction.
Matériel et méthode: dans le cadre du protocole préalablement approuvé par la faculté de Médecine, on a pris les premiers cinq cas de patientes qui ont été hospitalisées ayant un diagnostic de cancer du sein, sans jeunes enfants et à un stade initial. L'extraction de tissu ovarien a été réalisée après une chirurgie oncologique et avant le traitement complémentaire, moyennant une opération par laparoscopie. Le tissu a été stocké à l'Institut National des Dons et des Greffes de Cellules, Tissus et Organes (INDYT).
Résultats: cinq patientes, d'entre 26 à 35 ans, sont rentrées au protocole dans la période mai 2006 - janvier 2009. L'une des patientes est décédée: on a pu constater qu'il s'agissait d'un stade supérieur à celui qui avait été considéré au départ. Les autres quatre patientes sont actuellement sous traitement complémentaire, avec une bonne évolution et en aménorrhée. Donc, pour l'instant, il n'y a pas de proposition de procédures de réimplantation.
Discussion et conclusions: l'Uruguay dispose, de façon gratuite et universelle, d'une des options disponibles pour préserver du tissu ovarien indemne. Toutefois, il s'agit d'une procédure à caractère expérimental. Pourtant, peu de patientes souffrant de cancer du sein sont dérivées. L'assistance en fertilité et la dérivation correspondante est un aspect de base et fondamental.
Resumo
Introdução: o número de pacientes jovens com câncer de mama parece ser maior no Uruguai do que as médias internacionais. Muitas dessas jovens não têm filhos e atualmente o aconselhamento em reprodução é recomendado pelas sociedades científicas de referência. Desde 2005 funciona no Uruguai um programa de Preservação da Função Ovárica frente ao Câncer no Centro Hemato-Oncológico Pediátrico do Hospital Pereira Rossell que realiza aconselhamento e técnicas de criopreservação de tecido de ovário, destinadas a pacientes de todos os âmbitos e gratuitamente.
Objetivos: o objetivo principal deste trabalho é apresentar os primeiros casos de câncer de mama em paciente jovens incluídas no protocolo de criopreservação de tecido de ovário. O objetivo secundário é difundir e incorporar à prática clínica a derivação das pacientes jovens, sem filhos, que recebam esse diagnóstico ao aconselhamento em reprodução.
Material e método: de acordo com um protocolo aprovado previamente pela Faculdade de Medicina- UdelaR ingressaram ao programa as cinco primeiras pacientes jovens, sem filhos com diagnóstico de câncer de mama em fase inicial. A extração do tecido ovárico foi realizada por laparoscopia depois da cirurgia oncológica e antes do tratamento complementar. O tecido foi armazenado no Instituto Nacional de Doação e Transplantes de Células, Tecidos e Órgãos (INDYT).
Resultados: cinco pacientes, com idades entre 26 e 35 anos, foram ingressadas ao protocolo no período maio de 2006 - janeiro de 2009. Uma das pacientes faleceu comprovando que o estadio da neoplasia era superior ao inicialmente considerado. As demais pacientes estão recebendo tratamento complementar com boa evolução e amenorréia; por essa razão ainda não foram realizados procedimentos de reimplantaçao.
Discussão e conclusões: está disponível no Uruguai, de forma gratuita e universal, um procedimento experimental para preservar tecido ovárico íntegro. No entanto são poucas as derivações de pacientes com câncer de mama. O aconselhamento em reprodução e a derivação de pacientes são aspectos básicos e fundamentais.
Bibliografía
1. Jemal A, Murray T, Ward E, Samuels A, Tiwari RC, Ghafoor A, et al. Cancer statistics, 2005. CA Cancer J Clin 2005; 55(1): 10-30.
2. Bines J, Oleske DM, Cobleigh MA. Ovarian function in premenopausal women treated with adjuvant chemotherapy for breast cancer. J Clin Oncol 1996; 14(5): 1718-29.
3. National Cancer Institute. SEER Cancer Statistics Review, 1975-2005. Bethesda, MD: National Cancer Institute, 2008. Disponible en: http://seer.cancer.gov/csr/1975_2005/ (Consulta: 15/9/2010).
4. Vázquez T, Krygier G, Barrios E, Cataldi S,Vázquez A, Alonso R, et al. Análisis de sobrevida de una población con cáncer de mama y su relación con factores pronósticos: estudio de 1.311 pacientes seguidas durante 230 meses Rev Med Urug 2005; 21(2): 107-21.
5. Blakely LJ, Buzdar AU, Lozada JA, Shullaih SA, Hoy E, Smith TL, Hortobagyi GN. Effects of pregnancy after treatment for breast carcinoma on survival and risk of recurrence. Cancer 2004; 100(3): 465-9.
6. Ives A, Saunders C, Bulsara M, Semmens J. Pregnancy after breast cancer: population based study. BMJ 2007; 334(7586): 194.
7. Mueller BA, Simon MS, Deapen D, Kamineni A, Malone KE, Daling JR. Childbearing and survival after breast carcinoma in young women. Cancer 2003; 98(6): 1131-40.
8. Lee SJ, Schover LR, Partridge AH, Patrizio P, Wallace WH, Hagerty K, et al. American Society of Clinical Oncology. American Society of Clinical Oncology recommendations on fertility preservation in cancer patients. J Clin Oncol 2006; 24(18): 2917-31.
9. Bao T, Davidson NE. Adjuvant endocrine therapy for premenopausal women with early breast cancer. Breast Cancer Res 2007; 9(6): 115.
10. Razzak AR, Lin NU, Winer EP. Heterogeneity of breast cancer and implications of adjuvant chemotherapy. Breast Cancer 2008; 15(1): 31-4.
11. Rastogi P, Anderson SJ, Bear HD, Geyer CE, Kahlenberg MS, Robidoux A,et al. Preoperative chemotherapy: updates of National Surgical Adjuvant Breast and Bowel Project Protocols B-18 and B-27. J Clin Oncol 2008; 26(5):778-85. Erratum in: J Clin Oncol 2008; 26(16): 2793.
12. Davis VJ. Female gamete preservation. Cancer 2006; 107(7 Suppl): 1690-4.
13. Gadducci A, Cosio S, Genazzani AR. Ovarian function and childbearing issues in breast cancer survivors. Gynecol Endocrinol 2007; 23(11): 625-31.
14. Sonmezer M, Oktay K. Fertility preservation in young women undergoing breast cancer therapy. Oncologist 2006; 11(5): 422-34.
15. Paik S, Shak S, Tang G, Kim C, Baker J, Cronin M, et al. A multigene assay to predict recurrence of tamoxifen-treated, node-negative breast cancer. N Engl J Med 2004; 351(27): 2817-26.
16. Sotiriou C, Pusztai L. Gene-expression signatures in breast cancer. N Engl J Med 2009; 360(8): 790-800.
17. Ataya K, Rao LV, Lawrence E, Kimmel R. Luteinizing hormone-releasing hormone agonist inhibits cyclophosphamide-induced ovarian follicular depletion in rhesus monkeys. Biol Reprod 1995; 52(2): 365-72.
18. Meirow D, Assad G, Dor J, Rabinovici J. The GnRH antagonist cetrorelix reduces cyclophosphamide-induced ovarian follicular destruction in mice. Hum Reprod 2004; 19(6): 1294-9.
19. Gougeon A. Regulation of ovarian follicular development in primates: facts and hypotheses. Endocr Rev 1996; 17(2): 121-55.
20. Huser M, Crha I, Ventruba P, Hudecek R, Zakova J, Smardova L, et al. Prevention of ovarian function damage by a GnRH analogue during chemotherapy in Hodgkin lymphoma patients. Hum Reprod 2008; 23(4): 863-8.
21. Oktay K, Sönmezer M, Oktem O, Fox K, Emons G, Bang H. Absence of conclusive evidence for the safety and efficacy of gonadotropin-releasing hormone analogue treatment in protecting against chemotherapy-induced gonadal injury. Oncologist 2007; 12(9): 1055-66.
22. Waxman JH, Ahmed R, Smith D, Wrigley PF, Gregory W, Shalet S, et al. Failure to preserve fertility in patients with Hodgkin's disease. Cancer Chemother Pharmacol 1987; 19(2): 159-62.
23. Center for Disease Control and Prevention (CDC). 2004 Assisted Reproductive Technology (ART) Report. Disponible en: http://ftp.cdc.gov/pub/publications/art/2004ART508.pdf (Consulta: 15/9/2010)
24. Chen CH, Zhang X, Barnes R, Confino E, Milad M, Puscheck E, et al. Relationship between peak serum estradiol levels and treatment outcome in in vitro fertilization cycles after embryo transfer on day 3 or day 5. Fertil Steril 2003; 80(1): 75-9.
25. Calderon-Margalit R, Friedlander Y, Yanetz R, Kleinhaus K, Perrin MC, Manor O, et al. Cancer risk after exposure to treatments for ovulation induction. Am J Epidemiol 2009; 169(3): 365-75.
26. Oktay K, Buyuk E, Libertella N, Akar M, Rosenwaks Z. Fertility preservation in breast cancer patients: a prospective controlled comparison of ovarian stimulation with tamoxifen and letrozole for embryo cryopreservation. J Clin Oncol 2005; 23(19): 4347-53.
27. Steiner AZ, Terplan M, Paulson RJ. Comparison of tamoxifen and clomiphene citrate for ovulation induction: a meta-analysis. Hum Reprod 2005; 20(6): 1511-5.
28. Pfister CU, Martoni A, Zamagni C, Lelli G, De Braud F, Souppart C,et al. Effect of age and single versus multiple dose pharmacokinetics of letrozole (Femara) in breast cancer patients. Biopharm Drug Dispos 2001; 22(5): 191-7.
29. Casper RF. Aromatase inhibitors in ovarian stimulation. J Steroid Biochem Mol Biol 2007; 106(1-5): 71-5.
30. Gupta PB, Kuperwasser C. Contributions of estrogen to ER-negative breast tumor growth. J Steroid Biochem Mol Biol 2006; 102(1-5): 71-8.
31. Rienzi L, Martinez F, Ubaldi F, Minasi MG, Iacobelli M, Tesarik J, et al. Polscope analysis of meiotic spindle changes in living metaphase II human oocytes during the freezing and thawing procedures. Hum Reprod 2004; 19(3): 655-9.
32. Bianchi V, Coticchio G, Fava L, Flamigni C, Borini A. Meiotic spindle imaging in human oocytes frozen with a slow freezing procedure involving high sucrose concentration. Hum Reprod 2005; 20(4): 1078-83.
33. Gook DA, Osborn SM, Johnston WI. Cryopreservation of mouse and human oocytes using 1,2-propanediol and the configuration of the meiotic spindle. Hum Reprod 1993; 8(7): 1101-9.
34. Fabbri R, Porcu E, Marsella T, Rocchetta G, Venturoli S, Flamigni C. Human oocyte cryopreservation: new perspectives regarding oocyte survival. Hum Reprod 2001; 16(3): 411-6.
35. Oktay K, Cil AP, Bang H. Efficiency of oocyte cryopreservation: a meta-analysis. Fertil Steril 2006; 86(1): 70-80.
36. Practice Committee of the American Society for Reproductive Medicine. Ovarian tissue and oocyte cryopreservation. Fertil Steril 2004; 82(4): 993-8.
37. Stachecki JJ, Cohen J. An overview of oocyte cryopreservation. Reprod Biomed Online 2004; 9(2): 152-63.
38. Practice Committee of the Society for Assisted Reproductive Technology; Practice Committee of the American Society for Reproductive Medicine. Essential elements of informed consent for elective oocyte cryopreservation: a Practice Committee opinion. Fertil Steril 2007; 88(6): 1495-6.
39. Practice Committee of the American Society for Reproductive Medicine; Practice Committee of the Society for Assisted Reproductive Technology. Ovarian tissue and oocyte cryopreservation. Fertil Steril 2006; 86(5 Suppl 1): S142-7.
40. Parkes AS, Smith AU. Regeneration of rat ovarian tissue grafted after exposure to low temperatures. Proc R Soc Lond B Biol Sci 1953; 140(901): 455-70.
41. Deanesly R, Parkes A. Delayed development of grafts from frozen ovarian tissue. J Endocrinol 1956; 14: 35-6.
42. Newton H. The cryopreservation of ovarian tissue as a strategy for preserving the fertility of cancer patients. Hum Reprod Update 1998; 4(3): 237-47.
43. Hovatta O, Silye R, Krausz T, Abir R, Margara R, Trew G, et al. Cryopreservation of human ovarian tissue using dimethylsulphoxide and propanediol-sucrose as cryoprotectants. Hum Reprod 1996; 11(6): 1268-72.
44. Oktay K, Nugent D, Newton H, Salha O, Chatterjee P, Gosden RG. Isolation and characterization of primordial follicles from fresh and cryopreserved human ovarian tissue. Fertil Steril 1997; 67(3): 481-6.
45. Pérez Campos H, Cóppola Gonzálvez F , Martínez Torena J, Afonzo Y, Domínguez A, Aguirre R, et al. Criopreservación de corteza ovárica en pacientes jóvenes con cáncer e indicación de tratamiento gonadotóxico Rev Med Urug 2007; 23(2): 99-108
46. Royal College of Obstetricians and Gynaecologists. Storage of Ovarian and Prepubertal Testicular Tissue. Report of a Working Party. London: RCOG Press, 2000.
47. Multidisciplinary Working Group convened by the British Fertility Society. A strategy for fertility services for survivors of childhood cancer. Hum Fértil (Camb) 2003; 6(2): A1-A39.
48. Practice Committee of the American Society for Reproductive Medicine. Ovarian tissue and oocyte cryopreservation. Fertil Steril 2004; 82(4): 993-8.
49. FIGO Committee for the Ethical Aspects of Human Reproduction and Women's Health. Ethical considerations and recommendations on oocyte and ovarian cryopreservation. FIGO Committee for the Ethical Aspects of Human Reproduction and Women's Health. Int J Gynaecol Obstet 2006; 92(3): 335-6.
50. Poirot C, Vacher-Lavenu MC, Helardot P, Guibert J, Brugières L, Jouannet P. Human ovarian tissue cryopreservation: indications and feasibility. Hum Reprod 2002; 17(6): 1447-52.
51. Schmidt KL, Andersen CY, Loft A, Byskov AG, Ernst E, Andersen AN. Follow-up of ovarian function post-chemotherapy following ovarian cryopreservation and transplantation. Hum Reprod 2005; 20(12): 3539-46.
52. Meirow D, Baum M, Yaron R, Levron J, Hardan I, Schiff E, et al. Ovarian tissue cryopreservation in hematologic malignancy: ten years' experience. Leuk Lymphoma 2007; 48(8): 1569-76.
53. Anderson RA, Wallace WH, Baird DT. Ovarian cryopreservation for fertility preservation: indications and outcomes. Reproduction 2008; 136(6): 681-9.
54. Radich JP. The use of PCR technology for detecting minimal residual disease in patients with leukemia. Rev Immunogenet 1999; 1(2): 265-78.
55. Meirow D, Hardan I, Dor J, Fridman E, Elizur S, Ra'anani H, et al. Searching for evidence of disease and malignant cell contamination in ovarian tissue stored from hematologic cancer patients. Hum Reprod 2008; 23(5): 1007-13.
56. Curtin JP, Barakat RR, Hoskins WJ. Ovarian disease in women with breast cancer. Obstet Gynecol 1994; 84(3): 449-52.
57. Li CI, Anderson BO, Daling JR, Moe RE. Trends in incidence rates of invasive lobular and ductal breast carcinoma. JAMA 2003; 289(11): 1421-4.
58. Oktay K, Sonmezer M. Ovarian tissue banking for cancer patients: fertility preservation, not just ovarian cryopreservation. Hum Reprod 2004; 19(3): 477-80.
59. Mancini J, Rey D, Préau M, Malavolti L, Moatti JP. Infertility induced by cancer treatment: inappropriate or no information provided to majority of French survivors of cancer. Fertil Steril 2008; 90(5): 1616-2.
60. Donnez J, Squifflet J, Van Eyck AS, Demylle D, Jadoul P, Van Langendonckt A, et al. Restoration of ovarian function in orthotopically transplanted cryopreserved ovarian tissue: a pilot experience. Reprod Biomed Online 2008; 16(5): 694-704.
61. Kim SS, Radford J, Harris M, Varley J, Rutherford AJ, Lieberman B, et al. Ovarian tissue harvested from lymphoma patients to preserve fertility may be safe for autotransplantation. Hum Reprod 2001; 16(10): 2056-60.














