Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Médica del Uruguay
versión On-line ISSN 1688-0390
Rev. Méd. Urug. vol.23 no.3 Montevideo set. 2007
Escherichia coli enteropatógeno clásico (EPEC) asociado a casos de diarrea en niños usuarios del Hospital Pereira Rossell. Aspectos clínicos y características de las cepas involucradas
Dres. Gustavo Varela*, Clara Jasinski†, Pilar Gadea‡,
María Noel Tanzi§, María Inés Mota‡, Cristina Arenas¶,
Lorena Pardo††, Bres. Sabina González‡‡, Gladys González‡‡,
Lic. Alfredo Sirok§§, Dr. Felipe Schelotto†††
Departamentos de Bacteriología y Virología y de Laboratorio Clínico. Facultad de Medicina. Universidad de la República, Uruguay.
Unidad de Gastroenterología, Hepatología y Nutrición Pediátrica del Centro Hospitalario Pereira Rossell. Ministerio de Salud Pública, Uruguay
Resumen
Introducción: la enfermedad diarreica aguda (EDA) es responsable de 12.000 muertes por día en niños de Asia, África y Latinoamérica. Escherichia coli enteropatógeno clásico (EPEC) es un virotipo diarreogénico importante y se asocia a episodios de EDA en niños menores de 5 años que viven en estas regiones.
Objetivos: conocer las manifestaciones clínicas de los casos de diarrea por EPEC en niños usuarios de un servicio de Salud Pública y establecer las características de las cepas involucradas.
Material y método: se estudiaron 95 niños con EDA. A cada uno se le realizó historia clínica y estudio copromicrobiológico. Las cepas EPEC se detectaron por reacción en cadena de la polimerasa (PCR) para eae y se caracterizaron completamente incluyendo la determinación de las variantes genéticas del gen eae y bfp.
Resultados: se aislaron 26 cepas EPEC, 15 correspondieron a cepas "típicas" y 11 a cultivos "atípicos". La variante más frecuente de bfp fue b y se demostraron 9 variantes de eae. La mayoría de los niños infectados con EPEC presentó diarrea acuosa asociada a vómitos, y fiebre en 50% de los casos. En 20% se demostró la presencia de sangre y leucocitos fecales.
Conclusiones: como ocurre en otras zonas, las cepas EPEC "típicas" aparecen como enteropatógenos frecuentes en este grupo de niños. Los cultivos "atípicos" también jugarían un papel destacado como agentes de diarrea. Las características clínicas no difieren de las comunicadas en niños de países desarrollados con diarrea por EPEC y no hubo diferencias con los otros agentes.
Palabras clave: DIARREA INFANTIL - etiología.
DIARREA INFANTIL - epidemiología.
DIARREA INFANTIL - microbiología.
ENFERMEDAD AGUDA.
HECES - microbiología.
INFECCIONES POR ESCHERICHIA COLI - microbiología.
ESCHERICHIA COLI - aislamiento y purificación.
ESCHERICHIA COLI - patogenicidad.
* Profesor Agregado del Departamento de Bacteriología y Virología. Facultad de Medicina. Universidad de la República, Uruguay.
† Jefe de Unidad de Gastroenterología, Hepatología y Nutrición Pediátrica del Centro Hospitalario Pereira Rossell. Ministerio de Salud Pública, Uruguay.
‡ Asistente del Departamento de Bacteriología y Virología. Facultad de Medicina. Universidad de la República, Uruguay.
§ Médico Pediatra Gastroenterólogo.
¶ Asistente del Departamento de Laboratorio Clínico. Facultad de Medicina. Universidad de la República, Uruguay.
†† Ayudante de Clase del Departamento de Bacteriología y Virología.
‡‡ Bachiller.
§§ Ayudante de Clase del Departamento de Bacteriología y Virología. Facultad de Medicina. Universidad de la República, Uruguay.
††† Profesor Director del Departamento de Bacteriología y Virología. Facultad de Medicina. Universidad de la República, Uruguay.
Correspondencia: Dr. Gustavo Varela
Alfredo Navarro 3051. CP 11600. Montevideo, Uruguay.
Correo electrónico: gvarela@higiene.edu.uy
Recibido: 20/3/07.
Aceptado: 2/7/07.
Introducción
La enfermedad diarreica aguda (EDA) infantil se define como una entidad que ocurre habitualmente en lactantes menores de 1 año, de causa infecciosa, que se presenta de forma endémica con brotes epidémicos en los meses más cálidos y se manifiesta con síntomas y signos de la esfera digestiva, especialmente diarrea y vómitos(1). Se trata de una enfermedad frecuente en los países subdesarrollados y causa millones de defunciones por año en niños de estas regiones. Esta enfermedad es responsable de más de 12.000 muertes por día en niños menores de 5 años en Asia, África y Latinoamérica(2). En nuestro país, la mortalidad infantil por diarrea en el año 2005 fue de 0,2 por 1.000 nacidos vivos y para niños menores de 5 años representó 1,5% de todas las causas de muerte, según datos del Ministerio de Salud Pública. En el período 1999-2001, la EDA fue responsable de 5% del total de los ingresos anuales al Hospital Pediátrico.
Las características clínicas de la EDA son, en general, variables y dependen de los mecanismos patogénicos de los agentes involucrados y del estado general de salud del hospedero. Las manifestaciones más importantes y definidas ocurren a nivel del tubo digestivo e incluyen diarrea, vómitos y dolor de tipo cólico. También pueden acompañarse de signos y síntomas extraintestinales y complicaciones más o menos graves, como síndrome de Guillain-Barré o síndrome urémico hemolítico (SUH) asociadas a infecciones por Campylobacter o cepas de E. coli productoras de toxinas tipo Shiga (STEC), respectivamente(3,4). En general, la situación se resuelve en poco tiempo y no requiere de tratamiento con antimicrobianos, sino el uso de sales de rehidratación oral (SRO) para reponer agua y electrolitos, con o sin el agregado de probióticos(5,6). Dentro del conjunto de bacterias asociadas a EDA se destaca Escherichia coli patógeno entérico. Estas cepas se dividen en cinco virotipos de acuerdo con sus principales atributos de virulencia: E. coli enterotoxigénico (ETEC), E. coli productor de toxinas tipo Shiga (STEC), E. coli enteroinvasor (EIEC), E. coli enteroagregativo (EAEC) y E. coli enteropatógeno clásico (EPEC). La distribución relativa de los diferentes virotipos varía en las diversas regiones del mundo(7).
EPEC es un virotipo importante dentro de las cepas diarreogénicas de E. coli y se asocia a diarrea infantil, aguda o persistente, fundamentalmente en países en vías de desarrollo. Pertenece a la familia de patógenos bacterianos que a nivel intestinal causan lesiones de tipo adherencia y borramiento (A/E)(8,9). A partir del Segundo Simposio Internacional sobre EPEC realizado en San Pablo en 1995, la definición aceptada por consenso es la siguiente: "EPEC son cepas diarreogénicas de E. coli que producen en las células intestinales lesiones histopatológicas de tipo A/E y que no producen toxinas tipo Shiga. Los cultivos EPEC ‘típicos’ de origen humano presentan un plásmido de virulencia denominado E. coli-adherence-factor (EAF), mientras que las cepas EPEC ‘atípicas’ no poseen dicho plásmido"(10,11). En EPEC todos los determinantes genéticos para la producción de las lesiones de tipo A/E se encuentran en el locus of enterocyte effacement (LEE). LEE es una isla de patogenicidad (IP) de 35 kb ubicada en el cromosoma bacteriano que contiene los genes que codifican para la proteína de membrana externa denominada intimina (eae), los genes esp (por E. coli secreted proteins), el gen que codifica para el receptor translocado de intimina Tir (translocated intimin receptor) y los genes para la síntesis del sistema de secreción tipo III(12).
Intimina tiene una masa de 94 kDa y presenta dos regiones funcionales: la región amino-terminal, altamente conservada entre los diferentes tipos antigénicos descriptos en esta proteína y la región carboxilo-terminal altamente variable, responsable de la interacción con Tir(13).
Otra estructura de la superficie bacteriana presente en las cepas EPEC "típicas" y asociada con la virulencia es bundle-forming pilus (Bfp). Se trata de un pili de adherencia tipo IV, que forma "penachos" sobre la superficie bacteriana(14). El conjunto de genes bfp está localizado en el plásmido de alto peso molecular denominado EAF(15,16). En cepas EPEC "típicas" se han descripto dos variantes genéticas mayores del gen bfpA que codifica para la proteína "bundlina". La región variable de esta proteína se ubica en la mitad carboxilo-terminal, que está expuesta al exterior bacteriano y que actúa como dominio de unión a los distintos receptores ubicados sobre la célula eucariota(17).
Cepas de EPEC con LEE pero sin el plásmido EAF y, por lo tanto, sin Bfp, denominadas EPEC "atípicas", se han asociado a brotes y casos esporádicos de diarrea en seres humanos(7,18-20). Las cepas "atípicas" pueden expresar, además de los factores de virulencia codificados en LEE (intimina, Esp, Tir, sistema de secreción tipo III), otros factores accesorios como EAST1 (por enteroaggregative heat-stable1 toxin) una toxina estructuralmente relacionada con la enterotoxina termoestable ST1 de ETEC, la enterohemolisina E-hly (por EHEC-enterohemolysin) y Afa (por afimbrial adhesin). Estos factores de virulencia habitualmente no están presentes en cepas EPEC "típicas"(18).
El objetivo de este estudio fue conocer las características clínicas y epidemiológicas de los casos de EDA asociados a infección por EPEC que ocurren en niños menores de 3 años usuarios del Centro Hospitalario Pereira Rossell y determinar las características fenotípicas y genotípicas de las cepas involucradas.
Material y método
Tipo de estudio. Se realizó un estudio prospectivo y descriptivo. El período de análisis fue desde diciembre de 1999 a junio de 2001. Los estudios microbiológicos requirieron exámenes más prolongados.
Población analizada. Se estudiaron 95 niños, lactantes mayores de 1 mes y preescolares de hasta 3 años, que presentaron diarrea aguda definida según los criterios de la Organización Mundial de la Salud (OMS)(21). Los pacientes consultaron en el Servicio de Emergencia del Centro Hospitalario Pereira Rossell o en las policlínicas pediátricas de dicho hospital, o en ambos. Sólo se analizaron los niños en los cuales se logró obtener la muestra de materias fecales en el momento de la consulta. No se incluyeron niños con diarrea persistente y tampoco niños que estuvieran recibiendo antibióticos o que hubieran estado internados en los 30 días previos al episodio de diarrea aguda. Tampoco niños con patología gastrointestinal conocida como enfermedad celíaca, alergia a la leche de vaca o enfermedad inflamatoria intestinal.
Características clínicas. Los datos clínicos analizados fueron los siguientes: fecha de nacimiento, sexo, características macroscópicas de las deposiciones, síntomas y signos acompañantes, estado nutricional y duración en horas de la diarrea. La presencia de fiebre se definió por el hallazgo de una temperatura axilar mayor o igual a 38ºC. El estado nutricional se valoró comparando los datos antropométricos de talla y peso con tablas percentilares de referencia de la OMS(22). La deshidratación se determinó clínicamente por la constatación de pliegue hipoelástico, mucosas secas, taquicardia, polipnea y depresión neuropsíquica.
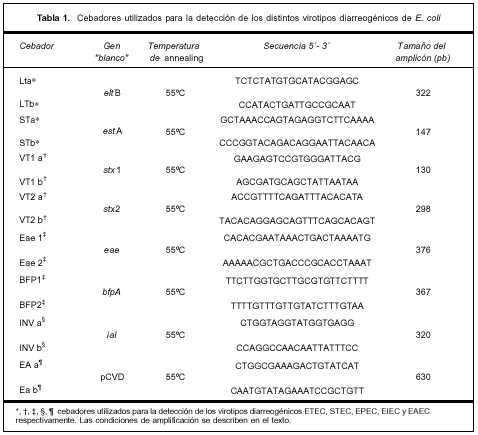
Estudio microbiológico de las muestras de materias fecales. Para el estudio microbiológico se obtuvo una muestra de materias fecales por defecación espontánea, previo al inicio del tratamiento con antimicrobianos en caso que estuvieran indicados. Las muestras fueron divididas en dos partes: una parte se colocó en medio de transporte Cary-Blair (C-B) y la otra en un frasco estéril. Las muestras se enviaron de inmediato y refrigeradas al laboratorio y se procesaron dentro de las dos horas de recibidas. La detección de los patógenos entéricos se realizó como se describió previamente(23). Sobre las colonias sospechosas de E. coli se realizó tamizaje inicial con pruebas bioquímicas. La identificación de los atributos de virulencia que definen los diferentes virotipos diarreogénicos se realizó por reacción en cadena de la polimerasa (PCR)(24,25). Para la extracción del ácido desoxirribonucleico (ADN) las bacterias se sembraron en agar infusión cerebro-corazón y se incubaron a 37ºC durante toda la noche. Una o dos colonias se resuspendieron en 150 µl de buffer TE 1X-Tritón X100 al 1% y el ADN se liberó por ebullición a 100ºC durante 5 minutos; 2 µl de este extracto crudo se utilizaron como molde en las diferentes reacciones de amplificación. La amplificación se realizó en un volumen final de 25 µl con las siguientes concentraciones: 0,2 mM de cada dNTP, 10 mM de Tris-HCl, 2 mM de MgCl2 y 1,5 U de Taq polimerasa. Las condiciones de amplificación fueron: un paso inicial de desnaturalización a 95ºC durante 5 minutos seguido de 30 ciclos a 94ºC por un minuto, 55ºC por un minuto y 72ºC un minuto. Se realizó una extensión final a 72ºC por 10 minutos. Los cebadores se usaron a una concentración final de 0,2 µM. Se utilizó termociclador GeneAmp® 2700 (AB, Applied Biosystem, Singapore). Los productos de amplificación se separaron por electroforesis en geles de agarosa al 2% y se revelaron por tinción con bromuro de etidio. La lista de cebadores utilizados se muestra en la tabla 1.
Estudio de las cepas EPEC recuperadas
Serotipificación. La determinación de los antígenos O somáticos se realizó por aglutinación en lámina y confirmación por ensayo en tubo con sueros monovalentes policlonales de conejo preparados en el Instituto de Higiene(26).
Biotipificación. Se utilizaron seis ensayos: producción de ácido a partir de sorbitol, dulcitol, ramnosa y rafinosa, decarboxilación de la lisina y movilidad(26).
Estudio de la sensibilidad a los antimicrobianos. Los ensayos se realizaron por la técnica de disco difusión en placas con agar Müller-Hinton, siguiendo las normas del Clinical and Laboratory Standars Institute (CLSI)(27). Los antibióticos probados fueron los siguientes: tetraciclina, ceftriaxona, ciprofloxacina, cefoxitina, ampicilina, trimetoprim-sulfametoxazol, cloranfenicol, ácido nalidíxico, gentamicina y nitrofurantoína (Oxoid Ltd., Basingstoke, Hampshire, England, UK). Se utilizaron como cepas control Escherichia coli ATCC 25922 y Pseudomonas aeruginosa ATCC 27853.
Tipificación de los genes eae. Se realizó por la técnica de PCR con las condiciones de extracción y amplificación descriptas anteriormente y utilizando cebadores específicos para las variantes de eae descriptas(28).
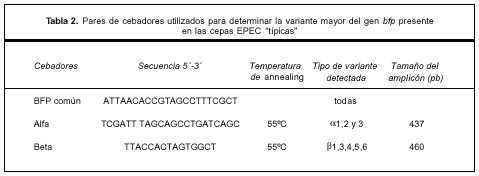
Tipificación de los genes bfp. Se realizó por técnica de PCR utilizando un cebador forward común y dos cebadores reverse específicos para la región 3´ de las variantes a y b, diseñados según las secuencias disponibles on-line (GeneBank, EMBL). La lista de cebadores utilizados se muestra en la tabla 2.
Cepas control. Las cepas de E. coli utilizadas como control en las distintas reacciones de amplificación fueron las siguientes: EPEC-2348 ( O127:H6, eae-a1), AEEC-IH2498a (O125:H6, eae-a2), REPEC-RDEC-1 (O15:H-, eae-b1), EPEC-359 (O119:H6, eae-b2), STEC-EDL933 (O157:H7, stx1, stx2, eae-g1, ehxA), STEC-VTB308 (O111:H-, stx1, eae-g2), STEC-TW07926 (O111:H8, stx1, stx2, eae-θ), EPEC-BP12665 (O86:H34, eae-d), AEEC-6044/95 (O118:H5, eae-κ), STEC-VTB-286 (O103:H2, stx1, eae-e), STEC-VTO-50 (O156:H-, stx1, eae-z), AEEC-CF11201 (O125:H-, eae-η), AEEC-7476/96 (O145:H4, eae-ι), AEEC-68-4 (O34:H-, eae-λ), EPEC-373 (O55:H51, eae-μ), AEEC-IH1229a (O10:H-, eae-ν), ATCC 35401 (ETEC, eltB y estA), ATCC 43893 (EIEC, ial), EAEC 97R (pCVD 432) y E. coli ATCC 11775 como control negativo (sin genes de virulencia).
Tests estadísticos. Para establecer el grado de asociación entre variables cualitativas se utilizó la prueba de chi cuadrado. Se consideró significativo un valor de p menor de 0,05.
Resultados
Características de la población analizada. De los 95 niños estudiados, 55% fue del sexo masculino y el promedio de edad fue de 8 meses. Sesenta y dos niños (65%) presentaron un estado nutricional adecuado en el momento del episodio agudo de diarrea, con percentiles peso/talla, peso/edad y talla/edad mayores de 10; 35% presentó un déficit nutricional crónico, con percentiles por debajo de 5 para la talla.
Aspectos microbiológicos y características clínicas. En 72 (74%) de los 95 niños se recuperaron uno o más patógenos entéricos potenciales. Los agentes identificados fueron los siguientes: rotavirus en 42 casos; Escherichia coli diarreogénico, 40 aislamientos; Shigella 18 cepas y siete aislamientos de Campylobacter jejuni. En varios niños se demostró la coinfección con dos o más agentes. Dentro del conjunto de E. coli diarreogénico, el virotipo más frecuentemente hallado fue EPEC con 26 aislamientos seguido por ETEC (ocho cepas) y EAEC (seis cepas). No se recuperaron cepas de los virotipos STEC ni EIEC. En 15 niños EPEC se identificó como único enteropatógeno.
EPEC presentó una distribución estable a lo largo del año, en cambio los aislamientos de Shigella ocurrieron sobre todo en los meses cálidos. Rotavirus mostró una distribución más o menos homogénea durante todo el año con aumento en el número de casos identificados durante los meses fríos.
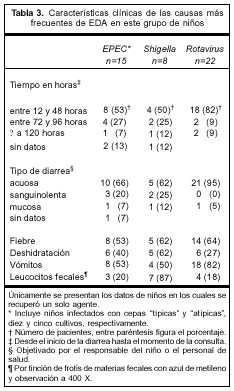
Las características clínicas de los niños con diarrea por EPEC, Shigella y rotavirus se muestran en la tabla 3. De los niños con EPEC, 80% fue llevado a la consulta dentro de las 96 horas de iniciada la enfermedad y la mayoría presentó diarrea de tipo acuoso. Los niños infectados por EPEC presentaron sangre en las heces al inicio de la diarrea con una frecuencia similar a la encontrada en los casos de infección por Shigella (20%). En el caso de rotavirus la diarrea se acompañó de vómitos sin repercusión importante sobre el estado de hidratación, mientras que 40% de los niños infectados por EPEC y 62% de los infectados por Shigella presentaron deshidratación en el momento de la consulta. El porcentaje de niños que presentaron vómitos fue similar para EPEC y Shigella. La fiebre se demostró en más de la mitad de los niños, independientemente del agente recuperado. En 87% de los niños infectados por Shigella se demostró la presencia de leucocitos fecales, mientras que en aquellos infectados por EPEC y rotavirus el porcentaje de detección fue notoriamente menor, 20% y 18% respectivamente. La asociación entre infección por Shigella y presencia de leucocitos fecales fue la única que mostró un valor estadísticamente significativo (p<0,05). Ninguno de estos niños desarrolló síndrome urémico hemolítico ni síndrome de Guillain-Barré. Tampoco hubo fallecimientos.
Características de las cepas EPEC recuperadas
Serotipificación. La distribución general por serogrupos de acuerdo a la presencia del antígeno O somático fue la siguiente: O55, ocho cepas; O119, cuatro; O142, dos; O111, dos; O26, dos y una cepa en cada uno de O33; O34; O49; O51; O101; O127; O128. Un aislamiento resultó no tipificable.
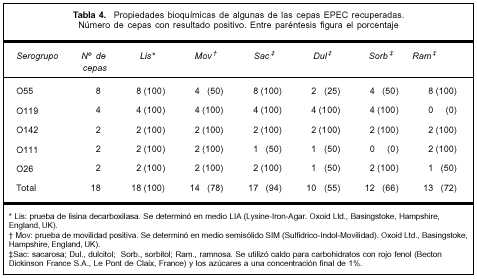
Biotipificación. Los resultados de los ensayos bioquímicos se muestran en la tabla 4. Las cepas O119(4) mostraron un patrón bioquímico idéntico, lo mismo sucedió con los dos aislamientos del serogrupo O142.
Estudio de la sensibilidad a los antimicrobianos. Ninguno de los aislamientos EPEC estudiados mostró resistencia para los antibióticos ensayados.
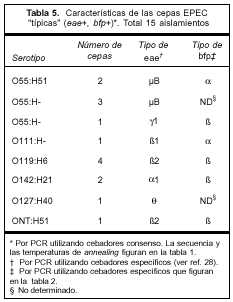
Atributos de virulencia. Categorización de las cepas EPEC recuperadas. Quince aislamientos correspondieron a cepas EPEC "típicas" con resultado positivo por PCR para los genes eae y bfp. Las 11 restantes fueron definidas como "atípicas" (eae+ y bfp-).
Los serogrupos más frecuentes en EPEC "típicas" fueron O55, O119 y O142. Estos tres serogrupos representaron 80% del total de las cepas "típicas" recuperadas en este estudio. Las características de estas cepas y las variantes de los genes eae y bfp encontradas se muestran en la tabla 5. La variante µB de eae fue la más frecuentemente hallada dentro del serogupo O55, mientras que todas las cepas del serogrupo O119 mostraron la variante b2. Diez aislamientos "típicos" mostraron bfp de tipo b. El único aislamiento O111 de esta categoría mostró bfp de tipo a. La variante del gen bfp no se pudo determinar en cuatro cepas.
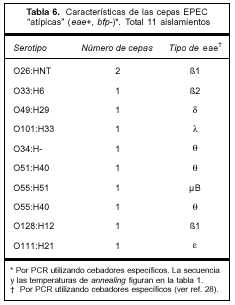
La distribución del antígeno somático O en las cepas "atípicas" fue más amplia, incluyó nueve serogrupos, y la variante del gen eae más frecuente dentro de esta categoría fue θ.
Las características de estas cepas y las variantes de los genes eae encontradas se muestran en la tabla 6.
Discusión
Diferentes estudios sobre la etiología de la EDA realizados en países industrializados comunican porcentajes de aislamiento de enteropatógenos cercanos a 60%(29,30). En este estudio el porcentaje de recuperación fue de 74%, un poco más elevado cuando se compara con esos trabajos. Este resultado podría atribuirse a que los agentes virales, más frecuentes como causa de EDA en niños que viven en zonas desarrolladas, serían más difíciles de detectar que los patógenos bacterianos, considerados más prevalentes en los niños con diarrea de zonas más pobres(30). Los resultados obtenidos en este trabajo destacan la importancia de rotavirus, Escherichia coli diarreogénico, Shigella y Campylobacter jejuni como agentes asociados a diarrea aguda en niños pequeños usuarios de los servicios de Salud Pública, y muestran nuevamente que EPEC representa un enteropatógeno frecuente para este grupo de niños(23).
Aspectos clínicos de los niños infectados por EPEC. Los datos obtenidos sugieren que los niños con gastroenteritis por EPEC fueron llevados más tarde a la consulta que los infectados por rotavirus. Esto puede deberse a que la mayoría de los casos asociados con rotavirus presentaron vómitos desde el inicio de la enfermedad; este porcentaje fue menor para niños infectados por EPEC. La presencia de vómitos podría actuar como elemento de alarma para los responsables de estos niños, llevándolos rápidamente a solicitar atención médica.
En los casos de infección por EPEC la diarrea acuosa fue frecuente, aunque algunos (20%) presentaron diarrea sanguinolenta. El mecanismo por el cual EPEC se asocia con diarrea con sangre no es claro. Sin embargo, la utilización de procedimientos sensibles para la detección de lactoferrina leucocitaria permite poner de manifiesto, en algunos casos de diarrea por EPEC, la existencia de elementos inflamatorios en las heces de estos niños(31).
La repercusión hidroelectrolítica sería mayor en niños con gastroenteritis por EPEC o Shigella que en aquellos con diarrea por rotavirus. En los casos por EPEC la deshidratación podría deberse a la doble acción de estas bacterias a nivel intestinal, por un lado actuarían directamente sobre el propio enterocito causando borramiento del borde en cepillo (lesiones de tipo A/E) y, por otro, a través de la acción de distintas moléculas bacterianas sobre las uniones intercelulares(7). Estos efectos combinados determinarían una disminución importante de la superficie de absorción del intestino con la consiguiente pérdida de agua y electrolitos. También podría atribuirse a que estos niños serían llevados más tarde a la consulta médica que aquellos infectados por rotavirus. En el momento de su observación, la EDA tendría una duración mayor con más pérdidas de agua y electrolitos. No se hallaron diferencias significativas en cuanto a la presencia de fiebre en los niños infectados por EPEC y rotavirus. Los resultados de las características clínicas fueron muy similares a los comunicados en estudios realizados en niños de países desarrollados con diarrea aguda causada por EPEC y rotavirus(29,30,32).
Epidemiología. En este estudio las cepas EPEC se recuperaron en cantidad similar a lo largo de todo el año. En cambio, en zonas industrializadas estos aislamientos ocurren fundamentalmente en los meses cálidos(30).
Los cultivos de los serogrupos O55, O119, O142, O26 y O111 representaron casi 70% del total de los aislamientos EPEC. La distribución global de serogrupos se ha mantenido más o menos constante a lo largo del tiempo, aunque en este estudio las cepas O55 aparecen como las más frecuentes, desplazando del primer lugar a los aislamientos del serogrupo O111(23). La alternancia en el tiempo de los serogrupos más frecuentes podría deberse a fenómenos de selección por parte del sistema inmune del hospedero. La circulación de un serogrupo particular durante un tiempo prolongado podría determinar la aparición de una respuesta inmune local o sistémica, o ambas, que protegería contra la infección por cepas del mismo serogrupo pero no contra aislamientos con antígenos O heterólogos.
Características de las cepas EPEC. El virotipo EPEC no debe considerarse como un conjunto homogéneo de cepas responsables de EDA. De acuerdo con la presencia o ausencia del pili Bfp, las cepas EPEC se dividen en dos categorías: "típicas" y "atípicas", respectivamente(10,18). Quince de los 26 aislamientos analizados en este estudio correspondieron a la primera categoría. Estas cepas se han asociado históricamente a casos de diarrea en niños menores de 2 años, y su papel como agentes de EDA, tanto en zonas desarrolladas como en otras regiones en vías de desarrollo, no estaría en discusión(7,10,33,34).
Las cepas EPEC "atípicas" que no presentan Bfp podrían ser menos virulentas que las "típicas". Sin embargo, no se ha demostrado que sean menos patogénicas. Algunos hallazgos en zonas desarrolladas aportarían evidencia a favor de su participación como agentes responsables de diarrea en niños y adultos. En brotes de gastroenteritis transmitidos por agua y alimentos que ocurrieron en Japón se recuperaron cepas EPEC "atípicas"(19,35). Estudios realizados en Reino Unido mostraron una frecuencia mayor de recuperación de cepas EPEC "atípicas" que de cepas "típicas" a partir de niños con gastroenteritis(36). El rol de estos cultivos en regiones menos desarrolladas no es claro todavía. Sin embargo, trabajos realizados en zonas de Brasil y Vietnam sugieren un papel importante de las cepas "atípicas" como enteropatógenos infantiles(18,25).
Once de las 26 cepas EPEC recuperadas en este trabajo correspondieron a este grupo y en cinco oportunidades se recuperaron como único enteropatógeno. La variedad de serogrupos encontrados en esta categoría fue mayor que para los aislamientos "típicos". Cinco de los cultivos de esta categoría correspondieron a serogrupos asociados previamente a brotes de diarrea en países desarrollados (O26, O55 y O111). Esta es la primera comunicación a nivel nacional que describe la circulación de cepas de esta categoría y se requieren estudios más detallados para establecer claramente el papel de estos agentes como patógenos entéricos locales. Los cultivos EPEC "atípicos" estarían relacionados con las cepas del virotipo STEC en cuanto a características genéticas, serotipos, producción de toxinas y reservorio. En ese sentido, tres de los 11 cultivos "atípicos" recuperados pertenecieron a dos serogrupos (O26 y O111) encontrados en cepas locales del virotipo STEC aisladas a partir de niños con diarrea sanguinolenta o SUH(4).
Atributos de virulencia. La proteína de membrana externa intimina es responsable de la adherencia íntima de EPEC a células eucariotas y sería esencial para la formación de las lesiones de tipo A/E. Varios estudios han mostrado que existe una gran variedad en la secuencia nucleotídica del gen que codifica para esta proteína. Hasta el momento se han descripto por lo menos 20 variantes(28). En las 26 cepas EPEC analizadas en este trabajo se hallaron nueve variantes de este gen. La variación en la secuencia nucleotídica ocurre a nivel del extremo 3' del gen y determinaría cambios antigénicos importantes en la región carboxilo terminal responsable de la unión a Tir conocida como int 280(37). La identificación de los diferentes tipos de intimina tendría valor para futuros estudios antigénicos, epidemiológicos y de relación clonal entre diferentes aislamientos de EPEC. Intimina –al igual que Bfp– se considera como un inmunógeno potencial que puede incluirse en una vacuna diseñada para el control de EPEC. La respuesta inmune a nivel intestinal para diferentes proteínas de la superficie bacteriana podría determinar en el hospedero protección contra la colonización por estas cepas. Esta proteína es inmunogénica para los seres humanos; se han identificado anticuerpos antiintimina en la leche, el calostro y el suero de individuos infectados por EPEC(38). La variación antigénica que ocurre en esta proteína implica que como paso previo para el diseño de inmunógenos se determine qué tipos de intimina están presentes en las cepas EPEC circulantes. Esto requiere de un laboratorio que disponga de la infraestructura adecuada.
Hasta el momento se reconocen dos variantes nucleotídicas mayores del gen bfpA denominadas a y b. Las diferencias ocurren en el extremo 3', responsable de codificar la parte carboxilo-terminal de la proteína "bundlina", componente fundamental del pili Bfp. Este extremo está expuesto al exterior bacteriano y participaría en la unión con diferentes receptores celulares. Con respecto a las variantes de Bfp encontradas, la mayoría presentó el tipo b. Un cultivo del serogrupo O111 mostró la variante a y cuatro aislamientos resultaron no tipificables. La variante menor b2 no es detectada por los cebadores utilizados, por lo tanto las cepas no tipificables podrían presentar esta variante o corresponder a una nueva. Se requiere de otros estudios para descartar o confirmar estas suposiciones. Cepas EPEC con el gen bfp tipo b se han aislado a partir de materias fecales de aves y perros(39). Es frecuente que los niños de los sectores más pobres convivan con estas mascotas y desde el punto de vista epidemiológico sería importante estudiar este reservorio animal para determinar la presencia de cepas EPEC y establecer las variantes de Bfp presentes. El conocimiento de las variantes de Bfp tendría aplicación para el diseño de vacunas utilizadas en el control de EPEC. Se ha sugerido que los anticuerpos dirigidos contra esta proteína podrían proteger contra la infección por estos agentes. Bfp es inmunogénico; se ha demostrado la presencia de anticuerpos anti "bundlina" en niños infectados de forma natural con cepas EPEC "típicas"(40). Por lo tanto, resulta de interés desde el punto de vista inmunológico determinar las variantes que circulan entre los niños que se pretende inmunizar. Este estudio informa por primera vez en Uruguay sobre las variantes mayores de Bfp presentes en las cepas de EPEC "típicas" aisladas en este grupo de niños.
Conclusiones
EPEC se confirma localmente como un enteropatógeno importante para niños pequeños usuarios del Centro Hospitalario Pereira Rossell que presentan diarrea aguda adquirida en la comunidad. Ocupa el segundo lugar de frecuencia luego de rotavirus y se recupera uniformemente a lo largo de todo el año. La mayoría de los niños infectados por EPEC son llevados a la consulta médica más tarde que aquellos infectados por rotavirus. El 60% presenta diarrea de tipo acuoso acompañada en la mitad de los casos de vómitos y fiebre. En 20% se demuestra la presencia de leucocitos fecales. No se encontraron características clínicas definidas que permitan determinar con certeza que EPEC es el agente responsable. El conjunto de serogrupos circulantes se mantiene más o menos constante en el tiempo. Los cultivos de los serogrupos O55, O119, O142, O111, O127 y O26 representan 70% del total de los aislamientos EPEC locales. Como ocurre en países desarrollados y en otras zonas menos desarrolladas, en este grupo de niños las cepas EPEC "atípicas" aparecen como agentes potencialmente asociados a diarrea.
Agradecimientos
Al doctor Juan Alfonso Ayala Serrano (Universidad Autónoma de Madrid, España) por la lectura crítica y los aportes realizados para la redacción del manuscrito.
Summary
Background: acute diarrhea disease (EDA) is responsible of 12.000 deaths per day in Asia, Africa and Latin America. Classic Enteropathogenic Escherichia coli (EPEC) is an important virotype associated with EDA episodes in children under five years of those regions.
Objectives: to know clinical manifestations of diarrhea cases due to EPEC in children users of a Public Health centre and to establish the characteristics of involved strains.
Methods: ninety-five children with EDA were studied. Every child underwent clinical history and copromi-crobiologic studies. EPEC strains were detected by reaction chain polymerase (PCR) of eae and were completely characterized including determination of genetic variations of eae and bfp gens.
Results: twenty-six EPEC strains were isolated, 15 typical and 11 atypical. The most frequent variant of bfp was b and 9 variants of eae were seen. Most of the infected children with EPEC presented watery diarrhea associated with vomiting, and fever in half of the cases. Blood and fecal leukocytes were found in 20% of the children.
Conclusions: as it happens in other areas, typical EPEC strains appear as frequent enteropathogens in this group of children. Atypical cultures also play an important rol as agents of diarrhea. Clinical characteristics do not differ from those of children with diarrhea in developed countries; no differences were seen with other agents.
Résumé
Introduction: la diarrhée aigue (EDA) est responsable de 12.000 décès par jour chez les enfants d’Asie, d’Afrique et d’Amérique Latine. Escherichia coli entéropathogène classique (EPEC) est un virotype diarrhéogénique impor-tant associé à des épisodes de EDA chez les mineurs de 5 ans de ces régions-là.
Objectifs: connaître les manifestations cliniques des cas de diarrhée par EPEC chez des enfants assistés dans un service de la Santé Publique et établir les caractéris-tiques des cèpes concernées.
Matériel et méthode: 95 enfants avec EDA furent étudiés, dont chacun avait l’histoire clinique et une étude copromicrobiologique. Les cèpes EPEC ont été repérées et caractérisées par réaction en chaîne de la polymérase (PCR) pour eae, la détermination des variantes génétiques du gène eae et bfp.
Résultats: 26 cèpes EPEC ont été isolées, dont 15 ap-partenaient à des cèpes typiques et 11 à des cultures "atypiques". La variante la plus fréquente de bfp fut b et 9 variantes de eae furent repérées. La plupart des enfants avec EPEC a subi une diarrhée aqueuse associée à des vomissements et de la fièvre à 50% des cas; 20% a présenté du sang et des leucocytes fécaux.
Conclusions: tel qu’il arrive dams d’autres régions, les cèpes EPEC "typiques" apparaissent comme des entéropathogènes fréquents dans ce groupe d’enfants. Les cultures "atypiques" joueraient aussi un rôle détaché en tant qu’agent de diarrhée. Les données cliniques ressemblent à celles des enfants originaires de pays développés, présentant diarrhée par EPEC et on n’a pas repéré de différences avec les autres agents.
Resumo
Introdução: a doença diarréica aguda (DDA) é respon-sável por 12.000 mortes por dia de crianças na Ásia, África e América Latina. A Escherichia coli enteropatogênica clássica (EPEC) é um virotipo diarreogênico importante e está associada a episódios de DDA em crianças menores de 5 anos que vivem nessas regiões.
Objetivos: conhecer as manifestações clínicas dos casos de diarréia por EPEC em crianças atendidas em um serviço de Saúde Pública e definir as características das cepas encontradas.
Material e método: foram estudadas 95 crianças com DDA. Para cada uma se abriu um protocolo clínico e foi realizado exame copromicrobiológico. As cepas EPEC foram detectadas por reação em cadeia da polimerase (PCR) para eae e foram completamente identificados incluindo as variantes genéticas do gen eae e bfp.
Resultados: foram isoladas 26 cepas EPEC, sendo 15 cepas "típicas" e 11 em cultivos "atípicos". A variante mais freqüente de bfp foi b e foram identificadas 9 variantes de eae. A maioria das crianças infectadas com EPEC apresentava diarréia aquosa associada a vômitos, e febre em 50% dos casos. Em 20% dos pacientes se observou sangue e leucócitos fecais.
Conclusões: como se observa em outras regiões, as cepas EPEC "típicas" aparecem como enteropatógenos freqüentes neste grupo de crianças. Os cultivos "atípicos" também tem um papel destacado como agentes causadores de diarréia. As características clínicas não são diferentes das comunicadas em crianças de países desenvolvidos com diarréia por EPEC e não foram observadas diferenças com os outros agentes.
Bibliografía
1. Galiana A, Ferrari AM, Nairac A, Peluffo L, Bello O. Diarrea aguda infantil. In: Atención pediátrica. Pautas de diagnóstico, tratamiento y prevención. 5 ed. Montevideo: Oficina del Libro-AEM, 2000: 67-72.
2. Bern C, Martines J, de Zoysa I, Glass RI. The magnitude of the global problem of diarrhoeal disease: a ten-year update. Bull World Health Organ 1992; 70: 705-14.
3. Koga, M, Yuki N, Takahashi M, Saito K, Hirata K. Are Campylobacter curvus and Campylobacter upsaliensis antecedent infectious agents in Guillain-Barre and Fisher’s syndrome? J Neurol Sci 1999; 163: 53-7.
4. Gadea M, Varela G, Bernadá M, Sirok A, Mota M, Sabelli R, et al. Primer aislamiento en Uruguay de Escherichia coli productora de toxina Shiga del serotipo O157:H7 en una niña con síndrome urémico hemolítico. Rev Méd Urug 2004; 20: 79-81.
5. World Health Organization. The treatment of diarrhoea: a manual for physicians and other senior health workers (WHO/CDR/95.3). Ginebra: WHO, 1995.
6. Food and Agriculture Association /World Health Organization. Evaluation of health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria. (Córdoba (Argentina), 1-4 oct. 2001). Ginebra: FAO/WHO, 2001. 34 p.
7. Nataro JP, Kaper JB. Diarrheagenic Escherichia coli. Clin Microbiol Rev 1998; 11: 142-201.
8. Knutton S, Lloyd DR, McNeish AS. Adhesion of enteropathogenic Escherichia coli to human intestinal enterocytes and cultured human intestinal mucosa. Infect Immun 1987; 55: 69-77.
9. McDaniel TK, Kaper JB. A cloned pathogenicity island from enteropathogenic Escherichia coli confers the attaching and effacing phenotype on E. coli K-12. Mol Microbiol 1997; 23: 399-407.
10. Kaper J B. Defining EPEC. Rev Microbiol 1996; 27: 130-3.
11. Brinkley C, Burland V, Keller R, Rose DJ, Boutin AT, Klink SA, et al. Nucleotide sequence analysis of the enteropathogenic Escherichia coli adherence factor plasmid pMAR7. Infect Immun 2006; 74: 5408-13.
12. Elliott S J, Wainwright LA, McDaniel TK, Jarvis KG, Deng YK, Lai LC, et al. The complete sequence of the locus of enterocyte effacement (LEE) from enteropathogenic Escherichia coli E2348/69. Mol Microbiol 1998; 28:1-4.
13. Girard F, Batisson I, Frankel GM, Harel JM, Fairbrother JM. Interaction of enteropathogenic and shiga toxin-producing Escherichia coli and porcine intestinal mucosa: role of intimin and tir in adherence. Infect Immun 2005; 73: 6005-16.
14. Girón JA, Ho AS, Schoolnik GK. Characterization of fimbriae produced by enteropathogenic Escherichia coli. J Bacteriol 1993; 175: 7391-403.
15. Stone KD, Zhang HZ, Carlson LK, Donnenberg MS. A cluster of fourteen genes from enteropathogenic Escherichia coli is sufficient for the biogenesis of a type IV pilus. Mol Microbiol 1996; 20: 325-37
16. Tobe T, Hayashi T, Han C, Schoolnik GK, Ohtsubo E, Sasakawa C. Complete DNA sequence and structural analysis of the enteropathogenic Escherichia coli adherence factor plasmid. Infect Immun 1999; 67: 5455-62.
17. Blank TE, Zhong H, Bell AL, Whittam TS, Donnenberg MS. Molecular variation among type IV pilin (bfpA) genes from diverse enteropathogenic Escherichia coli strains. Infect Immun 2000; 68: 7028-38.
18. Trabulsi LR, Keller R, Tardelli Gomes TA. Typical and atypical enteropathogenic Escherichia coli. Emerg Infect Dis 2002; 8: 508-13.
19. Yatsuyanagi J, Saito S, Miyajima Y, Amano K, Enomoto K. Characterization of atypical enteropathogenic Escherichia coli strains harboring the astA gene that were associated with a waterborne outbreak of diarrhea in Japan. J Clin Microbiol 2003; 41: 2033-9.
20. Alikhani MY, Mirsalehian A, Aslani MM. Detection of typical and atypical enteropathogenic Escherichia coli (EPEC) in Iranian children with and without diarrhoea. J Med Microbiol 2006; 55: 1159-63.
21. World Health Organization Programme for control of diarrheal diseases. Manual for laboratory investigations of acute enteric infections. Ginebra: WHO, 1987.
22. Evaluación del crecimiento del niño. In: Cusminsky M. Organización Panamericana de la Salud. Manual de crecimiento y desarrollo del niño. 2 ed. (Serie Paltex, 8). Washinton: OPS, 1993: 23-52.
23. Torres ME, Pírez MC, Schelotto F, Varela G, Parodi V, Allende F, et al. Etiology of children’s diarrhea in Montevideo, Uruguay: associated pathogens and unusual isolates. J Clin Microbiol 2001; 39: 2134-9.
24. Aranda KR, Fagundes-Neto U, Scaletsky IC. Evaluation of multiplex PCRs for diagnosis of infection with diarrheagenic Escherichia coli and Shigella spp. J Clin Microbiol 2004; 42: 5849-53.
25. Nguyen TV, Le Van P, Huy C, Nguyen Gia K, Weintraub A. Detection and characterization of diarrheagenic Escherichia coli from young children in Hanoi, Vietnam. J Clin Microbiol 2005; 43: 755-60.
26 Ewing WH. The genus Escherichia coli. In: Edwards and Ewing’s identification of enterobacteriaceae. 4 ed. New York: Elsevier, 1985: 93-134.
27. Clinical and Laboratory Standars Institute/NCCLS. Performance standards for antimicrobial susceptibility testing: 15º informational suppl. (Document M100-S15) . Pennsylvania: CLSI, 2005.
28. Blanco M, Blanco JE, Dahbi G, Mora A, Alonso MP, Varela G, et al. Typing of intimin (eae) genes from enteropathogenic Escherichia coli (EPEC) isolated from children with diarrhoea in Montevideo, Uruguay: identification of two novel intimin variants (muB and xiR/beta2B). J Med Microbiol 2006; 55: 1165-74
29. Tompkins DS, Hudson MJ, Smith HR, Eglin RP, Wheeler JG, Brett MM, et al. A study of infectious intestinal disease in England: microbiological findings in cases and controls. Commun Dis Public Health 1999; 2:108-13.
30. Olesen B, Neimann J, Böttiger B, Ethelberg N, Schiellerup P, Jensen C, et al. Etiology of diarrhea in young children in Denmark: a case-control study. J Clin Microbiol 2005; 43: 3636-41.
31. Miller JR, Barrett L, Kotloff K, Guerrant RL. A rapid diagnostic test for infectious and inflammatory enteritis. Arch Intern Med 1994; 154: 2660-4.
32. Cheng A, Mac Donald JR, Thielman NM. Infectious diarrhea in developed and developing countries. J Clin Gastoenterol 2005; 39: 757-72.
33. Scaletsky IC, Fabbricotti SH, Silva SO, Morais MB, Fagundes-Neto U. HEp-2-adherent Escherichia coli strains associated with acute infantile diarrhea, Sao Paulo, Brazil. Emerg Infect Dis 2002; 8: 855-8.
34. Rodrigues J, Thomazini CM, Morelli A, de Batista G. Reduced eiological role for enteropathogenic Escherichia coli in cases of diarrhea in brazilian infants. J Clin Microbiol 2004; 42: 398-400.
35 Yatsuyanagi J, Saito S, Sato H, Miyajima H, Amano K, Enomoto K. Characterization of enteropathogenic and enteroaggregative Escherichia coli isolated from diarrheal outbreak. J Clin Microbiol 2002; 40:294-7.
36. Scotland SM, Smith HR, Cheasty T, Said B, Willshaw GA, Stokes N, et al. Use of gene probes and adhesion tests to characterize E. coli belonging to enteropathogenic serogroups isolated in United Kingdom. J Med Microbiol 1996; 44: 438-43.
37. Hartland E, Batchelor M, Delahay RM, Hale C, Matthews S, Dougan G, et al. Binding of intimin from enteropathogenic Escherichia coli to tir and to host cells. Mol Microbiol 1999; 32: 151-8.
38. Carvalho H, Teel LD, Kokai-Kun JF, O’Brien AD. Antibody against the carboxyl terminus of intimin a reduces enteropathogenic Escherichia coli adherence to tissue culture cells and subsequent induction of actin polymerization. Infect Immun 2005; 73: 2541-6.
39. Blank TE, Zhong H, Bell AL, Whittam TS, Donnenberg JK. Molecular variation among type IV pilin (bfpA) genes from diverse enteropathogenic Escherichia coli strains. Infect Immun 2000; 68: 7028-38.
40. Loureiro I, Frankel G, Adu-Bobie J, Dougan G, Trabulsi LR, Carneiro-Sampaio MM. Human colostrum contains IgA antibodies reactive to enteropathogenic Escherichia coli virulence-associated proteins: intimin, BfpA, EspA, and EspB. J Pediatr Gastroenterol Nutr 1998; 27: 166-71.