Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Médica del Uruguay
versión On-line ISSN 1688-0390
Rev. Méd. Urug. vol.23 no.2 Montevideo jun. 2007
Criopreservación de corteza ovárica en pacientes jóvenes con cáncer e indicación de tratamiento gonadotóxico
Dres. Héctor Pérez Campos*, Francisco Cóppola Gonzálvez†, Jorge Martínez Torena‡,
Yahzmín Afonzo§, Álvaro Domínguez¶ , Rafael Aguirre††, Sara Parada‡‡,
María del Carmen Saldías§§, Liliana de Dios¶¶, Luis Castillo†††, Inés Álvarez‡‡‡
Clínica Ginecotocológica "C". Prof. J.G. Alonso. Facultad de Medicina. Universidad de la Republica Oriental del Uruguay.
Instituto Nacional de Donación y Trasplantes de Células, Tejidos y Órganos - INDYT.
Centro Hemato-Oncología Pediátrica Hospital Pereira Rossell.
Ministerio de Salud Pública (MSP)
Centro de Hemato-Oncología. Hospital Maciel. MSP.
Hospital Dra. Paulina Luisi. Centro Hospitalario Pereira Rossell. MSP
Resumen
Introducción: el aumento de la tasa de curación de pacientes jóvenes con cáncer hace imprescindible planear estrategias que puedan disminuir las secuelas de los tratamientos. Las repercusiones reproductivas son de las más importantes.
Objetivo: presentar la instrumentación del Programa de Preservación de la Función Ovárica Frente al Cáncer así como publicar el protocolo específico de criopreservación de tejido ovárico aplicado.
Material y método: se tomaron las primeras 15 pacientes en las que, cumpliendo los criterios de inclusión, se optó por la estrategia de criopreservar tejido ovárico previo al inicio de la quimioterapia. En 12 casos se les realizó la criopreservación de un ovario con conservación del otro, con biopsia ovárica bilateral como único procedimiento. En los tres casos restantes se asoció la traslocación heterotópica del otro ovario. Se describe el protocolo de criopreservación utilizado.
Resultados: se realizó el procedimiento en 15 pacientes con distintos tipos de cáncer que requerían tratamiento altamente gonadotóxico. El procedimiento se realizó con éxito en todas.
Discusión y conclusiones: la conjunción del esfuerzo multidisciplinario y multiinstitucional ha puesto en marcha este programa, que instrumenta una técnica aún en desarrollo. Se trata de un procedimiento a implementar dentro de un protocolo específico. Constituye, no obstante y por ahora, la única oportunidad para un grupo seleccionado de pacientes de preservar la función ovárica hormonal y eventualmente reproductiva.
Palabras clave: CRIOPRESERVACION.
OVARIO.
QUIMIOTERAPIA - efectos adversos.
NEOPLASIAS – quimioterapia.
CONSERVACION DE TEJIDO.
* Director del Laboratorio de Criobiología del Banco Nacional de Órganos y Trasplantes. Uruguay.
† Endocrinólogo y Ginecotocólogo. Prof. Adj. Clínica Ginecotocológica "C". Facultad de Medicina, Universidad de la República Oriental del Uruguay.
‡ Ginecólogo. Prof. Agdo. Clínica Ginecotocológica "C". Facultad de Medicina, Universidad de la República Oriental del Uruguay.
§ Especialista en Oncología Pediátrica Centro de Hemato-oncología Pediátrica del Centro Hospitalario Pereira Rossell. Uruguay.
¶ Ginecólogo Especialista en Reproducción Humana. Prof. Adj Clínica Ginecotocológica "C". Facultad de Medicina, Universidad de la República Oriental del Uruguay.
†† Ginecotocólogo. Coordinador Docente del Programa de Educación Médica Continua de la Clínica Ginecotocológica "C". Facultad de Medicina. Universidad de la República Oriental del Uruguay.
‡‡ Médico Ecografista. Unidad de Ecografía Ginecológica, Centro Hospitalario Pereira Rossell. Uruguay.
§§ Asistente Grado 2. INDYT Coordinadora de Control de Calidad del Banco de Tejidos y Sector Crio Preservados.
¶¶ Residente Clínica Ginecotocológica "C". Facultad de Medicina. Universidad de la República Oriental del Uruguay.
††† Director del Centro de Hemato-oncología Pediátrica del Centro Hospitalario Pereira Rossell. Uruguay.
‡‡‡ Directora del Instituto Nacional de Donación y Trasplante de Células, Tejidos y Órganos.
Correspondencia: Dr. Rafael Aguirre
Estomba 3495. Montevideo, Uruguay.
Correo electrónico: raguirre@chasque.net
Recibido: 7/8/06.
Aceptado: 26/3/07.
Introducción
Tasa de curación
En los pacientes jóvenes el avance en los tratamientos oncológicos ha permitido alcanzar cifras de curación importantes. Tanto a nivel nacional como internacional, la tasa de curación global a los cinco años para niños y jóvenes es mayor a 70%, llegando a alcanzar 80% en el caso de las leucemias linfoblásticas agudas y 90% en el caso de los linfomas de Hodgkin(1). Estas altas tasas de curación plantean un problema asociado: las secuelas poscuración y la repercusión endocrino-reproductiva, siendo esta la que más impacta desde el punto de vista psicobiológico. El desarrollo de diferentes estrategias para enfocar este problema está determinando el surgimiento de una nueva disciplina a nivel internacional.
Gonadotoxicidad
Los agentes alquilantes, utilizados comúnmente en la quimioterapia, son particularmente gonadotóxicos y su efecto es acumulativo, además la asociación de varios agentes potencian la toxicidad(2). Los ovarios son también muy sensibles a la radioterapia y se ha establecido un modelo de gonadotoxicidad relacionado a la edad. La dosis esterilizante para 97,5% de las pacientes es de 20 Gy a los 10 años, 18 Gy a los 20 años y 14 Gy a los 30 años(3). Estos cálculos son para dosis definidas como "esterilizantes", pero dosis menores pueden afectar en menor grado la reserva folicular ovárica exponiendo a las pacientes a una falla ovárica precoz (FOP) diferida. De hecho, la dosis necesaria para destruir 50% de los ovocitos es menor a 2 Gy(4). Es especialmente riesgosa la irradiación de las regiones anatómicas próximas a la ubicación del ovario: abdomen (incluida regiones paraaórticas), pelvis (incluida inguinal-ilíaca), espinal, en "Y" invertida y la irradiación del cuerpo entero(4). El potencial gonadotóxico máximo se da en la combinación radio-quimioterapia. Se ha publicado un seguimiento a 20 años de pacientes tratadas con radio y quimioterapia, 42% eran menopáusicas a la edad de 31 años comparado con 5% de la población control(5).
Fertilidad y capital folicular
El capital folicular (CF) es limitado y se reduce espontáneamente con el tiempo. Unos 400 mil folículos existen al momento de la menarca y su disminución progresiva determina una caída de la fertilidad espontánea prácticamente a partir de los 25 años(6). A los 37 años el CF es de 25 mil y la fertilidad decrece más rápidamente a partir de ese momento, sin embargo, las menstruaciones perduran siempre que el número de folículos sea mayor de mil. No obstante, ante una agresión a las gónadas (radiación o quimioterapia) que pueda acelerar la declinación natural del capital folicular el resultado puede ser el desarrollo de una FOP(7).
Muchos oncólogos son optimistas cuando observan que frecuentemente, luego de los tratamientos para el cáncer, sus pacientes jóvenes retoman las menstruaciones en el corto plazo. Sin embargo, recientes estudios publicados, que incluyen seguimientos a largo plazo, señalan que la repercusión en la función reproductiva y endocrina ovárica es mayor de lo pensado inicialmente. Pacientes jóvenes (por su edad biológica y cronológica), como consecuencia de los tratamientos, adquieren una "edad ovárica" mucho mayor, pese a lo cual siguen menstruando. Las pacientes menores de 20 años (las más resistentes a esta secuela) tienen globalmente una probabilidad de entre 20% y 50% de quedar en amenorrea luego del tratamiento (varía según el tipo y la dosis), pero existe un riesgo de 60% de desarrollar una FOP. Quiere decir que muchas pacientes que menstrúan presentan lo que se llama una falla ovárica oculta (FOO). Esto significa que si bien el capital folicular ovárico está por encima del rango crítico para mantener las menstruaciones, está muy por debajo del correspondiente a la edad cronológica(8). La tasa de embarazos espontáneos en este grupo no supera 28%. En pacientes mayores de 20 años la situación es impactante, ya que la tasa de amenorrea es de 80%, la de FOO 90% y hay sólo 5% de embarazos espontáneos(9). En las niñas que requieren trasplante de médula ósea sólo 19% conserva una función ovárica normal, y este porcentaje es virtualmente 0% en las pacientes de más edad(10).
Criopreservación, daño celular y criopreservantes.
Problemas y soluciones
La criobiología ha aportado conocimientos y herramientas de gran utilidad para la preservación de tejidos. El descenso térmico induce el cambio del agua del estado líquido al sólido-cristalino, y al mismo tiempo inhibe el metabolismo celular. El hielo es un solvente prácticamente nulo, por lo cual (al momento del crecimiento del frente sólido cristalino) los solutos del medio se desplazan y concentran en el compartimiento líquido del sistema. La hiperosmolaridad resultante de esta fracción líquida del espacio extracelular determina un fenómeno de deshidratación celular a través de un fenómeno de osmosis pasiva. Es así que el disbalance osmótico resultante determina sufrimiento y muerte celular por alteración de los equilibrios iónicos, con la consiguiente desestabilización de las proteínas celulares y pérdida definitiva de la funcionalidad estereo-química de las mismas. Concomitantemente, el hielo provoca daño y ruptura tisular por expansión mecánica(11) y la hiperosmolaridad del compartimiento líquido modifica las propiedades coligativas del medio, descendiendo la temperatura de cristalización e incrementando la viscosidad. En la formación de cristales y el daño tisular resultante influyen variables tales como el volumen de la muestra, la viscosidad del sistema y la velocidad de enfriamiento(12).
El fenómeno de la cristalización intracelular también contribuye a la desorganización estructural de los organelos, con severos efectos deletéreos sobre los componentes ultraestructurales del tejido. La importancia de la cristalización intracelular es conocida desde los trabajos de Mazur en la década de 1960(13,14). La disminución en la formación de cristales del medio intracelular es condición necesaria (pero no suficiente) para garantizar la viabilidad celular. Es por ello que la velocidad de enfriamiento es una variable esencial para mantener la viabilidad posdescongelado, debido a que el daño celular es muy dependiente del grado de deshidratación del medio intracelular y la formación de cristales intracelulares.
La utilización de aditivos crioconservadores busca la modificación de variables físico-químicas y termodinámicas, evitando el mayor daño posible a la población celular. Sin embargo, se debe recordar que los criopreservantes (CP) también tienen efectos tóxicos sobre los tejidos que son: concentración, dosis, temperatura y tiempo dependientes(15,16).
Básicamente, los crioprotectores protegen el medio biológico por diferentes mecanismos: a) contrarrestando la hiperosmolaridad del compartimiento líquido; b) reduciendo la deshidratación celular y, por tanto, el colapso de las membranas y los organelos; c) minimizando la formación de hielo intracelular.
Existen dos tipos de sustancias crioprotectoras: a) permeables a las membranas celulares, de acción intra y extra celular, con bajo peso molecular, como, por ejemplo, el dimetil sulfóxido (DMSO) o el glicerol; b) polímeros impermeables a las membranas, de acción exclusivamente extracelular y de alto peso molecular, como la polivinilpirrolidona o el hidroxi-etil-stach.
Los crioprotectores permeables como el DMSO actúan a bajas concentraciones (menor a 3 molar). Actúan estabilizando los equilibrios químicos en las membranas celulares por acción electrostática, y a nivel intracelular reduce la formación del hielo intracelular gracias a los cambios en las propiedades coligativas del medio(17,18). Se postula al DMSO como uno de los mejores CP gracias a su capacidad de permeación precongelamiento para el tejido ovárico humano(19).
En relación con la temperatura de almacenamiento, se conoce que a -196º C (temperatura del nitrógeno líquido) no existe ninguna posibilidad de intercambio químico molecular, al no haber suficiente energía química de activación. Esta condición hace, por lo tanto, indefinido el tiempo de almacenamiento a esta temperatura. Para el descongelamiento las técnicas de calentamiento rápidas mediante la inmersión de las muestras congeladas en baño a 37º C (diferencial térmica de 233º C desde el nitrógeno líquido a -196º C), aseguran una tasa de calentamiento suficientemente alta para evitar fenómenos termofísicos generadores de lesión tisular por destrucción celular.
Por último, entre las variables que deben ser consideradas para la mejor viabilidad posdescongelado, se encuentra la dilución osmolar progresivamente decreciente a que debe ser sometido el tejido dentro del líquido descongelado a los efectos de evitar el shock osmótico desde las condiciones de dicho líquido al medio isotónico
La criopreservación del ovario
Los primeros trabajos relacionados con el ovario se recogen de la literatura y fueron realizados en ratas y ratones(20-24). La corteza ovárica alberga una población de folículos primordiales que son poco dañadas por los procedimientos criopreservantes(25). El estudio de la cortical ovárica criopreservada y descongelada utilizando DMSO mostró la normalidad morfológica de sus folículos(26). Estos folículos criopreservados, y luego descongelados, al ser aislados enzimáticamente muestran al microscopio electrónico integridad estructural y viabilidad al usar técnicas específicas de tinción vital(27). El éxito funcional del modelo de criopreservación ovárica se ha demostrado por la restitución de la función reproductiva que se ha observado en protocolos experimentales de ratón con implantes ortotópicos. La criopreservación y autoimplante de tejido ovárico humano genera una sustancial reducción en el tamaño de la población folicular recuperada en el descongelamiento(25). Pero la prueba mayor de la integridad de este tejido es la publicación reciente de dos embarazos luego de reimplantado el tejido ovárico que se había criopreservado(28).
Objetivo
En nuestro país, desde noviembre de 2004 se está implementando un Programa de Preservación de la Función Ovárica frente al Cáncer, que reúne esfuerzos de varias instituciones y disciplinas biomédicas. El objetivo de este artículo es difundir el programa mediante la publicación del protocolo de estudio, sus criterios de inclusión y la casuística correspondiente.
Material y método
Aspectos éticos y legales
El protocolo fue sometido a consideración y finalmente aprobado por el Comité de Ética de la Facultad de Medicina de la Universidad de la República Oriental del Uruguay (expediente N° 071140-000442-05) y por el Instituto Nacional de Donación y Trasplantes de Células, Tejidos y Órganos (INDYT). De esta forma quedan contemplados los requerimientos éticos, de registros y legales necesarios. Luego de iniciado este programa se publicó un consenso de la Federación Internacional de Ginecología y Obstetricia (FIGO), que es coincidente con nuestros criterios(29).
Selección de pacientes
No existe un modo específico mediante el cual se pueda establecer el riesgo preciso de gonadotoxicidad de los tratamientos, por lo que debe considerarse en términos de probabilidades, basadas estas en las consideraciones resultantes de la observación de las series publicadas hasta el momento. La tabla 1 muestra una estimación de riesgo según enfermedad y tratamiento sobre la que hay, en general, acuerdo y que aplica nuestro programa(30).
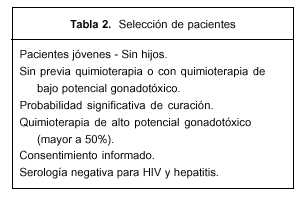
Criterios de inclusión. Hay consenso a nivel internacional sobre los criterios de inclusión, basados en la estimación del riesgo y los beneficios, los que también aplicamos en nuestro protocolo(30). En base a estos criterios se ofrece el procedimiento a las pacientes en las que el riesgo gonadotóxico es muy elevado, pero que además tienen una alta tasa de probabilidades de curación y que por su juventud puede garantizarse la preservación de un capital folicular significativo. La tabla 2 resume estos criterios de inclusión.
Criterios de exclusión. Se excluyen las pacientes infectadas con los virus de VIH y de la hepatitis B, y aquellas que no comprenden o no aceptan el procedimiento.
Luego del tamizaje inicial las pacientes fueron entrevistadas y recibieron una cartilla de información sobre el procedimiento. La decisión final la toma la paciente junto con su familia en un plazo promedio de dos a tres días según las circunstancias. Las pacientes firmaron dos consentimientos informados, uno específico para el programa, y otro en el INDYT, y son incorporadas al sistema propio de registros de este banco, que por su alta calidad garantiza uno de los requerimientos más difíciles, que es el de un sistema de registros eficiente a largo plazo.
Extracción del material
Salvo en un caso (N° 1) en que se extrajo el ovario al momento de la laparotomía para el tratamiento de cáncer de cérvix uterino, en todos los demás se extrajo un ovario mediante laparoscopia quirúrgica o minilaparotomía suprapúbica. El ovario luego es sumergido en líquido para transporte de órganos: RPMI 1640* , más albúmina humana a 10%, a efectos de preservar al máximo las condiciones de nutrición del tejido. Luego es conservado a 0 grado y transportado al INDYT.
Conducta con el ovario restante:
– En el caso N°1, tratándose de un cáncer de cérvix uterino que seguramente iba a requerir radioterapia, y para intentar protegerlo de esta, se translocó a un sitio lo más alejado posible del campo durante la laparotomía.
– En el caso N° 2, también un cáncer de cérvix uterino, el ovario restante se implantó directamente en un sitio heterotópico el (subcutáneo braquial).
– En el caso N° 4, un neuroependimoma recidivado, también se extrajo el segundo ovario y se realizó un trasplante subcutáneo heterotópico en fresco, ya que tanto la dosis como la extensión de la radioterapia que se planeaba realizar no dejaron otra opción.
– En los 12 casos restantes no se realizó ningún procedimiento adicional sobre el segundo ovario.
El único caso de descongelamiento programado es el N°1, en la que se reimplantó 50% del tejido ovárico en el espacio subdérmico braquial derecho.
En todos los casos se enviaron biopsias adicionales de ambos ovarios para la búsqueda de células tumorales y recuento folicular. El tiempo en el transporte del material nunca fue superior a los 20 minutos.
Protocolo de criopreservación
El mismo se desarrolló con el asesoramiento técnico de la Universidad de Barcelona (Dr. Callejo y colaboradores). El tejido cortical ovárico proveniente de cada paciente fue procesado bajo cámara de flujo laminar† en condiciones de estricta asepsia quirúrgica. Se procedió al fraccionamiento de láminas de tejido de 2 a 4 mm de largo por 1 a 2 mm de ancho. Los líquidos de preservación se constituyeron con 85% de RPMI 1640‡ como medio de cultivo, 5% de albúmina humana§ como medio de suplemento y 10% de DMSO¶ como medio criopreservante. El protocolo de impregnación del tejido para los líquidos se realizó por inmersión de los segmentos ováricos en los mismos durante 20 minutos a 4º C bajo agitación mecánica suave, en acuerdo con los protocolos modificados de Callejo y colaboradores(31). Finalmente, dos a tres segmentos por vial se envasaron para un volumen final de 3,5 cc en crioviales estériles de tapa rosca††. Se utilizó el protocolo de congelamiento programado de Callejo(31) mediante equipo Controlled Rate Freezing System‡‡ de acuerdo con los siguientes pasos:
1. 10º a -7º a 2º/min mantenimiento a -7º c durante 10 min
2. -7º a -17º a 0,3º/min.
3. -17º a -25º a 25º/min mantenimiento a -25º durante 5 min
4. -25º a -17º a 15º/min.
5. -17º a - 40º a 0,3º/min.
6. -40º a -140º a 10º/min.
La temperatura de almacenamiento final alcanzada es de -142º C en equipo Mark III§§.
Técnica de descongelamiento
Consiste en:
1. Exposición a temperatura ambiente: 2 min.
2. Exposición a 37º c hasta liquefacción total.
- Cuatro lavados en concentraciones decrecientes de DMSO al 5%, 2,5%, 1,25%, 0% en RPMI durante 5 min cada uno.
Estudio histológico
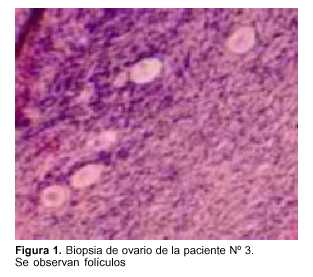
En todas las pacientes se tomaron biopsias de ambos ovarios con dos finalidades, certificar la ausencia de enfermedad de base en el tejido y realizar el conteo de folículos por mm2. Promedialmente se encontraron 12 folículos primordiales por mm2, como el caso de la figura 1. Se trata de la biopsia de la paciente Nº 3 de 31 años con diagnóstico de enfermedad de Hodgkin. No obstante, dada la irregularidad de la distribución folicular dentro de la corteza ovárica, hoy se sabe que estas biopsias son de dudosa utilidad para estimar la reserva ovárica(32). Pese a ello, las biopsias bilaterales continúan siendo de rigor para estudiar la posibilidad de células tumorales en el tejido ovárico.
Resultados
Durante el período noviembre de 2004 a marzo de 2006 (16 meses) ingresaron al programa 15 pacientes de entre 12 y 35 años, referidas de centros hemato-oncológicos, ginecológicos y de oncología pediátrica del Uruguay. La casuística se muestra en la tabla 3. Los casos presentados, en acuerdo con el protocolo aplicado, son pacientes de entre 12 y 35 años, sin hijos, procedentes en seis casos del ámbito privado y en nueve del público.
En cuanto a los diagnósticos oncológicos encontramos dos carcinomas de cérvix uterino con extensión pélvica, seis linfomas de Hodgkin, un linfoma no Hodgkin, cuatro leucemias, una neuroependimima lumbosacro y un cáncer de mama.
En cuanto a las consideraciones especiales de algunos casos destacamos:
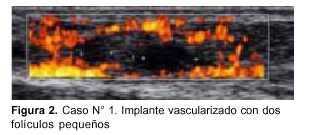
– En el caso N° 1, simultáneamente a la extracción de un ovario para criopreservación, se translocó el otro al espacio subfrénico. A pesar de la translocación y como consecuencia de la radioterapia, la paciente entró en falla ovárica (a los cuatro-cinco meses de finalizada la radioterapia: FSH de 93 mu/ml, estradiol indosificable y claros síntomas de tipo climatérico). Esta paciente solicitó reimplante de tejido ovárico, el que se le realizó injertando 50% del material a un sitio heterotópico (braquial). En la evolución mostró buena vascularización, a los cinco meses se observó crecimiento folicular y recuperación funcional con aumento del estradiol y reducción de la FSH. En la figura 2 se muestra mediante ecografía el implante vascularizado de este caso con dos folículos pequeños.
– En el caso N° 2, una paciente portadora de cáncer de cérvix uterino, se optó por criopreservar un ovario y realizar un autoinjerto heterotópico "en fresco" del tejido del otro ovario, con buena recuperación funcional y reclutamiento folicular a los cuatro meses de intervenida.
– En el caso N° 4, una paciente portadora de una recidiva de un neuroependimoma de ubicación pélvica que, antes de recibir una dosis masiva de radioterapia abdomino-pélvica, se criopreservó un ovario y al otro se le efectuó un trasplante heterotópico en fresco. La radioterapia determinó una falla ovárica aguda (FSH 113 mu/ml y estradiol indosificable), pero el implante subcutáneo braquial al tercer mes demostró recuperación funcional y de maduración folicular, luego de lo cual la paciente reinició los ciclos menstruales.
En los 12 casos restantes se les realizó el procedimiento clásico de criopreservación de un ovario con conservación del otro, con biopsia ovárica bilateral como se muestra en la tabla 3.
Discusión
Del punto de vista biológico y de los resultados reproductivos la mejor forma de preservar la fertilidad en una mujer joven que va a recibir tratamiento quimioterápico gonadotóxico es criopreservar embriones para su posterior transferencia. Sin embargo, este procedimiento tiene grandes limitaciones: a) requiere retardar el tratamiento oncológico para efectuar el estímulo ovárico y la aspiración ovocitaria; b) debe existir una pareja constituida con deseos concepcionales claros; c) se agrega un importante costo adicional al propio de la enfermedad de base; d) la situación psicológica no es apta para esta decisión que es de preocupación por la muerte. Por todo ello, las condiciones propicias para criopreservar embriones se dan excepcionalmente en pacientes tan jóvenes.
Este programa ofrece una oportunidad de bajo costo y menos compleja desde varios puntos de vista (retraso del tratamiento, situación de pareja, psicológica, etcétera). Sin embargo, dado que los resultados obtenidos son aún preliminares, el procedimiento no se debe ofrecer por fuera del protocolo establecido y aprobado. Un gran impulso han tomado programas similares que ya funcionan en Europa y Estados Unidos, por los embarazos logrados de reimplantes ováricos. No obstante, desconocemos realmente cuántos intentos no se han publicado, generando así un sesgo de publicación. De todas formas, se están criopreservando fragmentos ováricos que en algunos casos serán reimplantados dentro de 10, 15 y hasta 20 años. Esto da la posibilidad de mejorar la técnica y sus resultados a la espera que (al igual que con las técnicas de fertilización asistidas en donde sus resultados mejoraron radicalmente con su perfeccionamiento), podamos reimplantar con resultados más ciertos.
No hay duda que con el tiempo conoceremos más sobre las técnicas de reimplante, pero la posibilidad futura de practicarlo sólo se dará si desde ahora conservamos tejido criopreservado. En la tabla 4 se muestran los casos de reimplantes ovárico criopreservado que fueron comunicados, a los que se agrega nuestro caso N° 1.
En nuestra serie no se ha reimplantado ninguna paciente en situación ortotópica con fines de restablecer la fertilidad, y esto no ocurrirá hasta un período de cuatro o cinco años, cuando las pacientes cumplan con criterios de curación. Las publicaciones referidas en la tabla 4 informan casos de reimplantes de tejido ovárico previamente criopreservado, seis de ellos ortotópicos y cuatro heterotópicos, a los que se agrega nuestra paciente (paciente Nº 1)(28,33-39,42). Excepto un caso (Oktay, 2000)(34) en el que al menos se restableció el estatus hormonal, en los demás hubo crecimiento folicular, aun en los trasplantes heterotópicos.
En otro caso (Oktay, 2004)(37) se aspiraron folículos del implante heterotópico durante ocho ciclos consecutivos. Mediante fertilización in vitro (FIV) se lograron varios embriones que, sin embargo, no progresaron al momento de la transferencia. En dos casos de implantes ortotópicos, estos permitieron embarazos con nacidos vivos sanos: en un caso espontáneo (Donnez, 2004)(28) y otro mediante procedimiento de fertilización asistida (Meirow, 2005)(39). No obstante, ha sido cuestionado el caso de Donnez debido a la posibilidad de que el ovario restante (no reimplantado) pueda presentar ovulación esporádica (pese a que se trata de una falla ovárica documentada)(40,41). El caso de Meirow parece indiscutible
Más recientemente una publicación (Oktay, 2006)(42) ha llamado la atención. Presenta el caso de una paciente de 32 años portadora de un linfoma que, previo al tratamiento, se realizó la criopreservación de un ovario. Luego del tratamiento se confirmó una falla ovárica por los siguientes 2,5 años. En ese momento fue trasplantado tejido cortical ovárico al subcutáneo abdominal (heterotópico). Luego de este reimplante se restablecieron las ovulaciones del ovario ortotópico, a tal punto que ocurrió un embarazo espontáneo.
Esto ha cuestionado el concepto tradicional de que el ovario tiene un número limitado de folículos(43). Se está planteando un circuito regenerativo a partir de Stem Cell(44). En esta última publicación de Oktay(42), donde el ovario, luego de una falla ovárica, es "regenerado" después del implante subcutáneo sería explicado por este mecanismo. En ese artículo se plantea la posibilidad de que la quimioterapia lesione no solo los folículos primordiales sino las señales que inducen la regeneración folicular, mecanismo que sería recompuesto al implantar tejido no lesionado. Sin duda, de confirmarse, estaríamos ante un cambio radical en los paradigmas tradicionales de la fisiología ovárica.
Un problema adicional de este tipo de programas es la posibilidad latente de reimplantar células tumorales con el tejido ovárico, sobre todo en algunas leucemias, linfomas y en el cáncer de mama. Si bien el tejido es biopsiado previo a la criopreservación, y los grupos que han reimplantado vuelven a estudiar otro fragmento antes del reim-plante, siempre existe la posibilidad de que en otro segmento ovárico sí existan células tumorales. Sin embargo, este riesgo no debe ser exagerado ni ignorado. Muchos tumores directamente no se relacionan con metástasis ovárica. Se ha discutido este aspecto, y es preciso relacionarlo a la historia natural del tumor y a su estadio. En el caso de cáncer de mama, por ejemplo, está aceptado que en estadios del I al III, si se trata de un carcinoma ductal, no está contraindicada la criopreservación ni el reim-plante(45). Aun en el caso que corroboramos infiltración ovárica continuamos con la criopreservación, es que nuevas técnicas de maduración in vitro de ovocitos están en curso y no sabemos cuándo estarán disponibles(46). En estos casos se podrán aislar los ovocitos del resto del parénquima.
Conclusiones
La presente casuística plasma el protocolo y la instrumentación del Programa de Preservación de la Función Ovárica frente al Cáncer, programa que ha cumplido tanto los pasos éticos (aprobación del Comité de Ética de la Facultad de Medicina), como legales (Instituto Nacional de Donación y Trasplantes de Células, Tejidos y Órganos) y se encuentra en plena aplicación. Con el asesoramiento técnico de la Universidad de Barcelona se ha logrado poner a punto esta técnica que constituye hoy la única oportunidad para un número creciente de pacientes que logran la curación del cáncer.
Las características de largo plazo del protocolo hacen que el control estatal de este programa es –a nuestro parecer– la única garantía de custodia del material biológico durante varios años y a veces por varias décadas en espera de su utilización. La implementación desde el ámbito público es otra novedad, en un programa que ha nacido en la Facultad de Medicina, se ha aplicado desde el Hospital Pereira Rossell y se ha extendido al ámbito privado.
Summary
Background: the improvement of curation rates in young patients with cancer leads to plan strategies that decrease treatment sequelae, specially reproductive repercussions.
Objective: to present the Preservation of the Ovarian Function Program in patients with cancer ant to publish the Cryopreservation of Ovarian Cortex Protocol.
Methods: we included the first 15 patients that met the inclusion criteria, and who would be undergoing cryopreservation of ovarian tissue prior to chimiotherapy.
Cryopreservation of one ovary with bilateral ovarian biopsy as a unique procedure was performed in 12 patients. In the remaining 3 patients, heterotopic translocation was associated with the left ovary. We describe the cryopreservation protocol we used.
Results: successful cryopreservation was performed in 15 patients carriers of diverse cancers who needed gonadotoxic treatment.
Discussion and conclusions: multidisciplinary and multi-institutional efforts have allowed to develop this program that orchestrate a still emerging technique. It is a procedure to be incorporated in a specific protocol. It is for many women, an opportunity to preserve hormonal and occasionaly reproductive ovarian function.
Résumé
Introduction: l’augmentation du taux de guérison de jeunes patientes souffrant de cancer rend indispensable de planifier des stratégies qui puissent diminuer les séquelles des traitements. Les répercutions réproductives sont des plus importantes.
Objectif: présenter la mise en place du Programme de Préservation de la Fonction Ovarienne Face au Cancer, ainsi que de publier le protocole spécifique de cryo-préservation de tissu ovarien appliqué.
Matériel et méthode: on a pris les premières 15 patientes chez qui, en respectant les critères d’inclusion, on a opté par la stratégie de cryopréserver du tissu ovarien avant le commencement de la chimiothérapie. Dans 12 cas, on a réalisé le cryopréservation d’un ovaire avec la conservation de l’autre, avec une biopsie ovarienne bilatérale comme seule procédure. Dans les trois autres cas, on a associé la translocation hétérotopique de l’autre ovaire. On décrit le protocole de cryopréservation utilisé.
Résultats: on a réalisé la procédure sur 15 patients ayant de différents types de cancer qui demandaient un traitement hautement gonadotoxique. La procédure a eu du succès dans tous les cas.
Discussion et conclusions: la conjonction de l’effort multidisciplinaire et multi-institutionnel a mis en œuvre ce programme, qui met en place une technique encore en développement. Il s’agit d’une procédure à mettre en place dans un protocole spécifique. Elle constitue, toutefois et pour l’instant, la seule chance pour un groupe sélectionné de patientes de préserver la fonction ovarienne hormonale et éventuellement, reproductive.
Resumo
Introdução: o aumento da taxa de cura de pacientes jovens com câncer torna imprescindível planejar estratégias que levem à redução das seqüelas dos tratamentos. As reper-cussões reprodutivas estão entre as mais importantes.
Objetivo: apresentar a instrumentação do "Programa de Preservação da Função Ovariana Frente ao Câncer" e publicar o protocolo específico de criopreservação de tecido ovariano aplicado.
Material e método: foram incluídas as primeiras 15 pacientes nas quais, obedecendo aos critérios de inclusão, foi decidido criopreservar tecido de ovário antes do início da quimioterapia. Em 12 casos foi feita a criopreservação de um ovário com conservação do outro, com biópsia bilateral de ovário como único procedimento. Nos outros três casos foi feita a associação da traslocação heterotópica do outro ovário. Faz-se a descrição do protocolo de criopreservação utilizado.
Resultados: o procedimento foi bem sucedido nas 15 pacientes com diferentes tipos de câncer que necessitavam tratamento gonadotóxico.
Discussão e conclusões: a conjunção de um esforço multiprofissional e multiinstitucional pôs em marcha este programa que instrumenta uma técnica ainda em fase de desenvolvimento. É um procedimento que deve ser implementado de acordo com um protocolo específico. No entanto, e por enquanto, é a única oportunidade de preservar a função ovariana hormonal e eventualmente reprodutiva em um determinado grupo de pacientes.
Bibliografía
1. Sklar C. Endocrine complications of the successful treatment of neoplastic diseases in childhood. GGH 2001; 17(3): 37. Obtenido de: http://gghjournal.com.
2. Chiarelli A, Marrett L, Darlington G. Early menopause and infertility in females after treatment for childhood cancer diagnosed in 1964-1988 in Ontario, Canada. Am J Epidemiol 1999; 150: 245-54.
3. Wallace W , Thomson AB, Saran F , Kelsey T. Predicting age of ovarian failure after radiation to a field that includes the ovaries. Int J Radiat Oncol Biol Phys 2005; 62(3): 738-44.
4. Wallace W, Thomson A, Kelsey T. The radiosensitivity of the human oocyte. Hum Reprod 2003; 18(1): 117-21.
5. Byrne J, Fears T, Gail M, Pee D, Connelly R, Austin D, et al. Early menopause in long-term survivors of cancer during adolescence. Am J Obstet Gynecol 1992; 166: 788-93.
6. Coppola F, Nader J. Visión neuroendócrina de la menopausia. Arch Ginecol Obstet 2002; 40(3): 129-33.
7. Faddy M, Gosden R, Gougeon A, Richardson S, Nelson J. Accelerated disappearance of ovarian follicles in mid-life: implications for forecasting menopause. Hum Reprod 1992; 7(10): 1342-6.
8. Larsen E, Müller J, Rechnitzer C, Schmiegelow K, Andersen A. Diminished ovarian reserve in female childhood cancer survivors with regular menstrual cycles and basal FSH <10 IU/l. Hum Reprod 2003; 18: 417-22.
9. Clark S, Redford J, Crowther D, Swindell R, Shale S. Gonadal function following chemotherapy for Hodgkin’s disease: a comparative study of MVPP and a seven-drug hybrid regimen. J Clin Oncol 1995; 13: 134-9.
10. Meirow D. Reproduction post-chemotherapy in young cancer patients. Mol Cell Endocrinol 2000; 169: 123-31.
11. Lovelock J. The haemolysis of human red blood-cells by freezing and thawing. Biochem Biophys Acta 1953; 10: 414-26.
12. Arav A, Zeron Y, Ocheretny A. A new device and method for vitrification increases the cooling rate and allows successful cryopreservation of bovine oocytes. Theriogenology 2000; 53(1): 248.
13. Mazur P. Kinetics of water loss from cells at subzero temperatures and the likelihood of intracellular freezing. J Gen Physiol 1963; 47: 347-69.
14. Mazur P. Freezing of living cells: mechanisms and implications. Am J Physiol 1984; 247(3 Pt1): C125-42.
15. Fahy GM. The relevance of cryoprotectant "toxicity" to cryobilogy. Cryobilogy 1986; 23: 1-13.
16. Karow A. Biological effects of cryoprotectant perfusion, delivery and removal to nonfroze organ. In: Pegg D, Karow A Jr. ed. The biophysics of organ preservation. NewYork: Plenum, 1987: 25-41.
17. Anchordoguy T, Cecchini C, Croswe J. Insights into the cryoprotective mechanism of dimethyl sulfoxide for phospholid bilayers. Cryobiology 1991; 28: 467-73.
18. McGann L. Differing actions of penetrating and nonpenetrating cryoprotective agents. Cryobiology 1978; 15: 382-90.
19. Fahy G, MacFarlane D, Angell C, Meryman H. Vitrification as an approach to cryopreservation. Cryobiology 1984: 407-26.
20. Parkes A, Smith A. Regeneration of rat ovarian tissue grafted after exposure to low temperatures. Proc R Soc Lond B Biol Sci 1953; 140: 455-67.
21. Parkes A. Grafting of mouse ovarian tissue after freezing and thawing. J Endocrinol 1956; 14(3): 30-1.
22. Parkes A. Viability of ovarian tissue after freezing. Proc R Soc Lond B Biol Sci 1957; 147: 520-8.
23. Deanesly R. Immature rat ovaries grafted after freezing and thawing. J Endocrinol 1954; 11: 197-200.
24. Deanesly R, Parkes A. Delayed development of grafts from frozen ovarian tissue. J Endocrinol 1956; 14: 35-6.
25. Newton H. The cryopreservation of ovarian tissue as a strategy for preserving the fertility of cancer patients. Hum Reprod Update 1998; 4(3): 237-47.
26. Hovatta O, Silye R, Krausz T, Abrir R, Margara R, Trew G, et al. Cryopreservation of human ovarian tissue using dime-thyulsulphoxide and propanediol-sucrose as cryporotectans. Hum Reprod 1996; 45: 898-906.
27. Oktay K, Nugent D, Newton H, Salha O, Chatterjee P, Gosden R. Isolation and characterisation of primordial follicles from fresh and cryopreserved human ovarian tissue. Fertil Steril 1997; 67: 481-6.
28. Donnez J, Dolmans M, Demylle D, Jadoul P, Pirard C, Squifflet J, et al. Livebirth after orthotopic transplantation of cryopreserved ovarian tissue. Lancet 2004; 364(9443): 1405-10.
29. FIGO Committee for the Ethical Aspects of Human Reproduction and Women’s Health. Ethical considerations and recommendations on oocyte and ovarian cryopreservation. Int J Gynaecol Obstet 2006; 92(3): 335-6.
30. Multidisciplinary Working Group convened by the British Fertility Society. A strategy for fertility services for survivors of childhood cancer. Hum Fertil (Camb) 2003; 6: A1-A39.
31. Callejo J, Salvador C, Miralles A, Vilaseca S, Lailla JM, Balasch J. Long-term ovarian function evaluation after autografting by implantation with fresh and frozen-thawed human ovarian tissue. J Clin Endocrinol Metab 2001; 86(9): 4489-94.
32. Schmidt K, Byskov A, Nyboe Andersen A, Mueller J, Yding Andersen C. Density and distribution of primordial follicles in single pieces of cortex from 21 patients and in individual pieces of cortex from three entire human ovaries. Human Reprod 2003; 18(6):1158-64.
33. Oktay K, Gosden R, Schwarz R. Ovarian function after autologus transplantation of frozen-banked human ovarian tissue. ASRM 1999. Toronto, Ontario, Canada.
34. Oktay K, Karlikaya G. Ovarian function after transplantation of frozen, banked autologous ovarian tissue. N Engl J Med 2000; 342: 1919.
35. Radford J, Liebermann B, Brison D, Smith A, Critchlow J, Russell S, et al. Orthotopic reimplantation of cryopreserved ovarian cortical strips after high-dose chemotherapy for Hodgkin’s lymphoma. Lancet 2001; 357: 1172-5.
36. Kim S, Hwang I, Lee H. Heterotopic autotransplantation of cryobanked human ovarian tissue as a strategy to restore ovarian function. Fertil Steril 2004; 82(4): 930-2.
37. Oktay K, Buyuk E, Veeck L, Zaninivic N, Xu K, Takeuchi T, et al. Embryo development after heterotopic transplantation of cryopreserved ovarian tissue. Lancet 2004; 363: 837-40.
38. Kirsten L, Schmidt T, Yding Andersen C, Starup J, Loft A, Grete Byskov A, et al. Orthotopic autotransplantation of cryopreserved ovarian tissue to a woman cured of cancer-follicular growth, steroid production and oocyte retrieval Reproductive Bio Medicine Online 2004; 8(4): 448-53.
39. Meirow D, Levron J, Eldar-Geva T, Hardan I, Fridman E, Zalel Y, et al. Pregnancy after Transplantation of Cryopreserved Ovarian Tissue in a Patient with Ovarian Failure after Chemotherapy. BMJ 2005; 353(3): 318-21.
40. Wallace W, Pritchard J. Livebirth after cryopreserved ovarian tissue autotransplantation. Lancet 2004; 364: 2093-4.
41. Oktay K, Tilly J. Livebirth after cryopreserved ovarian tissue autotransplantation. Lancet 2004; 364: 2091-2.
42. Oktay K. Spontaneous conceptions and live birth after heterotopic ovarian transplantation: is there a germline stem cell connection? Hum Reprod 2006; 21: 1345-8.
43. Johnson J, Canning J, Kaneko T, Pru J, Tilly J. Germline stem cells and follicular renewal in the postnatal mammalian ovary. Nature 2004; 428: 145-50.
44. Johnson J, Bagley J, Skaznik-Wikiel M, Lee H, Adams G, Niikura Y, et al. Oocyte generation in adult mammalian ovaries by putative germ cells in bone marrow and peripheral blood. Cell 2005; 122: 303-15.
45. Oktay K, Sonmezer M. Ovarian tissue banking for cancer patients: fertility preservation, not just ovarian cryopreservation. Hum Reprod 2004; 19(3): 477-80.
46. Abir R, Nitke S, Ben-Haroush A, Fisch B. In vitro maturation of human primordial ovarian follicles: clinical significance, progress in mammals, and methods for growth evaluation. Histol Histopathol 2006; 21(8): 887-98.