Services on Demand
Journal
Article
Related links
Share
Revista Médica del Uruguay
On-line version ISSN 1688-0390
Rev. Méd. Urug. vol.22 no.4 Montevideo Dec. 2006
Asociación de hemoglobina S (HbS) y beta talasemia en dos pacientes del Centro Hemato-Oncológico del Hospital Pereira Rossell
Magíster Julio Abayubá da Luz*, Dra. María Delia Góngora†,
Lic. Elza Miyuki Kimura‡, Dres. María Fátima Sonati§, Fernando Ferreira Costa¶, Mónica Sans††
Departamento de Genética, Facultad de Medicina. Centro Hemato-Oncológico del Hospital Pereira Rossell.
Departamento de Patología Clínica. Facultad de Ciencias Médicas. Universidad Estadual de Campinas, Brasil. Hemocentro. Facultad de Ciencias Médicas. Universidad Estadual de Campinas, Brasil. Departamento de Antropología Biológica. Facultad de Humanidades y Ciencias de la Educación. Universidad de la República Oriental del Uruguay
Resumen
La asociación del alelo bS que produce hemoglobina S (HbS) y de un alelo de beta talasemia (btal), ocurre principalmente en poblaciones que tienen simultáneamente ascendencia africana y mediterránea, y provoca un síndrome drepanocítico denominado HbS-beta talasemia. Este síndrome presenta una gran heterogeneidad clínica y genética debida en gran parte al alelo talasémico presente. Los individuos que portan un alelo talasémico b0 presentan, en general, un curso clínico similar a los homocigotas para el alelo bS de la HbS. En cambio, los que portan un alelo b+ presentan un curso clínico variable, dependiendo de la reducción en la síntesis de cadena de beta globina. En este estudio se describe el caso clínico de dos pacientes con HbS-beta talasemia que consultaron en el Centro Hemato-Oncológico Pediátrico del Hospital Pereira Rossell. Se analizó el genotipo de los dos pacientes por medio de secuenciación automática del gen de la beta globina. Se demostró la presencia del alelo talasémico b+ IVS-1-110 G®A en uno de los pacientes y del alelo b0 codón39 C®T en el otro paciente, por lo cual ambos son heterocigotos compuestos bS/btal. Se discute la relación entre los datos clínicos y paraclínicos con los resultados del diagnóstico molecular. También se discute la importancia del diagnóstico molecular en relación con la composición y estructura de la población uruguaya.
Palabras clave: hemoglobinopatías.
BETATALASEMIA.
URUGUAY.
* Asistente del Departamento de Genética, Facultad de Medicina. Universidad de la República.
† Médico Laboratorista del Centro Hemato-Oncológico Pediátrico del Hospital Pereira Rossell. Ex Asistente de Laboratorio Clínico. Orientación Hematogía y Citología.
‡ Jefa del Laboratorio de Hemoglobinas. Departamento de Patología Clínica. Facultad de Ciencias Médicas. Universidad Estadual de Campinas. Brasil.
§ Profesora del Departamento de Patología Clínica. Facultad de Ciencias Médicas. Universidad Estadual de Campinas. Brasil.
¶ Profesor Titular del Hemocentro. Facultad de Ciencias Médicas. Universidad Estadual de Campinas. Brasil.
†† Profesora Agregada y Directora del Departamento de Antropología Biológica, Facultad de Humanidades y Ciencias de la Educación. Universidad de la República.
Instituciones responsables: Departamento de Genética, Facultad de Medicina. Centro Hemato-Oncológico del Hospital Pereira Rossell.
Correspondencia: Julio Abayubá da Luz
Gral. Flores 2125. Montevideo, Uruguay
Correo electrónico: jdal@fmed.edu.uy
Recibido: 19/1/06.
Aceptado: 28/8/06.
Este trabajo fue parcialmente financiado por PEDECIBA (Uruguay) y la Fundación de Amparo a la Investigación del Estado de San Pablo-FAPESP (subsidio 02/13801-7) (Brasil).
Introducción
La hemoglobina S (HbS)-beta talasemia es un síndrome drepanocítico que afecta principalmente a personas que presentan simultáneamente ascendencia africana y de los países del Mediterráneo. Esta enfermedad se debe a la herencia del alelo bS de la HbS y de un alelo de beta talasemia (btal). La mutación que produce la HbS así como las que producen beta talasemias se encuentran en el gen de la beta globina (b), por lo cual son alélicas entre sí. Este gen forma parte de un cluster de genes ubicado en el brazo corto del cromosoma 11 (11p.15.5) y que presenta cinco genes activos: e, el cual codifica las cadenas de beta globina de las hemoglobinas embrionarias Gg y Ag, que codifican las cadenas de beta globina de la hemoglobina fetal; y d y b, que codifican las cadenas de beta globina de la hemoglobina A2 (HbA2) y A (HbA) del adulto, respectivamente. Todos los genes de las globinas presentan una estructura similar con tres exones y dos intrones. Los dos tipos de mutaciones mencionados afectan al gen b, cuyo producto (las cadenas de beta globina) junto con las cadenas de alfa globinas, forman la molécula de hemoglobina del adulto (HbA), la cual constituye aproximadamente 98% de la hemoglobina total. Por lo tanto, los individuos que presentan el alelo bS y una mutación que produzca beta talasemia, no tienen genes normales para producir beta globina(1).
A nivel molecular la mutación que produce la HbS presenta un cambio de una base (A a T) en el primer exón, en la posición 2 del codón 6 del gen b (GAG®GTG), lo cual produce una sustitución de ácido glutámico por valina en la sexta posición de la cadena de beta globina. A diferencia de la HbS, existen muchas mutaciones distintas que producen beta talasemias. Estas se encuentran distribuidas a lo largo de todo el gen b. Sin embargo, las mutaciones más frecuentes en poblaciones mediterráneas se encuentran en el primer exón y en el primer intrón. Aunque menos frecuentes que en poblaciones mediterráneas, las poblaciones africanas también presentan mutaciones de beta talasemia, ubicadas principalmente en la región promotora del gen b. Actualmente se conocen más de 200 alelos distintos que producen beta talasemias, que se clasifican como b0 cuando no hay producción de cadenas de beta globinas, y b+ cuando hay reducción en la producción de las cadenas de globinas(1-3).
La enfermedad producida por la asociación de HbS y beta talasemia es muy heterogénea, tanto clínica como genéticamente, lo que en parte se debe al alelo talasémico del cual se trate: mientras que los pacientes con un alelo b0 presentan manifestaciones clínicas muy similares a los individuos homocigotos para la HbS, los pacientes con alelos b+ presentan, en general, manifestaciones clínicas variables dependiendo de la cuantía de la reducción en la producción de cadenas de beta globina. La frecuencia de la HbS-beta talasemia depende de las frecuencias de los alelos bS y btal en la población, así como de la subestructuración y pautas matrimoniales de la misma.
En Uruguay no existen antecedentes acerca de la asociación de estas dos formas alélicas, ni tampoco acerca de las frecuencias de los alelos bS, b0 o b+ en la población. En un estudio previo realizado en la subpoblación de ascendencia africana se encontró una frecuencia de 10% de portadores de bS(4). Por otra parte, un estudio sobre la población de Buenos Aires estimó la incidencia de portadores btal en 0,8%, mientras que la frecuencia de estos portadores en España e Italia, de donde proviene la mayor parte de la población de origen europeo de Uruguay, se encuentra entre 2% y 19%(2-5,6).
En este trabajo presentamos los datos hematológicos y las bases moleculares del estudio de dos pacientes con HbS-beta talasemia del Centro Hemato-Oncológico Pediátrico del Hospital Pereira Rossell.
Casos clínicos
Pacientes
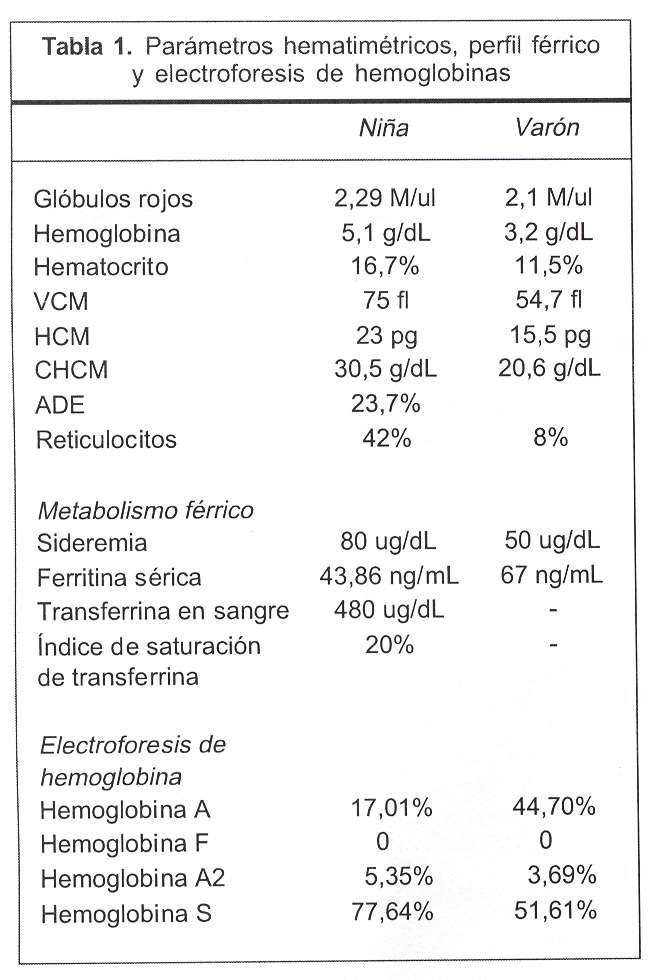
En octubre de 1997, una niña de 7 años, de piel blanca, cabello rubio y ojos azules, pero con ascendencia africana por vía paterna, procedente de Paysandú, es enviada al Hospital Pediátrico del Centro Hospitalario Pereira Rossell (CHPR) presentando un cuadro febril sin foco clínico evidente, palidez cutáneo-mucosa y esplenomegalia grado III de consistencia aumentada, por lo que consulta en el Centro Hemato-Oncológico Pediátrico. Los datos hematológicos muestran anemia microcítica e hipocrómica (tabla 1), observándose en lámina anisopoiquilocitosis con hipocromía, presencia de drepanocitos, policromatofilia y cuatro eritroblastos cada 100 glóbulos blancos. El perfil férrico fue normal. El test de Coombs indirecto fue negativo al igual que el test de criohemólisis hipertónica de Streichmann para el diagnóstico de esferocitosis hereditaria. El análisis de hemoglobina mostró la presencia de HbS, HbA y aumento de HbA2 (tabla 1). Se controló periódicamente en el Centro Hemato-Oncológico Pediátrico, observándose elementos de hiperesplenismo vinculados a su esplenomegalia.
En noviembre de 2000, un niño de 15 meses con ascendencia paterna africana y materna de origen incierto, es enviado al Hospital Pediátrico del CHPR por un cuadro de tres días de evolución caracterizado por fiebre, decaimiento e intensa palidez cutáneo-mucosa y esplenomegalia, por lo que consulta en el Centro Hemato-Oncológico Pediátrico. Los datos hematológicos muestran anemia microcítica e hipocrómica (tabla 1), observándose en lámina anisopoiquilocitosis con presencia de drepanocitos. El perfil férrico se encontraba dentro de los valores esperados para la edad. El test de Coombs indirecto y el test de criohemólisis hipertónica de Streichmann fueron negativos. El test de falciformación provocada fue positivo. El análisis de hemoglobinas fue realizado postransfusionalmente, mostrando la presencia de HbS, HbA y aumento moderado de HbA2 (tabla 1).
Material y método
Se realizó la extracción de ácido desoxirribonucleico a partir de leucocitos de sangre periférica utilizando protocolos estandarizados de extracción salina y precipitación con etanol(7). Mediante la técnica de replicación en cadena de polimerasa (PCR)(8), se amplificó un fragmento del gen de la beta globina de 770 pb comprendido entre las posiciones -161 del promotor y la 115 del intrón 2, el cual fue secuenciado automáticamente utilizando el kit de secuenciación Big Dye Terminator versión II (Applied Byosistems), usando un cebador interno localizado en la posición +2 con relación al sitio de inicio de la transcripción(9). Adicionalmente se analizó por PCR la presencia de alelos de alfa talasemia, ya que estos pueden ser factores que mejoren el curso clínico de estos pacientes(10).
Resultados
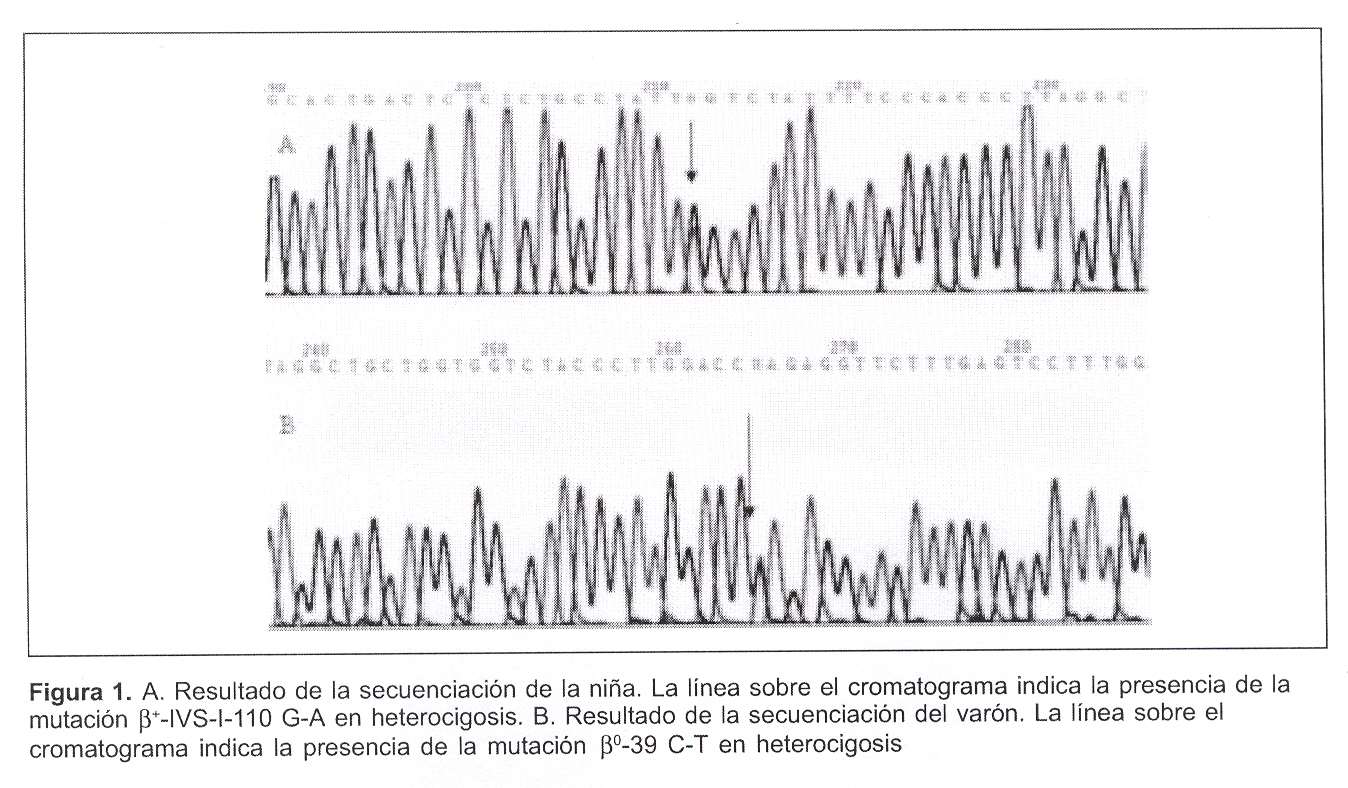
En la niña la secuenciación mostró la presencia de la mutación que produce HbS en estado heterocigota y la presencia de la mutación talasémica en la posición 110 del intrón 1 (b+IVS-I-110 G®A) (figura 1). Esta mutación genera un sitio de "splicing" alternativo, lo cual reduce la formación de los ARNm normales y, por lo tanto, de las cadenas de beta globina adulta normales(3). Por ende, al ser esta paciente heterocigota compuesta HbS/b+tal, uno de los alelos codifica para la cadena de beta globina con la mutación de la HbS, mientras que el otro alelo, aunque puede sintetizar una cadena de beta globina normal, lo hace en cantidades reducidas.
En el niño la secuenciación manifestó también la presencia de la mutación para HbS en estado heterocigota, a la cual se agrega la presencia de la mutación talasémica en la posición 1 del codón 39, CAG/TAG (b0-39 C®T) (figura 1). Esta mutación genera un codón de terminación, lo cual impide la síntesis de la cadena de beta globina(3). Este paciente es, por lo tanto, un heterocigota compuesto para HbS/b0tal, por lo cual la única cadena de beta globina sintetizada es la que forma la HbS.
En ambos pacientes se excluyó la presencia de los alelos de alfa talasemia más frecuentes en poblaciones africanas y mediterráneas.
Discusión
Las dos mutaciones talasémicas que presentan estos pacientes son características de poblaciones mediterráneas. En España e Italia la mutación del codón 39, encontrada en el varón, es la más frecuente de las mutaciones de beta talasemia (31,2% y 40,1%, respectivamente), mientras que la mutación IVS-I-110 de la otra paciente es la cuarta más frecuente en España (8,1%) y la segunda en Italia (23%)(2-6). En Argentina y Brasil estas dos mutaciones son las más frecuentes, siendo aproximadamente entre 70% y 85% de todas las mutaciones beta talasémicas observadas en estos países(11). Teniendo en cuenta que la población uruguaya de origen europeo procede principalmente de España e Italia, era esperable encontrar estas mutaciones en pacientes con HbS-beta talasemias así como en pacientes con beta talasemias.
Al contrario de las talasemias, los síndromes drepanocíticos son habitualmente asociados a personas de ascendencia africana homocigotos para el alelo bS, aunque este también está presente en poblaciones mediterráneas (Italia, España, etcétera). La frecuencia de este alelo en el sur de Italia es de 2% y se han observado pacientes homocigotas sin ascendencia ni apariencia fenotípica africana evidente(12).
Aunque en la mayoría de los países se conoce la incidencia de la HbS y de la beta talasemia separadamente, son muy escasos los datos sobre la incidencia de la HbS-beta talasemia. En Brasil la mayor parte de los individuos con HbS-beta talasemia portan un alelo b0 presentando un cuadro clínico severo(13).
En relación con Uruguay, se ha visto que la frecuencia de genes africanos varía de 20% en Tacuarembó a 8% en Montevideo, con un valor similar a este último para todo el país (3%-5%)(14,15). La distribución de estos genes en la población, además de variar por región, presenta valores diferentes en distintos sectores de aquélla, llegando a ser cerca de 50% en personas autoidentificadas como afro-descendientes(4-16). Sobre la heterogeneidad dentro de una misma población actúan, por ejemplo, las pautas matrimoniales, ya que a mayor consanguinidad y endogamia aumenta la posibilidad de homocigosis. A principios del siglo XX había una preferencia hacia los matrimonios entre los individuos del mismo origen, con los mayores índices de endogamia para italianos (0,713), franceses (0,675) y españoles (0,506)(17). Sin embargo, esta tendencia endogámica ha ido disminuyendo con el correr del siglo, aumentando el número de matrimonios entre individuos con ascendencia africana y aquellos con ascendencia mediterránea, lo cual puede favorecer la aparición de los síndromes drepanocíticos debido a HbS-beta talasemia. Es interesante notar que, si bien la endogamia favorece la homocigosis, la exogamia favorece la presencia de enfermedades que tienen un origen combinado, como en el caso de la HbS/beta talasemia que, en general, se asocia a ascendencia africana y mediterránea conjuntamente. Otro aspecto a resaltar es que en estos casos no siempre se observan las características fenotípicas que indican ambas ascendencias, ya que pueden estar muy lejanas en el tiempo, como es el caso de la niña, donde la ascendencia africana no es notoria. Por esto, no es posible descartar de antemano la existencia de ancestros de orígenes diversos.
El aumento de HbA2 observado en la electroforesis de hemoglobinas junto con la presencia de HbS en los dos pacientes es sugestivo de asociación de HbS y beta talasemia. En el varón el incremento moderado de HbA2 puede estar subestimado ya que la electroforesis de hemoglobinas fue realizada postransfusión, lo que diluye las hemoglobinas del receptor. Otro hallazgo clínico poco frecuente observado en estos dos pacientes es el aumento en el tamaño del bazo (esplenomegalia) mantenido en el tiempo, que en los homocigotos para la HbS generalmente decrece con la edad.
Los datos hematimétricos observados son difíciles de vincular a una única causa de anemia en estos pacientes, ya que aunque la beta talasemia puede reducir los valores de volumen corpuscular medio y hemoglogina corpuscular media, la hemólisis producida por causa de la HbS aumenta los reticulocitos circulantes, lo cual puede compensar la reducción en los valores antes mencionados. Sin embargo, el aumento de la reticulocitosis encontrado en ambos pacientes es indicativo de un proceso hemolítico, el cual puede ser debido a factores hereditarios o ambientales(18).
Como conclusión debemos subrayar que el diagnóstico molecular de pacientes con HbS-beta talasemia es importante para la realización de un adecuado asesoramiento genético a los familiares así como también para predecir el curso de la enfermedad, ya que la mayor parte de la heterogeneidad clínica es debida al alelo talasémico presente.
Agradecimientos
Agradecemos especialmente a Dulcineia Martins de Albuquerque por el apoyo técnico brindado.
Summary
Association between allele bS that produces hemoglobin S and allele (btal) is mainly seen in African and Mediterranean populations, it causes the HbS-beta-thalassemia syndrome. This syndrome shows a wide range of clinical and genetic forms due mostly to the thalassemic allele. Carriers of thalassemic allele b0 generally follow a similar clinical course to homocygote for talasémico bS of the HbS. On the other hand, carriers of b+ allele follow a variable clinical course, depending on the reduction of beta-globin chain. This study describe two clinical cases of patients with HbS-beta thalassemia of the Hematologic and Oncologic Centre of the Pereira Rossell Hospital.
Genotypes of patients were analysed using automatic sequences of beta globin gen. Thalassemia allele b+ IVS-1-110 G®A was seen in one patient and allele b0 codon39 C®T in the other, so that both are compound heterozygous bS/btal.
Clinical and paraclinical data is compared with molecular diagnostic findings; the importance of the molecular diagnosis in Uruguayan population is also discussed.
Résumé
L´association de l´allèle bS qui produit hémoglobine S (HbS) et d´un allèle de bêta tallasémie (btal), arrive surtout chez des individus noirs d´Afrique et méditerranéens, et provoque un syndrome drépanocytaire appelé HbS-bêta tallasémie. Ce syndrome présente une grande hétérogé-néité clinique et génétique dûe surtout à l´allèle tallasémi-que présent. Les individus porteurs d´un allèle tallasémque b0 présentent en général,un cours clinique semblable aux homozygotes pour l´allèle bS de la HbS. En revanche, ceux qui portent un allèle b+ ont un cours clinique variable qui dépend de la réduction à la synthèse de la chaîne de beta globine.
On décrit ici le cas de deux patients avec HbS-bêta tallasémie ayant consulté le Centre Hémato- Oncologique Pédiatrique de l´Hôpital Pereira Rossell. On analyse le génotype de deux patients au moyen de séquencement automatique du gène de bêta globine. On constate la présence de l´allèle tallasémique â+IVS-1-110G®A chez l´un des patients et de l´allèle b0 codon 39C®T chez l´autre. Les deux sont donc hétérozygotes composés bS/btal. On discute ici le rapport entre les données cliniques et para cliniques et les résultats du diagnostic moléculaire.
Resumo
A associação do alelo bS que produz hemoglobina S (HbS) e de um alelo de beta talassemia btal se dá principalmente em populações com ascendência africana e mediterrânea simultáneamente e provoca uma síndrome drepanocítica denominada HbS-beta talasemia. Esta síndrome apresenta uma grande heterogeneidade clínica e genética devida principalmente ao alelo para talassemia presente. Os indivíduos que são portadores de un alelo talassémico b0 apresentam de maneira geral uma evolução clínica semelhante aos homozigotos para o alelo bS da HbS. Por outro lado, os portadores do alelo b+ apresentam um quadro clínico variável, dependendo da redução na síntese da cadeia beta-globina. Neste trabalho descrevemos os casos clínicos de dois pacientes com talassemia HbS.beta que foram admitidos no Centro Hemato-Oncológico Pediátrico do Hospital Pereira Rossel. O genotipo dos pacientes foi analizado pela sequenciação automática do gen da beta globina. A presença do alelo para talassemia b+ IVS-1-110 G®A em um dos pacientes e do alelo b0 codon39 C®T no outro foi demonstrada sendo os dois, por tanto, heterozi-gotos compostos bS/btal. Discute-se a relação entre os dados clínicos e paraclínicos com os resultados do diagnóstico molecular. Também se discute a importância do diagnóstico molecular em relação a composição e estrutura da população uruguaya.
Bibliografía
1. Steimberg M. ed. Disorders of hemoglobin: genetics, pathophysiology, and clinical management. Cambridge: Cambridge University Press, 2001: 1235.
2. Weatherall DJ, Clegg J. Inherited haemoglobin disorders: an increasing global health problem. Bull World Health Organ 2001; 79: 704-12.
3. Huisman T, Carver M, Baysal E. A Syllabus of thalassemia mutations. 1997. Obtenido de: http://globin.cse.psu.edu/html/huisman/thals/ contents.html. (Consulta: dic 2005).
4. Luz J. da Caracterización genética de los loci de las a y b-globinas en dos sub-poblaciones afro-uruguayas. (Tesis para el Magister en Biología-Genética). Montevideo: PEDECIBA, 2004.
5. Abreu M, Peñalver J. Hemoglobinopatías en la Argentina. Medicina 1992; 52: 341-6.
6. Villegas A, Ropero P, González F, Anguita E, Espinos D. The thalassemia syndromes: molecular characterization in the Spanish population. Hemoglobin 2001; 25: 273-83.
7. Sambrook J, Fritsch E, Maniatis T. Molecular cloning: a laboratory manual. 2 ed. New York : Cold Spring Harbor Laboratory Press, 1989: 900-62. v.2.
8. Saiki R, Gelfand H, Stoffell B, Scharf S, Higuchi R, Horn G, et al. Primer-directed enzymatic amplification of DNA with a thermostable DNA polymerase. Science 1988; 39: 487-91.
9. Miranda S, Fonseca S, Figueiredo M, Grotto H, Kimura E, Saad S, et al. Hb Köln (a2ß298(FG5) Val®Met) identified by DNA analysis in a Brazilian family. Braz J Genet 1997; 20: 745-8.
10. Oron-Karni V, Filon D, Oppenheim A, Rund D. Rapid detection of the common Mediterranean a-globin deletions/rearrangements using PCR. Am J Hematol 1998; 58: 306-10.
11. Roldan A, Gutiérrez M, Cygler A, Bonduel M, Sciuccati G, Feliu Torres A. Molecular characterization of b-thalassemia genes in an Argentine population. Am J Hematol 1997; 54: 179-82.
12. Russo G, Schiliro G. Sickle cell anemia and S-thalassemia in Sicilian children. 2003. Obtenido de: http://www.sicklecellsociety.org/resrep/res14.htm. (Consulta: dic 2005).
13. Sonati MF, Kaeda J, Kimura EM, Ferreira Costa F, Luzzatto L. Mild clinical expression of S-b thalassemia in a Brazilian patient with the b+ IVS-I-6 (T®C) mutation. Genet Mol Biol 1998; 21(4): 431-3.
14. Sans M, Salzano FM, Chakraborty R. Historical genetics in Uruguay: estimates of biological origins and their problems. Hum Biol 1997; 161-70.
15. Hidalgo PC, Bengochea M, Abilleira, Cabrera A, Álvarez I. Genetic admixture estimate in the Uruguayan population based on the loci LDLR, GYPA, HBGG, Gc and D7S8. Int J Hum Genet 2005; 5: 217-22.
16. Sans M, Weimer TA, Franco MHLP, Salzano FM, Bentancor N, Álvarez NO, et al. Unequal contributions of male and female gene pools from parentals populations in the african descendents of the city of Melo, Uruguay. Am J Phys Anthropol 2002; 118: 33-44.
17. Barreto I, Sans M. Endogamia y consanguinidad en la población uruguaya: los inmigrantes y sus pautas matrimoniales. In: Varela TA. ed. Investigaciones en biodiversidad humana. Santiago de Compostela: Universidad de Santiago de Compostela, 2000: 28-34.
18. Sans-Sabrafen J, Besses Raebel C, Vives Corrons J. Hematología clínica. 4 ed. Barcelona: Harcourt, 2001: 183-222.