Services on Demand
Journal
Article
Related links
Share
Revista Médica del Uruguay
On-line version ISSN 1688-0390
Rev. Méd. Urug. vol.21 no.4 Montevideo Dec. 2005
Fibrilación auricular: más vale prevenir que tratar
Dres. Gabriel Vanerio Balbela*, Daniel Banina Aguerre†,
Juan Luis Vidal Amaral*, Pablo Fernández Banizi*,
Ana Vanerio de León†, Gustavo López Achigar‡
Servicio de Arritmias del Centro de Asistencia del Sindicato Médico del Uruguay (CASMU). Servicio de Arritmias del Instituto Nacional de Cirugía Cardíaca (INCC). Unidad de Cuidado Intensivo del Hospital Británico. Montevideo, Uruguay
Resumen
La fibrilación auricular es la arritmia cardíaca sostenida más frecuente. Afecta a 0,6% de la población, y a 6% y 8% de los sujetos mayores de 60 y 80 años, respectivamente. Los pacientes con fibrilación atrial tienen una morbilidad cinco veces mayor y el doble de mortalidad.
En esta revisión analizamos la remodelación auricular eléctrica y anatómica. También discutimos sobre los factores de riesgo más relevantes para desarrollar fibrilación atrial. La edad es el más importante, seguida por la disfunción diastólica, provocada en la gran mayoría por la hipertensión arterial. El tratamiento agresivo de la hipertensión puede invertir los cambios estructurales provocados por la hipertensión en el corazón y retardar o prevenir la ocurrencia de la fibrilación atrial. Se describe el efecto de fármacos no antiarrítmicos y antiarrítmicos. Finalmente enfocamos aspectos de la prevención primaria y secundaria.
La fibrilación auricular no es una entidad homogénea, varios parámetros afectan su origen, perpetuación y terminación. En algunos pacientes nuestro objetivo es modesto, reducir la frecuencia, duración y severidad de los episodios. Pero en otros se puede prevenir en forma definitiva.
Palabras clave: FIBRILACIÓN ATRIAL - prevención y control.
* Médicos Cardiólogos.
† Médicos posgrados de Cardiología.
‡ Médico Internista.
Correspondencia: Dr. Gabriel Vanerio
Servicio de Electrofisiología del CASMU. Policlínico CASMU, 8 de Octubre 3310, 2do. piso. Montevideo, Uruguay
E-mail: gabvaner@mednet.org.uy
Presentado: 23/9/04.
Modificado: 12/5/05.
Aceptado: 11/10/05.
Introducción
La fibrilación auricular es la arritmia cardíaca sostenida más frecuente. Afecta a 0,6% de la población, y a 6% y 8% de los sujetos mayores de 60 y 80 años, respectivamente(1-12). Los pacientes con fibrilación auricular tienen una morbilidad cinco veces mayor (incluyendo cardiomiopatía dilatada e insuficiencia cardíaca congestiva) y el doble de mortalidad que los que tienen ritmo sinusal(10,11,13,14). En pacientes derivados para el tratamiento de insuficiencia cardíaca, la incidencia de fibrilación atrial es de 5% a 10%(13,14).
En un estudio publicado en Estados Unidos en el año 2002, se estima que la fibrilación atrial aumentará de 2,3 millones de individuos a 5,6 millones en el año 2050(9). En nuestro país y en la región carecemos de datos, pero como demográficamente pertenecemos a los países estacionarios como Estados Unidos, Suiza o Canadá, podemos estimar que hay aproximadamente 20.000 personas con fibrilación atrial en Uruguay y probablemente se sumen 1.000 pacientes cada año.
La importancia de esta entidad es evidente, sin mencionar sus efectos sobre los costos en el sistema de salud.
Nuestro grupo realizó una búsqueda en la base de datos PUBMED usando como palabra clave "arritmia". En el lapso de 14 años (1980 a 1994), se publicaron 46.601 artículos, de estos, 5.686 (12%) incluían la fibrilación auricular. En los últimos nueve años (1995 a 2004), se han publicado 34.936 trabajos sobre "arritmia", de estos, la fibrilación atrial aparece en 10.821 artículos (31%), casi 300% más que en el período previo. En consecuencia, esta nueva y abundante información sobre fibrilación atrial nos estimuló a realizar esta revisión.
¿Podemos hacer algo para prevenirla? En nuestra experiencia, la fibrilación auricular es la arritmia más frecuente, en particular en pacientes adultos mayores y en ocasiones es de difícil manejo. Nuestro trabajo es una revisión de la información relacionada con la prevención primaria y secundaria de la fibrilación auricular.
No consideraremos la anticoagulación en fibrilación auricular dado que excede los objetivos de este trabajo.
Analizaremos la clasificación, fisiopatología y los factores de riesgo más importantes.
Clasificación clínica de la fibrilación auricular(15,16)
La fibrilación auricular tiene diversas presentaciones clínicas, puede ocurrir en paroxismos breves, o persistir por muchas horas, días o incluso meses. Algunos pacientes la notan inmediatamente y otros no, no percibiendo ningún síntoma. Otros refieren disnea; particularmente, una disminución de la tolerancia al ejercicio. De los pacientes con fibrilación atrial sintomática, 18% tienen episodios de fibrilación atrial asintomática o silente(1,2).
Estas características hacen difícil distinguir entre el primer episodio detectado y su duración, hecho fundamental para delinear la estrategia terapéutica.
Cuando el paciente tiene dos o más episodios, la fibrilación atrial se considera recurrente.
La fibrilación auricular se clasifica en:
1. Paroxística, si la arritmia termina espontáneamente, en general, luego de un lapso variable; 70% convierte a ritmo sinusal dentro de las 24 horas sin ninguna intervención.
2. Persistente, si es sostenida, requiriendo de cardioversión farmacológica o eléctrica para convertir a ritmo sinusal. La fibrilación atrial persistente también incluye casos de fibrilación atrial de larga duración (más de un año), en los cuales la cardioversión no está indicada o no se ha intentado, lo que usualmente conduce a fibrilación atrial permanente(17,18). La fibrilación atrial persistente puede ser la primera presentación de la arritmia o la culminación de episodios recurrentes de fibrilación atrial paroxística.
3. Permanente, se considera permanente cuando es refractaria a cardioversión eléctrica o farmacológica o en aquellos casos de larga duración (varios años) y se decide no intentar la reversión a ritmo sinusal.
A veces se utilizan otras expresiones para definir tipos específicos de fibrilación auricular como: solitaria, focal, vagal y adrenérgica. Las dos primeras las definimos a continuación y las otras dos, más adelante, en relación con el sistema nervioso autónomo.
El término fibrilación atrial solitaria ("lone atrial fibrillation") se aplica a pacientes menores de 60 años, sin evidencias clínicas o ecocardiográficas de enfermedad cardiopulmonar. Su pronóstico es benigno en relación con tromboembolismo y mortalidad. Pero conforme pasa el tiempo, su "benignidad" puede cambiar debido al desarrollo de cambios estructurales auriculares(19-21).
Fibrilación auricular "focal". Es una definición electrofisológica: cuando nace en un foco aislado, que funciona como el gatillo para la fibrilación atrial. Generalmente localizado en la aurícula izquierda dentro o cercano a una de las venas pulmonares(22-24).
Fisiopatología auricular
Remodelación auricular
Los pacientes que desarrollan fibrilación atrial presentan algún tipo de remodelación auricular. La remodelación tiene dos componentes: eléctrico y anatómico(17,25-32). La remodelación eléctrica en la fibrilación atrial paroxística se caracteriza por la presencia de electrogramas atriales anormales, y una onda P de mayor duración (mayor de 100 ms)(33). El período refractario auricular se acorta luego de un episodio prolongado de fibrilación auricular, favoreciendo que nuevos episodios se hagan más persistentes o que duren más tiempo(18). Todas estas anormalidades pueden ser la respuesta del miocardio atrial a ciertas condiciones de trabajo(17,18,26-32).
El concepto de remodelación anatómica está relacionado con la estructura auricular. Ambas aurículas están compuestas por miocitos y una matriz extracelular proteica con varios tipos de colágeno. La biopsia de la orejuela atrial izquierda en pacientes sometidos a cirugía cardíaca ha mostrado nidos de amiloidosis atrial(33). Del total de las biopsias, 16% tenían una sustancia amiloide con inmuno-rreactividad para el péptido natriurético auricular. La relación entre la presencia de amiloidosis y fibrilación atrial fue estadísticamente significativa. La progresión y las consecuencias de la amiloidosis atrial aislada son influenciadas particularmente por las valvulopatías, que incrementan la síntesis y producción del péptido natriurético auricular. La cantidad de colágeno es mayor en pacientes con fibrilación atrial (más que en sujetos con ritmo sinusal), tanto paroxística como permanente(33).
Mediadores neurohormonales
Los péptidos natriuréticos están relacionados con el balance de agua, sodio y homeostasis cardiovascular. El péptido natriurético auricular (ANP) es producido y liberado por miocitos atriales en respuesta a la distensión o sobrecarga auricular. El ANP y el péptido natriurético tipo B (BNP) se liberan a la circulación en respuesta al aumento de la presión de llenado y por el estiramiento de la pared atrial y ventricular respectivamente. En consecuencia, el nivel plasmático de ANP es considerado un marcador de sobrecarga atrial. El ANP posee potentes efectos: natriuresis, vasodilatación, inhibición del eje renina-angiotensina-aldosterona y del sistema simpático. Reduce la precarga al aumentar la excreción de agua, sodio y movilizar plasma del espacio intravascular al extravascular(34-36).
Se han detectado niveles plasmáticos elevados de ANP en fibrilación atrial permanente provocados por la pérdida de la contracción atrial y la respuesta ventricular anormal, que conducen a sobrecarga de volumen y estiramiento atrial. Tal aumento en la secreción de ANP se puede relacionar con el sistema nervioso simpático así como con el sistema renina-angiotensina-aldosterona. Las concentraciones plasmáticas de ANP en pacientes con fibrilación atrial se reducen sensiblemente después de una cardioversión exitosa(34-36).
Todas estas observaciones apuntan a que la determinación de los niveles plasmáticos de ANP podría ser valiosa para predecir quién está en riesgo para desarrollar fibrilación atrial o para complementar la valoración del tratamiento.
Sistema nervioso autónomo
Las propiedades electrofisiológicas de las células auriculares son moduladas por influencias vagales y simpáticas (duración del potencial de acción, período refractario y velocidad de conducción). El sistema parasimpático puede favorecer la aparición de arritmias, por ejemplo, los fenómenos de macro reentrada, mientras que el simpático favorece el automatismo anormal y la actividad gatillada.
La fibrilación auricular vagal es una entidad poco común. Se observa más en hombres jóvenes sin enfermedad cardíaca detectable. Los pacientes refieren palpitaciones nocturnas, que comienzan con actividad ectópica auricular frecuente, que termina en fibrilación auricular durante la noche, desapareciendo con el despertar (paroxística)(25).
La fibrilación atrial mediada por el simpático o adrenérgica es también de rara observación y se desencadena durante el esfuerzo, en general en pacientes con enfermedad cardíaca o pulmonar.
Cuando se considere el tratamiento, el rol de las influencias autonómicas debe ser tenido en cuenta. Los beta-bloqueantes y el digital pueden ser beneficiosos o deletéreos dependiendo del mecanismo causal(25).
Factores de riesgo para desarrollar fibrilación auricular
1. Edad
La edad es el factor de riesgo más importante y obviamente no corregible. En todas las revisiones es mencionado como el elemento más importante para desarrollar fibrilación atrial. El envejecimiento altera las propiedades de la aurícula. A nivel celular, se observa acortamiento del potencial de acción, que se podría explicar por cambios en la regulación de la corriente activada de calcio durante la fase meseta del potencial de acción. Los cambios eléctricos que ocurren con la edad pueden estar asociados con modificaciones tisulares y celulares, incluyen fibrosis, distrofia miocítica, miolísis, des-diferenciación, apoptosis, hipertrofia celular y desorganización de las uniones tipo gap(26,27).
2. Disfunción diastólica e hipertensión arterial
La disfunción diastólica favorece el desarrollo de fibrilación atrial. La disfunción diastólica es consecuencia de la hipertensión arterial (HTA) o de otras enfermedades; pero sin duda, la HTA es la más importante y prevenible. En sujetos hipertensos con ritmo sinusal y sin ninguna otra condición predisponente, el riesgo de fibrilación atrial está directamente relacionado con la masa ventricular izquierda. El tamaño atrial izquierdo, en cambio, predispone a que la fibrilación atrial se vuelva permanente. La hipertensión genera hipertrofia ventricular izquierda, provocando un llenado ventricular anormal, dilatación auricular izquierda y retardo en la velocidad de conducción atrial. Estos cambios en la estructura y fisiología cardíacas favorecen el desarrollo de fibrilación atrial y aumentan el riesgo de complicaciones tromboembólicas(37,38).
El tratamiento agresivo de la hipertensión puede invertir los cambios estructurales en el corazón y retardar o prevenir la ocurrencia de la fibrilación atrial. Recientemente, dos trabajos muestran la relación entre la fibrilación atrial y la hipertensión, tanto como factor de riesgo como de los beneficios del control de la presión arterial para controlar la fibrilación atrial(37,38).
3. Sustratos electrofisiológicos específicos(1,3,24)
Hay otras arritmias que predisponen a la fibrilación atrial. Algunas tienen tratamientos específicos.
§ Fibrilación auricular focal ® ablación del foco.
§ Flutter auricular típico ® ablación del istmo cavo-tricuspídeo.
§ Enfermedad del nódulo sinusal con insuficiencia cronotrópica durante el ejercicio ® implante de marcapasos con estimulación auricular.
§ Trastornos de la conducción intraauricular ® implante de marcapasos con estimulación auricular.
§ Otras arritmias por reentrada (sobre todo síndromes de preexcitación) que pueden degenerar en fibrilación auricular ® ablación de la vía accesoria.
En estos casos el tratamiento de cada una de estas entidades tendría un efecto curativo sobre la fibrilación atrial.
4. Otras causas: fibrilación atrial secundaria(22)
Aquí la arritmia no es el problema primario. El tratamiento de la condición subyacente, concomitantemente con el manejo de la fibrilación atrial, usualmente resulta en terminación sin recurrencias o en una disminución significativa de las mismas. Una enumeración de las causas más frecuentes de fibrilación atrial secundaria comprende: a) empuje agudo de enfermedad pulmonar obstructiva crónica; b) tirotoxicosis con compromiso cardíaco; c) crisis hipertensiva; d) cardiopatía alcohólica; e) intoxicación alcohólica; f) episodios de insuficiencia cardíaca; g) posoperatorio de cirugía cardíaca; h) esofagitis-gastritis, reflujo gastroesofágico(39,40); i) posdiálisis; j) posvómitos(41-43); k) asociada al uso de agentes inotrópicos y vasopresores.
En esta parte del trabajo analizaremos estudios relacionados con el efecto de medicamentos y suplementos alimenticios sobre la fibrilación auricular. Posteriormente trataremos de sugerir medidas para prevención primaria y secundaria. Los antiarrítmicos se recomiendan solamente en prevención secundaria. Por último discutiremos nuevos aspectos del tratamiento no farmacológico de la fibrilación auricular en prevención secundaria.
Efectos de medicamentos no antiarrítmicos
Hay medicamentos que pueden tener efectos beneficiosos sobre esta arritmia, sin poseer propiedades antiarrítmicas directas. Sin embargo, la información que se desarrolla a continuación no cuenta aún con evidencia suficiente como para recomendarla en la práctica diaria.
Inhibidores de la enzima convertidora de la angiotensina
El enalapril parece disminuir la incidencia de fibrilación atrial en pacientes con disfunción ventricular izquierda. En un análisis retrospectivo del estudio SOLVD (pacientes con insuficiencia cardíaca, que recibieron enalapril y placebo), se observó que solamente 5,4% del grupo de enalapril desarrolló fibrilación atrial contra 24% del grupo placebo(44-50).
La remodelación auricular anatómica parece tener un componente dependiente de angiotensina II y otro independiente. El hallazgo de una correlación inversa entre la presencia de amiloidosis y fibrosis intersticial explicaría por qué no todos los pacientes se benefician del uso de inhibidores de la enzima convertidora de la angiotensina (IECAs) dado que reducen la fibrosis intersticial pero no la amiloidosis(33). Los IECAs parecen disminuir parcialmente la apoptosis, evitando parte de la remodelación auricular, pero no han demostrado evitar el desarrollo de mayor fibrosis en la fibrilación auricular permanente(50).
Bloqueadores de los receptores de angiotensina
Los bloqueadores de los receptores de angiotensina (ARA II) también parecen prevenir la remodelación estructural auricular disminuyendo la cantidad de fibrosis intersticial. Tienen efecto sobre la remodelación eléctrica acortando el tiempo de conducción entre la orejuela derecha y la aurícula derecha baja. En un estudio de pacientes con fibrilación atrial persistente sometidos a cardioversión eléctrica se trató a un grupo con amiodarona y a otro con amiodarona más irbesartán. El punto final era el mantenimiento del ritmo sinusal. Luego de dos meses de seguimiento el grupo tratado con irbesartán tenía menos pacientes con fibrilación atrial recurrente(51).
Estatinas
Algunos trabajos recientes sugieren que las estatinas podrían tener un efecto protector o preventivo en fibrilación auricular. En pacientes con enfermedad coronaria, la incidencia de fibrilación auricular es menor que en quienes no reciben estatinas(52). El mecanismo es desconocido, pero parece ser independiente de la reducción de los niveles de colesterol. En otro trabajo, el uso de estatinas se asoció con una disminución significativa del riesgo de recurrencia de arritmia luego de cardioversión eléctrica exitosa(53). También se ha descripto que la atorvastatina evita el mantenimiento de fibrilación auricular en modelos animales de pericarditis(54-58). Sin embargo, podría no ser un efecto de todas las estatinas como grupo. En un estudio multicéntrico randomizado controlado, la pravastatina no redujo las recurrencias de fibrilación auricular luego de cardioversión eléctrica(59).
Magnesio
La hipomagnesemia se encuentra con frecuencia en pacientes que reciben diuréticos. El magnesio juega un papel importante en la homeostasis del potasio. Posee propiedades fisiológicas que podrían explicar su efecto antiarrítmico, como la reducción del tono coronario y la inhibición de la liberación de catecolaminas(60-66). El magnesio también suprime arritmias ventriculares provocadas por actividad automática exagerada o gatillada(60).
Se han encontrado niveles bajos de magnesio en 24% de los hipertensos y 25% de los diabéticos y también en alcoholistas(64). El déficit de magnesio puede prolongar el intervalo PR y el intervalo QT, provocar extrasístoles auriculares, taquicardia y fibrilación auricular, extrasístoles ventriculares, fibrilación ventricular y torsades de pointes(60). La hipomagnesemia está asociada frecuentemente con hipopotasemia. En pacientes con falla cardíaca y arritmias ventriculares, se ha detectado hipomagnesemia y pérdida excesiva de magnesio.
En consecuencia, los suplementos de magnesio parecen estar indicados en portadores de insuficiencia cardíaca que reciben diuréticos, particularmente si son diabéticos e hipertensos.
En un estudio reciente de pacientes con fibrilación auricular persistente, el tratamiento oral con magnesio o asociado al sotalol no tuvo influencia en la tasa de recurrencias luego de la cardioversión electiva(67).
Espironolactona
La aldosterona parece favorecer el desarrollo de fibrosis cardíaca y vascular(68-77). Dosis altas de espironolactona reducen la presión arterial y la fibrosis cardíaca, pero dosis bajas disminuyen solamente la fibrosis. La aldosterona es uno de los mediadores de la lesión microangiopática inducida por angiotensina, generando fibrosis y necrosis en el corazón y riñón. El tratamiento crónico con espironolactona previene la fibrosis aórtica, además disminuye el contenido de colágeno aórtico y de elastina en modelos animales de hipertensión(73). La espironolactona disminuye los niveles del péptido P III NP, marcador del pro colágeno que indica el grado de recambio vascular de colágeno. El análisis de un subgrupo del estudio RALES reveló una disminución significativa de los niveles de P III NP en los tratados con dosis bajas de espironolactona(74).
En modelos animales, dietas con alto contenido de sal generan hipertrofia, fibrosis cardíaca, y aumentan la concentración de aldosterona cardíaca. El uso de espironolac-tona evitó la dilatación ventricular izquierda, así como la disminución del colágeno biventricular, la fibrosis intersticial y perivascular(76,77).
PUFA
Los ácidos grasos omega-3 optimizan la función endotelial, estabilizan las membranas celulares, inhiben la agregación plaquetaria, y suprimen la proliferación de las células musculares lisas(78). Estos compuestos son inhibidores potentes de los canales de sodio voltaje-activados. Otro probable efecto antiarrítmico estaría relacionado con la capacidad para prevenir la sobrecarga intracelular de calcio, ya sea manteniendo la actividad de los canales del calcio tipo L, así como el aumento de la actividad de la ATPasa cardíaca microsomal(61). Otros mecanismos por los que probablemente tienen propiedades antiarrítmicas son secundarios a su incorporación a la membrana celular(78-86).
Clonazepam
En un estudio reciente, la administración de clonazepam en 50 pacientes con fibrilación auricular paroxística demostró que los episodios de fibrilación auricular fueron menos frecuentes y de menor duración. Incluso en algunos sujetos los episodios desaparecieron por el tiempo que duró el estudio(87).
Inhibidores de la bomba de protones
En este interesante estudio se analizaron pacientes con esofagitis por reflujo. De 89 pacientes, 18 (6 mujeres, 39-69 años) tenían historia de fibrilación auricular paroxística. Después de iniciada la terapia con inhibidores de la bomba de protones, se observó la disminución de síntomas relacionados con la fibrilación auricular en 14 de 18 pacientes (78%). Los fármacos antiarrítmicos se continuaron sólo en cinco pacientes. Los autores concluyeron que en sujetos con fibrilación auricular paroxística solitaria, el reflujo gastro-esofágico se debe investigar como mecanismo potencial. La terapia con inhibidores de la bomba de protones no sólo reduce síntomas relacionados con el reflujo gastro-esofágico, sino que también parece disminuir los síntomas provocados por la fibrilación auricular(39,40).
¿Cómo prevenir la fibrilación auricular?
La prevención de la fibrilación auricular persigue tres objetivos:
– Disminuir la cantidad de sujetos con fibrilación auricular (prevención primaria).
– Reducir la frecuencia, duración y severidad de los episodios o suprimir definitivamente la misma (prevención secundaria).
Prevención primaria
La disminución del riesgo cardiovascular absoluto es fundamental para disminuir la incidencia de la fibrilación auricular. Si bien no disponemos aún de medicamentos que eviten directamente la remodelación auricular, en hipertensos con aumento de la masa ventricular izquierda se debería observar un beneficio luego de un tratamiento agresivo que incluya IECAs o ARA II, asociados a betabloqueantes y espironolactona.
Los betabloqueantes están asociados a una disminución significativa de la incidencia de fibrilación auricular. Desde hace décadas se utilizan en enfermedades que habitualmente se complican con fibrilación auricular(88,89).
En pacientes con enfermedad del nódulo sinusal, o alteraciones de la conducción intra-atrial, si tienen indicación de marcapasos, la estimulación auricular parecería tener un efecto protector para el desarrollo de fibrilación auricular, en particular la estimulación del séptum inter-atrial bajo(90,91).
Prevención secundaria
En pacientes portadores de hipertensión arterial y fibrilación auricular nos enfrentamos a cambios estructurales atriales evidentes o no, pero potencialmente reversibles. Su tratamiento es complejo, pero el control estricto de la presión arterial tanto con beta-bloqueantes, IECAs o ARAIIs e incluso espironolactona puede ser eficaz. El tiempo es crítico, y en algunos casos un apropiado control de la presión arterial basta para disminuir los episodios de fibrilación auricular tanto en duración como en frecuencia. En otros casos, se deberá considerar el uso de antiarrítmicos.
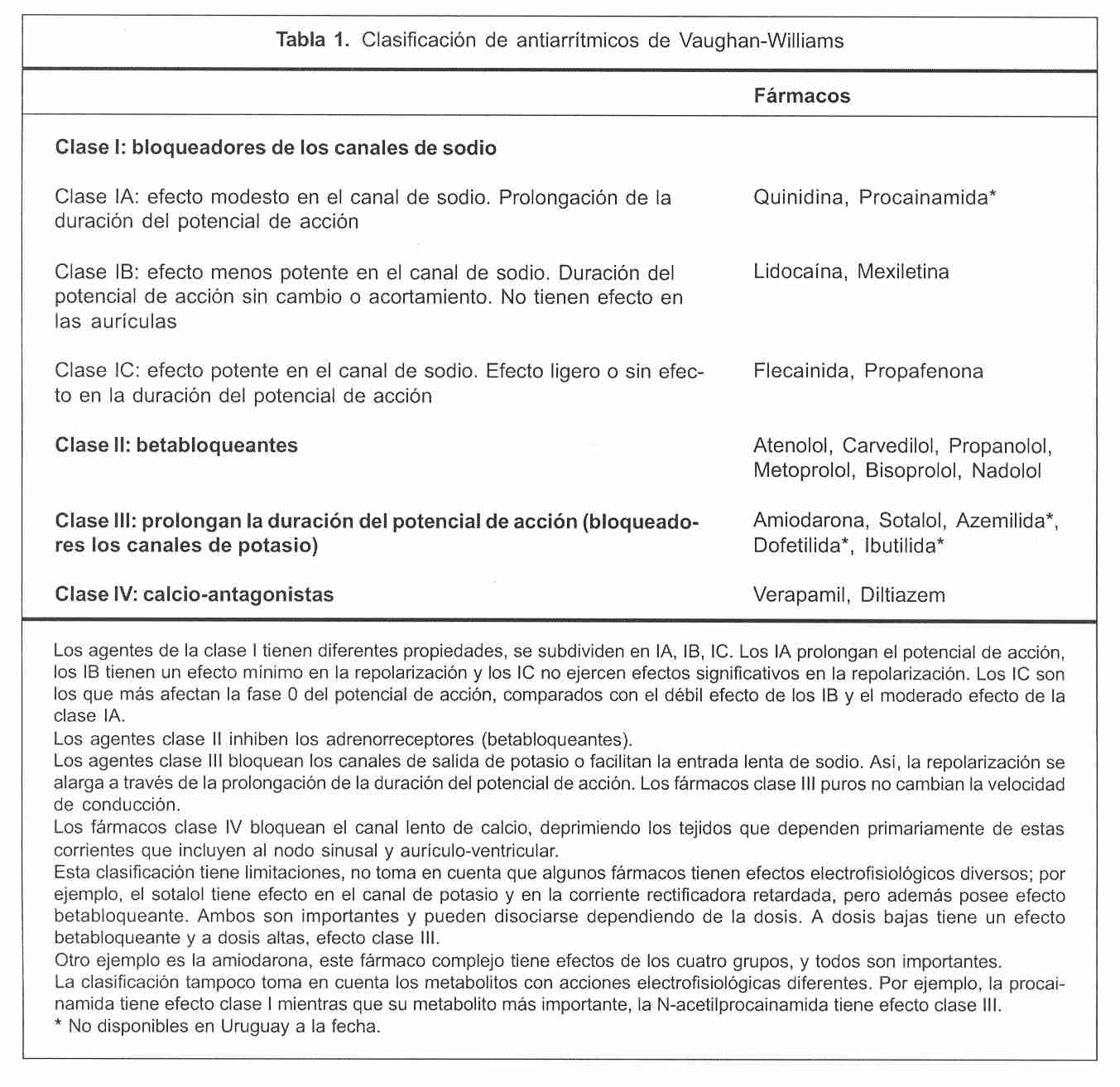
Antiarrítmicos (tabla 1)
El objetivo del tratamiento antiarrítmico es relativamente modesto, esencialmente reducir la frecuencia, duración y severidad de los episodios de fibrilación auricular, permitiendo mejorar la calidad de vida. Un fármaco no es más efectivo que otro sino que es más apropiado. También debemos asegurarnos que el paciente tome la medicación, con especial cuidado en minimizar los riesgos del tratamiento(92).
La terapia antiarrítmica se debe considerar para:
1. Lograr la cardioversión (los agentes más efectivos son el ibutilide o fármacos clase IC en fibrilación auricular de reciente comienzo).
2. Prevenir recurrencias tempranas luego de cardioversión.
3. Mantener el ritmo sinusal durante terapia a largo plazo (agentes clase III).
4. Facilitar la conversión de fibrilación a flutter, siendo éste pasible de terminación con estimulación antitaquicardia o métodos ablativos. En algunos pacientes, los antiarrítmicos pueden "organizar" la fibrilación auricular y desarrollar flutter auricular típico. En estos casos, el tratamiento de elección, en nuestra opinión, es la ablación del istmo cavotricuspídeo, eliminando el flutter, y logrando disminuir la frecuencia y duración de los episodios de fibrilación auricular.
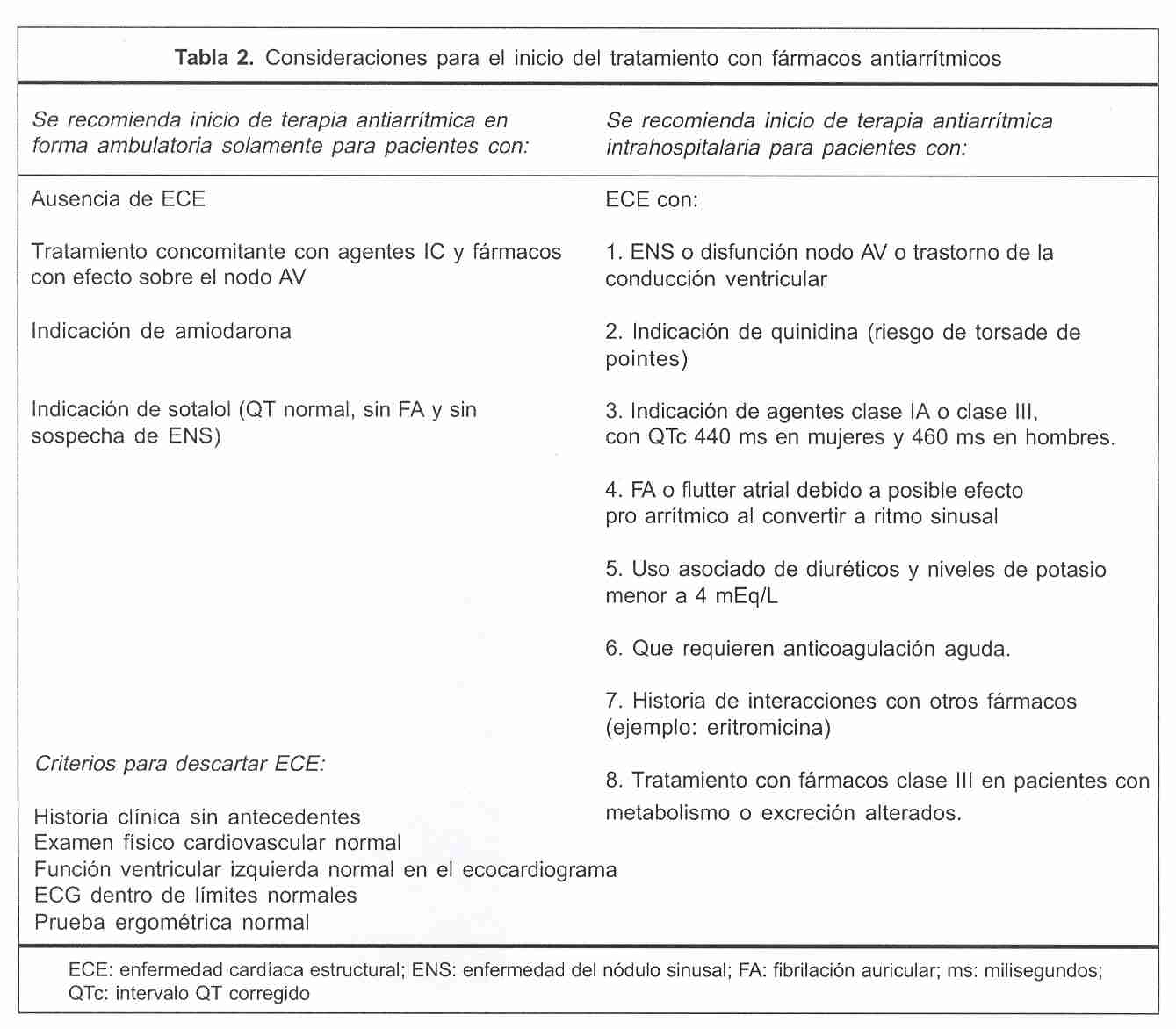
La selección de fármacos antiarrítmicos debe ser guiada considerando tanto la eficacia como la seguridad, pero probablemente esta última es más importante. Varios autores sugieren comenzar algunos antiarrítmicos con el paciente internado(92-98) (tabla 2). Cuando sea posible, los fármacos con mayor potencial tóxico o riesgo pro arrítmico deben ser evitados. En corazones estructuralmente sanos, los fármacos clase IC son menos pro arrítmicos. En corazones hipertróficos, el riesgo de torsade de pointes con agentes clase III/IA es alto, mientras que si hay isquemia o condiciones con contacto celular alterado, sea funcional (isquemia) o anatómico (fibrosis, infiltración, etcétera), el riesgo pro arrítmico con fármacos clase I (fibrilación/flutter ventricular sostenido) es importante. En estas circunstancias los fármacos clase I deben ser evitados(93).
Al seleccionar un antiarrítmico debemos considerar cuatro grupos de pacientes(22,41,49,92-97):
- Pacientes sin enfermedad cardíaca estructural. En estos no existe contraindicación para el uso de fármacos antiarrítmicos. Los fármacos de tipo IC son los agentes de primera línea y pueden ser usados por la baja probabilidad de pro arritmia y efectos colaterales(22). Los representantes del grupo IC son la flecainida y la propafenona. Ambos fármacos bloquean los canales de sodio, en particular la pendiente inicial del potencial de acción, disminuyendo su tasa de incremento (Vmax, fase 0). Tienen poco efecto sobre la duración del potencial de acción, y sus efectos son mayores en el ventrículo que en las aurículas. Ejercen pobre efecto sobre el tiempo de conducción y los períodos refractarios atriales. Son más efectivos para fibrilación auricular que para flutter auricular, en el caso del flutter se ha descripto que estos fármacos pueden enlentecer el circuito del mismo y desarrollar conducción 1:1 con una frecuencia ventricular superior a la previa. Muchos expertos recomiendan el uso de fármacos IC asociado a otros fármacos con efecto bloqueador sobre el nodo AV(98). La propafenona tiene algunas características particulares. En 90% de los pacientes el fármaco es rápido y extensivamente metabolizado con una vida media de eliminación de dos a diez horas. En 10% de los pacientes (y en aquellos que reciban quinidina asociada), el tiempo medio de eliminación oscila entre 10 y 32 horas, son metabolizadores lentos. La propafenona no debería administrarse a pacientes con historia de asma o enfermedad pulmonar obstructiva severa dado que posee propiedades betabloqueadoras. La flecainida tiene un metabolismo más simple y con menos efectos colaterales. En ambos fármacos se recomienda realizar electrocardiogramas seriados (en los primeros días y semanas) para medir el efecto sobre la duración del intervalo PR y QRS, que habitualmente no se incrementan más de 15% con respecto al basal. Si se observan incrementos superiores es recomendable suspender el fármaco(92-98).
2. Pacientes con hipertrofia ventricular izquierda sin elementos de isquemia o trastornos de la conducción intraventricular. El tratamiento es similar al de los pacientes sin enfermedad cardíaca estructural. Los pacientes con hipertrofia ventricular izquierda tienen un riesgo mayor para desarrollar torsade de pointes(98-101). En consecuencia, un fármaco que no prolongue el intervalo QT intervalo es preferible como terapia de primera línea, si no hay hipertrofia severa (grosor del tabique o de la pared posterior mayor o igual a 14 mm), la propafenona y la flecainida son elecciones razonables(100). Si un paciente desarrolla pro arritmia con un fármaco, no implica el mismo tipo de respuesta con otros. La amiodarona se convierte en primera opción si hay hipertrofia ventricular izquierda severa (más de 14 mm de espesor de las paredes ventriculares). El Canadian Trial of Atrial Fibrillation (CTAF) comparó amiodarona, propafenona y sotalol en fibrilación auricular de reciente comienzo para prevenir la primera recurrencia(101). La amiodarona fue superior a los otros dos agentes, pero debe tenerse en cuenta que la amiodarona se discontinuó en 18% de los pacientes debido a eventos adversos sintomáticos(101).
3. Pacientes con cardiopatía isquémica. El estudio CAST demostró que el uso de fármacos antiarrítmicos tipo IC (flecainida) en pacientes con historia previa de infarto de miocardio es peligroso y está absolutamente contraindicado(102). La propafenona no se incluyó dentro del CAST pero las recomendaciones son las mismas. El sotalol y la amiodarona pueden ser usados sin riesgo(93,94). Sin embargo, el sotalol debe ser administrado con cautela en mujeres y con mucho cuidado en sujetos con insuficiencia renal(92-94).
4. Pacientes con insuficiencia cardíaca congestiva. En este grupo no se deben usar antiarrítmicos clase I y la amiodarona es el único fármaco que se recomienda. Varios estudios multicéntricos han sugerido su eficacia y seguridad(92,103-107).
Prevención secundaria no farmacológica
· Ablación por catéter
En jóvenes con fibrilación auricular solitaria, paroxística o persistente, la arritmia nace en nidos de actividad eléctrica en las venas pulmonares o en su vecindad(20,21,108-112). La fibrilación auricular es solamente una manifestación eléctrica sin evidencias de alteraciones estructurales. Datos recientes reportan que 89% de los individuos, tengan fibrilación auricular o no, poseen extensiones de tejido auricular dentro de las venas pulmonares, aun más, los pacientes con fibrilación auricular son los que tienen más cantidad de tejido auricular en estas extensiones, donde también se ha descripto hipertrofia y fibrosis(101). La técnica del aislamiento de las venas pulmonares parece ser muy eficaz para tratar definitivamente la fibrilación auricular. Desafortunadamente, el procedimiento tiene una curva de aprendizaje, es costoso, y conlleva riesgos no despreciables, con una tasa de recurrencias relativamente alta(109-113). La anatomía de las venas pulmonares es compleja, y los resultados están relacionados con la identificación cuidadosa de los disparadores de la arritmia. La fibrilación auricular paroxística es la que mejor responde a este tratamiento(111-113).
Una nueva técnica desarrollada por el doctor José Pachón (San Pablo, Brasil) identifica de una manera especial los "nidos" en donde se origina la fibrilación auricular y parece ofrecer resultados muy interesantes y prometedores(114,115).
· Estimulación auricular permanente
Cuando existen trastornos de la conducción intraauricular, la estimulación simultánea en dos sitios auriculares ha demostrado ser efectiva para prevenir la fibrilación auricular(116,117). La estimulación en el séptum atrial bajo permite activar ambas aurículas simultáneamente y preexcitar una zona de conducción anisotrópica no uniforme, logrando reducir significativamente el riesgo de fibrilación auricular paroxística y la progresión hacia la forma permanente(118-120). En consecuencia, en pacientes con enfermedad del nódulo sinusal, fibrilación auricular paroxística, u otros factores de riesgo para desarrollar fibrilación auricular, se debería considerar como el lugar de estimulación de primera elección(90). El catéter se debe implantar cerca del orificio del seno coronario y de la fosa oval. La estimulación septal parece ser fácil, segura, y evita los problemas técnicos de utilizar dos electrodos(90,91,119,120).
5 pasos para hacer realidad una idea

“Primero viene el pensamiento. Luego, la organización de ese pensamiento, en ideas y planes. Después, la transformación de esos planes en realidad. El comienzo, como podrás observar, está en tu imaginación”, Napoleon Hill.
· Procedimiento del laberinto o Maze
Este procedimiento tiene como objetivo canalizar la conducción eléctrica aurículo-nodal a través de un laberinto que se efectúa mediante incisiones o lesiones por radiofrecuencia en la aurícula izquierda durante la cirugía cardíaca. El procedimiento es sobre todo útil en pacientes que requieren cirugía cardiovascular, especialmente de la válvula mitral, y que además tienen fibrilación auricular paroxística, persistente o permanente(121-124). En nuestro país, la experiencia inicial en 33 pacientes portadores de fibrilación auricular permanente sometidos a cirugía cardíaca por enfermedad valvular o coronariopatía ha mostrado resultados espectaculares. En ellos, se realizaron líneas de ablación en la aurícula izquierda, rodeando las venas pulmonares. Al cabo de seis meses de seguimiento, 91% estaban en ritmo sinusal y 87% tenían actividad mecánica atrial (onda A en el ecocardiograma Doppler). Se observó también una disminución significativa del diámetro auricular izquierdo así como del diámetro diastólico ventricular izquierdo en comparación con los valores preoperatorios. La mortalidad operatoria fue 0%(125).
· Fibrilación auricular en el posoperatorio de cirugía cardíaca
La fibrilación auricular posoperatoria es frecuente, con una incidencia que oscila entre 25% a 65%(126,127). En un reciente metaanálisis que incluyó 52 estudios donde se analizó la eficacia de la prevención con fármacos, se destacó el uso profiláctico de los betabloqueantes, sotalol o amiodarona(127). Todos redujeron el riesgo de fibrilación auricular, sin diferencias significativas; los betabloqueantes tuvieron menor incidencia de efectos colaterales.
La estimulación auricular temporaria en dos sitios (estimulación simultánea de aurícula derecha e izquierda) y provocaron reducciones significativas de episodios de fibrilación auricular cuando se comparó con la estimulación en un sitio único(128,129).
Conclusiones
La fibrilación auricular no es una entidad homogénea, es una arritmia compleja, o un grupo de arritmias que aún no sabemos diferenciar. En muchos casos el tratamiento apropiado de la hipertensión arterial es suficiente para prevenirla. Pero cuando se manifiesta, antes de decidir su tratamiento, debemos evaluar la presencia de cardiopatía y la función ventricular. En algunos pacientes el objetivo del tratamiento será modesto: reducir la frecuencia, duración y severidad de los episodios, mejorando la calidad de vida. En otros se puede prevenir definitivamente.
Summary
Atrial fibrillation is the most common sustained arrhythmia. It affects 0.6% of the overall population and 6 to 8% in elderly people aged 60 to 80 years respectively. Patients with atrial fibrillation show a morbility five times higher and twice mortality rates.
This review analyzes electric and anatomy atrial remodelation. Risk factors are also discussed: age, followed by diastolic heart failure, are the most relevant risk factors. Aggresive treatment might invert structural changes provoked by hypertension, and could prevent atrial fibrillation.
Effects of non-antiarrhythmic and antiarrhythmic drugs are described. Finally we focused on primary and secondary prevention.
Atrial fibrillation is not an homogenous entity: many parameters affect initiation, perpetuation and ending ot this condition. For many patients, our goal is modest: to reduce frequency, lenght and severity of episodes; but for other patients, prevention may be definitive.
Résumé
La fibrillation auriculaire est l’arythmie cardiaque la plus fréquente. 0,6% de la population en est atteinte, dont 6% et 8% des plus âgés de 60 et 80 ans respectivement.
Les patients ayant une fibrillation auriculaire ont une morbidité 5 fois plus élevée et le double de mortalité.
On analyse ici la rémodélation auriculaire et anatomique. On discute aussi sur les facteurs de risque les plus significatifs pour avoir une fibrillation auriculaire. L’âge en est le plus important ainsi que la disfonction diastolique, provoquée en général par l’hypertension artérielle. Le traitement agressif de celle-ci peut inverser les change-ments structuraux causés par l’hypertension dans le coeur et retarder ou prévenir une fobrillation auriculaire. On fait la description des effets des médicaments non anti-arythmiques et anti-arythmiques. On envisage enfin quelques aspects concernant la prévention primaire et secondaire.
La fibrillation auriculaire n’étant pas une entité homogène, plusieurs paramètres varient son origine, durée et fin. Pour certains patients, notre objectif reste modeste, celui de réduire la fréquence, la durée et la sévérité des épisodes. Pour d’autres, on peut prévenir de façon plus définitive.
Bibliografía
1. Levy S, Breithardt G, Campbell RW, Camm AJ, Daubert JC, Allessie M, et al. Atrial fibrillation: current knowledge and recommendations for management. Working Group on Arrhythmias of the European Society of Cardiology. Eur Heart J 1998; 19(9): 1294-320.
2. Feinberg WM, Blackshear JL, Laupacis A, Kronmal R, Hart RG. Prevalence, age distribution, and gender of patients with atrial fibrillation: analysis and implications. Arch Intern Med 1995; 155(5): 469-75.
3. Prystowsky EN, Katz AM. Atrial fibrillation. In: Topol ES, ed. Textbook of Cardiovascular Medicine. Philadelphia: Lippincott-Raven, 1998: 1827-61.
4. Levy S, Maarek M, Coumel P, Guize L, Lekieffre J, Medvedowsky JL, et al. Characterization of different subsets of atrial fibrillation in general practice in France: the ALFA study. The College of French Cardiologists. Circulation 1999; 99(23): 3028-35.
5. Krahn AD, Manfreda J, Tate RB, Mathewson FA, Cuddy TE. The natural history of atrial fibrillation: incidence, risk factors, and prognosis in the Manitoba Follow-Up Study. Am J Med 1995; 98(5): 476-84.
6. Furberg CD, Psaty BM, Manolio TA, Gardin JM, Smith VE, Rautaharju PM. Prevalence of atrial fibrillation in elderly subjects (the Cardiovascular Health Study). Am J Cardiol 1994; 74(3): 236-41.
7. Kannel WB, Abbott RD, Savage DD, McNamara PM. Coronary heart disease and atrial fibrillation: the Framingham Study. Am Heart J 1983; 106(2): 389-96.
8. Psaty BM, Manolio TA, Kuller LH, Kronmal RA, Cushman M, Fried LP, et al. Incidence of and risk factors for atrial fibrillation in older adults. Circulation 1997; 96(7): 2455-61.
9. Go AS, Hylek EM, Chang Y, Phillips KA, Henault LE, Selby JV, et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the Anticoagulation and Risk Factors In Atrial Fibrillation (ATRIA) Study. JAMA 2001; 285(18): 2370-5.
10. Wattigney WA, Mensah GA, Croft JB. Increased atrial fibrillation mortality: United States, 1980-1998. Am J Epidemiol 2002; 155(9): 819-26.
11. Benjamin EJ, Levy D, Vaziri SM, D’Agostino RB, Belanger AJ, Wolf PA. Independent risk factors for atrial fibrillation in a population-based cohort. The Framingham Heart Study. JAMA 1994; 271(11): 840-4.
12. Lok NS, Lau CP. Presentation and management of patients admitted with atrial fibrillation: A review of 291 cases in a regional hospital. Int J Cardiol 1995; 48(3): 271-8.
13. Crijns HJ, Tjeerdsma G, de Kam PJ, Boomsma F, van Gelder IC, van den Berg MP, et al. Prognostic value of the presence and development of atrial fibrillation in patients with advanced chronic heart failure. Eur Heart J 2000; 21(15): 1238-45.
14. Dries DL, Exner DV, Gersh BJ, Domanski MJ, Waclawiw MA, Stevenson LW. Atrial fibrillation is associated with an increased risk for mortality and heart failure progression in patients with asymptomatic and symptomatic left ventricular systolic dysfunction: a retrospective analysis of the SOLVD trials: Studies of Left Ventricular Dysfunction. J Am Coll Cardiol 1998; 32(3): 695-703.
15. Gallagher MM, Camm J. Classification of atrial fibrillation. Am J Cardiol 1998; 82(8A):18N-28N
16. Levy S, Camm AJ, Saksena S, Aliot E, Breithardt G, Crijns HJ, et al. International consensus on nomenclature and classification of atrial fibrillation: a collaborative project of the Working Group on Arrhythmias of European Society of Cardiology, Working Group of Cardiac Pacing of European Society of Cardiology, North American Society of Pacing and Electrophysiology. J Cardiovasc Electrophysiol 2003; 14(4): 443-5.
17. Allessie M, Ausma J, Schotten U. Electrical, contractile and structural remodeling during atrial fibrillation. Cardiovasc Res 2002; 54(2): 230-46.
18. Centurion OA, Isomoto S, Shimizu A, Konoe A, Kaibara M, Hirata T, et al. The effects of aging on atrial endocardial electrograms in patients with paroxysmal atrial fibrillation. Clin Cardiol 2003; 26(9): 435-8.
19. Evans W, Swann P. Lone auricular fibrillation. Br Heart J 1954; 16(2): 189-94.
20. Brand FN, Abbott RD, Kannel WB, Wolf PA. Characteristics and prognosis of lone atrial fibrillation: 30-year follow-up in the Framingham Study. JAMA 1985; 254(24): 3449-53.
21. Kopecky SL, Gersh BJ, McGoon MD, Whisnant JP, Holmes DR Jr, Ilstrup DM, et al. The natural history of lone atrial fibrillation: a population-based study over three decades. N Engl J Med 1987; 317(11): 669-74.
22. Jais P, Haissaguerre M, Shah DC, Chouairi S, Gencel L, Hocini M, et al. A focal source of atrial fibrillation treated by discrete radiofrequency ablation. Circulation 1997; 95(3): 572-6.
23. Saad EB, Marrouche NF, Natale A. Ablation of focal atrial fibrillation. Card Electrophysiol Rev 2002; 6(4): 389-96.
24. Milstein S. Pautas terapéuticas para el mantenimiento de ritmo sinusal en la fibrilación auricular crónica persistente. Rev Urug Cardiol 1998, 13(1): 12-8.
25. Coumel P. Autonomic influences in atrial tachyarrhythmias. J Cardiovasc Electrophysiol 1996; 7(10): 999-1007.
26. Boldt A, Wetzel U, Lauschke J, Weigl J, Gummert J, Hindricks G, et al. Fibrosis in left atrial tissue of patients with atrial fibrillation with and without underlying mitral valve disease. Heart 2004; 90(4): 400-5.
27. Bauer A, McDonald AD, Donahue JK. Pathophysiological findings in a model of persistent atrial fibrillation and severe congestive heart failure. Cardiovasc Res 2004; 61(4): 764-70.
28. Allessie MA, Konings K, Kirchhof CJ, Wijffels M. Electrophysiologic mechanism of perpetuation of atrial fibrillation. Am J Cardiol 1996; 77(3): 10A-23A.
29. Cardin S, Li D, Thorin-Trescases N, Leung TK, Thorin E, Nattel S. Evolution of the atrial fibrillation substrate in experimental congestive heart failure: angiotensin-dependent and independent pathways. Cardiovasc Res 2003; 60(2): 315-25.
30. Schotten U, Neuberger HR, Allessie MA. The role of atrial dilatation in the domestication of atrial fibrillation. Prog Biophys Mol Biol 2003; 82(1-3): 151-62.
31. Hoit BD. Matrix metalloproteinases and atrial structural remodeling. J Am Coll Cardiol 2003; 42(2): 345-7.
32. Gronefeld GC, Hohnloser SH. Heart failure complicated by atrial fibrillation: mechanistic, prognostic, and therapeutic implications. J Cardiovasc Pharmacol Ther 2003; 8(2): 107-13.
33. Rocken C, Peters B, Juenemann G, Saeger W, Klein HU, Huth C, et al. Atrial amyloidosis: an arrhythmogenic substrate for persistent atrial fibrillation. Circulation 2002; 106(6): 2091-7.
34. Wozakowska-Kaplon B, Opolski G, Janion M. Atrial natriuretic peptide before and after cardioversion of persistent atrial fibrillation. Kardiol Pol 2003; 58(4): 255-63.
35. Rossi A, Enriquez-Sarano M, Burnett JC Jr, Lerman A, Abel MD, Seward JB. Natriuretic peptide levels in atrial fibrillation: a prospective hormonal and Doppler-echocardio-graphic study. J Am Coll Cardiol 2000; 35(5): 1256-62.
36. Arad M, Shotan A, Weinberger A, Aurbach I, Rabinowitz B. Plasma atrial natriuretic peptide levels for predicting the outcome of atrial fibrillation. Cardiology 2001; 95(2): 74-9.
37. Verdecchia P, Reboldi G, Gattobigio R, Bentivoglio M, Borgioni C, Angeli F, et al. Atrial fibrillation in hypertension: predictors and outcome. Hypertension 2003; 41(2): 218-23.
38. Healey JS, Connolly SJ. Atrial fibrillation: hypertension as a causative agent, risk factor for complications, and potential therapeutic target. Am J Cardiol 2003; 91(10A): 9G-14G.
39. Stollberger C, Finsterer J. Treatment of esophagitis/vagitis-induced paroxysmal atrial fibrillation by proton-pump inhibitors. J Gastroenterol 2003; 38(11): 1109.
40. Weigl M, Gschwantler M, Gatterer E, Finsterer J, Stollberger C. Reflux esophagitis in the pathogenesis of paroxysmal atrial fibrillation: results of a pilot study. South Med J 2003; 96(11): 1128-32.
41. Harkonen M. Vomiting, nausea and episodic atrial fibrillation Duodecim 1999; 115(24): 2795-7.
42. Brodsky MA, Orlov MV, Allen BJ, Selvan A. Frozen yogurt near deep-freeze. Am J Cardiol 1994; 73(8): 617-8.
43. Wilson CL, Davis SJ. Recurrent atrial fibrillation with nausea and vomiting. Aviat Space Environ Med 1978; 49(4): 624-5.
44. Vermes E, Tardif JC, Bourassa MG, Racine N, Levesque S, White M, et al. Enalapril decreases the incidence of atrial fibrillation in patients with left ventricular dysfunction: insight from the Studies Of Left Ventricular Dysfunction (SOLVD) trials. Circulation 2003; 107(23): 2926-31.
45. Shi Y, Li D, Tardif JC, Nattel S. Enalapril effects on atrial remodeling and atrial fibrillation in experimental congestive heart failure. Cardiovasc Res 2002; 54(2): 456-61.
46. Holtwick R, Baba HA, Ehler E, Risse D, Vobeta M, Gehrmann J, et al. Left but not right cardiac hypertrophy in atrial natriuretic peptide receptor-deficient mice is prevented by angiotensin type 1 receptor antagonist losartan. J Cardiovasc Pharmacol 2002; 40(5): 725-34.
47. Pedersen OD, Bagger H, Kober L, Torp-Pedersen C. Trandolapril reduces the incidence of atrial fibrillation after acute myocardial infarction in patients with left ventricular dysfunction. Circulation 1999; 100(4): 376-80.
48. Aronson RS. Mechanisms of arrhythmias in ventricular hypertrophy. J Cardiovasc Electrophysiol 1991; 2: 249-61.
49. Coumel P, Thomas O, Leenhardt A. Drug therapy for prevention of atrial fibrillation. Am J Cardiol 1996; 77(3): 3A-9A.
50. Hirayama Y, Atarashi H, Kobayashi Y, Takano T. Angiotensin-converting enzyme inhibitors are not effective at inhibiting further fibrous changes in the atria in patients with chronic atrial fibrillation: speculation from analysis of the time course of fibrillary wave amplitudes. Jpn Heart J 2004; 45(1): 93-101.
51. Madrid AH, Bueno MG, Rebollo JM, Marin I, Pena G, Bernal E, et al. Use of irbesartan to maintain sinus rhythm in patients with long-lasting persistent atrial fibrillation: a prospective and randomized study. Circulation 2002; 106(3): 331-6.
52. Young-Xu Y, Jabbour S, Goldberg R, Blatt CM, Graboys T, Bilchik B, et al. Usefulness of statin drugs in protecting against atrial fibrillation in patients with coronary artery disease Am J Cardiol 2003; 92(12): 1379-83.
53. Korantzopoulos P, Kokkoris S. The antioxidant effects of statins may extend beyond atherosclerosis: potential benefits for atrial fibrillation and heart failure. Atherosclerosis 2004; 175(1): 187.
54. Korantzopoulos P, Kountouris E, Kolettis T, Siogas K. Anti-inflammatory and antioxidant actions of statins may favorably affect atrial remodeling in atrial fibrillation. Am J Cardiol 2004; 93(9): 1200.
55. Siu CW, Lau CP, Tse HF. Prevention of atrial fibrillation recurrence by statin therapy in patients with lone atrial fibrillation after successful cardioversion. Am J Cardiol 2003; 92(11): 1343-5.
56. Statins becoming ever more versatile. Now also for prevention of atrial fibrillation and depression. MMW Fortschr Med 2003; 145(16): 10.
57. Futterman LG, Lemberg L. Stroke risk, cholesterol and statins. Am J Crit Care1999; 8(6): 416-9.
58. Kumagai K, Nakashima H, Saku K. The HMG-CoA reductase inhibitor atorvastatin prevents atrial fibrillation by inhibiting inflammation in a canine sterile pericarditis model. Cardiovasc Res 2004; 62(1): 105-11.
59. Tveit A, Grundtvig M, Gundersen T, Vanberg P, Semb AG, Holt E, et al. Analysis of pravastatin to prevent recurrence of atrial fibrillation after electrical cardioversion. Am J Cardiol 2004; 93(6): 780-2.
60. Alberte C, Zipes DP. Use of nonantiarrhythmic drugs for prevention of sudden cardiac death. J Cardiovasc Electrophysiol 2003; 14(9 Suppl): S87-95.
61. Topol EJ, Lerman BB. Hypomagnesemic torsades de pointes. Am J Cardiol 1983; 52(10): 1367-8.
62. Gottlieb SS, Fisher ML, Pressel MD, Patten RD, Weinberg M, Greenberg N. Effects of intravenous magnesium sulfate on arrhythmias in patients with congestive heart failure. Am Heart J 1993; 125(6): 1645-50.
63. James MF, Beer RE, Esser JD. Intravenous magnesium sulfate inhibits catecholamine release associated with tracheal intubation. Anesth Analg 1989; 68(6): 772-6.
64. Fox CH, Ramsoomair D, Mahoney MC, Carter C, Young B, Graham R. An investigation of hypomagnesemia among ambulatory urban African-Americans. J Fam Pract 1999; 48(8): 636-9.
65. Topalov V, Kovacevic D, Topalov A, Kovacevic D. Magnesium in cardiology. Med Pregl 2000; 53(5-6): 319-24.
66. Fox C, Ramsoomair D, Carter C. Magnesium: its proven and potential clinical significance. South Med J 2001; 94(12): 1195-201.
67. Frick M, Darpo B, Ostergren J, Rosenqvist M. The effect of oral magnesium, alone or as an adjuvant to sotalol, after cardioversion in patients with persistent atrial fibrillation. Eur Heart J 2000; 21(14): 1177-85.
68. MacFadyen RJ, Barr CS, Struthers AD. Aldosterone blockade reduces vascular collagen turnover, improves heart rate variability and reduces early morning rise in heart rate in heart failure patients. Cardiovasc Res 1997; 35(1): 30-4.
69. Pitt B, Zannad F, Remme WJ, Cody R, Castaigne A, Perez A, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med 1999; 341(10): 709-17.
70. Rocha R, Stier CT Jr, Kifor I, Ochoa-Maya MR, Rennke HG, Williams GH, et al. Aldosterone: A mediator of myocardial necrosis and renal arteriopathy. Endocrinology 2000; 141(10):3871-8.
71. Benetos A, Lacolley P, Safar ME. Prevention of aortic fibrosis by spironolactone in spontaneously hypertensive rats. Arterioscler Thromb Vasc Biol 1997; 17(6): 1152-6.
72. Zannad F, Alla F, Dousset B, Perez A, Pitt B. Limitation of excessive extracellular matrix turnover may contribute to survival benefit of spironolactone therapy in patients with congestive heart failure: insights from the randomized aldactone evaluation study (RALES). RALES Investigators. Circulation 2000; 102(22): 2700-06.
73. Stier CT Jr, Chander PN, Rocha R. Aldosterone as a mediator in cardiovascular injury. Cardiol Rev 2002; 10(2): 97-107.
74. Barr CS, Lang CC, Hanson J, Arnott M, Kennedy N, Struthers AD. Effects of adding spironolactone to an angiotensin-converting enzyme inhibitor in chronic congestive heart failure secondary to coronary artery disease. Am J Cardiol 1995; 76(17): 1259-65.
75. Farquharson CA, Struthers AD. Aldosterone induces acute endothelial dysfunction in vivo in humans: evidence for an aldosterone-induced vasculopathy. Clin Sci (Lond) 2002; 103(4): 425-31.
76. Lal A, Veinot JP, Leenen FH. Prevention of high salt diet-induced cardiac hypertrophy and fibrosis by spironolactone. Am J Hypertens 2003; 16(4): 319-23.
77. Cittadini A, Casaburi C, Monti MG, Di Gianni A, Serpico R, Scherillo G, et al. Effects of canrenone on myocardial reactive fibrosis in a rat model of postinfarction heart failure. Cardiovasc Drugs Ther 2002; 16(3): 195-201.
78. Siscovick DS, Raghunathan TE, King I, Weinmann S, Wicklund KG, Albright J, et al. Dietary intake and cell membrane levels of long-chain n-3 polyunsaturated fatty acids and the risk of primary cardiac arrest. JAMA 1995; 274(17): 1363-7.
79. de Lorgeril M, Salen P, Martin JL, Monjaud I, Delaye J, Mamelle N. Mediterranean diet, traditional risk factors, and the rate of cardiovascular complications after myocardial infarction: final report of the Lyon Diet Heart Study. Circulation 1999; 99(6): 779-85.
80. Gruppo Italiano per lo Studio della Sopravvivenza nell’ Infarto miocardico. Dietary supplementation with n-3 polyunsaturated fatty acids and vitamin E after myocardial infarction: results of the GISSI-Prevenzione trial. Lancet 1999; 354(9177): 447-55.
81. Christensen JH, Korup E, Aaroe J, Toft E, Moller J, Rasmussen K, et al. Fish consumption, n-3 fatty acids in cell membranes, and heart rate variability in survivors of myocardial infarction with left ventricular dysfunction. Am J Cardiol 1997; 79(12): 1670-3.
82. Pepe S, McLennan PL. Dietary fish oil confers direct antiarrhythmic properties on the myocardium of rats. J Nutr 1996; 126(1): 34-42.
83. Kinoshita I, Itoh K, Nishida-Nakai M, Hirota H, Otsuji S, Shibata N. Antiarrhythmic effects of eicosapentaenoic acid during myocardial infarction-enhanced cardiac microsomal (Ca(2+)-Mg2+)-ATPase activity. Jpn Circ J 1994; 58(12): 903-12.
84. Grimsgaard S, Bonaa KH, Hansen JB, Myhre ES. Effects of highly purified eicosapentaenoic acid and docosahexaenoic acid on hemodynamics in humans. Am J Clin Nutr 1998; 68(1): 52-9.
85. Kang JX, Leaf A. Antiarrhythmic effects of polyunsaturated fatty acids. Recent studies. Circulation 1996; 94(7): 1774-80.
86. Kris-Etherton PM, Harris WS, Appel LJ. Fish consumption, fish oil, omega-3 fatty acids, and cardiovascular disease. Circulation 2002; 106(21): 2747-57.
87. Nedostup AV, Solov’eva AD, San’kova TA. Use of clonaze-pam for treatment of patients with paroxysmal atrial fibrillation with regard to their psychoautonomic status. Ter Arkh 2003; 75(8): 35-8.
88. Bigger JT Jr. Epidemiological and mechanistic studies of atrial fibrillation as a basis for treatment strategies. Circulation 1998; 98(10): 943-5.
89. Van-Noord T, Tieleman RG, Bosker HA, Kingma T, Van-Veldhuisen DJ, Crijns HJ, et al. Beta-blockers prevent subacute recurrences of persistent atrial fibrillation only in patients with hypertension. Europace 2004; 6(4): 343-50.
90. Lieberman R, Grenz D, Mond HG, Gammage MD. Selective site pacing: defining and reaching the selected site. Pacing Clin Electrophysiol 2004; 27(6 Pt 2): 883-6.
91. Padeletti L, Michelucci A, Pieragnoli P, Colella A, Musilli N. Atrial septal pacing: a new approach to prevent atrial fibrillation. Pacing Clin Electrophysiol 2004; 27(6 Pt 2): 850-4.
92. Leenhardt A, Extramiana F, Cauchemez B, Denjoy I, Maison-Blanche P, Coumel P. Role of antiarrhythmics in the treatment of paroxysmal atrial fibrillation. Arch Mal Coeur Vaiss 2002; 95 (Spec No 5): 7-13.
93. Reiffel JA. Drug choices in the treatment of atrial fibrillation. Am J Cardiol 2000; 85(10A): 12D-19D.
94. Roden DM. Risks and benefits of antiarrhythmic therapy. N Engl J Med 1994; 331(12): 785-91.
95. Coplen SE, Antman EM, Berlin JA, Hewitt P, Chalmers TC. Efficacy and safety of quinidine therapy for maintenance of sinus rhythm: a meta-analysis of randomized clinical trials. Circulation 1990; 82(4): 1106-16.
96. Falk RH. Proarrhythmia in patients treated for atrial fibrillation or flutter. Ann Intern Med 1992; 117(2): 141-50.
97. Roden DM. Antiarrhythmic drugs: from mechanisms to clinical practice. Heart 2000, 84(3): 339-46
98. Prystowsky EN. Management of atrial fibrillation: therapeutic options and clinical decisions. Am J Cardiol 2000; 85(10A): 3D-11D.
99. Jackman WM, Friday KJ, Anderson JL, Aliot EM, Clark M, Lazzara R. The long QT syndromes: a critical review, new clinical observations and a unifying hypothesis. Prog Cardiovasc Dis 1988; 31(2): 115-22.
100. Ben-David J, Zipes DP, Ayers GM, Pride HP. Canine left ventricular hypertrophy predisposes to ventricular tachycardia induction by phase 2 early afterdepolarizations after administration of BAY K 8644. J Am Coll Cardiol 1992; 20(7): 1576-84.
101. Roy D, Talajic M, Dorian P, Connolly S, Eisenberg MJ, Green M, et al. Amiodarone to prevent recurrence of atrial fibrillation. Canadian Trial of Atrial Fibrillation Investigators. N Engl J Med 2000; 342(13): 913-20.
102. The Cardiac Arrhythmia Suppression Trial (CAST) Investigators. Preliminary report. Effect of encainide and flecainide on mortality in a randomized trial of arrhythmia suppression after myocardial infarction. N Engl J Med 1989; 321(6): 406-12.
103. Cairns JA, Connolly SJ, Roberts R, Gent M. The Canadian Amiodarone Myocardial Infarction Arrhythmia Trial Investigators. Randomized trial of outcome after myocardial infarction in patients with frequent or repetitive ventricular premature depolarizations: CAMIAT. Lancet 1997; 349 (9053): 675-82.
104. Doval HC, Nul DR, Grancelli HO, Perrone SV, Bortman GR, Curiel R. Randomized trial of low-dose amiodarone in severe congestive heart failure. Lancet 1994; 344(8921): 493-8.
105. Grosselink AT, Crijns HJ, Van Gelder IC, Hillige H, Wiesfeld AC, Lie KI. Low-dose amiodarone for maintenance of sinus rhythm after cardioversion of atrial fibrillation or flutter. JAMA 1992; 267(24): 3289-93.
106. Julian DG, Camm AJ, Frangin G, Janse MJ, Munoz A, Schwartz PJ, et al. Randomised trial of effect of amiodarone on mortality in patients with left-ventricular dysfunction after recent myocardial infarction: EMIAT. European Myocardial Infarct Amiodarone Trial Investigators. Lancet 1997; 349(9053): 667-74.
107. Massie BM, Fisher SG, Radford M, Deedwania PC, Singh BN, Fletcher RD, et al. Effect of amiodarone on clinical status and left ventricular function in patients with congestive heart failure. CHF STAT Investigators. Circulation 1996; 93(12): 2128-34.
108. Hassink RJ, Aretz HT, Ruskin J, Keane D. Morphology of atrial myocardium in human pulmonary veins: a postmortem analysis in patients with and without atrial fibrillation. J Am Coll Cardiol 2003; 42(6): 1108-14.
109. Haissaguerre M, Fischer B, Labbe T, Lemetayer P, Montserrat P, d’ Ivernois C, et al. Frequency of recurrent atrial fibrillation after catheter ablation of overt accessory pathways. Am J Cardiol 1992; 69(5): 493-7.
110. Haissaguerre M, Gencel L, Fischer B, Le Metayer P, Poquet F, Marcus FI, et al. Successful catheter ablation of atrial fíbrillation. J Cardiovasc Electrophysiol 1994; 5(12): 1045-52.
111. Seshadri N, Marrouche NF, Wilber D, Packer D, Natale A. Pulmonary vein isolation for treatment of atrial fibrillation: recent updates. Pacing Clin Electrophysiol 2003; 26(7 Pt 2): 1636-40.
112. Pappone C, Santinelli V, Manguso F, Vicedomini G, Gugliotta F, Augello G, et al. Pulmonary vein denervation enhances long-term benefit after circumferential ablation for paroxysmal atrial fibrillation. Circulation 2004; 109(3):327-34.
113. Pappone C, Rosanio S, Augello G, Gallus G, Vicedomini G, Mazzone P, et al. Mortality, morbidity, and quality of life after circumferential pulmonary vein ablation for atrial fibrillation: outcomes from a controlled nonrandomized long-term study. J Am Coll Cardiol 2003; 42(2): 185-97.
114. Pachon J. Atrial fibrillation treatment. North American Society of Pacing and Electrophysiology Meeting, San Francisco, May 20-22, 2004.
115. Andersen HR, Thuesen L, Bagger JP, Vesterlund T, Thomsen PE. Prospective randomized trial of atrial versus ventricular pacing in sick sinus syndrome. Lancet 1994; 344(8936): 1523-8.
116. Attuel P, Pellerin D, Mugica J, Coumel P. DDD pacing: an effective treatment modality for recurrent atrial arrhythmias. Pacing Clin Electrophysiol 1988; 11(11 Pt 2): 1647-54.
117. Daubert C, Mabo P, Berder V. Atrial tachyarrhythmias associated with high degree interatrial conduction block: prevention by permanent atrial resynchronization. J Cardiovasc Pacing Electrophysiol 1994; 4: 35-44.
118. Kristensen L, Nielsen JC, Mortensen PT, Christensen PD, Vesterlund T, Pedersen AK et al. Sinus and paced P wave duration and dispersion as predictors of atrial fibrillation after pacemaker implantation in patients with isolated sick sinus syndrome. Pacing Clin Electrophysiol 2004; 27(5): 606-14.
119. Padeletti L, Purerfellner H, Adler SW, Waller TJ, Harvey M, Horvitz L, et al. Worldwide ASPECT Investigators. Combined efficacy of atrial septal lead placement and atrial pacing algorithms for prevention of paroxysmal atrial tachyarrhythmia. J Cardiovasc Electrophysiol 2003; 14(11): 1189-95.
120. Hertervig E, Yuan S, Liu S, Kongstad O, Luo J, Olsson SB. Electroanatomic mapping of transseptal conduction during coronary sinus pacing in patients with paroxysmal atrial fibrillation. Scand Cardiovasc J 2003; 37(6): 340-3.
121. Cox JL, Schuessler RB, D’Agostino HJ Jr, Stone CM, Chang BC, Cain ME, et al. The surgical treatment of atrial flbrillation. J Thorac Cardiovasc Surg 1991; 101(4): 569-83.
122. Kosakai Y, Kawaguchi AT, Isobe F, Sasako Y, Nakano K, Eishi K, et al. Modified maze procedure for patients with atrial fibrillation undergoing simultaneous open heart surgery. Circulation 1995; 92(9 Suppl): II359-64.
123. Melo JQ, Santiago T, Gouveia RH, Martins AP. Atrial ablation for the surgical treatment of atrial fibrillation: principles and limitations. J Card Surg 2004; 19(3): 207-10.
124. Melo J. Concomitant surgery for atrial fibrillation in the patient undergoing mitral surgery. Rev Esp Cardiol 2001; 54(6): 675-6.
125. Stanham R, Cura L, Pizzano N, Vignolo G, Fernández Banizi P, Casinelli M, et al. Ablación intraoperatoria de fibrilación auricular crónica por radiofrecuencia irrigada. Resultados a corto y mediano plazo. Congreso Uruguayo de Cardiología, 20. Montevideo, nov. 2004. Rev Urug Cardiol 2004; 19(2-3): 177-8.
126. Maisel WH, Rawn JD, Stevenson WG. Atrial fibrillation after cardiac surgery. Ann Intern Med 2001; 135(12): 1061-73.
127. Auer J, Weber T, Berent R, Puschmann R, Hartl P, Ng CK, et al. Study of Prevention of Postoperative Atrial Fibrillation. A comparison between oral antiarrhythmic drugs in the prevention of atrial fibrillation after cardiac surgery: the pilot study of prevention of postoperative atrial fibrillation (SPPAF), a randomized, placebo-controlled trial. Am Heart J 2004; 147(4): 636-43.
128. Crystal E, Connolly SJ, Sleik K, Ginger TJ, Yusuf S. Interventions on prevention of postoperative atrial fibrillation in patients undergoing heart surgery: a meta-analysis. Circulation 2002; 106(1): 75-80.
129. Crystal E, Healey J, Connolly SJ. Atrial fibrillation after cardiac surgery: update on the evidence on the available prophylactic interventions. Card Electrophysiol Rev 2003; 7(2): 189-92.