Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Médica del Uruguay
versión On-line ISSN 1688-0390
Rev. Méd. Urug. vol.20 no.3 Montevideo dic. 2004
Cáncer localizado de próstata.
Experiencia de diez años con radioterapia conformal tridimensional
Dres. Felix Leborgne*, José H. Leborgne†, Eduardo Zubizarreta‡,
Bettys Ortega§, José Leborgne Deus¶, Francisco Leborgne††,
Sergio Aguiar‡‡, Ing. Fís. René Curochquin§§, Bioestadística Julieta Mezzera¶¶, Téc. Rad. Mercedes Mullin†††, A/C Jorge Beraza§§§
Departamento de Radioterapia del Hospital Italiano y del Instituto
de Radiología y Centro de Lucha contra el Cáncer,
Centro Hospitalario Pereira Rossell, Montevideo. Uruguay
Resumen
Se analizaron 560 pacientes consecutivos con cáncer localizado de próstata tratados con radioterapia conformal tridimensional entre 1993 y 2001. La sobrevida global actuarial a los nueve años fue de 71%, y la sobrevida causa específica de 88%. La mortalidad cruda por cáncer de próstata fue de 4,8% mientras que la mortalidad por otras causas fue de 8,3%. La sobrevida libre de recaída bioquímica en función del grupo de riesgo fue de 83%, 68% y 41% a los nueve años, respectivamente para los grupos de riesgo bajo, intermedio y alto en 504 pacientes (p<0,05). La dosis mayor o igual a 72 Gy mejora el control bioquímico a los siete años en todos los grupos de riesgo aunque sólo es estadísticamente significativa en el grupo de riesgo alto (p<0,006). El modelo de Cox reveló que solamente el grupo de riesgo, la dosis total como variable continua y el antígeno prostático específico inicial como variable categórica fueron significativos. Cuando el modelo de Cox fue aplicado a los 188 pacientes de riesgo alto, el uso de la hormonoterapia de inducción o concomitante, o ambas, y la edad, resultaron además significativos. La tasa actuarial de complicaciones severas a diez años grados 3 y 4 (no hubo complicaciones grado 5) fue de 1,2% para las urinarias y de 1,4% para las digestivas. La radioterapia conformal tridimensional a altas dosis es un tratamiento efectivo y de baja morbilidad para el tratamiento del cáncer localizado de próstata.
Palabras clave: NEOPLASMAS DE PROSTATA - radioterapia
RADIOTERAPIA CONFORMAL
* Director, Instituto de Radiología y Centro de Lucha contra el Cáncer, Centro Hospitalario Pereira Rossell.
† Jefe del Departamento de Radioterapia, Hospital Italiano.
‡ Radioterapeuta, Departamento de Radioterapia, Hospital Italiano.
§ Radioterapeuta, Instituto de Radiología y Centro de Lucha contra el Cáncer, Centro Hospitalario Pereira Rossell.
¶ Radioterapeuta, Departamento de Radioterapia, Hospital Italiano.
†† Radiólogo, Instituto de Radiología y Centro de Lucha contra el Cáncer, Centro Hospitalario Pereira Rossell.
‡‡ Radioterapeuta, Departamento de Radioterapia, Hospital Italiano.
§§ Departamentos de Física del Instituto de Radiología y Centro de Lucha contra el Cáncer, Centro Hospitalario Pereira Rossell, y del Hospital Italiano.
¶¶ Departamentos de Bioestadística del Instituto de Radiología y Centro de Lucha contra el Cáncer, Centro Hospitalario Pereira Rossell, y del Hospital Italiano.
††† Departamento de Radioterapia del Hospital Italiano.
§§§ Departamento de Informática del Hospital Italiano.
Correspondencia: Dr. Felix Leborgne
Casilla Postal 6571, 11100 Montevideo, Uruguay.
E-mail: flebor@adinet.com.uy
Presentado: 6/1/04.
Aceptado: 24/9/04.
Introducción
En Uruguay el cáncer de próstata tiene una incidencia anual de 41,9/100.000 y una mortalidad anual de 21,2/100.000. Representa la segunda causa más frecuente de cáncer en el hombre y la segunda causa de mortalidad más frecuente por cáncer en el hombre(1). Con la incorporación de la determinación de la concentración plasmática de antígeno prostático específico (PSA) en pacientes asintomáticos desde comienzos de la década de 1990, hemos asistido a una migración de la estadificación clínica del cáncer hacia los estadios más iniciales. Todavía no se ha demostrado que estos efectos hayan disminuido la mortalidad por cáncer de próstata, salvo algunas excepciones(2).
El cáncer localizado de próstata puede tratarse con prostatectomía, radioterapia u observación sin tratamiento(3,4). La observación está reservada para pacientes cuya expectativa de vida y enfermedad neoplásica de bajo riesgo haga pensar que no necesitarán tratamiento activo para una enfermedad relativamente indolente(5,6). La cirugía y la radioterapia a altas dosis tienen equivalentes resultados de curación, aunque no se han realizado buenos ensayos aleatorios para demostrarlo.
La radioterapia externa a altas dosis sin complicaciones sólo es posible con técnica conformal tridimensional o técnica de intensidad modulada. Las ventajas de la radioterapia conformal tridimensional son: el volumen tratado a altas dosis se adapta exactamente al volumen de planeamiento en las tres dimensiones, existe, por lo tanto, una mejor protección de los tejidos sanos vecinos, pudiéndose aumentar las dosis administradas al tumor sin incrementar las complicaciones, lo que permite aumentar el porcentaje de curaciones(7,8).
En este trabajo se analizan los resultados obtenidos con esta técnica, y en nuestro conocimiento constituye la primera publicación sobre resultados de tratamiento de cáncer de próstata localizado que se presenta en Uruguay.
Material y método
Se revisaron las historias clínicas de pacientes con cáncer de próstata vistos entre el 1º de enero de 1993 y el 30 de junio de 2001 y se analizaron 561 pacientes consecutivos con cáncer localizado tratados con irradiación conformal tridimensional radical, con o sin hormonoterapia de inducción o concomitante, que no tuvieran evidencia patológica o imagenológica de adenopatías metastásicas pelvianas, ni signos de diseminación a distancia u ósea. Se excluyó del análisis un paciente que debió interrumpir el tratamiento por intolerancia. La mediana de edad fue de 70 años (rango 48-85). La mediana del tiempo de observación hasta el 31 de julio de 2003 fue de 56 meses (rango 24-125).
La estadificación clínica por el sistema AJCC(9) se detalla en la tabla 1. Los pacientes estadificados luego de iniciar hormonoterapia previo a la consulta en nuestros hospitales seguramente han sufrido un retroceso en su estadio clínico T (backstaging), que les habrá permitido artificialmente ingresar en los grupos de mejor pronóstico.
Doscientos seis pacientes presentaron un PSA inicial menor a 10 ng/ml (MEIA, Abbott Laboratories), 196 con valores entre 10 y 19,9 ng/ml, y 158 con valores mayores a 20 ng/ml (rango 20-203).
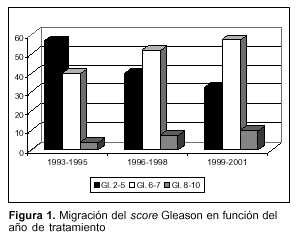
Todos los pacientes tuvieron confirmación histopatológica de la enfermedad a través de biopsias transrectales, transperineales o por resección transuretral (RTU). Las sumas de los puntajes de Gleason (score) fueron las siguientes: Gleason 2-6, 402 pacientes; Gleason 7, 113 pacientes; Gleason 8-10, 45 pacientes. En el curso del estudio hemos asistido a una migración del score de Gleason hacia valores más altos (figura 1). Este hecho es conocido y ya ha sido descrito por otros autores(10,11). Puede introducir confusión cuando se comparan grupos de pacientes tratados en diferentes épocas.
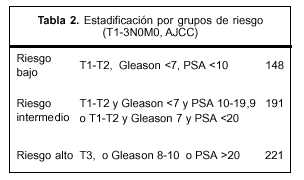
La estadificación por grupos de riesgo se observa en la tabla 2.
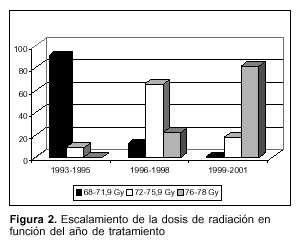
Todos los pacientes fueron tratados con radioterapia conformal tridimensional en decúbito dorsal(12), sin inmovilizadores especiales. Se simularon en forma convencional con uretrocistografía retrógrada en vejiga llena y luego con un tomógrafo helicoidal con una mesa adaptada a la geometría de la mesa del acelerador utilizando un espesor de corte de 3,2 mm, un pitch de 1:1 y un fantoma para corrección de la heterogeneidad píxel por píxel. Se adquirieron las imágenes tomográficas por medio de un escáner (Vidar Systems Corporation, Hendon, Virginia, USA) o directamente con disco óptico en los sistemas de planificación computadorizada de radioterapia tridimensional (ROCS, Radiation Oncology Comuter Systems, Carlsbad, California, USA, o Focus 9200SP TPS, CMS, St. Louis, USA). Se delinearon los contornos de la próstata y de las vesículas seminales para obtener el volumen clínico correspondiente a ambos órganos en conjunto y a la próstata solamente (CTV1 y CTV2, respectivamente). Opcionalmente se delinearon otras áreas de interés, como recto, vejiga y cuellos de fémur. Se expandieron automáticamente los contornos CTV1 y CTV2 uniformemente 10 mm obteniendo el volumen de planeamiento (PTV1 y PTV2). Los PTV1 y PTV2 fueron a su vez expandidos 5 mm para contemplar la penumbra de los bloques de cerrobend con cuatro campos conformados coplanares y cuatro no coplanares(13). El límite inferior del PTV se topografió 5 mm caudal al cono de la uretrografía. Se desarrollaron histogramas dosis/volumen para el recto a fin de determinar la factibilidad de la planificación obtenida. Se utilizaron aceleradores lineales de 6 MV (Clinac 6/00 y 600C, Varian Medical Systems, Palo Alto, California, USA). La irradiación fue administrada por cuatro campos ortogonales anteroposteriores y laterales y cuatro campos oblicuos no coplanares. Los pacientes con prótesis de cadera necesitaron planificaciones individualizadas. Los sistemas de planificación computadorizada permiten la generación virtual de visión desde el foco del haz (BEV) para diseño de filtros de cerrobend conformados individualmente para cada campo de todos los pacientes. La dosis total calculada al centro de cruzamiento de los haces en la próstata (punto ICRU)(14) fue entre 68 Gy y 78 Gy, 2 Gy por fracción, cinco días en la semana. La figura 2 muestra que hubo un escalamiento de la dosis en función del año de tratamiento, de acuerdo con nuestra estrategia consistente con la evidencia de que mayores dosis administradas logran mejores resultados(15). Se utilizaron las tablas de Partin(16) para decidir si los pacientes eran irradiados sólo en la próstata, en próstata y vesículas seminales, o en próstata, vesículas seminales y cadenas ganglionares pelvianas. Las dosis en las vesículas seminales oscilaron entre 54 Gy y 64 Gy y las cadenas ganglionares se irradiaron hasta 44 Gy. Teniendo en cuenta la reducción del volumen del PTV, el número total de campos para cada paciente osciló entre 8 y 14. Semanalmente se verificó la alineación de los campos de irradiación con radiografías de verificación obtenidas con el haz de irradiación en los campos anteroposteriores y laterales y se compararon con las radiografías obtenidas en el simulador o las radiografías reconstruidas digitalmente (DRR), o ambas.
Los objetivos primarios analizados fueron la sobrevida global, la sobrevida causa específica, la sobrevida libre de recaída bioquímica y las complicaciones alejadas. Los objetivos secundarios incluyeron los efectos de varias variables en la sobrevida. El análisis univariado se efectuó comparando grupos de pacientes usando el test chi cuadrado con un grado de libertad. El programa estadístico SPSS (SPSS Inc. Chicago) fue utilizado para el análisis multivariado del modelo de Cox(17) y para la determinación de las curvas de sobrevida. Se aplicó el consenso ASTRO(18,19) para determinar la recaída bioquímica: tres elevaciones sucesivas de PSA luego del nadir y clasificación como evento entre la fecha del nadir y de la primera recaída de PSA (se aplica, por lo tanto, un sistema de retrodatación del evento). Las curvas de sobrevida actuariales se calcularon según el método de Kaplan-Meier(20). La comparación entre curvas se realizó con el log rank test(21). La significación fue definida como p<0,05.
Las complicaciones tardías se determinaron de acuerdo a la clasificación de RTOG/LENT (ver apéndice)(22) y su probabilidad actuarial (Kaplan-Meier) fue estimada computando el evento de más alta gradación en cada paciente.
Los pacientes fueron seguidos cada seis meses luego del tratamiento con una determinación de PSA y un examen digital rectal hasta el 1º de julio de 2003.
Resultados
Hay cinco pacientes perdidos de vista (0,9%). La sobrevida global actuarial a los nueve años fue de 71%, y la sobrevida causa específica de 88%. La mortalidad cruda por cáncer de próstata fue de 4,8% mientras que la mortalidad por otras causas fue de 8,3%. El modelo de Cox mostró que solamente la presencia de metástasis a distancia fue un factor pronóstico significativo para la mo rtalidad global (p<0,001). La edad, el PSA inicial y la recaída bioquímica no fueron significativos, probablemente debido a la baja tasa de eventos.
La sobrevida libre de recaída bioquímica en función del grupo de riesgo fue de 83%, 68% y 41% a los nueve años, respectivamente, para los grupos de riesgo bajo, intermedio y alto en 504 pacientes (p<0,05) (figura 3). Para estos resultados se excluyeron 31 pacientes que presentaron una recaída bioquímica dentro de los 12 meses de iniciado el tratamiento con un tacto rectal normal, pues se consideró que estos pacientes presentaban enfermedad metastásica (M1) previa al tratamiento. También se excluyeron 21 pacientes cuya determinación de PSA postratamiento se ignora: cinco están perdidos de vista y el resto presenta una afección severa, vive en casa de salud con enfermedad de Alzheimer, o se niega a efectuar las determinaciones de control. Se sabe que todos los integrantes de este último grupo están en remisión clínica.
Las figuras 4 y 5 muestran los resultados de control bioquímico para los mismos 504 pacientes de la figura 3, de acuerdo a haber recibido una dosis menor a 72 Gy o mayor o igual a 72 Gy. La mediana de observación fue de 101 meses y 51 meses para ambos grupos, respectivamente. La dosis más elevada mejora el control bioquímico a los siete años en todos los grupos de riesgo aunque sólo es estadísticamente significativa en el grupo de riesgo alto (p<0,006).
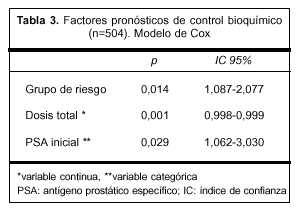
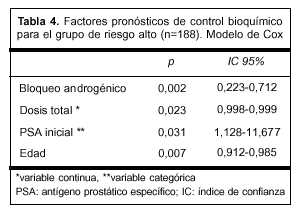
El modelo de Cox aplicado a los mismos 504 pacientes reveló que solamente el grupo de riesgo, la dosis total como variable continua y el PSA inicial como variable categórica fueron significativos para el control bioquímico. Cuando el modelo de Cox fue aplicado a los 186 pacientes de riesgo alto, el uso de la hormonoterapia de inducción o concomitante, o ambos, y la edad, resultaron además significativos. Los pacientes más jóvenes tuvieron peor pronóstico (tablas 3 y 4).
Si sólo se consideran 157 pacientes de los grupos de riesgo intermedio y alto con hormonoterapia y 229 pacientes de los mismos grupos sin hormonoterapia, la sobrevida libre de recaída bioquímica fue de 73% versus 45%, respectivamente, a los nueve años (p=0,012) (figura 6). Este hecho ya fue observado por otros investigadores(23).
El efecto del nadir de PSA posirradiación en la sobrevida cruda libre de recaída bioquímica, para pacientes tratados con radioterapia exclusiva sin hormonoterapia, fue el siguiente: con un nadir menor o igual a 1 ng/ml en 257 pacientes se controlaron 81% versus 46% en 100 pacientes con nadir mayor a 1 ng/ml (p<0,001). El efecto del tiempo en que se presenta el nadir luego de finalizada la irradiación fue el siguiente: con la aparición del nadir menor o igual a 12 meses en 69 pacientes se controlaron 43% versus 81% de 228 pacientes con aparición del nadir mayor a 12 meses (p<0,001). Estos datos no pueden ser extrapolados a los pacientes que también recibieron hormonoterapia en adición a la radioterapia porque la expresión del nadir tiene un perfil diferente bajo el efecto de las hormonas.
La sobrevida actuarial causa específica a los cinco años para 146 pacientes con recaída bioquímica a partir de la primera recaída fue de 76%, con una mediana de sobrevida de 87 meses.
El control clínico local por medio del examen digital sólo pudo comprobarse en 480 pacientes de los cuales 457 (95%) obtuvo un control local. En los restantes 80 pacientes (todos con recaída bioquímica) no fue posible realizar un examen digital antes de que se les administrara hormonoterapia y, por lo tanto, su situación local es incierta.
La tasa cruda de las complicaciones urinarias y digestivas tardías grados 1-5 fue de 14% en 298 pacientes irradiados con dosis menor a 76 Gy versus 13% para 262 pacientes irradiados con dosis mayor o igual a 76 Gy (p=NS). La mayor parte de las complicaciones regresan espontáneamente o con tratamientos. La tasa actuarial de complicaciones severas grados 3 y 4 a diez años (no hubo complicaciones grado 5) fue de 1,2% para las urinarias y de 1,4% para las digestivas. Todas las complicaciones tardías severas se habían expresado dentro de los primeros 40 meses de terminado el tratamiento. La RTU previa al tratamiento no fue un factor significativo para complicaciones tardías vesicales. Tres de seis pacientes sufrieron incontinencias severas de orina luego de ser tratados por RTU o uretrotomía posteriormente a la irradiación, para aliviar una obstrucción crónica del tracto urinario bajo. Los pacientes tratados con hormonoterapia no tuvieron una tasa mayor de complicaciones tardías, en contra de lo que se ha señalado en la literatura(24).
Discusión
Los resultados presentados en este trabajo muestran que en Uruguay es posible tratar con irradiación externa el cáncer localizado de próstata y obtener controles bioquímicos comparables con los publicados en la literatura. Cuando se hacen comparaciones con resultados de otros centros hay que tener en cuenta los factores que inciden en el control bioquímico tales como la dosis total administrada, el año en que el tratamiento fue realizado y la mediana de seguimiento de los pacientes.
Por ejemplo, Zelefsky y colaboradores(25) han presentado resultados de control bioquímico de 460 pacientes del Hospital Memorial Sloan-Kettering de Nueva York, con una mediana de observación de nueve años a los que administrara 79 Gy (dosis en el punto ICRU). En realidad sus tasas de control bioquímico de 83%, 50% y 42% para los grupos de riesgo bajo, intermedio y alto, respectivamente, son ligeramente inferiores a las presentadas en la figura 5 con una dosis mayor a 72 Gy. Estos pacientes de la figura 5 tienen una mediana de seguimiento de 51 meses, menor que la de Zelefsky y colaboradores(25), y es posible que con el tiempo estos resultados desmejoren en virtud de la retrodatación del fracaso bioquímico resultante del consenso ASTRO.
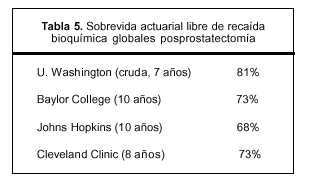
Naturalmente, una comparación con los resultados quirúrgicos tampoco es posible pues los pacientes sometidos a prostatectomía son seleccionados en forma diferente, normalmente se excluyen los estadios T3 y PSA iniciales muy elevados. La cirugía, además, se beneficia de la frecuente sobrepuntuación del score Gleason de la pieza de prostatectomía comparando con la biopsia transrectal obtenida antes de la operación(11). A fines solamente comparativos señalamos los resultados de cuatro series quirúrgicas estadounidenses en la tabla 5.
El segundo aspecto que señalan los resultados de este trabajo se refiere al beneficio de la escalada de la dosis. Se ha observado que es posible curar más pacientes con mayor dosis. Actualmente consideramos que la dosis óptima debe ser mayor o igual a 78 Gy. El aumento de dosis no se ha visto relacionado con un incremento de las complicaciones. Nuestras cifras coinciden con las del ensayo aleatorizado 3DOG/RTOG 9406, donde las ramas de 71,8 Gy y 77,5 Gy de grupos de riesgo bajo e intermedio mostraron una idéntica tasa actuarial a los 36 meses de 14% de grados 2-5 de complicaciones tardías(26).
Nuestra sobrevida causa específica de 76% a los cinco años luego de la primera recaída bioquímica es también comparable con la publicada por Sandler y colaboradores, de la Universidad de Michigan, de 73% a los cinco años luego de la tercera determinación de recaída bioquímica(27).
Este estudio tiene la debilidad de poseer los sesgos potenciales de un análisis retrospectivo. En 172 pacientes se realizó una estadificación clínica poshormonoterapia de inducción, hecho que potencialmente ha de resultar en una subestadificación al producir una migración de mayor a menor estadio, perjudicando los resultados de la radioterapia dentro de cada grupo de riesgo. No fue posible realizar una revisión centralizada de la histopatología. Salvo excepciones, no hay un diagnóstico histopatológico de recidiva local. Los pacientes tratados con dosis de radiación mayores tienen menos duración de seguimiento, y el control bioquímico depende también de la duración del seguimiento(28). Los pacientes fueron tratados en años diferentes y se ha descrito la influencia del año del tratamiento en los resultados(29).
Por otra parte, existen las siguientes fortalezas en este estudio: es una serie numerosa de pacientes estadificados y tratados por el mismo grupo de especialistas con la misma técnica conformal tridimensional. La evolución es conocida en 99,1% de los pacientes.
Conclusiones
En una población de pacientes con adenocarcinoma localizado de próstata como la descrita, la mayor parte de los pacientes que fallecen lo hace por causas distintas al carcinoma prostático. Los pacientes con recaídas bioquímicas, si no fallecen de otras causas, fallecerán de cáncer de próstata. La escalada de dosis de radioterapia aumenta el control bioquímico en todos los grupos de riesgo, pero especialmente en los de alto riesgo. En pacientes de riesgo intermedio y alto la adición de hormonoterapia mejora el control bioquímico. En pacientes sin hormonoterapia, un nadir menor o igual a 1 ng/ml y su manifestación más de 12 meses después del tratamiento, estuvo significativamente correlacionada con el control bioquímico. La radioterapia externa conformal tridimensional permite incrementar la dosis de radioterapia sin aumentar la tasa de complicaciones. La tasa actuarial a los diez años de complicaciones severas digestivas y urinarias fue de 1,4% y 1,2%, respectivamente. Nuestros resultados son comparables con los resultados de cirugía y radioterapia publicados en la literatura(30,31).
Apéndice. Complicaciones tardías de acuerdo a RTOG/LENT (simplificada)(22)
Urinarias:
Grado 1: Nicturia doble de la basal. Microhematuria.
Grado 2: Polaquiuria. Nicturia doble de la basal. Hematuria intermitente. Hasta dos coagulaciones. Incontinencia moderada. Dolor vesical.
Grado 3: Polaquiria y disuria severa. Retracción vesical. Hematuria frecuente con hasta una transfusión. Más de dos coagulaciones. Incontinencia severa.
Grado 4: Cistitis hemorrágica severa que puede requerir derivación urinaria o cistectomía.
Grado 5: Muerte por complicaciones.
Digestivas:
Grado 1: Aumento al doble las deposiciones normales. Alguna rectorragia.
Grado 2: Hasta dos coagulaciones por rectorragias. Uso de antidiarreicos (más de dos por semana). Uso de corticoides por ulceraciones. Dilataciones ocasionales. Incontinencia moderada. Analgésicos.
Grado 3: Diarrea severa. Rectorragia con transfusión. Más de dos coagulaciones por rectorragias. Dilataciones. Incontinencia.
Grado 4: Cirugía necesaria. Perforación. Rectorragias graves.
Grado 5: Muerte por complicaciones.
Summary
A sample of 560 patients with localized prostate cancer were analyzed from 1993 to 2001. All patients were treated with tridimensional conformal radiotherapy.
Global survival after 9 years was 71%, while specific cause survival was 88%. Mortality due to prostate cancer was 4,8% compared to 8,3% observed in other causes mortality.
Survival without biochemical fallen again according to risk-group was 83%, 68% and 41% after 9 years, respectively for groups at low, medium and high risk in 504 patients (p<0,05). Dosage >72 Gy improved biochemical control at 7 years in the whole population but was significant only in the group at high risk (p<0,006). Cox model showed that the group at risk, total dosage at continual variable and initial PSA as categorical variable were significant. When Cox model was employed in 188 patients at high risk, inductive or concomitant use of hormonetherapy and age became significant. Grade 3 and 4 severe complications after 10 years accounted for 1,2% and 1,4% (actuarial rates) respectively at urinary and digestive levels. tridimensional conformal radiotherapy at high dosage is an effective and of low morbidity treatment for localized prostate cancer.
Résumé
On fait un rapport de 560 patients de cancer localisé de prostate traités avec radiothérapie conformelle tridimensionnelle entre 1993 et 2001. La survie globale après 9 ans fut de 71% et la survie cause spécifique de 88%. La mortalité crue par cancer de prostate fut de 4,8% tandis que la mortalité par d’autres causes fut de 8,3%. La survie libre de rechute biochimique selon le groupe de risque fut de 83%, 68% et 41% après 9 ans, pour les groupes à faible risque, moyen et élevé chez 504 patients (p<0,05). La dose > 72 Gy améliore le contrôle biochimique au bout de 7 ans dans tous les groupes de risque quoiqu’elle soit statistiquement importante dans le groupe à risque élevé (p<0,006). Le modèle de Cox a montré que seulement le groupe de risque, la dose totale comme variable continue et le PSA initiel comme variable catégorique furent significatifs. Lorsque le modèle de Cox fut appliqué aux 188 patients de risque élevé, l’emploi de l’hormonothérapie d’induction ou concomitante, ou toutes les deux, et l’âge furent aussi significatifs. Le taux de troubles sévères à 10 ans degrés 3 et 4 (il n’y eut pas de troubles degré 5) fut de 1,2% pour les urinaires et de 1,4% pour les digstives. La radiothérapie tridimensionnelle à doses élevées est un traitement effectif et de basse morbilité pour le cancer localisé de prostate.
Bibliografía
1. Vassallo JA, Barrios De Stefani E, Ronco A. Atlas de incidencia del cáncer en Uruguay – período 1996-1997. Montevideo: Comisión Honoraria de Lucha contra el Cáncer, 2000.
2. Mettlin CJ, Murphy GP. Why is the prostate cancer death rate declining in the United States? Cancer 1998; 82: 249-25.
3. Catalona WJ. Surgical management of prostate cancer. Contemporary results with anatomic radical prostatectomy. Cancer 1995; 75: 1903-8.
4. Kupelian PA, Potters L, Khuntia D, Ciezki JP, Reddy C, Reuther A, et al. Radical prostatectomy, external beam radiotherapy <72 Gy, external beam radiotherapy =72 Gy, permanent seed implantation, or combined seeds/external beam radiotherapy for stage T1–T2 prostate cancer. Int J Rad Oncol Biol Phys 2004; 58: 25-33.
5. Chodak GW, Thisted RA, Gerber GS, Johansson JE, Adolfsson J, Jones GW. Results of conservative management of clinically localized prostate cancer. N Engl J Med 1994; 330: 242-8.
6. Carter CA, Donahue T, Sun L, Wu H, McLeod DG, Amling C. Temporarily deferred therapy (watchful waiting) for men younger than 70 Years and with low-risk localized prostate cancer in the prostate-specific antigen era. JCO 2003; 21: 4001-8.
7. Hanks GE. Three-dimensional conformal radiation therapy for prostate cancer. In: D’Amico AV, Hanks GE, eds. Radiotherapuetic management of prostate adenocarcinoma. Londres: Arnold, 1999: 21-50.
8. Armstrong J. Three-dimensional conformal radiation the-rapy: evidence-based treatment of prostate cancer. Radioth Oncol 2002; 64: 235-7.
9. American Joint Committee on Cancer. Cancer Staging Manual. 6ª ed. New York: Springer, 2002: 309-12.
10. Chism DB, Hanlon AL, Troncoso P, Al-Saleem T, Horwitz EM, Pollack A. The Gleason score shift: Score four and seven years ago. Int J Radiat Oncol Biol Phys 2003; 56(5): 1241-7.
11. Smith EB, Frierson HF, Jr, Mills SE, Boyd JC, Theodorescu D. Gleason scores of prostate biopsy and radical prostatectomy specimens over the past 10 years: Is there evidence for systematic upgrading? Cancer 2002; 94: 2282-7.
12. Bayley AJ, Catton CN, Haycocks T, Kelly V, Alasti H, Bristow R, et al. A randomized trial of supine vs. prone positioning in patients undergoing escalated dose conformal radiotherapy for prostate cancer. Radioth Oncol 2004; 70: 37-44.
13. Tinger A, Michalski JM, Cheng A, Low DA, Zhu R, Bosch WR, et al. A critical evaluation of the planning target volume for 3-D conformal radiotherapy of prostate cancer. Int J Radiat Oncol Biol Phys 1998; 42: 213-21.
14. International Commission on Radiation Units and Measurements (ICRU). Prescribing, recording, and reporting photon beam therapy. Washington: ICRU, 1993: 280 pp. (ICRU Report No. 50).
15. Hanks GE, Hanlon AL, Pinover WH, Horwitz EM, Price RA, Schultheiss T. Dose selection for prostate cancer patients based on dose comparison and dose response studies. Int J Radiat Oncol Biol Phys 2000; 46: 823-32.
16. Partin AW, Kattan MW, Subong EN, Walsh PC, Wojno KL, Oesterling JE, et al. Combination of prostate-specific antigen, clinical stage, and Gleason score to predict pathological stage of localized prostate cancer. A multi-institutional update. JAMA 1997; 277: 1445-51.
17. Cox DR. Regression models and life tables (with discussion), J R Stat Soc B 1972; 34: 187-200.
18. American Society for Therapeutic Radiology and Oncology Consensus Panel. Consensus statement: Guidelines for PSA following radiation therapy. Int J Radiat Oncol Biol Phys 1997; 37: 1035-41.
19. Thames H, Kuban D, Levy L, Horwitz EM, Kupelian P, Martínez AA. Comparison of alternative biochemical failure definitions based on clinical outcome in 4839 prostate cancer patients treated by external beam radiotherapy between 1986 and 1995. Int J Radiat Oncol Biol Phys 2003; 57: 929-43.
20. Kaplan EL, Meier P. Non parametric estimation from incomplete observations. J Am Statist Assoc 1958; 53: 457-81.
21. Mantel N. Evaluation of survival data and two new rank order statistics arising in its consideration. Cancer Chemother Rep 1966; 50: 163-70.
22. Storey MR, Pollack A, Zagars G, Smith L, Antolak J, Rosen I. Complications from radiotherapy dose escalation in prostate cancer: preliminary results of a randomized trial. Int J Radiat Oncol Biol Phys 2000; 48: 635-42.
23. Pilepich MV, Winter K, John MJ, Mesic JB, Sause W, Rubin P, et al. Phase III radiation therapy oncology group (RTOG) trial 86-10 of androgen deprivation adjuvant to definitive radiotherapy in locally advanced carcinoma of the prostate. Int J Rad Oncol Biol Phys 2001; 50: 1243-52.
24. Liu M, Pickles T, Arganovich A, Berthelet E, Duncan G, Keyes M, et al. Impact of neoadjuvant androgen ablation and other factors on late toxicity after external beam prostate radiotherapy. Int J Rad Oncol Biol Phys 2004; 58: 59-67.
25. Zelefsky M, Fuks Z, Chan H. Ten-year results of dose escalation with 3-dimensional conformal radiotherapy for patients with clinically localized prostate cancer. Int J Rad Oncol Biol Phys 2003: 57(2S): S149-S150.
26. Michalsky JM, Purdy JA, Winter K, Roach M 3rd, Vijayakumar S, Sandler HM, et al. Preliminary report of toxicity following 3D radiation therapy for prostate cancer on 3DOG/RTOG 9406. Int J Radiat Oncol Biol Phys 2000; 46: 391-402.
27. Sandler HM, Dunn RL, McLaughlin PW, Hayman JA, Sullivan MA, Taylor JM. Overall survival after prostate-specific-antigen-detected recurrence following conformal radiation therapy. Int J Radiat Oncol Biol Phys 2000; 48: 629-33.
29. Kupelian PA, Buchsbaum JC, Elshaikh MA, Reddy CA, Klein EA. Improvement in relapse-free survival throughout the PSA era in patients with localized prostate cancer treated with definitive radiotherapy: Year of treatment an independent predictor of outcome. Int J RadiatOncol Biol Phys 2002; 57: 629-34.
30. Kuban DA, Thames HD, Levy LB, Horwitz EM, Kupelian PA, Martinez AA, et al. Long-term multi-institutional analysis of stage T1–T2 prostate cancer treated with radiotherapy in the PSA era. Int J Radiat Oncol Biol Phys 2003; 57: 915-28.
31. Kupelian PA, Elshaikh M, Reddy CA, Zippe C, Klein EA. Comparison of the efficacy of local therapies for localized prostate cancer in the prostate-specific antigen era: a large single-institution experience with radical prostatectomy and external-beam radiotherapy JCO 2002; 20: 3376-85.