Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Revista Médica del Uruguay
versão On-line ISSN 1688-0390
Rev. Méd. Urug. vol.20 no.2 Montevideo ago. 2004
Trombofilia y pérdida recurrente de embarazo
Dres. Ana María Otero *, Ricardo Pou Ferrari †, Enrique Pons ‡,
Daniela Lens §, Elena De Lisa ¶, Marisa Dellepiane ††, Eduardo Storch ‡‡, Lics. Datevid Attarian §§, Alicia Ferrari §§, Dra. Silvia Pierri ¶¶,
Lic. Nora Motta §§
Cátedra de Hematología. Clínica Ginecotocológica "A",
Departamento de Medicina. Facultad de Medicina. Montevideo, Uruguay
Resumen
La búsqueda de factores pro trombóticos que incidan en la pérdida recurrente de embarazo, ha adquirido en los últimos años un especial interés para hematólogos y obstetras. La identificación progresiva de las diferentes enfermedades trombofílicas constituye un desafío en el diagnóstico de nuevas causas que puedan ser responsables de la pérdida recurrente de la gestación. Se estudió una población de 115 mujeres con pérdida recurrente de embarazo en quienes se descartaron previamente causas hormonales, anatómicas, infecciosas o genéticas. En ellas se buscaron diferentes causas trombofílicas y se comparó con una población control. Dentro de los factores pro trombóticos estudiados se encontró una prevalencia significativamente mayor en los anticuerpos antifosfolípidos/anticoagulante lúpico, (p<0,0001, OR=8,85, IC95% 3,8-20,8), la lipoproteína (a) (p<0,0001, OR=6,05, IC95% 2,5-14,3), el factor V Leiden (p<0,005, OR=5, IC95% 1,5-21), el factor II G20210A (p< 0,005, OR=4, IC95% 1,4-11,5) y la variante homocigota de la MTHFR C677T (p= 0,0002, OR=2,4, IC95% 1,1-5,1). La asociación de dos o más factores de riesgo trombótico se observa en 65% de las pacientes por lo cual el estudio trombofílico de las mismas debe ser completo.
Palabras clave: TROMBOFILIA.
ABORTO HABITUAL.
* Profesor Agregado de Hematología.
† Ex Profesor Agregado de Ginecología y Obstetricia.
‡ Profesor Clínica Ginecotocológica "A".
§ Profesor Adjunto del Departamento de Medicina.
¶ Hematóloga.
†† Ex Asistente Clínica Ginecotológica y Obstetricia.
‡‡ Ex Profesor Agregado de Ginecología y Obstetricia.
§§ Licenciadas en Laboratorio Clínico.
¶¶ Profesor Adjunto de Hematología.
Correspondencia: Dra. Ana María Otero
Chucarro 1277 AP 402. Montevideo, Uruguay.
E-mail: amob@netgate.com.uy
Recibido: 9/3/04.
Aceptado: 30/4/04.
Introducción
Se entiende como pérdida recurrente de embarazo (PRE) la pérdida de dos o más embarazos consecutivos. La PRE es causada por diferentes enfermedades bien conocidas y otras en estudio; 7% se debe a anormalidades cromosómicas, cerca de 10% a anomalías anatómicas, 15% son de causa hormonal (estrógenos, progesterona, diabetes y hormonas tiroideas), mientras que 53%-62% se debe a anomalías de la hemostasis(1). La PRE se ve en 2% de las mujeres en edad reproductiva(2,3).
Analizado el problema desde otro ángulo, las mujeres con trombofilia identificada previa al embarazo tienen una posibilidad de que llegue su embarazo a término con feto vivo de menos de 25%(4).
Objetivo del estudio
Establecer la prevalencia de diferentes causas de trombofilia, FV Leiden, protrombina G20210A, metilentetrahidrofolato reductasa (MTHFR), lipoproteína "a", homocisteinemia, anticuerpos anticardiolipinas, anticoagulante lúpico (AL), proteína C, proteína S y antitrombina III, en mujeres con PRE y compararla con la prevalencia en una población control.
Material y método
- Población en estudio: 115 mujeres con antecedentes de PRE (dos o más), en quienes se descartó una causa ginecológica, infecciosa, endócrina o genética. Edad media de la población: 37 años (DS 6, rango: 21-47).
Embarazos previos de la población en estudio: 307.
Número total de pérdida de embarazos 287/307 (93,6%).
Número de embarazos que terminaron con un hijo vivo: 20/307 (6,5%).
- Población control: 100 mujeres con historia de por lo menos dos embarazos sin complicaciones y sin abortos. Edad media: 35 años (DS 5, rango: 22-45).
- Factores trombofílicos estudiados en la población en estudio y en la población control.
Screening del anticoagulante lúpico
PTT-LA (tiempo de tromboplastina parcial sensibilizado para anticoagulante lúpico) (Diagnóstica Stago) APTT (tiempo de tromboplastina parcial activado) sensibilizado para detectar el AL. Medida del tiempo de recalcificación del plasma en presencia de cefalina (tromboplastina de cerebro de conejo) y sílica como activador (particulado). El tiempo de coagulación de los plasmas screening positivo para AL fue mayor que el límite superior del rango normal (media más 2DS), debido a que el AL neutralizó los fosfolípidos requeridos para el APTT. LAC Screen (Instrumentation Laboratory). Tiempo de veneno de víbora Russell diluido (dRVVT). El veneno activa directamente el factor X en presencia de calcio y presenta la gran ventaja de no verse afectado por defectos de la fase de contacto o del factor VII (déficit del mismo o presencia de inhibidores). Es insensible a la presencia de heparina en concentraciones de hasta 1 U/ml por la acción de polibrene. Se consideró screening positivo a aquellos plasmas cuyos tiempos de coagulación superaron en 20% al del plasma normal.
Estudio de mezclas con plasma normal. Se utilizó el índice de Rosner para definir presencia o ausencia de inhibidor. Índice de Rosner mayor a 15% evidenció presencia de inhibidor, menor de 15% ausencia de inhibidor.
Confirmación de anticoagulante lúpico
Staclot LA (Diagnóstica Stago). Técnica designada en la categoría de alta complejidad en Estados Unidos por CLIA 1988. Utiliza moléculas de fosfolípidos en fase hexagonal (fosfatidiletanolamina). El plasma a testar se incubó a 37ºC en presencia y en ausencia de los fosfolípidos. Luego se realizó el APTT a ambas mezclas con un reactivo sensible al AL como es el PTT-LS, que consiste en cefalina, sílica e inhibidor de heparina. Plasmas positivos para AL expresaron un acortamiento del tiempo de coagulación de la mezcla con fosfolípidos mayor o igual a 8 segundos respecto a la mezcla sin fosfolípidos. El reactivo incluye plasma normal para corregir posibles defectos debidos a déficit de factores.
Muestra para screening/confirmatorio: sangre venosa recogida en tubo plástico con citrato trisódico al 3,2% (0,109 M) en relación 1/10. Se practicó doble centrifugación (15 minutos a 2.500 g) para obtener un recuento plaquetario menor a 10.000/ml en el plasma. Se utilizaron como control de calidad interno plasmas normales y plasmas positivos para anticoagulante lúpico.
La caracterización por el laboratorio del AL sigue siendo problemática y existen una serie de variables que tomamos en cuenta para realizar un correcto diagnóstico. Se siguieron los criterios recomendados por el subcomité para la estandarización del AL/APA del Comité Científico y de Estandarización (SSC) de la Sociedad Internacional de Trombosis y Hemostasis (ISTH):
- Demostrar prolongación de al menos uno de los tests de screening (APTT, dRVVT, KCT).
- Evidenciar efecto inhibitorio en los ensayos de mezclas con plasma normal.
- Confirmar corrección de los tiempos de coagulación de los tests de screening mediante el agregado de exceso de fosfolípidos o de fosfolípidos hexagonales.
- Diferenciar al AL de otras alteraciones de coagulación, como es la presencia de heparina e inhibidores antifactor VIII.
Determinación de anticuerpos anticardiolipinas
ETI-aCL (Diasorin). Ensayo inmunoenzimático en fase sólida para detección y medida de autoanticuerpos en suero humano dirigidos contra la cardiolipina. Se realizó primero un screening al suero mediante el uso de un anticuerpo polivalente contra IgM, IgG e IgA. Frente a un "test borderline" o positivo el nivel de cada clase de anticuerpo se determinó utilizando anticuerpos específicos de clase, anti IgM, anti IgG o anti IgA.
Muestra: suero. Control de calidad interno: sueros positivo y negativo para anticuerpo anticardiolipina (ACA) provistos por el "kit".
Determinación de proteína C
Stachrom ProteinC (Diagnóstica Stago). Técnica cromogénica para determinación cuantitativa del nivel de actividad de la proteína C (PC). En una primera etapa se incubó la mezcla muestra/reactivo a 37ºC para permitir la activación de la PC por un activador específico derivado del veneno de Agkistrodon c.contortrix. La cantidad de enzima formada PCa fue medida por su actividad amidásica sobre el sustrato cromogénico CBS 42.46.
Muestra para PC, PS y ATIII: sangre venosa recogida con citrato trisódico al 3,2% en relación 1/10 y centrifugada 15 minutos a 2.500 g para obtener el plasma.
Control de calidad interno: plasmas System Control Normal y Patológico (Diagnóstica Stago).
Determinación de proteína S
Asserachrom Free Protein S (Diagnóstica Stago). Ensayo inmunoenzimático para proteína S libre (PS). En la primera etapa se incubó a temperatura ambiente el plasma a testar con un primer anticuerpo monoclonal anti PS libre que recubre los pocillos de reacción y un segundo anticuerpo monoclonal ligado a peroxidasa, permitiendo así que la PS libre fuera capturada simultáneamente por ambos anticuerpos. Se midió luego la actividad de la peroxidasa sobre el sustrato OPD en presencia de peróxido de hidrógeno, siendo la intensidad del color obtenida directamente proporcional a la concentración inicial de PS libre en el plasma.
Como control de calidad interno se empleó el plasma control provisto por el kit.
Determinación de antitrombina III
Berichrom antitrombina III (Dade Behring). Técnica cromogénica para determinación de la actividad funcional de la antitrombina III (ATIII) en plasma.
En una primera etapa la mezcla muestra/reactivo de trombina se incubó a 37ºC posibilitando que la heparina que contiene dicho reactivo acelere la capacidad de la ATIII de la muestra para inhibir a la trombina agregada. Luego se midió la resultante de la acción de la trombina residual sobre un sustrato cromogénico específico, intensidad de color que fue inversamente proporcional a la concentración inicial de ATIII en la muestra.
Como control de calidad interno se emplearon plasmas System Control Normal y Patológico (Diagnóstica Stago).
Se consideró déficit de inhibidores fisiológicos de la coagulación valores iguales o menores de 60%, confirmados fuera de los embarazos y en más de una oportunidad. Este valor de corte se basó en que en nuestra experiencia los valores entre 61%-70% son de difícil interpretación clínica.
Determinación de lipoproteína (a)
Tina-quant lipoproteína (a) (Diagnóstica Stago). Test inmunoturbidimétrico que utiliza anticuerpos anti Lp(a) humana de conejo. Analizador utilizado: Hitachi 704 Roche.
Muestra: suero. Como control de calidad interno se utilizaron sueros Control Set Lp(a) bajo y alto. Se tomó como corte patológico para la lipoproteína "a" el valor usado como factor de riesgo para enfermedad coronaria o sea mayor de 300 mg/l.
Determinación de homocisteína
IMX Homocystein (Abbott). Inmunoensayo por fluorescencia polarizada (FPIA) para la medida cuantitativa de la homocisteína total presente en suero o plasma. Analizador utilizado: IMX Abbott.
Muestra: se recogió sangre venosa con heparina lítica, se centrifugó y se separó el plasma antes de la hora de extracción debido a que la síntesis de homocisteína continúa en los eritrocitos luego de la extracción. Como control de calidad se utilizó set de plasmas control, bajo, medio y alto (Abbott).
La homocisteína se determinó en sus valores basales y no se determinó poscarga de metionina.
La homocisteinemia basal se consideró elevada en valores superiores a 15 mmol/l como está establecido en la mayoría de los estudios internacionales.
Polimorfismos genéticos
Extracción de DNA
El DNA genómico fue extraído de sangre periférica total mediante técnicas convencionales. Las muestras de sangre fueron centrifugadas a 2.500 rpm durante 10 minutos. El "buffy coat" fue colectado y guardado a -20°C hasta la extracción del ADN.
Detección del FV Leiden
El factor V Leiden se detectó mediante amplificación por reacción en cadena de la polimerasa (PCR) seguida de digestión con la enzima de restricción MnlI según el método publicado por Beauchamp y colaboradores (1994)(5).
Detección de la variante protrombina 20210A
Se realizó mediante amplificación por PCR de un fragmento de la región 3’UT de la protrombina y restricción del producto con la enzima HindIII según el método publicado por Poort y colaboradores (1996)(6).
Detección de la MTHFR C677T
Se realizó mediante PCR/RFLP utilizando la enzima HinfI según método proporcionado por Frosst y colaboradores (1995)(7).
La prevalencia de los factores moleculares de trombofilia: factor V Leiden, factor II G20210A y MTHFR C677T, fueron comparados con la prevalencia en 148 individuos de la población general.
Resultados
La tabla 1 muestra los resultados de trombofilia congénita y adquirida en las dos poblaciones estudiadas, con PRE y control.
La lipoproteína (a) se encontró en valores superiores a 320 mg/l en 31% de las pacientes y en 15 pacientes los valores oscilaron entre 500 y 1.200.
El ACA fue positivo en 46 pacientes (40%), mientras que el anticoagulante lúpico sólo se encontró en 7 (7%) y siempre asociado a los ACA.
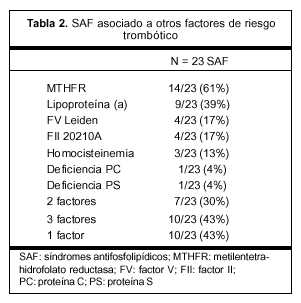
El isotipo predominante en los ACA fue: IgM en 29 pacientes, IgG en 14 y mixto en 3 pacientes. Cuando se estudió la asociación entre diferentes factores de riesgo, se constató que 50% (23/46) de las pacientes con síndrome antifosfolipídico asociaron otros factores de riesgo trombótico (tabla 2).
Para el estudio de asociación entre los tres polimorfismos génicos se incluyeron tanto casos heterocigotos como homocigotos. Encontramos ocho casos con FV Leiden que presentaron MTHFR C677T heterocigota u homocigota, dos casos de FII G20210A y factor V Leiden, dos casos de FII G20201A y MTHFR C677T y un paciente con presencia de los tres polimorfismos.
Comentarios
La trombofilia congénita o adquirida se observa en 50%-65% de las mujeres con PRE y en mujeres con otras enfermedades vasculares placentarias como preeclampsia, desprendimiento prematuro de placenta y retardo del crecimiento intrauterino(8).
En nuestro estudio, 65% de las mujeres con PRE presentaron por lo menos un factor de riesgo trombótico mientras que en la población control este hallazgo fue de 20%.
Síndromes antifosfolipídicos
Los síndromes antifosfolipídicos constituyen la causa más frecuente de PRE. Existe una amplia experiencia en este sentido(9-16).
Esto se confirma en nuestro estudio donde la prevalencia de los ACA o el AL, o ambos, es significativamente mayor en mujeres con PRE comparadas con la población control (p<0,0001, OR 8,85, IC95% 3,8-20,8) (tabla 1).
Un hecho a destacar es que en esta población no se observaron casos aislados de anticoagulante lúpico sino que el mismo siempre se vio asociado al ACA, aunque debemos tener en cuenta que fueron excluidas del estudio las mujeres con síndrome antifosfolipídico (SAF) secundario a colagenopatía donde la presencia de anticoagulante lúpico es más frecuente.
En cuanto al isotipo que encontramos con mayor frecuencia es el IgM y, el menos frecuente, el IgG o la asociación de ambos. Si se observa la tabla 3 se puede constatar que cuando hacemos el seguimiento de estos anticuerpos a los seis meses del parto, el isotipo IgM tiene una fuerte tendencia a desaparecer (93,1%), mientras que a la inversa, el isotipo IgG tiene una tendencia mayor a perdurar (68%) y la asociación de ambos persistió al cabo de este tiempo en todas las pacientes. Esto sugiere que el isotipo IgG o la asociación IgG-IgM podrían estar indicando un desajuste inmunológico diferente e independiente del embarazo.
También resulta muy interesante en este estudio la alta frecuencia (50%) en la que el síndrome antifosfolipídico se asocia a otros factores biológicos de riesgo trombótico (tabla 2).
El mecanismo etiopatogénico por el cual los anticuerpos antifosfolipídicos provocan la pérdida del embarazo es complejo y aún no del todo dilucidado. Dentro de los mecanismos propuestos están la resistencia adquirida a la proteína C activada, interferencias con el factor II, las proteínas S y C y el factor tisular, la relación factor tisular/inhibidor factor tisular, así como una activación plaquetaria con secreción de tromboxano A2 aumentado. Uno de los mecanismos etiopatogénicos propuestos es la inter-acción de estos anticuerpos con la anexina V 5 (proteína anticoagulante placentaria) en la superficie trofoblástica aunque esto no ha sido confirmado por otros autores(17-23).
Inhibidores fisiológicos de la coagulación
Los déficit de inhibidores fisiológicos de la coagulación como la proteína C, la proteína S y la antitrombina III son para algunos autores un factor de riesgo trombofílico asociado a la PRE(24,25). Nosotros no pudimos confirmar estos resultados ya que, si bien encontramos una tendencia a una prevalencia mayor, estas diferencias no fueron significativas cuando se compararon las dos poblaciones (tabla 1).
Lipoproteína (a)
La lipoproteína (a) es un factor de riesgo trombótico clásicamente considerado en relación a la enfermedad coronaria y el "stroke"(26,27). Más recientemente se ha vinculado la lipoproteína (a) con complicaciones gestacionales como la PRE y la eclampsia(28-30).
Los niveles de lipoproteína (a) en el embarazo normal aumentan llegando al doble de sus valores iniciales entre la décima y la 35ª semana de gestación, pero no sobrepasando el nivel de 300 mg/l.
El nivel elevado de lipoproteína (a) sigue a los síndromes antifosfolipídicos en la prevalencia de factores pro trombóticos en la población estudiada 36/115 (31%) versus 7/100 (p<0,0001, OR= 6,05, IC95% 2,5-14,3).
Los niveles de lipoproteína (a) oscilaron entre 500-1.200 mg/l en 15 pacientes y en las 21 pacientes restantes entre 320 y 499. Estos valores fueron constatados en más de una oportunidad fuera de embarazo. Es sabido que los niveles de lipoproteína (a) tienen una fuerte determinación genética.
Polimorfismos génicos causantes de trombofilia
Los polimorfismos génicos causantes de trombofilia como el FV Leiden, el factor II G20210A y la MTHFR C677T son de descubrimiento reciente, por lo cual la búsqueda de su prevalencia en las mujeres con PRE data de poco tiempo, habiéndose publicado resultados contradictorios a nivel internacional, si bien hay una fuerte tendencia a involucrarlos en estas situaciones. Para algunos autores el factor V Leiden y la variante termolábil de la MTHFR C677T, son las alteraciones más frecuentemente halladas en mujeres con PRE u otras complicaciones vasculares del embarazo(31-38).
Es sabido que la prevalencia de estos polimorfismos varía en las diferentes áreas geográficas, por lo cual es necesario estudiar las prevalencias regionales y étnicas en forma específica. En Uruguay la prevalencia de la MTHFR C677T es muy alta, encontrando 8% de individuos homocigotos y 42% heterocigotos. Por otro lado, la prevalencia del factor V Leiden es muy baja (1,9%) y menor que la de la protrombina G20210A (3,8%)(39).
En nuestro estudio se observa que la población con PRE tiene una mayor prevalencia de FV Leiden, 10,4% (p<0,005, OR=5, IC95% 1,5-21), así como de FII G20210A, 12,3% (p<0,005, OR=4, IC95% 1,4-11,5). En cuanto a la mutación de la MTHFR C677T encontramos una diferencia significativa sólo a nivel de su variante homocigota, 16% (p= 0,0002, OR=2,4, IC95% 1,1-5,1). Otros estudios encuentran una asociación con la variante heterocigota que nosotros no pudimos demostrar(40).
Otro hallazgo interesante en nuestro estudio es la asociación de dos o tres de estos polimorfismos génicos en 12 pacientes con PRE mientras que en ningún individuo de la población normal se encontró asociación. En varios casos esta asociación se dio con la forma heterocigota de la MTHFR. Esto podría indicar que la presencia de un solo alelo mutado para esta enzima podría jugar un rol patogénico en aquellos casos con FV Leiden o FII mutado, sin embargo se requieren más estudios para confirmar esta hipótesis.
Hiperhomocisteinemia
La homocisteína elevada es un factor conocido de riesgo vascular tanto arterial como venoso. Una moderada hiperhomocisteinemia asociada a vasculopatía placentaria se encuentra en mujeres con la variante termolábil de la MTHFR(41,42).
Nuestra población muestra una tendencia mayor al hallazgo de hiperhomocisteinemia en mujeres con PRE, sin llegar a ser significativa. Es importante tener en cuenta que no se hizo la determinación poscarga de metionina con lo cual el diagnóstico puede aumentar 30%.
Por lo tanto pensamos que debemos seguir estudiando esta variable.
La combinación de defectos trombofílicos aumenta el riesgo de pérdida fetal(43,44). De las mujeres con PRE de nuestro estudio, 40% presentó asociación de dos o tres factores de riesgo trombótico. Teniendo en cuenta que la trombosis es de causa multifactorial, es importante determinar todos los factores de riesgo trombótico en cada paciente con pérdida recurrente de embarazo, no sólo por el tratamiento obstétrico futuro, sino porque permite un diagnóstico precoz de los factores de riesgo, lo cual es útil para la mujer. La PRE debe ser incluida como parte de las manifestaciones clínicas de los síndromes trombofílicos.
El hallazgo de factores trombofílicos en las mujeres con PRE es de gran importancia y ha dado un gran aporte a la obstetricia ya que los tratamientos de estas mujeres con heparinas de bajo peso molecular o aspirina, o ambas, ofrecen un cambio significativo en la fertilidad de las mismas(45-47).
Conclusiones
Este trabajo muestra que un alto porcentaje de mujeres con PRE de causa inexplicable presentan un estado trombofílico. Dentro de los factores pro trombóticos estudiados, predominan los anticuerpos anticardiolipinas, la lipoproteína (a), el factor V Leiden, el factor II G20210A y la variante homocigota de la MTHFR C677T.
La asociación de dos o más factores de riesgo trombótico se observa en 65% de las pacientes por lo cual el estudio trombofílico debe ser completo.
La identificación de estos factores permite indicar un tratamiento racional con heparinas de bajo peso molecular que ha demostrado ser muy eficaz en estas situaciones.
Abreviaturas:
PRE: pérdida recurrente del embarazo
SAF: síndromes antifosfolipídicos
OPD: orto phenyldiamina
PC: proteína C
PS: proteína S
ATIII: antitrombina III
ACA: anticuerpo anticardiolipina
FV: factor V
PTT-LA: tiempo de tromboplastina parcial sensibilizado para anticoagulante lúpico
APTT: tiempo de tromboplastina parcial activado
AL: anticoagulante lúpico
KCT: tiempo de coagulación con kaolín
ETI-aCL: ETI anticardiolipina
MTHFR: metilentetra-hidrofolato reductasa
FPIA: inmunoensayo por fluorescencia polarizada
Summary
Hematologists and obstetricians have been studying the incidence of prothrombotic factors in recurrent pregnancy loss. The progressive identification of different thrombophilic pathologies is a challenge for diagnosis new causes of recurrent pregnancy loss. The study included 115 women with recurrent pregnancy loss with no hormonal, anatomic, infectious and genetic causes. Thrombophilic causes were determined and compared with a control group. Among prothrombotic factors, the prevalence of antiphospholipid /anticoagulante lúpico antibodies was higher (p<0.0001 OR=8.85 IC95% 3.8-20.8), lipoproteine (a) (p<0.0001 OR=6.05 IC95% 2.5-14.3), factor V Leiden (p<0.0005 OR=5 IC95% 1.5-21), factor II G20210A (p<0.0005 OR=4 IC95% 1.4-11.5) and MTHFR C677T variant homocigota (p<0.0002 OR=2.4 IC95% 1.1-5.1). Association of two or more thrombotic risk factors was seen in 65% women, therefore thromophilic analysis must be complete.
Résumé
La recherche de facteurs prothrombotiques qui incident sur la perte répétée de la grossesse, a gagné un spécial intérêt pour les hématologues et les obstétriciens. On a fait l’étude d’une population de 115 femmes ayant eu une perte répétée de grossesse, après avoir prouvé l’absence de causes hormonales, anatomiques, infectieuses ou génétiques. On y a cherché des causes thrombophyliques tout en comparant à une population- contrôle. On a constaté une présence remarquablement plus élevée dans les anti-corps antiphospholipides/anticoagulant lupique, (p<0,0001, OR=8,85, IC95% 3,8-20,8), la lipoprotéine (a) (p<0,0001, OR=6,05, IC95% 2,5-14,3), le Facteur V Leiden (p<0,005, OR=5, IC95% 1,5-21), le Facteur II G20210A (p<0,005, OR=4, IC95% 1,4-11,5) et la variante homocigote de la MTHFR C677T (p<0,0002, OR=2,4, IC95% 1,1-5,1). L’association de deux ou plus facteurs de risque thrombotique est observé chez 65% des patientes, si bien que l’étude thrombotique doit être complète.
Bibliografía
1. Bick RL, Madden J, Heller KB. Recurrent miscarriage: causes, evaluation, and treatment. Medscape Womens Health 1998; 3 ( 3): 2.
2. Stirrat GM. Recurrent miscarriage. Lancet 1990; 336 ( 8716): 673-5.
3. Blumenfield Z, Brenner B. Trombophilia-associated pregnancy wastage. Fertil Steril 1999; 72 ( 5): 765-74.
4. Mc Coll MD, Walker ID, Greer IA. The role of inherited thrombophilia in venous thromboembolism associated with pregnancy. Br J Obstet Gynaecol 1999; 106 ( 8): 756-66.
5. Beauchamp NJ, Daly ME, Hampton KK, Cooper PC, Preston FE, Peake IR. High prevalence of a mutation in the factor V gene within the U.K. population: relationship to activated protein C resistance and familial thrombosis. Br J Haematol 1994; 88(1): 219-22.
6. Poort SR, Rosendaal FR, Reitsma PH, Bertina RM. A common genetic variation in the 3’-untranslated region of the prothrombin gene is associated with elevated plasma prothrombin levels and an increase in venous thrombosis. Blood 1996; 88 ( 10): 3698-703.
7. Frosst P, Blom HJ, Milos R, Goyette P, Sheppard CA, Mathews RG, et al. A candidate genetic risk factor for vascular disease: a common mutation in methylenetetrahydrofolate reductase. Nat Genet 1995; 10 ( 1): 111-3.
8. Arnout J. Antiphospholipid syndrome: diagnostic aspects of lupus anticoagulant. Thromb Haemost 2001; 86 ( 1): 83-91.
9. Greer IA. The challenge of thrombophilia in maternal-fetal medicine. N Engl J Med 2000; 342 ( 6): 424-5.
10. Lockshin MD. Pregnancy loss in the antiphospholipid syndrome. Thromb Haemost 1999; 82 ( 2): 641-8.
11. Infante-Rivard C, David M, Gauthier R, Rivard GE. Lupus anticoagulants, anticardiolipin antibodies and fetal loss. A case -control study. N Eng J Med 1991; 325(15): 1063-6.
12. Lynch A, Marlar R, Murphy J, Davila G, Santos M, Rutledge J, et al. Antiphospholipid antibodies predicting adverse outcome. A prospective study. Ann Intern Med 1994; 120(6): 470-5.
13. Bowie EJ, Thompson JH Jr, Pascuzzi CA, Owen CA Jr. Thrombosis in systemic lupus erithematosus despite circulating anticoagulants. J Lab Clin Med 1963; 42: 416-8.
14. Triplett DA, Brandt JT, Musgrave KA, Orr CA. The relationship between lupus anticoagulant and antibodies to phospholipid. JAMA 1988; 259(4): 550-3.
15. Asherson RA, Khamashta MA, Ordi-Ros J, Derksen RH, Machin SJ, Barquinero J, et al. The "primary" antiphospholipid syndrome: mayor clinical and serological features. Medicine (Baltimore) 1989; 68(6): 366-74.
16. Sheng Y, Kandiah DA, Krilis SA. Beta-2-glycoprotein: target antigen for antiphospholipid antibodies. Immunological and molecular aspects. Lupus 1998; 7 (Suppl 2): S5-9.
17. Hughes GRV. The antiphospholipid syndrome: ten years on. Lancet 1993; 342(8867): 341-4.
18. Rai R, Regan L, Hadley E, Dave M, Cohen H. Second-trimester pregnancy loss is associated with activated protein C resistance. Br J Haematol 1996; 92(2): 489-90.
19. Amengual O, Atsumi T, Khamashta MA, Hughes GR. The role of the tissue factor pathway in the hypercoagulable state in patients with the antiphospholipid syndrome. Thromb Haemost 1998; 79(2): 276-81.
20. Oosting JD, Derksen RH, Bobbink IW, Hackeng TM, Bouma BN, de Groot PG. Antiphospholipid antibodies directed against a combination of phospholipid with prothrombin, protein C, or protein S: an explanation for their pathogenic mechanism? Blood 1993; 81(10): 2618-25.
21. Rand JH, Wu XX. Antibody-mediated disruption of annexin-V antithrombotic shield: a new mechanism for thrombosis in the antiphospholipid syndrome. Thromb Haemost 1999; 82(2): 649-55.
22. Rand JH, Wu XX, Andree HA, Ross JB, Rusinova E, Gascon-Lema MG, et al. Antiphospholipid antibodies accelerate plasma coagulation by inhibiting annexin-V binding to phospholipid syndrome: a "lupus procoagulant" phenomenon. Blood 1998; 92(5): 1652-60.
23. Forastiero RR, Martinuzzo ME, Kordich LC, Carreras LO. Reactivity to beta 2 glycoprotein I clearly differentiates anticardiolipin antibodies from phospholipid syndrome and syphilis. Thromb Haemost 1996; 75(5): 717-20.
24. Matsuda J, Saitoh N, Gohchi K, Tsukamoto M. Anti-annexin V antibody in systemic lupus erythematosus patients with lupus anticoagulant and/or anticardiolipin antibody. Am J Hematol 1994; 47(1): 56-8.
25. Kupferminc MJ, Eldor A, Steinman N, Many a, Bar-Arm A, Jaffa A, et al. Increased frecuency of genetic thrombophilia in women with complications of pregnancy. N Engl J Med 1999; 340(1): 9-13.
26. Miller GJ. Lipoproteins and haemostatic system in the atherothrombotic disorders. Baillieres Best Pract Res Clin Haematol 1999; 12(3): 555-75.
27. Bostom AG, Gagnon DR, Cupples LA, Wilson PW, Jenner JL, Ordovas JM, et al. A prospective investigation of elevated lipoprotein (a) detected by electrophoresis and cardiovascular disease in women: The Framingham Heart Study. Circulation 1994; 90(4): 1688-95.
28. Nowak-Gottl U, Sonntag B, Junker R, Cirkel U, von Eckardstein A. Evaluation of lipoprotein (a) and genetic prothrombotic risk factors in patients with recurrent fetal loss. Thromb Haemost 2000; 83(2): 350-1.
29. Ogunyemi D, Ku W, Arkel Y. The association between inherited thrombophilia, antiphospholipid antibodies and lipoprotein A levels with obstetrical complications in pregnancy. J Thromb Thrombolysis 2002; 14(2): 157-62.
30. Sattar N, Clark P, Greer IA, Shepherd J, Packard CJ. Lipoprotein (a) levels in normal pregnancy and in pregnancy complicated with preeclampsia. Atherosclerosis 1999; 148(2): 407-11.
31. van Pampus MG, Koopman MM, Wolf H, Buller HR, Prins MH, van den Ende A. Lipoprotein (a) concentrations in women with a history of severe preeclampsia: a case control study. Thromb Haemost 1999; 82(1): 10-3.
32. Brenner B, Sarig G, Weiner Z, Younis J, Blumenfeld Z, Lanir N. Thrombophilic polimorphisms are common in women with fetal loss without apparent cause. Thromb Haemost 1999; 82(1): 6-9.
33. van der Molen EF, Arends GE, Nelen WL, van der Put NJ, Heil SG, Eskes TK, et al. A common mutation in the 5,10-methylenetrahydrofolate reductase gene as a new risk factor for placental vasculopathy. Am J Obstet Gynecol 2000; 182(5): 1258-63.
34. Bokarewa MI, Bremme K, Blomback M. Arg 506-Gln mutation in factor V and risk of thrombosis during pregnancy. Br J Haematol 1996; 92(2): 473-8.
35. Grandone E, Margaglione M, Colaizzo D, d’Addedda M, Capucci G, Vecchione G, et al. Factor V Leiden mutation is associated with repeated and recurrent unexplained fetal losses. Thromb Haemost 1997; 77(5): 822-4.
36. Kutteh WH, Park VM, Deitcher SR. Hypercoagulable state mutation analysis in white patient with early first-trimester recurrent pregnancy loss. Fertil Steril 1999; 71(6): 1048-53.
37. McColl MD, Ellison J, Reid F, Tait RC, Walker ID, Greer IA. Prothrombin G/20210A, MTHFR C677T mutations in women with venous thromboembolism associated with pregnancy. Br J Obstet Gynecol 2000; 107(4): 565-9.
38. Brenner B, Sarig G, Weiner Z, Younis J, Blumenfeld Z, Lanir N. Thrombophilic polimorphisms in women with fetal loss. Blood 1998; 92 (Suppl 1): 558a.
39. Deitcher SR, Park VM, Kutteh WH. Prothrombin 20210A mutation analysis in Caucasian women with early first trimester recurrent pregnancy loss. Blood 1998; 92 (Suppl 1): S250.
40. van der Molen EF, Verbruggen B, Novakova I, Eskes TK, Monnens LA, Blom HJ. Hyperhomocysteinemia and other thrombotic risk factors in women with placental vasculopaty. BJOG 2000; 107(6): 785-91.
41. Lens D, Otero AM, Brugnini A, Henry S, Trías N, Díaz A. Prevalence of FV Leiden, prothrombin 20210A and the thermolabile MTHFR in the Uruguayan population. Thromb Haemost 2001; 86 (Suppl): P668.
42. Volsett SE, Bjorke-M AAL, Igrens LM. Plasma total homocysteine and previous pregnancies: the Hordalnd homocysteine study. Proceedings of the 2nd International Symposium on Homocysteine. Neth J Med 1998; 52: 854.
43. Zoller B, Berntsdotter A, Garcia de Frutos P, Dahlback B. Resistance to activated protein C as an additional genetic risk factor in hereditary deficiency of protein S. Blood 1995; 85(12): 3518-23.
44. Mandel H, Brenner B, Berant M, Rosenberg N, Lanir N, Jakobs C, et al. Coexistence of hereditary homocystinuria and factor V Leiden-effect on thrombosis. N Eng J Med 1996; 334(12): 763-8.
45. Otero AM, Pou Ferrari R, Dellepiane M, Muxi P, De Lisa E, Attarian D, et al. Pregnancy outcome in women with recurrent pregnant loss treated with enoxaparin. Thromb Hemost 2001; 86 (Suppl): P3029.
46. Sorensen HT, Johnsen SP, Larsen H, Pedersen L, Nielsen GL, Moller M. Birth outcomes in pregnant women treated with low-molecular-weight heparin. Acta Obstet Gynecol Scand 2000; 79(8): 655-9.
47. Brenner B, Hoffman R, Blumenfeld Z, Weiner Z, Younis JS. Gestational outcome in thrombophilic women with recurrent pregnancy loss treated by enoxaparin. Thromb Haemost 2000; 83(5): 693-7.