Services on Demand
Journal
Article
Related links
Share
Revista Médica del Uruguay
On-line version ISSN 1688-0390
Rev. Méd. Urug. vol.20 no.2 Montevideo Aug. 2004
Control de un brote epidémico de enfermedad meningocócica por N. meningitidis serogrupo B
Dras. María Catalina Pírez *, Teresa Picón †, Jeannette Galazka †,
Ivonne Rubio ‡, Alicia Montano ‡, Ana María Ferrari ‡
Comité de Infectología de la Sociedad Uruguaya de Pediatría.
Facultad de Medicina, Montevideo, Uruguay
Resumen
Introducción: en Uruguay, en julio del año 2001, algunos eventos alertaron sobre la posibilidad de un cambio en la evolución de la enfermedad invasiva meningocócica (EIM), por Neisseria meningitidis serogrupo B y señalaron la posibilidad del pasaje de la forma endémica a la forma epidémica de la enfermedad. El brote epidémico que ocurrió entre mayo y julio de 2001 en la ciudad de Santa Lucía, departamento de Canelones, con una tasa de incidencia de 30 casos/100.000 habitantes motivó una amplia discusión entre las autoridades sanitarias del país que culminó con la vacunación de la población de 4 a 19 años de esta ciudad y sus alrededores y que se extendió luego al resto del país. Se usó la vacuna antimeningocócica B-C desarrollada por el Instituto Finlay de Cuba.
Objetivo: analizar los casos de EIM ocurridos después de la vacunación con vacuna antimeningocócica B-C en los departamentos de Canelones (443.053 habitantes) y de Montevideo (1.344.839 habitantes) en el año de observación posvacunación, abril de 2002 - marzo de 2003 para Canelones, y agosto de 2002 - julio de 2003 para Montevideo.
Material y método: se analizaron los casos de EIM ocurridos en los departamentos de Canelones y de Montevideo y notificados al Área de Vigilancia Epidemiológica del Ministerio de Salud Pública (MSP) después de administrar la vacuna antimeningocócica B-C. Se compararon con los casos ocurridos en los dos años previos. Las variables analizadas fueron: edad, forma clínica, vacunación con vacuna antimeningocócica B-C, evolución clínica, serotipo y subserotipo de N. meningitidis serogrupo B.
Resultados: a) Canelones: en el período 1º abril de 2000 - 31 marzo de 2001 la incidencia fue de 1,5 casos/100.000 habitantes, se duplicó en el período 1º abril de 2001- 31 marzo de 2002 a 3,4/100.000 y en el período posvacunal disminuyó a 1,8/100.000 habitantes. La letalidad fue 27% en el período del brote epidémico y 12,5% en el período posvacunal. En el grupo de 4 a 19 años la incidencia fue de 7,4/100.000 en el período 1º abril de 2001 - 31 marzo de 2002 con tres muertes (todas asociadas a la cepa B: 4,7: P1.19,15); no hubo casos en ese grupo en el período posvacunal.
b) Montevideo: en el período 1º agosto de 2000 - 31 julio de 2001 la incidencia fue de 1,5 casos/100.000 habitantes, aumentando a 2,3/100.000 en el período 1º agosto de 2001 - 31 julio de 2002 y disminuyendo a 1,8/100.000 en el posvacunal. En los dos primeros períodos predominó la cepa B: 4,7: P1.19,15. La letalidad fue de 5% en el período 1º agosto de 2000 - 31 julio de 2001, 10% en el período 1º agosto de 2001 - 31 julio de 2002 y 4,5% en el posvacunal. De los 24 casos ocurridos luego de la vacunación, seis se presentaron en pacientes vacunados. En el grupo de 4 a 19 años hubo 15 casos en el período 1º agosto de 2001 - 31 julio de 2002 y 11 después de la vacunación.
Discusión: la incidencia de la enfermedad después de la campaña de vacunación se situó en los valores previos al año 2001. No se presentaron casos en el grupo de 4 a 19 años (población objeto de la vacunación) en Canelones. En ese grupo etario en Montevideo no se observaron cambios. Se destaca la disminución de muertes causadas por la cepa vacunal.
Conclusión: la vacunación con la vacuna antimeningocócica B-C fue útil para el control del brote epidémico del año 2001. Logró reducir la incidencia y los casos fatales en el grupo vacunado.
Palabras clave: MENINGITIS MENINGOCÓCICA- epidemiología.
MENINGITIS MENINGOCÓCICA - inmunología.
VACUNAS MENINGOCÓCICAS.
* Prof. Agregada de Pediatría. Facultad de Medicina. Universidad de la República. Montevideo, Uruguay.
† Pediatras. Comité Infectología de la Sociedad Uruguaya de Pediatría.
‡ Profesoras de Pediatría. Facultad de Medicina. Universidad de la República. Montevideo, Uruguay.
Correspondencia: Dra. María Catalina Pírez
Centro Hospitalario Pereira Rossell. Hospital Pediátrico. Br. Artigas 1550, piso 3. CP 11600. Montevideo, Uruguay.
E-mail: mcpirez@yahoo.com
Recibido: 5/9/03.
Reenviado para modificaciones: 29/1/04.
Aceptado: 23/4/04.
Antecedentes
En los últimos años ha ocurrido en Uruguay un cambio en la epidemiología de la enfermedad invasiva meningocócica (EIM), asistiéndose prácticamente a la desaparición de casos correspondientes a Neisseria meningitidis serogrupo C, lo que puede atribuirse en parte a las campañas de vacunación de los años 1996 y 1999. Los casos por serogrupo B han ido aumentando siendo actualmente el único serogrupo aislado de casos de EIM en Montevideo y Canelones.
En julio del año 2001 se detectaron algunos eventos que alertaron sobre la posibilidad de un cambio en la evolución de la EIM por Neisseria meningitidis serogrupo B: aumento en el número de casos, desplazamiento de las edades de los pacientes afectados hacia la franja de mayores de 5 años, agrupamiento de casos en una pequeña ciudad del departamento de Canelones (Santa Lucía), fallecimiento de pacientes predominantemente mayores de 5 años y predominio de una cepa, la B:4,7:P1.15,19, sobre una mezcla de cepas de Neisseria meningitidis serogrupo B. Estos cambios señalaban la posibilidad del pasaje de la forma endémica a la forma epidémica de la enfermedad(1-6).
El brote epidémico que ocurrió entre los meses de mayo y julio de 2001 en la ciudad de Santa Lucía, de 16.500 habitantes, con una tasa de incidencia de 30 casos/100.000 habitantes, determinó el alerta de la población y motivó una amplia discusión entre las autoridades sanitarias del país que culminó con la vacunación de la población de 4 a 19 años de esta ciudad y sus alrededores en el mes de diciembre, que se extendió luego progresivamente al resto del país(6).
La campaña de vacunación se realizó con la vacuna antimeningocócica B-C desarrollada por el Instituto Finlay de Cuba (proteínas de membrana externa, cepa B:4:P1,15 polisacárido capsular C)(7).
La vacunación fue gratuita y no obligatoria y se administró en un régimen de dos dosis (0 y 8 semanas). Se recomendó vacunar a la población de 4 a 19 años dado que estudios previos demostraron mayor eficacia en este grupo etario(8-11).
La vacunación se realizó entre diciembre de 2001 - marzo de 2002 en Canelones, abril de 2002 - julio de 2002 en Montevideo y junio de 2002 - octubre de 2002 en el resto del país.
Durante la campaña no se llevó registro individual de los niños vacunados, pero según el número de dosis aplicadas se estima que fue vacunada 70% de la población de 4 a 19 años de todo el país (81% en Canelones y 73% en Montevideo). Sin embargo, se supone que el número de niños de esa edad vacunado debe ser mayor, ya que la vacuna está disponible en el país para su adquisición privada desde 1992, habiéndose vendido desde entonces 170.933 dosis.
En la presente comunicación se analizan los casos de EIM por Neisseria meningitidis serogrupo B ocurridos un año después de esta vacunación en los departamentos de Canelones (443.053 habitantes) de abril de 2002 a marzo de 2003 y de Montevideo (1.344.839 habitantes) de agosto de 2002 a julio de 2003* .
* Instituto Nacional de Estadística. Censo poblacional 1996
Objetivo
Analizar los casos de EIM ocurridos en los departamentos de Canelones y Montevideo después de la vacunación con vacuna antimeningocócica B-C.
Material y método
Se analizaron los casos de EIM ocurridos en los departamentos de Canelones y Montevideo y notificados al Área de Vigilancia Epidemiológica del Ministerio de Salud Pública (MSP) un año después de la vacunación. Dado que la vacunación se realizó en forma escalonada, el período de observación es diferente para cada departamento y se denominó como período posvacunal. La observación se inició al menos un mes después de la aplicación de la segunda dosis. El período posvacunal se extendió para el departamento de Canelones desde el 11 abril de 2002 - 31 marzo de 2003 y para Montevideo desde el 1º agosto de 2002 - 31 julio de 2003. Los casos se compararon con los ocurridos en el mismo departamento en los dos años previos. Para Canelones el primer período de observación fue: 1º abril de 2000 - 31 marzo de 2001; el segundo, 1º abril de 2001 - 31 marzo de 2002 (período que comprendió el brote epidémico). Para Montevideo el primer período de observación fue: 1º agosto de 2000 - 31 julio de 2001; el segundo período fue: 1º agosto de 2001 - 31 julio de 2002.
Un caso de enfermedad meningocócica se definió por el aislamiento de N. meningitidis serogrupo B en un sitio normalmente estéril, como sangre o líquido cefalo-rraquídeo.
La seroagrupación y serosubtipificación de Neisseria meningitidis se realizó en el Departamento de Laboratorios de Salud Pública; las cepas aisladas en el año 2001 fueron también procesadas en el Laboratorio Adolfo Lutz, en Brasil*.
Las variables que se analizaron fueron: edad (menor de 4 años, 4 a 19 años, 20 años y más); forma clínica (meningitis-meningococcemia); vacunación con vacuna antimeningocócica B-C (dos dosis, una dosis, no vacuna); evolución clínica (alta o fallecimiento); serotipo y sub-serotipo de N. meningitidis serogrupo B.
* Ministerio de Salud Pública. Área de Vigilancia Epidemiológica "Situación de las meningitis supuradas en el Uruguay" 13/1/02.
Resultados
a) Canelones
En el período abril de 2000 - marzo de 2003 se registraron 30 casos de EIM en el departamento de Canelones. La incidencia en el primer período fue de 1,5/100.000 habitantes, se duplicó en el segundo período llegando a 3,4/100.000 habitantes y disminuyó en el período posvacunal a 1,8/100.000 habitantes. Durante el segundo período ocurre el brote en la ciudad de Santa Lucía con cinco afectados en 16.500 habitantes, determinando una incidencia de 30/100.000 habitantes.
La distribución de los casos en los tres períodos según sexo, forma clínica, evolución y estado vacunal se presenta en la tabla 1. En el segundo período hubo un predominio de casos en el sexo femenino. Ninguno de los casos de EIM había recibido la vacuna antimeningocócica BC. La letalidad fue de 27% en el segundo período y 12,5% en el período posvacunal. No se habían registrado muertes en el primer período previo al brote epidémico.
En el grupo etario de 4 a 19 años, al que fue dirigida la vacunación, la incidencia en el primer período fue 1,6/100.000 (dos casos), 7,4/100.000 (nueve casos) en el brote epidémico y no se presentó ningún caso en el período posvacunal (figura 1).
La tabla 2 muestra el serotipo y subserotipo de N. meningitidis tipo B, responsable de los casos de EIM y su relación con la mortalidad. Se observa que en los tres períodos analizados la cepa B:4,7: P1.19,15 es la predominante.
La cepa B:4,7: P1.19,15 se identificó en los cinco casos fatales, cuatro durante el brote epidémico y uno en el período posvacunal. De los cuatro casos fallecidos en el segundo período, tres correspondían al grupo de 4 a 19 años y el restante al de 20 y más años. En el período posvacunal no se observaron muertes en el grupo etario vacunado; el caso fallecido correspondió al grupo de 20 y más años.
La figura 2 muestra la distribución de las cepas vacunales y no vacunales causantes de EIM según el grupo etario en los períodos analizados. En el período posvacunal en el grupo etario de 20 años y más, tres de los cuatro casos observados correspondieron a la cepa vacunal.
b) Montevideo
En el período agosto de 2000 - julio de 2003 se registraron 75 casos de EIM en el departamento de Montevideo. La incidencia en el primer período fue de 1,5/100.000 habitantes, aumentó a 2,3/100.000 en el segundo período y disminuyó en el período posvacunal a 1,8/100.000 habitantes.
La distribución de los casos según sexo, presentación clínica, estado vacunal, y evolución se presenta en la tabla 3. En el primer período hubo un predominio de casos en el sexo femenino que no se repitió en los otros períodos. Se observó un aumento marcado de las meningococemias como forma de presentación clínica en el segundo período, que disminuyó francamente en el posvacunal.
La letalidad fue de 5% en el primer período, 10% en el segundo período y 4% en el posvacunal.
En el período posvacunal ocurrieron seis casos en pacientes vacunados con dos dosis:1) niña de 6 años en la que la cepa aislada fue clasificada como B:4: P1 no serotipificada; 2) niño de 5 años cuya cepa correspondió a B:4:P1.15; 3) niño de 7 años cuya cepa correspondió a B:4:P1.15; 4) niño de 3 años cuya cepa fue clasificada como B:15: P1. 16; 5) niña de 4 años no tipificada y 6) niño de 9 años con la cepa B:4: P1. 7.1.
En el grupo etario de 4 a 19 años, al que fue dirigida la vacunación, la incidencia en el primer período fue 2,4/100.000 (8 casos), 4,6/100.000 (15 casos) en el segundo y 3,4/100.000 (11 casos) en el período posvacunal (figura 3).
La tabla 4 muestra el serotipo y subserotipo de N. meningitidis tipo B, responsable de los casos de EIM y su relación con la mortalidad.
En el segundo período sucedieron tres muertes, dos en menores de 4 años y una en el grupo de 4 a 19 años. La muerte ocurrida en el período posvacunal correspondió a un niño de 2 años de edad.
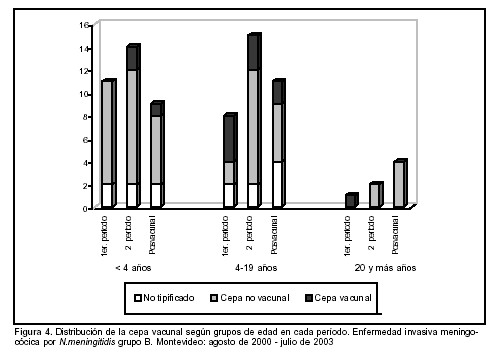
La figura 4 muestra la distribución de cepas vacunales y no vacunales causantes de EIM según grupo etario en los períodos analizados.
Discusión
La EIM es una de las más serias infecciones que genera preocupación en el equipo de salud y la población. Existen estrategias de prevención adecuadas para el control de brotes o epidemias. La utilización de vacunas polisacarídicas o polisacáridos conjugados con proteínas ha demostrado su eficacia en la prevención de enfermedad por los serogrupos A, C, Y y W135. El desarrollo de vacunas que protejan contra la infección por N. meningitidis grupo B ha sido abordado por diferentes grupos(7,12,13).
En Uruguay, en el año 2001, se observaron indicadores epidemiológicos que señalaban la posibilidad de una epidemia(6). La cepa predominante era la B:4,7: P1.19,15.
La vacuna desarrollada por el Instituto Finlay es preparada con esta cepa(7). Existe suficiente información acerca de la efectividad de esta vacuna en la población mayor de 4 años y se ha recomendado su utilización para situaciones como la ocurrida en Uruguay(3,14).
Después de una profunda revisión del tema y de la situación epidemiológica, las autoridades sanitarias del país resolvieron la inmunización de la población de 4 a 19 años con la vacuna preparada con proteína de membrana externa serotipo B 4,7 subserotipo 15,19 del Instituto Finlay.
La incidencia de la enfermedad después de un año de finalizada la campaña de inmunización en Canelones se situó en los valores previos al año 2001, con ausencia de casos en el grupo de 4 a 19 años, población objeto de la vacunación. La incidencia en los niños menores de 4 años se mantuvo incambiada.
La disminución de casos -sobre todo de muertes- fue el hecho más importante observado después de la vacunación.
Los resultados de esta campaña coinciden con las comunicaciones de otros autores que demostraron la eficacia de esta vacuna en las personas mayores de 4 años(8-11).
No se pudo calcular la eficacia de la vacuna porque durante esta campaña no se llevó un registro individual de los niños vacunados, así como tampoco existen registros que permitan conocer el número de niños vacunados previamente a la campaña. En Canelones no se presentaron casos en pacientes vacunados, lo que permite suponer que la eficacia fue alta en esta población. La aparición de casos en los que se aisló la cepa vacunal en pacientes mayores de 20 años indica que la cepa continuaba circulando en la población. En estudios realizados en Brasil y Cuba la eficacia en mayores de 4 años varió entre 71% y 84% según el grupo etario y el momento epidémico en el que se vacunó(3,8-11).
En Montevideo la vacunación se realizó un mes después de finalizada la campaña en Canelones. Se observó una disminución del número de casos en el año posterior a la vacunación. En Montevideo sucedieron seis casos de EIM en niños vacunados con dos dosis de vacuna antimeningocócica B-C. La eficacia de la vacuna se sitúa en alrededor de 80%, lo que podría explicar los casos que se presentaron en niños vacunados. Tres de estos casos fueron debidos a la cepa vacunal.
El análisis de los resultados de esta campaña permite catalogarla de exitosa, ya que logró el objetivo de reducir el número de casos en el grupo etario donde predominaban y en especial disminuir los casos fatales. La decisión de vacunar precozmente cuando hay indicadores que señalan el comienzo de una epidemia por N. meningitis grupo B es recomendada por algunos autores(3,14). Esta recomendación se ajustaba a la situación epidemiológica relatada. La disponibilidad de una vacuna con eficacia y tolerancia adecuadas hizo posible su utilización para controlar este brote epidémico(15).
Las epidemias por meningococo B se caracterizan por iniciarse lentamente, alcanzar tasas de 5 a 20/100.000 habitantes por año y persistir por cinco a diez años(4). Por ejemplo, en Nueva Zelanda, país con una incidencia de 1,6/100.000 en la preepidemia, alcanzó una incidencia de 16,9/100.000 en 1997 para mantenerse hasta el año 2000 con una incidencia anual de 13,9/100.000 habitantes(5). En ese país se realizaron ensayos para lograr una vacuna adecuada(12). Se ha señalado la importancia de disponer de vacunas que permitan controlar estos brotes epidémicos antes de que se instale una epidemia de la magnitud de las descritas en Cuba, Brasil, Noruega, Nueva Zelanda, Estados Unidos (Oregon)(3,4,13,14).
La decisión adoptada en Uruguay de actuar al inicio del brote epidémico, la diferencia con otras situaciones en que se ha utilizado esta vacuna cuando la epidemia ya estaba instalada(8-11), constituye un aporte interesante al tema.
Aún continúan la discusión y las investigaciones sobre la protección para cepas homólogas versus la protección para cepas homólogas y heterólogas incluidas en las vacunas(12,16,17).
Avances en el estudio de la eficacia de las vacunas preparadas con proteínas de membrana externa, en los conocimientos de la respuesta inmunológica a la EIM y a las vacunas antimeningocócicas, así como disponer de pruebas adecuadas para medir esta respuesta, seguramente permitirán el desarrollo de nuevas vacunas o la mejor utilización de las disponibles hoy día para prevenir las epidemias de N. meningitidis grupo B(16-19).
Las nuevas vacunas conjugadas (antimeningocócica conjugada C, antimeningocócica conjugada A + C + W 135 + Y), obligan a mantenerse atentos a la posibilidad de nuevos recursos para la prevención de esta enfermedad(20, 21).
La meta de prevenir la EIM por meningococo grupo B no se ha alcanzado. Quedan muchos aspectos a investigar sobre las vacunas existentes, como su eficacia en los menores de 4 años, protección cruzada contra otros subserotipos, número de dosis, duración de la protección, etcétera(12,16). No se descarta la posibilidad de desarrollar nuevas vacunas.
Estos datos permiten concluir que la vacunación con la vacuna antimeningocócica B-C fue útil para el control del brote epidémico del año 2001 en Canelones y Montevideo, Uruguay.
Agradecimientos
Los autores desean agradecer especialmente a los doctores Mariela Savio y Sergio Curto, del Área de Vigilancia Epidemiológica del Ministerio de Salud Pública, por la disposición para el análisis y la revisión permanente de los casos.
Summary
Background. In July 2001, some events indicated a possible variation in the course of invasive meningococcal disease (EIM) by Neisseria meningitidis serogroup B showing a transformation from an endemic to an epidemic form of the disease. The epidemic peak occurred from May to July 2001in Santa Lucía with an incident rate of 30 cases/100 000 inhabitants, led to a discussion within the public health authorities and concluded with a vaccination for children over 4 years and youths under 19 years all over the country.
BC antimeningococcal vaccine from Finlay (Cuba) was chosen to prevent the disease.
Objective. To analize EIM cases occurred after vaccination with BC antimeningococcal vaccine in Canelones (443 053 inhabitants) from April 2002 to March 2003 and Montevideo (1 344 839 inhabitants) from August 2002 to July 2003.
Methods. EIM cases reported to the Epidemiologic Department of the Public Health Minister (Area de Vigilancia Epidemiológica-MSP) after vaccination were analyzed and compared to cases occurred the prior two years. Variables analyzed were age, clinical presentation, BC antimeningococcal vaccine, clinical evolution, serotype and subserotype N. meningitidis serogroup B.
Results. a) Canelones: From April 1, 2000 to March 31, 2001 the incidence was 1.5 cases/100 000 inhabitants, from April 1, 2001 to March 31, 2002 the incidence doubled to 3.4/100 000, but decreased to 1.8/100 000 after vaccination. Mortality was 27% during epidemic peak and 12.5% after vaccination. In the 4-19 years old group incidence was 7.4/100 000 (from April 1, 2001 to March 31, 2002) with 3 deaths (all associated with strain B: 4.7: P11.19,15; there were no cases after vaccination. b) Montevideo: From August 1, 2000 to July 31, 2001 the incidence was 1.5 cases/100 000 inhabitants, from August 1, 2001 to July , 2002 the incidence increased to 2.3/100 000, and decreased to 1.8/100 000 after vaccination. Strain B was predominant in the first and second periods. Mortality was 5% from August 1, 2000 to July 31, 2001, 10% from August 1, 2001 to July 31, 2002 and 4.5% after vaccination. Out of the 24 cases occurred after vaccination, 6 presented in immunized patients. There were 15 cases in the 4-19 years old group from August 1, 2001 to July 31, 2002 and 11 after vaccination.
Discussion. The incidence of the disease was similar both for the period after the vaccination campaign and the period previous to 2001. There were no cases in the 4-19 years old group (objective population) in Canelones. There were no changes for the same age group in Montevideo. Vaccination-related deaths decreased.
Conclusion. BC antimeningococcal vaccine controlled the epidemic peak of 2001. Incidence and fatal deaths were reduced after vaccination.
Résumé
Introduction: en juillet 2001, en Uruguay, quelques événements ont alerté sur la possibilité d’un changement à l’évolution de la maladie invasive méningococcique, EIM par Neisseria meningitidis sérogroupe B et ont signalé la possibilité du passage du stade endémique au stade épidémique de la maladie. La hausse épidémique de mai-juillet 2001 à la ville de Santa Lucía (30 cas/100.000 habitants) a causé une discussion parmi les autorités sanitaires du pays, ce qui a mené à la vaccination de la population de 4-19 ans de cette ville et de ses alentours pour après s’étendre dans le reste du pays. On a utilisé le vaccin méningococcique B-C de l’Institut Finlay de Cuba.
But: analyser les cas de EIM survenus après la vaccination avec vaccin méningococcique B-C dans les départements de Canelones (443.053 habitants) et de Montevideo (1.344.839 hab.) en avril 2002-mars 2003 pour le premier et en août 2002-juillet 2003 pour Montevideo.
Méthodes: On analyse les cas de EIM survenus aux départements de Canelones et de Montevideo, après avoir vacciné avec antiménigococcique B-C. On compare aux cas survenus deux ans avant. Les variables analysées: âge, forme clinique, vaccination avec vaccin antiméninco-coccique B-C, évolution clinique, sérotype et sursérotype de N. Meningitidis sérogroupe B.
Résultats: a) Canelones: dans la période 1er avril-31 mars 2001, l’incidence est de 1,5 cas/100.000 habitants, elle devient le double dans la période 1er avril 2001- 31 mars 2003 (3,4/100.000) et dans la période post-vaccinale elle diminue (1,8/100.000). La létalité a été de 27% dans la période de poussée épidémique et de 12,5% dans la période post-vaccinale. Pour le groupe de 4 à 19 ans l’incidence a été de 7,4 /100.000 (période 1er avril 2001-31 mars 2002) avec trois morts (toutes associées à la cèpe B:4,7:P1.19,15); pas de cas dans la période post-vaccination.
b) Montevideo: dans la période 1er août 2000-31 juillet 2001 l’incidence a été de 1,5 cas/100.000 habitants, a augmenté à 2,3/100.000 dans la période 1er août 2001- 31 juillet 2002 et a diminué à 1,8/100.000 après le vaccin. La cèpe B:4,7:P1.19,15 a prédominé dans les deux premières périodes. La létalité a été de 5% pour la période 1er août 2000-31 juillet 2001, 10% en août 2001-31 juillet 2002 et 4,5% après vaccination. Des 24 cas survenus après la vaccination, 6 étaient des patients vaccinés. Dans le groupe de 4 à 19 ans il y a eu 15 cas dans la période 1er août 2001-31 juillet 2002 et 11 après vaccin.
Discussion: L’incidence de la maladie après la campagne de vaccination s’est située dans les valeurs antérieures à 2001. Il n’y a pas eu de cas dans le groupe de 4 à 19 ans (population cible de la vaccination) à Canelones. Dans ce même groupe à Montevideo on n’a pas apprécié de variantes. On signale la diminution de morts causées par cèpe vaccin.
Conclusion: la vaccination avec le vaccin anti-méningococcique B-C a été utile pour le contrôle de la hausse épidémique de l’an 2001. Elle a réussi à réduire l’incidence et les cas mortels dans le groupe vacciné.
Bibliografía
1. Diermayer M, Hedberg K, Hoesly F, Fischer M, Perkins B, Reeves M, Fleming D. Epidemic serogroup B meningococcal disease in Oregon: the evolving epidemiology of the ET-5 strain. JAMA 1999; 281(16): 1493- 7.
2. Cartwright KA, Stuart JM, Noah ND. An outbreak of meningococcal disease in Goucestershire. Lancet 1986; 2(8506): 558-61.
3. Peltola H. Prophylaxis of bacterial meningitis. Infect Dis Clin North Am 1999;13 (3): 685-710.
4. Wenger JD. Serogroup B meningococcal disease: new outbreaks, new strategies. JAMA 1999; 281(16): 1541-3.
5. Baker MG, Martin DR, Kieft CE, Lennon D. A 10-year serogroup B meningococcal disease epidemic in New Zealand: descriptive epidemiology, 1991-2000. J Paediatr Child Health 2001; 37(5): S13-9.
6. Pírez MC, Picon T, Galazka J, Quian j, Gutiérrez S, Ferrari AM, et al. Enfermedad invasiva meningocócica en Uruguay. Informe epidemiológico y recomendaciones, mayo 2002. Rev Med Urug 2002; 18(1): 83-8.
7. Sierra GV, Campa HC, Varcacel NM, Garcia IL, Izquierdo PL, Sotolongo PF, et al. Vaccine against group B Neisseria meinigitidis: protection trial and mass vaccination results in Cuba. NIPH Ann 1991; 14(2): 195-207.
8. Rico Cordeiro O, Pereira Colls C, Fernández AA. Eficacia poslicenciamiento de Va-MENGOC-BC en menores de 6 años en Holguin, Cuba. Primer año de observación. Rev Cubana Med Trop 1995, 47(1): 59-64.
9. de Moraes JC, Perkins BA, Camargo MC, , Hidalgo NT, Barbosa HA, Sacchi CT, et al. Protective efficacy of a serogroup B meningococcal vaccine in Sao Paulo, Brazil. Lancet 1992; 340(8827): 1074-8.
10. Noronha CP, Struchiner CJ, Halloran ME. Assessment of the direct effectiveness of BC meningococcal vaccine in Rio de Janeiro, Brazil: a case control study. Int J Epidemiol 1995; 24(5): 1050-7.
11. Costa EA, Martins H, Klein CH. Avaliaçao da proteçao conferida pela vacina antimeningocica BC no Estado de Santa Catarina, Brasil, 1990-1992. Rev Saude Publica 1996; 30(5): 460-70.
12. de Kleijn ED, de Groot R, Lafeber AB, Labadie J, van Limpt CJ, Visser J, et al. Prevention of meningococcal serogroup B infections in children: a protein-based vaccine induces immunologic memory. J Infect Dis 2001; 184(1): 98-102.
13. Bjune g, Hojby EA, Gronnesby JK, Arnesen O, Fredriksen JH, Halstensen A, et al. Effect of outer membrane vesicle vaccine against group B meningococcal disease in Norway. Lancet 1991; 338(8775): 1093-6.
14. Asociación Americana de Infectología. Asociación Española de Pediatría. Sociedad Latinomericana de Pediatría. Vacunación contra el meningococo In: Manual de Vacunas en Pediatría. 2ed. Madrid: Latinoamericana, 2000: 165-78.
15. Debbag R, Rittiman R, Stamboulian D. Evaluación de las reacciones adversas asociadas con la vacuna antimeningocócica BC: informe preliminar sobre 8.117 vacunados. Rev Hosp Niños Bs As 1994; 36:158-9.
16. Morley SL, Cole MJ, Ison CA, Camaraza MA, Solotongo F, Anwar N, et al. Immunogenicity of a serogroup B meningococcal vaccine against multiple Neisseria meningitidis strains in infants. Pediatr Infect Dis J, 2001; 20(11): 1054-61.
17. Tappero JW, Lagos R, Ballesteros AM¸ Plikaytis B, Williams D, Dykes J, et al. Immunogenicity of 2 serogroup B outer-membrane protein meningococcal vaccines: a randomized controlled trial in Chile. JAMA 1999; 281(16): 1520-7.
18. Perkins BA, Jonsdottir K, Briem H, Griffiths E, Plikaytis BD, Hoiby EA, et al. Immunogenicity of two efficacious outer membrane protein-based serogoup B meningococcal vaccines among adults in Iceland. J Infect Dis 1998; 177(3): 683-91.
19. Pollard AJ, Galassini R, Rouppe van der Voort EM, Hibberd M, Booy R, Langford P, et al. Cellular Immune Responses to Neisseria meningitidis in children. Infect Immun 1999; 67(5): 2452-63.
20. Peter G. Update on meningococcal vaccine. Pediatr Infect Dis J 2000; 20(3):311-2.
21. Lepow ML, Perkins BA, Hughes PA, Poolman JT. Meningococcal Vaccines. In: Plotkin S, Orenstein W, eds. Vaccines. 3 ed. Philadelphia: Saunders, 1999:711-27.