Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Médica del Uruguay
versión On-line ISSN 1688-0390
Rev. Méd. Urug. vol.19 no.1 Montevideo mayo 2003
Tratamiento inhalatorio en la crisis asmática severa
Dres. Gustavo J. Rodrigo1, Carlos Rodrigo2
Resumen
Se realiza una revisión sobre el tratamiento inhalatorio de la crisis asmática. La inhaloterapia está ampliamente difundida en la práctica médica habitual, implicando importantes costos económicos. Sin embargo, se estima a nivel mundial que hay una administración inadecuada en un porcentaje importante, lo que resulta en fracasos terapéuticos y gastos innecesarios. Esto adquiere relevancia cuando se conoce el aumento de la mortalidad por asma en las últimas décadas y se detecta que tanto los pacientes como los médicos y paramédicos carecen mayoritariamente de los conocimientos básicos y habilidades para su adecuado manejo. Se establecen los objetivos de la inhaloterapia y se consideran sus aspectos fundamentales (físicos, generadores de aerosoles, farmacología). Se estudian y comparan los distintos sistemas de generación de aerosoles y también se analizan los diferentes fármacos inhalados. Se exponen con detalle los beta agonistas, anticolinérgicos y corticoides en sus formas inhaladas. También se presentan otros tratamientos inhalatorios no tradicionales como el sulfato de magnesio y una mezcla gaseosa heliox. En los distintos tópicos se recurre en lo posible a revisiones sistemáticas o metaanálisis para establecer preferencias o elegir tratamientos. Los autores proponen algunas estrategias terapéuticas avaladas en su experiencia, documentada en la bibliografía aportada.
Palabras clave: ASMA - quimioterapia.
ASMA - terapia.
ENFERMEDAD AGUDA.
ESTADO ASMATICO - terapia.
AEROSOLES - uso terapéutico.
BETA AGONISTAS ADRENERGICOS - uso terapéutico.
ANTAGONISTAS COLINERGICOS - uso terapéutico.
CORTICOSTEROIDES - uso terapéutico.
TERAPIA POR INHALACION DE OXIGENO.
1. Departamento de Emergencia, Hospital Central de las Fuerzas Armadas.
2. Centro de Tratamiento Intensivo, Asociación Española Primera de Socorros Mutuos.
Correspondencia: Dr. Carlos Rodrigo.
Gabriela Mistral 2256 - Parque Miramar. Canelones-Uruguay.
E-mail: crodrigo@adinet.com.uy
Recibido: 12/8/02.
Aceptado: 14/3/03.
Introducción
La inhaloterapia puede ser definida como la administración de fármacos (en forma de aerosoles o aerosolterapia) o gases directamente en el árbol traqueobronquial y alveolar(1). La aerosolterapia puede ser concebida como la conjunción de dos ciencias, la farmacología y la física de la administración de fármacos. Los aerosoles constituyen sistemas físicos bifásicos (suspensión de partículas sólidas o líquidas en un medio gaseoso) y son ampliamente usados en forma de formulaciones terapéuticas. Así, se utilizan en pacientes de todas las edades y en todos los ámbitos (desde el hogar hasta la unidad de cuidados intensivos). En Estados Unidos se gastan cada año billones de dólares en medicaciones que son administradas por vía inhalatoria, con una estimación de que una proporción sustancial de estos fármacos (28% a 87%) se administra inadecuadamente(2). Lamentablemente, muchos pacientes, médicos, así como personal paramédico, carecen de los conocimientos y las habilidades necesarias para un adecuado manejo de los dispositivos generadores de aerosoles.
La historia moderna de la inhaloterapia comienza en la década de 1930 con el desarrollo de los nebulizadores de jet (NEB), luego de los inhaladores de dosis medida (IDM) en los 50, los sistemas de polvo seco (SPS) en los 70 y, finalmente, la introducción de cámaras de inhalación en los 80. En comparación con la vía sistémica, la inhalatoria se encuentra asociada a un más rápido comienzo de acción y a menores efectos secundarios, ya que requiere dosis más pequeñas para alcanzar la concentración terapéutica a nivel de la pared de la vía aérea, y al hecho de que algunos fármacos son absorbidos pobremente en la circulación. Así, la mayoría de los fármacos utilizados en el tratamiento de la crisis asmática (CA) puede ser administrado por esta vía. Por estas razones, los agentes farmacológicos inhalados constituyen la base del tratamiento de la enfermedad respiratoria obstructiva(3,4) actuando en sitios específicos a nivel pulmonar (receptores) con mínimos efectos secundarios. El éxito de la terapia con aerosoles depende de que una cantidad adecuada del fármaco alcance los bronquiolos secundarios(5). La efectividad del tratamiento estará determinada por diversos factores tales como las características físicas de las formulaciones terapéuticas, el sistema de generación del aerosol, la condición y la edad del paciente, la técnica inhalatoria utilizada, así como el uso de cámaras de inhalación.
Metodología científica
Esta revisión tiene una estructura básica de las revisiones narrativas (estado del arte) pero compartiendo criterios de la medicina basada en la evidencia. Se consideraron los aspectos fundamentales de la inhaloterapia (física, generación de aerosoles y farmacología) relacionados con el tratamiento del paciente asmático agudo, adolescente y adulto. Estos conceptos pueden ser también aplicados en gran medida a la población pediátrica. Se realizó una extensa búsqueda bibliográfica sin restricción idiomática consultándose las bases de datos Medline, Current Contents, Science Citation y Embase, así como artículos de revisión no sistemática, metaanálisis, resúmenes de publicaciones de congresos nacionales, regionales e internacionales. Se puso especial énfasis en las 15 mejores revistas internacionales de neumología, aerosolterapia, medicina crítica, medicina interna y emergencia. Las búsquedas sistemáticas realizadas por los autores sobre varios temas fueron llevadas a cabo sobre el texto total de los trabajos en una labor independiente entre ellos, pero usando criterios específicos previamente determinados para la inclusión de los estudios abarcando diseño, características de la población, tipo de intervención, y objetivos finales a evaluar. La calidad metodológica de los trabajos fue evaluada siguiendo los siguientes criterios: 1) método de randomización; 2) características demográficas de la muestra; 3) criterios de inclusión /exclusión; 4) definición de enfermedad, asma aguda, crisis asmática; 5) cálculo del tamaño de la muestra, y 6) deserciones del protocolo. La evidencia disponible fue calificada en niveles: 1) metaanálisis de alta calidad, revisiones sistemáticas de estudios randomizados controlados o estudios randomizados y controlados con resultados definitivos; 2) revisiones sistemáticas de alta calidad de estudios no randomizados, caso-control o cohorte; 3) estudios no analíticos (reporte de casos, serie de casos), y 4) opinión de expertos.
Propiedades físicas del aerosol
Factores tales como el tamaño, la forma y la densidad del aerosol, afectan la deposición de las partículas dentro de la vía aérea(5). Estas características se encuentran determinadas por los generadores de aerosoles, los que serán analizados posteriormente, así como por la formulación del fármaco, el solvente y el propelente.
El tamaño de las partículas del aerosol es el determinante primario de la deposición pulmonar. Los generadores de aerosoles utilizados con propósitos terapéuticos son habitualmente heterodispersos, es decir, generan partículas de diferente tamaño (0,5 ?m a 35 ?m). El comportamiento de estos aerosoles se describe adecuadamente por medio de la mediana del diámetro de la masa aerodinámica (MMAD)(6): 50% de la masa del aerosol se encuentra conformada por partículas más pequeñas, y el otro 50% por partículas de mayor tamaño que el MMAD. Sólo las partículas con un MMAD entre 1 ?m a 5 ?m son depositadas eficientemente en el tracto respiratorio inferior (partículas "respirables")(7,8). Las partículas de mayor diámetro impactan en la vía aérea superior (orofaringe) y en las bifurcaciones debido a la inercia (cuanto mayor es la partícula mayor es la velocidad y el impacto), mientras que las más pequeñas son exhaladas (<0,5 ?m). Las partículas entre 1 ?m y 5 ?m son relativamente estables en el aire, y así su depósito en los pulmones se incrementa por la acción de la gravedad. De esta forma, detener la respiración al fin de la inspiración permite incrementar dicho depósito a nivel de la vía aérea periférica. Por lo tanto, la probabilidad de que las partículas penetren en el árbol traqueobronquial se correlaciona con el MMAD: cuanto menor el MMAD mayor penetración y depósito en las ramas más finas del árbol bronquial(9,10).
La humedad ambiental puede ser también un factor importante, ya que los aerosoles terapéuticos son frecuentemente higroscópicos pudiendo aumentar su tamaño dos a tres veces como consecuencia de la humedad de la vía aérea(11).
Finalmente, diversos factores relacionados con la ventilación, incluyendo la velocidad de la partícula, el volumen y el tiempo inspiratorio, pueden afectar la deposición del aerosol. La velocidad de las partículas se encuentra determinada por el generador del aerosol. Por ejemplo, los IDM producen partículas en un rango de 10 m/s a 100 m/s, mientras que los NEB o ultrasónicos así como los SPS producen aerosoles con velocidades relativamente bajas. También el incremento del flujo inspiratorio aumenta la deposición orofaríngea debido a un mayor impacto inercial.
Generadores de aerosoles
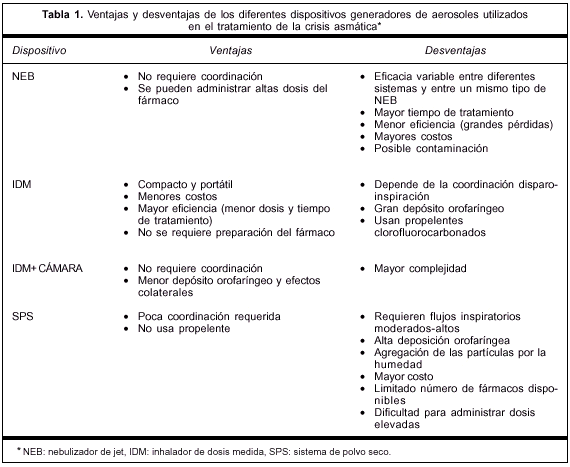
Existen cuatro generadores de aerosoles terapéuticos: el NEB, el nebulizador ultrasónico, el IDM, y los SPS. El IDM puede ser usado conjuntamente con una cámara de inhalación. Los NEB y los nebulizadores ultrasónicos pueden utilizar diversas medicaciones, mientras que los IDM y los SPS siempre contienen una medicación específica. Desde el punto de vista de la utilización en el tratamiento de la CA, consideraremos solamente los NEB, los IDM y los SPS. Cada sistema posee ventajas y limitaciones que deberán considerarse en la selección del dispositivo adecuado para cada paciente (tabla 1).
A pesar de una aceptación creciente de los tratamientos basados en la evidencia, globalmente en los servicios de urgencia, la forma más frecuente de generar aerosoles es el NEB (pequeño depósito donde se coloca el fármaco y el solvente) potenciado por gas (aire comprimido u oxígeno)(12). Si bien se pueden administrar grandes dosis de fármaco sin requerir coordinación con la inspiración del paciente, ello implica un tiempo de administración relativamente largo, es menos eficaz (utilización de dosis altas y grandes pérdidas), más costoso, y está sujeto a posible contaminación. Debemos recordar que sólo el fármaco nebulizado durante la inspiración del paciente puede alcanzar la vía aérea. En las mejores condiciones, sólo 10% de la dosis total administrada puede depositarse en el pulmón(13). Debe tenerse en cuenta que la administración del aerosol es considerablemente menos eficiente en la población pediátrica que en la adulta(14); así, la deposición puede ser tan baja como 1% en los neonatos.
Dentro de los principales factores que afectan la performance de un NEB se encuentran el volumen de llenado y el flujo de oxígeno o aire. Si aumentamos el volumen de llenado del NEB disminuye el volumen residual (volumen que queda al fin de la nebulización en el dispositivo y en las tubuladuras, de 0,5 mL a 1,5 mL) y aumenta la cantidad de fármaco nebulizado(15). También el aumento del flujo de aire u oxígeno incrementa la proporción de partículas en rango respirable producidas por el NEB. En términos generales, un volumen de llenado de 4 mL a 6 mL (fármaco y solvente), y un flujo de 6 L/minuto a 8 L/minuto disminuirán la concentración de la droga en el NEB, resultando en una mayor cantidad de droga disponible para el paciente, así como una buena proporción de partículas en rango respirable, aunque el tiempo de nebulización permanecerá relativamente prolongado (15 a 20 minutos). Sin embargo, el factor más importante en cuanto a variabilidad del volumen residual, masa de fármaco administrado y porcentaje de partículas en rango respirable es la marca comercial del NEB, existiendo grandes diferencias entre ellos(15-17). Por supuesto que la utilización de máscaras o piezas bucales incrementa las pérdidas de fármaco a nivel de la cara y la bucofaringe. Debe considerarse que el pasaje del aerosol por la nariz filtra parte de las gotas emitidas por el NEB provocando una reducción de hasta 50% del aerosol que llega al pulmón(18). Así, cuando se adiciona una máscara al NEB (particularmente en niños), es importante instruir al paciente para que inhale por la boca.
Los IDM (canisters presurizados con cloroflurocarbono u otros propelentes que contienen cristales micronizados de medicación) son dispositivos compactos y portátiles. Su eficacia depende críticamente de la coordinación disparo-inspiración, presentando un alto depósito orofaríngeo (80% de la dosis). Sin embargo, son más eficientes y permiten administrar grandes cantidades de fármaco en tiempos breves. El problema de la coordinación ha sido solucionado mediante la introducción de espaciadores y cámaras de inhalación univalvuladas que se interponen entre el IDM y el paciente. Dado que el tamaño de la partícula y la velocidad disminuyen con la distancia, la interposición de una cámara de inhalación entre la boca del paciente y el IDM conduce a partículas respirables más pequeñas y con menor velocidad. La utilización de estos dispositivos produce los siguientes beneficios: 1) la deposición orofaríngea se reduce drásticamente (10-15 veces), disminuyendo a su vez los efectos secundarios; 2) aumenta la cantidad de fármaco administrado que alcanza los pulmones, aunque en menor proporción que la reducción del deposito orofaríngeo dado que muchas partículas se depositan en las paredes de la cámara de inhalación; 3) se reduce la cantidad de fármaco administrado y el tiempo de tratamiento, con disminución de los costos(19,20); 4) permite la evaporación del propelente evitando una finalización prematura de la inspiración por el estímulo del "frío del freón", y 5) reduce el sabor desagradable de algunas medicaciones.
Es importante diferenciar espaciadores de cámaras univalvuladas de inhalación. Un espaciador es simplemente un tubo o bolsa abierta en sus extremos que contiene un volumen suficientemente grande para permitir la expansión del disparo del IDM y la evaporación del propelente. Para llevar a cabo esta función, debe tener un volumen interno de por lo menos 100 ml y establecer una distancia de 10 a 13 cm entre el IDM y la boca. Espaciadores más pequeños pueden reducir la dosis administrada en 60% y no ofrecer protección contra una inadecuada coordinación disparo-inspiración. Las cámaras univalvuladas de inhalación (140 ml a 750 ml de volumen) de forma cónica o de pera, permiten también la expansión del disparo del IDM e incorporan una válvula unidireccional por la que el aerosol solo puede ser administrado durante la inspiración del paciente, quien exhala a la atmósfera y no al interior de la cámara.
El uso de disparos múltiples dentro de la cámara en comparación con disparos únicos previamente a la inspiración, fue recomendado ampliamente en el pasado; sin embargo, estudios más recientes(21,22) han demostrado que esta técnica conduce a una reducción en la proporción de partículas respirables dentro de la cámara. Finalmente, en las cámaras plásticas, debido a su superficie no conductora, se acumula carga electrostática, lo que produce un fuerte depósito del fármaco dentro de la misma. Dicha carga puede ser eliminada mediante cámaras de inhalación de metal, o en el caso de las plásticas, mediante el lavado con jabón desionizante, o por medio de la administración de dosis repetidas del fármaco dentro de la cámara previamente a su uso.
En cuanto a los SPS, son activados por la respiración, por lo que se elimina la necesidad de coordinación. Constituyen ventajas la facilidad de administración y el hecho de que no contengan propelentes cloroflurocarbonados. Sin embargo, habitualmente requieren flujos inspiratorios moderados-altos (30 l/minuto a 120 l/minuto). Son también desventajas una alta deposición orofaríngea, el hecho de que la humedad puede producir agregación de las partículas, su costo elevado, una limitada cantidad de fármacos disponibles y, finalmente, la dificultad para administrar dosis elevadas del fármaco.Dichos factores hacen que este tipo de dispositivo no sea el más adecuado para el tratamiento del paciente asmático agudo.
Fármacos inhalados para el tratamiento de la crisis asmática
Como ya hemos visto, la inhaloterapia constituye el método de elección para la administración de fármacos en el tratamiento de la CA. En comparación con la vía sistémica, se encuentra asociada a un más rápido comienzo de acción y a menores efectos secundarios como consecuencia de las bajas dosis requeridas para obtener el efecto terapéutico a nivel de la vía aérea, y al hecho de que algunos broncodilatadores se absorben pobremente a la circulación. Excepto la teofilina, los fármacos más frecuentemente utilizadas en el tratamiento de las exacerbaciones de asma se encuentran disponibles para su administración por vía inhalatoria (tabla 2), tanto en forma de aerosoles (beta agonistas, anticolinérgicos, corticosteroides, y sulfato de magnesio) como de gases (oxígeno y heliox).
Agonistas beta adrenérgicos
Los beta2 agonistas inhalados de corta duración de acción constituyen los fármacos de elección en el tratamiento del asma aguda(23-25). Por el contrario, los beta agonistas de larga duración no están indicados debido a un comienzo de acción más lento. La evidencia disponible no apoya la utilización de la vía intravenosa en el tratamiento de pacientes con CA(26).
¿Cuál es la dosis adecuada?
El consenso sobre la administración clínica de aerosoles(1) enfatiza tres principios con relación a la dosis, especialmente de beta agonistas. En primer lugar establece que la dosis así como los intervalos de administración deberían ser individualizados de acuerdo con la severidad de la obstrucción de la vía aérea, de la respuesta al tratamiento, y del sistema de administración utilizado. En segundo lugar la obstrucción de la vía aérea debe ser evaluada objetivamente (pico de flujo espiratorio [PEF] o volumen espiratorio forzado en el primer segundo [VEF1]) con la finalidad de determinar la severidad a la presentación así como la respuesta al tratamiento. La respuesta temprana al tratamiento (30 minutos) en el servicio de urgencia es mejor predictor de la necesidad de hospitalización que la severidad inicial de la crisis(27,28). En tercer lugar, existe un sustancial cuerpo de evidencia que apoya la utilización de dosis altas, frecuentes y acumulativas(25).
Se han llevado a cabo algunos intentos con el objetivo de analizar cuál es la dosis óptima. Así, nosotros(29) analizamos 116 asmáticos agudos severos (función pulmonar <50%) tratados con salbutamol administrado mediante IDM y cámara inhalatoria, en una dosis de 400 ?g (cuatro disparos) cada 10 minutos durante tres horas. Casi 70% de los pacientes presentó una rápida respuesta (67% obtuvo el umbral de alta luego de la administración de 2,4 ?g de salbutamol en una hora). De hecho, 53% de estos pacientes con buena respuesta recibió sólo 12 disparos (1,2 mg). En el restante 30%, el tratamiento tuvo poco efecto. Un aumento de 50% de la dosis (600 ?g cada 10 minutos) produce un ligero pero no significativo incremento en la respuesta terapéutica, aunque con un aumento de los efectos secundarios vinculado a la mayor concentración plasmática de salbutamol(30). De la misma forma, McFadden y colaboradores(31) hallaron que 75% de los pacientes que eran dados de alta de un servicio de urgencia presentaban un PEF promedio de alrededor de 60% del normal luego de haber recibido tres nebulizaciones de salbutamol (2,5 mg cada una) en una hora. En otro estudio(32), dos tercios de los pacientes con CA tratados con tres dosis de 2,5 mg, NEB cada 20 minutos, presentaron una buena respuesta. De ellos, 56% requirió 5 mg o menos del fármaco para obtener el umbral de alta.
En conjunto estos datos demuestran que existen dos diferentes patrones de respuesta a la administración de dosis altas y frecuentes de salbutamol por vía inhalatoria. Cerca de dos tercios de los pacientes presentarán una buena respuesta, requiriendo 2,4 mg a 3,6 mg del fármaco administrado mediante IDM y cámara de inhalación, o 5 mg a 7,5 mg administrados mediante nebulización. En los pacientes restantes el tratamiento presentará poco efecto. Estos hechos apoyan las dosis recomendadas por el panel de expertos del Instituto de Salud de Estados Unidos(25) para el tratamiento de la CA: tres dosis de salbutamol 2,5 mg - 5 mg administrado por NEB o 4-8 disparos (100 ?g/disparo) cada 20 minutos mediante IDM y cámara de inhalación. Sin embargo, como será expuesto más adelante, existe información reciente que sugiere que en el subgrupo de pacientes refractario a los beta agonistas el tratamiento combinado con anticolinérgicos inhalados y aun con corticosteroides, también por vía inhalatoria, puede incrementar la función pulmonar y reducir sustancialmente la frecuencia de hospitalizaciones.
Nebulización continua versus intermitente
En Norteamérica, alrededor de 5% de los pacientes que consultan en un servicio de urgencia por asma aguda reciben beta agonistas por nebulización continua(12). Así, esta modalidad de tratamiento es poco frecuentemente utilizada. Algunos expertos sugieren que la nebulización continua es superior a la intermitente debido a que la administración constante permitiría una mayor penetración del fármaco y una mayor broncodilatación. Si bien la nebulización continua ha sido considerada superior a la intermitente en el tratamiento de niños(33,34), en adultos los datos son contradictorios(35-40). Recientemente, nosotros completamos una revisión sistemática sobre este tópico(41): sobre la base de seis estudios relevantes, utilizando la función pulmonar como variable, no hubo diferencia entre ambos métodos en un período de una a tres horas de tratamiento. Cuando las hospitalizaciones fueron consideradas como variable, tampoco pareció existir beneficio de la nebulización continua sobre la intermitente. En suma, de acuerdo con la información disponible, ambos métodos parecen equivalentes.
NEB versus IDM con cámaras de inhalación
Actualmente persiste la noción equivocada de que los NEB deben utilizarse en aquellos pacientes con obstrucción más grave, mientras que los IDM deberían reservarse para las crisis leves-moderadas o para tratamiento de mantenimiento(42). Con relación a la administración de aerosoles broncodilatadores en pacientes con asma aguda severa tratados en un servicio de urgencia, existen dos revisiones sistemáticas con metaanálisis que confirman que, por el contrario, los IDM con cámaras de inhalación son por lo menos equivalentes en términos terapéuticos a los NEB. Estos datos coinciden con los de estudios con isótopos que muestran porcentajes equivalentes de depósito pulmonar total con ambos métodos(43). Así, Turner y colaboradores(44) concluyeron que ambos métodos son equivalentes en el tratamiento del asma aguda del adulto aunque estos autores no llevaron a cabo un análisis de los efectos secundarios o de los costos. Por otro lado, Cates y Rowe(45), sobre la base del análisis de 16 trabajos randomizados en adultos y niños con crisis asmática, concluyeron que los IDM con cámaras de inhalación producen resultados en términos de hospitalizaciones, duración del tratamiento y función pulmonar, por lo menos equivalentes a los NEB. También encontraron que los IDM pueden tener algunas ventajas sobre los NEB en niños (por ejemplo, menor frecuencia cardíaca). En forma coincidente, en dos trabajos sucesivos(46,47), nosotros hallamos que en asmáticos agudos adultos tratados con salbutamol, la administración del fármaco mediante NEB produjo un aumento de los efectos secundarios tales como la frecuencia cardíaca, temblor y ansiedad, relacionado con un nivel significativamente mayor de la concentración plasmática del fármaco. En suma, existe una considerable evidencia a favor de la utilización de los IDM con cámaras de inhalación en la administración de beta2 agonistas tanto en niños como en adultos particularmente con asma aguda grave, especialmente por su mayor flexibilidad y menores costos y efectos secundarios(48).
Efectos secundarios
Es frecuente que durante el tratamiento con beta agonistas ocurran efectos secundarios. Estos efectos son normalmente dosis-dependientes y pueden producirse con todas las rutas de administración, aunque son más pronunciados cuando se administran por vía oral o intravenosa. Los principales efectos secundarios producidos por la utilización de beta2 agonistas selectivos, son mediados por los receptores ubicados en los vasos (aumento de la presión sistólica, disminución de la diastólica, y taquicardia refleja(49,50), músculo esquelético (temblor, hipopotasemia por entrada del potasio en las células musculares(51-53), y células involucradas en el metabolismo de los lípidos y carbohidratos (aumento de los ácidos grasos libres, de la insulina, glucosa y piruvato). Otro efecto indeseado es un aumento de la relación ventilación/perfusión, lo que conduce a un incremento de la diferencia alvéolo-arterial de oxígeno(54-56). De todas formas la caída en la PO2 es pequeña y de corta duración y, generalmente, de poca importancia clínica. En términos generales, la evidencia nos muestra que el tratamiento de pacientes adultos con CA utilizando las dosis de beta agonistas anteriormente establecidas es seguro, y se acompaña de mínimos efectos secundarios; habitualmente no se observan arritmias significativas ni otros efectos cardiovasculares importantes(29-32,57-60).
Fármacos anticolinérgicos
Los agentes anticolinérgicos no selectivos como la atropina, el bromuro de ipratropio (BI) y el bromuro de oxitropio bloquean los receptores muscarínicos M2 y M3, produciendo relajación del músculo liso de la vía aérea. El sulfato de atropina ha sido extensamente utilizado en forma de nebulización por emergencistas e intensivistas. Sin embargo, este fármaco se absorbe rápidamente en la mucosa respiratoria produciendo importantes efectos secundarios que limitan su utilización. Más recientemente, el desarrollo de agentes sintéticos que conservan las propiedades anticolinérgicas pero con mínima absorción, ha renovado el interés por estas sustancias. En el momento actual, el BI constituye el agente más frecuentemente utilizado. Su vida media es similar a la de la atropina, unas tres horas, y el comienzo de acción es algo más lento que el de los beta agonistas; el pico de broncodilatación ocurre entre 30 y 90 minutos después de su administración. Menos de 1% de la dosis administrada se absorbe en la mucosa respiratoria, por lo que la toxicidad es mínima. Más importante aun es que no afecta la secreción del mucus ni el movimiento ciliar, ni la viscosidad de las secreciones(61). El papel de los fármacos anticolinérgicos en el tratamiento de pacientes con asma aguda ha sido controversial(62). El uso del BI como broncodilatador inicial en la CA se ha mostrado inferior al de los beta agonistas. Por otro lado, el uso de ambas clases de broncodilatadores, ya sea en secuencia o simultáneamente, ha producido resultados contradictorios. Sin embargo, en los últimos años una serie de revisiones sistemáticas y ensayos randomizados y controlados ha comenzado a clarificar este punto.
En primer lugar, una revisión de diez ensayos randomizados de niños y adolescentes asmáticos en crisis(63) tratados con beta agonistas más anticolinérgicos o placebo, mostró un incremento significativo en la función pulmonar en el grupo con tratamiento combinado; los protocolos que incluyeron dosis múltiples, especialmente en pacientes con exacerbaciones severas, disminuyeron el riesgo de hospitalización en 30%. En un segundo metaanálisis de pacientes adultos, se evaluaron diez trabajos randomizados, doble ciego(64); el uso de BI se asoció con un incremento significativo de la función pulmonar y una reducción de 27% de las hospitalizaciones. Finalmente, un tercer metaanálisis de diez ensayos randomizados y doble ciego(65), con un análisis de 1.483 pacientes adultos con CA, mostró otra vez un incremento significativo pero modesto de la función pulmonar (nuevamente el mayor incremento se produjo en los pacientes más severos), así como una reducción de 38% de las hospitalizaciones. En forma sorprendente, estos beneficios fueron obtenidos con la utilización de dosis únicas de BI, lo que representa un esquema terapéutico totalmente inadecuado en la CA. Solamente unos pocos estudios han utilizado protocolos combinados de dosis altas, múltiples y acumuladas. Así, recientemente, nosotros(66) estudiamos los efectos de dosis altas y acumuladas de beta agonistas y BI en pacientes adultos con asma aguda severa. Los hallazgos mostraron un sustancial incremento en la función pulmonar así como una reducción de 49% en las hospitalizaciones. Este fue el primer trabajo en adultos en que ambos fármacos fueron administrados mediante IDM y cámara de inhalación. También aquí los beneficios resultaron mayores cuando el tratamiento se aplicó a los pacientes con mayor nivel de obstrucción.
Globalmente el análisis de la evidencia sugiere que los anticolinérgicos administrados por vía inhalatoria junto con fármacos beta agonistas aportan un sustancial beneficio adicional tanto en niños como en adultos con asma aguda(62). Dicho análisis revela que la utilización de protocolos terapéuticos que incluyan dosis altas, frecuentes y acumulativas de BI y beta agonistas inhalados en pacientes con asma aguda severa son de particular utilidad, constituyendo un tratamiento de primera línea en aquellos pacientes con una reducción de más de 50% de la función pulmonar. Así, 250 ?g cada 20 minutos nebulizados en niños, o 500 ?g cada 20 minutos en adultos, o bien 4-6 disparos (80-120 ?g) cada 10-20 minutos vía IDM con cámara inhalatoria constituyen dosis adecuadas. También cuatro disparos de bromuro de oxitropio (400 ?g) cada 20 minutos mediante IDM y cámara son igualmente efectivos. Estos beneficios se presentan sin efectos adversos de consideración.
Corticoides inhalados
Los glucocorticoides administrados por vía sistémica han constituido uno de los pilares del tratamiento de las exacerbaciones asmáticas. Estas sustancias no son broncodilatadoras, y su mayor utilidad se encuentra relacionada a la capacidad de reducir la inflamación de la vía aérea. La evidencia disponible demuestra que los corticosteroides administrados por vía parenteral reducen significativamente la frecuencia de hospitalización así como que incrementan la función pulmonar aunque en forma lenta (entre 6 a 24 horas)(67-69). El tiempo que requieren para actuar se encuentra en concordancia con el concepto de que los corticoides actúan incrementando la síntesis de proteínas mediante inducción genética.
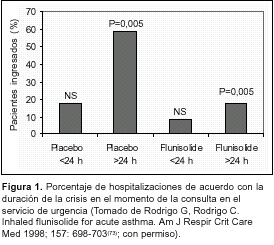
Por otro lado, los corticosteroides administrados por vía inhalatoria no han sido considerados como eficaces en el tratamiento de la CA. De hecho no existe ningún trabajo antes de 1992 sobre este tópico. Sin embargo, durante la última década se ha publicado una serie de ensayos clínicos randomizados y controlados en niños y adolescentes con CA que sugieren que los corticoides administrados por vía inhalada pueden producir efectos terapéuticos tempranos (2-3 horas)(70-72). En adultos, nosotros(73) diseñamos un estudio randomizado, doble ciego, y placebo controlado con el objeto de determinar el beneficio de dosis altas y repetitivas de flunisolida junto con salbutamol en pacientes con CA. Ambas medicaciones fueron administradas mediante IDM y cámara de inhalación cada 10 minutos durante tres horas (400 ?g de salbutamol y 1 mg de flunisolida cada 10 minutos). Los pacientes tratados con flunisolida presentaron un incremento significativo en la función pulmonar a partir de los 90 minutos de tratamiento y una disminución de las hospitalizaciones. Aquellos pacientes con crisis asmática de larga evolución fueron los más beneficiados (figura 1).
Schuh y colaboradores(74) en un estudio randomizado y controlado en niños con CA comparó 2 mg fluticasona inhalada administrado al inicio con IDM-inhalocámara contra prednisona 2 mg/kg por boca evaluando los pacientes durante más de cuatro horas en la emergencia. Los autores comprobaron que en ese lapso, aquellos pacientes tratados con prednisona tuvieron una mejoría de su función pulmonar que duplicó a los medicados con fluticasona mientras que el nivel de hospitalizaciones del grupo fluticasona fue tres veces mayor que el de los que recibieron prednisona.
Recientemente, Edmonds y colaboradores(75) publicaron un metaanálisis evaluando la utilidad de los corticoides inhalados en asma aguda en la emergencia donde se seleccionaron 11 estudios en adultos y niños (se incluyeron los dos referidos anteriormente) comparando en cinco estudios corticoides inhalados versus placebo, en dos trabajos corticoides inhalados y corticoides sistémicos conjuntamente versus corticoides sistémicos y placebo y, por último, en cuatro estudios corticoides inhalados contra corticoides sistémicos. Como objetivos finales se evaluaron los efectos sobre la función pulmonar y las hospitalizaciones. En cinco estudios se comprobó una reducción significativa de las hospitalizaciones en el grupo corticoides inhalados comparado con los que no los recibieron (placebo) (OR 0,30; 95% IC 0,16 a 0,57) sin evidencia de heterogenicidad (P=62) en los resultados. El promedio global del nivel de ingresos fue 10% en el grupo corticoides inhalados contra 27% en el otro, por lo que sería necesario tratar seis pacientes para prevenir una admisión (95% IC 4 a 11).
En otros dos estudios con corticoides inhalados más corticoides sistémicos versus placebo y corticoides sistémicos se mostró un efecto beneficioso en las admisiones, similar al grupo anterior
Por último, el análisis de un grupo de pacientes tratados con corticoides inhalados versus otro con corticoides sistémicos no demostró un efecto significativo en las hospitalizaciones (OR 0,89; IC 0,18 a 4,52) mostrando una marcada heterogeneidad entre los estudios (P<0,01).
En cuanto a los efectos sobre la función pulmonar hubo una gran variedad de tests funcionales aplicados con criterios temporales diferentes, lo que generó heterogeneidad en los datos. El conjunto de resultados mostró en los estudios con espirometría un beneficio en el VEF1% para los corticoides inhalados a las dos horas de tratamiento (95% IC 0,4% a 9,7%) sin heterogeneidad estadística (P=51). No todos los estudios presentaron datos espirométricos y en varios de los trabajos pediátricos se manejaron con el puntaje de un índice pulmonar. Las conclusiones de este metaanálisis serían que hay evidencia de que los corticoides inhalados disminuyen el nivel de hospitalizaciones de los asmáticos en crisis en la emergencia. Sin embargo, hay insuficiente evidencia de que esta terapéutica genere importantes cambios en la función pulmonar al tratar CA, así como también la evidencia es insuficiente para establecer que los corticoides inhalados sean tan efectivos como los sistémicos. Debe destacarse que la forma de administración de los aerosoles, el ritmo, lapso y dosis, mostraron variaciones importantes en este metaanálisis, siendo baja la dosificación de corticoides inhalados utilizada en la mayoría de los estudios, a excepción de nuestro trabajo en el que utilizamos altas dosis, reiteradas y acumulativas, dando los resultados ya comentados sobre la función pulmonar evidentes a las dos horas.
En conjunto, estos trabajos sugieren que los corticosteroides inhalados y en altas dosis, en función de su rápida acción, pueden ser de utilidad en el tratamiento de pacientes asmáticos en crisis, especialmente en aquellos con evoluciones prolongadas al momento de su atención en un servicio de urgencias. Esta rápida respuesta sugiere un mecanismo antiinflamatorio no inmunológico de tipo tópico(76) relacionado con efectos menos conocidos tales como inhibición del edema y vasoconstricción a nivel de la microcirculación(77). Por otro lado, existe cierta evidencia que sugiere que este efecto rápido de los corticosteroides inhalados puede estar también relacionado con un efecto permisivo que pueden ejercer sobre los receptores beta2(78).
Sulfato de magnesio
El sulfato de magnesio administrado por vía parenteral fue utilizado por primera vez en el tratamiento del asma aguda por los compatriotas Roselló y Pla hace más de 60 años(79). Desde entonces han aparecido nuevos trabajos que han reavivado el interés por esta sustancia. Sin embargo, estos estudios han comprendido solo un pequeño número de pacientes y además han presentado una baja calidad metodológica. Más recientemente se publicaron algunos ensayos randomizados y controlados cuyos resultados han sido contradictorios(80-83). Dos revisiones sistemáticas sugieren un cierto beneficio en el subgrupo de pacientes con obstrucción más severa(84,85). De todas formas, dado el reducido número de trabajos sobre los cuales se encuentran basadas estas revisiones, debemos concluir que la evidencia actualmente disponible no apoya el uso rutinario de este fármaco por vía parenteral en el tratamiento de pacientes con CA. En cuanto al uso del magnesio en forma nebulizada, dos publicaciones recientes no lograron demostrar un beneficio significativo de él respecto a los beta agonistas(86,87).
Oxígeno
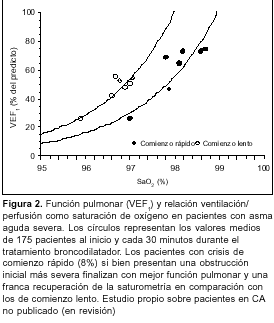
La asfixia o hipoxemia severa debida fundamentalmente al subtratamiento del paciente constituye la causa principal de muerte del asmático(88). La obstrucción de la vía aérea produce alteraciones de la relación ventilación/perfusión. Como en promedio, este shunt es de sólo 1,5% del flujo sanguíneo pulmonar(89), se requieren concentraciones bajas de oxígeno para corregirlo (3 L/minuto mediante cánula nasal o máscara, FiO2 = 0,3 a 0,4). El objetivo de la oxigenoterapia debe ser mantener la saturación por encima de 92%. Debe evitarse la administración de oxígeno a flujo libre ya que, contra lo pensado, existe evidencia de que puede deteriorar la condición del paciente y conducirlo a la insuficiencia respiratoria(90). Debemos recordar que mientras que las variables espirométricas mejoran rápidamente como consecuencia del tratamiento broncodilatador, las alteraciones ventilación/perfusión pueden tomar más tiempo en recuperarse. Esto es debido a que mientras la espirometría se encuentra vinculada con la obstrucción de la vía aérea gruesa, los disturbios ventilación/perfusión están más relacionados con la inflamación de la vía aérea de pequeño calibre(90). Esto es particularmente así en aquellos pacientes que presentan CA de lento comienzo (> 6 horas de evolución). Estos pacientes presentan al inicio menos obstrucción que aquellos con crisis de comienzo rápido o asma hiperaguda (< 6 horas). Sin embargo, a igualdad de mejoría espirométrica, aquellos con crisis de comienzo lento muestran un mayor deterioro de la relación ventilación/perfusión manifestado por una menor saturación de oxígeno (figura 2).
Heliox
Las mezclas de helio y oxígeno (heliox) debido a su baja densidad respecto al aire, pueden potencialmente disminuir la resistencia de la vía aérea, y así beneficiar a aquellos pacientes que presentan asma aguda. Dada la baja densidad con respecto al aire (una mezcla de 80% de helio y 20% de oxígeno tiene una densidad de aproximadamente un tercio de la del aire), las mezclas de helio/oxígeno pueden disminuir el trabajo respiratorio en aquellas situaciones asociadas a un aumento de la resistencia de la vía aérea, beneficiando a pacientes con lesiones obstructivas de laringe, tráquea y vía aérea inferior. Una ventaja adicional puede consistir en un incremento en el depósito de las partículas inhaladas a nivel pulmonar(91). Sin embargo, el beneficio de la utilización de heliox en el tratamiento de la CA no ha sido probado. Así, ha sido publicada una serie de ensayos clínicos pequeños y no controlados, tanto en adultos como en niños, que reportan resultados conflictivos(92-95). Recientemente, con el objeto de determinar el posible beneficio de la adición de heliox en el tratamiento del asma aguda, nuestro grupo(96) llevó a cabo una revisión sistemática que incluyó cuatro estudios randomizados con 288 pacientes. Los autores concluyeron en que la administración de mezclas de helio/oxígeno en asmáticos en crisis con asma moderada o severa no modifica la evolución de los pacientes.
En conclusión, la evidencia disponible no permite indicar el uso del heliox como tratamiento de primera línea de la CA. Quizás podría ser de utilidad en aquellos pacientes que se deterioran a pesar de un adecuado tratamiento. Sin embargo, existe muy poca información sobre el heliox en el asma aguda. Por un lado, muy pocos estudios controlados, incertidumbre en cuanto al tiempo en que debería administrarse y, finalmente, el alto costo del tratamiento.
Conclusiones
En comparación con la vía sistémica, la inhalada se encuentra asociada con un comienzo de acción más rápido y menos efectos secundarios. Por estas razones, la inhalación de diversos agentes farmacológicos junto con el oxígeno configura la base del tratamiento de la CA. El éxito de la terapia con aerosoles depende de que una cantidad adecuada del fármaco alcance los receptores a nivel pulmonar con mínimos efectos secundarios. La efectividad del tratamiento estará determinada por diversos factores tales como las características físicas de las formulaciones terapéuticas, el sistema de generación del aerosol, la condición y la edad del paciente, la técnica inhalatoria utilizada, y el uso de cámaras de inhalación. Existe una serie de fármacos como los beta agonistas selectivos, los anticolinérgicos, y los corticosteroides, disponibles en forma de aerosoles, los que usados aisladamente o en combinación permiten un rápido control de la mayor parte de los pacientes con asma aguda severa. También el uso del sulfato de magnesio así como de mezclas de helio-oxígeno puede ser considerado en casos específicos. En nuestro servicio de urgencia utilizamos el siguiente esquema: 1) los pacientes con CA severas (PEF o VEF1 < 50% del ideal) reciben salbutamol y BI preferentemente mediante IDM y cámara de inhalación (cuatro disparos o 400 ?g de salbutamol y 80 ?g de BI cada 10-15 minutos) o, de lo contrario, mediante NEB (salbutamol 2,5 mg en adultos o 0,15 mg/kg en niños y BI 0,5 mg en adultos y 0,25 mg en niños, cada 20 minutos). Estos pacientes pueden también recibir, en caso de respuesta mala o incompleta, dosis altas de corticosteroides inhalados (cuatro disparos cada 10-15 minutos mediante IDM y cámara de inhalación o NEB cada 20 minutos; dosis de acuerdo con la droga utilizada: budesonida, fluticasona o flunisolida). En forma extrema, puede considerarse la utilización de sulfato de magnesio nebulizado y heliox; 2) los pacientes con CA leve-moderadas (función pulmonar > 50% del ideal) reciben salbutamol NEB (2,5 mg en adultos o 0,15 mg/kg en niños) cada 20 minutos; 3) todos los pacientes reciben oxígeno mediante máscara (3 l/minutos); 4) el protocolo terapéutico se ajusta según evaluación de la función pulmonar cada 30 minutos, y 5) se considera la administración de corticosteroides por vía parenteral en aquellos pacientes que a pesar del tratamiento presentan mala respuesta.
CA: crisis asmática; NEB: nebulizadores de jet; IDM: inhalador de dosis media; SPS: sistemas de polvo seco; MMAD: diámetro de la masa media aerodinámica; PEF: pico de flujo espiratorio; VEF1: volumen espiratorio forzado en el primer segundo; BI: bromuro de ipratropio.
Summary
A review of treatments by inhalation of acute asthma was undertaken. Although therapy by inhalation is widespread among practitioners, it is thought that inappropriate administration is frequently found, causing failed treatments and unnecessary expenses. This point becomes highly relevant since mortality from asthma has increased during the last decades and both patients and practitioners as well as paramedics lack of basic knowledge and skills to manage acute asthma.
The objectives of a therapy by inhalation and its main aspects (physical, aerosol generator, pharmacology) were determined. The analysis and comparison included different systems for generating aerosols and diverse drugs to be inhaled, especially beta agonists, anticholinergics and inhaled corticosteroids. Other non-traditional treatments by inhalation such as magnesium sulfate and a gaseous mixture of helium are also shown. The discussion over various topics included systematic reviews or meta-analysis in order to determine preferences or to choose the treatment. The authors propose some therapeutic strategies on the basis of their experience supported by bibliography.
Résumé
On fait une révision du traitement inhalateur de la crise d'asthme. L'inhalothérapie est largement diffusée dans la pratique médicale habituelle, ce qui comporte d'importants
coûts économiques. Pourtant, on estime dans le monde qu'il y en a une gestion inappropriée élevée, ce qui aboutit à des échecs thérapeutiques et à des dépenses innécessaires. Cela est surtout signalé lorsqu'on connaît l'augmentation de la mortalité par asthme pendant les dernières décennies et on remarque que patients et médecins n'ont pas les connaisances de base ni les instruments pour une gestion adéquate. On établit les buts de l'inhalothérapie et on considère ses aspects fondamentaux (physiques,générateurs d'inhalateurs, pharmacologie). On étudie et on compare les différents systèmes de génération d'inhalateurs et on analyse aussi les médicaments inhalés. On expose au détail les bêta-antagonistes, anticolinergiques et coticoïdes sous leur forme inhalée. On présente aussi d'autres traitements inhalateurs pas traditionnels tels que le sulfate de magnésium et un mélange gazeuse heliox. On a recours si possible aux révisions systématiques et à la méta-analyse afin d'établir des préférances ou de choisir des traitements. Les auteurs proposent quelques stratégies thérapeutiques basées sur leur expérience, documentées à la bibliographie apportée.
Bibliografía
1. American Respiratory Care Foundation. Consensus conference on aerosols and delivery devices. Respir Care 2000; 45: 589-96.
2. Fink JB, Dhand R. Aerosol therapy: Preface. Respir Care Clin North Am 2001; xi-xii.
3. Rodrigo C, Rodrigo GJ. Inhalotherapy in nonintubated acute asthma patients. In: Hall JB, Corbridge T, Rodrigo C, Rodrigo GJ, ed. Acute asthma. Assessment and Management. New York: McGraw-Hill, 2000: 161-78.
4. Rodrigo GJ, Rodrigo C. Aerosol and inhaled therapy in treatment of acute adult airway obstruction in the emergency department. Respir Care Clin North Am 2000; 7(2): 215-31.
5. Dolovich MB, Fink JB. Aerosols and devices. Respir Care Clin North Am 2001; 7(2): 131-73.
6. Morrow PE. An evaluation of the physical properties of monodisperse and heterodisperse aerosols used in the assessment of bronchial function. Chest 1981; 80(Suppl): 809-13.
7. Zanen P, Go LT, Lammers JW. Optimal particle size for beta 2 agonist and anticholinergic aerosols in patients with severe airflow obstruction. Thorax 1996; 51(10): 977-80.
8. Laube BL. In vivo measurements of aerosol dose and distribution: clinical relevance. J Aerosol Med 1996; 9(Suppl 1): S77-S91.
9. Lipworth BJ. Targets for inhaled treatment. Respir Med 2000; 94(Suppl D): S13-S16.
10. Dolovich MA. Influence of inspiratory flow rate, particle size, and airway caliber on aerosolized drug delivery to the lung. Respir Care 2000; 45(6): 597-608.
11. Fuller HD, Dolovich M, Chambers C, Newhouse MT. Aerosol delivery during mechanical ventilation: A predictive in-vitro lung model. J Aerosol Med 1992; 5: 251-9.
12. Gibbs MA, Camargo CA (Jr), Rowe BH, Silverman RA. State of the art: Therapeutic controversies in severe acute asthma. Acad Emerg Med 2000; 7(7): 800-15.
13. Newman SP, Clarke SW. Therapeutic aerosols 1. Physical and practical considerations. Thorax 1983; 38(12): 881-6.
14. Rubin BK, Fink JB. Aerosol therapy for children. Respir Care Clin North Am 2001; 7(2): 175-213.
15. Hess D, Fisher D, Williams P, Pooler S, Kacmarek RM. Medication nebulizer performance: effects of diluent volume, nebulizer flow, and nebulizer brand. Chest 1996; 110(2): 498-505.
16. Alvine GF, Rodgers P, Fitzsimmons KM, Ahrens RC. Disposable jet nebulizers. How reliable are they? Chest 1992; 101(2): 316-9.
17. Loffert DT, Ikle D, Nelson HS. A comparison of commercial jet nebulizers. Chest 1994; 106(6): 1788-93.
18. Everald ML, Hardy JG, Milner AD. Comparison of nebulized aerosol deposition in the lungs of healthy adults following oral and nasal inhalation. Thorax 1993; 48(10): 1045-6.
19. Jasper AC, Mohsenifar Z, Kahan S, Goldberg HS, Koerner SK. Cost-benefit comparison of aerosol bronchodilator delivery methods in hospitalized patients. Chest 1987; 91(4): 614-8.
20. Bowton DL, Goldsmith WM, Haponik EF. Substitution of metered-dose inhalers for hand-held nebulizers. Success and cost savings in a large acute-care hospital. Chest 1992; 101(2): 305-8.
21. O'Callaghan C. In vitro performance of plastic spacer devices (review). J Aerosol Med 1997; 10(Suppl 1): S31-S35.
22. Barry PW, O'Callaghan C. The effect of delay, multiple actuations and spacer static charge on the in vitro delivery of budesonide from the nebuhaler. Br J Clin Pharmacol 1995; 40(1): 76-8.
23. Beveridge RC, Grunfeld AF, Hodder RV, Verbeek PR. Guidelines for the emergency management of asthma in adults. Can Med Assoc J 1996; 155(1): 25-37.
24. British asthma guidelines coordinating committee. British guidelines on asthma management: 1995-review and position statement. Thorax 1997; 52: S1-S24.
25. National Asthma Education and Prevention Program Expert Panel Report-2. Guidelines for the diagnosis and management of asthma. Bethesda: NIH, Publication, 1977: 55-4051.
26. Travers A, Jones AP, Kelly K, Barker SJ, Camargo CA, Rowe BH. Intravenous beta2-agonists for acute asthma in the emergency department (Cochrane Review). In: The Cochrane Library, Issue 4, 2001. Oxford Update Software. Oxford: Cochrane Foundation, 2001. [Programa infromático].
27. Rodrigo G, Rodrigo C. Assessment of the patient with acute asthma in the emergency department. A factor analytic study. Chest 1993; 104(5): 1325-8.
28. Rodrigo GJ, Rodrigo C. A new index of early prediction of hospitalization in patients with acute asthma. Am J Emerg Med1997; 15: 8-13.
29. Rodrigo C, Rodrigo GJ. Therapeutic response patterns to high and cumulative doses of salbutamol in acute severe asthma. Chest 1998; 113: 593-8.
30. Rodrigo GJ, Rodrigo C. Metered dose inhaler salbutamol treatment of asthma in the ED: comparison of two doses with plasma levels. Am J Emerg Med 1996; 14: 144-50.
31. McFadden ER (Jr), Elsanadi N, Dixon L, Takacs M, Deal EC, Boyd KK, et al: Protocol therapy for acute asthma: therapeutic benefits and cost savings. Am J Med 1995; 99(6): 651-61.
32. Strauss L, Hejal R, Galan G, Dixon L, McFadden ER Jr. Observations of the effects of aerosolized albuterol in acute asthma. Am J Respir Crit Care Med 1997; 155(2): 545-8.
33. Papo MC, Frank J, Thompson AE. A prospective, randomized study of continuous versus intermittent nebulized albuterol for severe status asthmaticus in children. Crit Care Med 1993; 21(10): 1479-86.
34. Khine H, Fuchs SM, Saville Al. Continuous vs intermittent nebulized albuterol for emergency management of asthma. Acad Emerg Med 1996; 3(11): 1019-24.
35. Colacone A, Wolkove N, Stern E, Afilalo M, Rosenthal TM, Kreisman H. Continuous nebulization of albuterol (Salbutamol) in acute asthma. Chest 1990; 97(3): 693-7.
36. Lin RY, Sauter D, Newman T, Sirleaf J, Walters J, Tavakol M. Continuous versus intermittent albuterol nebulization in the treatment of acute asthma. Ann Emerg Med 1993; 22(12): 1847-53.
37. Rudnitsky GS, Eberlein RS, Schoffstall JM, Mazur JE, Spivey WH. Comparison of intermittent and continuously nebulized albuterol for treatment of asthma in an urban emergency department. Ann Emerg Med 1993; 22(12): 1842-6.
38. Reisner C, Kotch A, Dworkin G. Continuous versus frequent intermittent nebulization of albuterol in acute asthma: a randomized, prospective study. Ann Allergy Asthma Immunol 1995; 75(1): 41-7.
39. Shrestha M, Bidadi K, Gourlay S, Hayes J. Continuous vs intermittent albuterol, at high and low doses, in the treatment of severe asthma in adults. Chest 1996; 110(1): 42-7.
40. Besbes-Ouanes L, Nouira S, Elatrous S, Knani J, Boussarsar M, Abroug F. Continuous versus intermittent nebulization of Salbutamol in acute severe asthma. A randomized, controlled trial. Ann Emerg Med 2000; 36(3): 198-203.
41. Rodrigo GJ, Rodrigo C. Continuous vs intermittent beta-agonists in the treatment of acute adult asthma: A systematic review with meta-analysis. Chest 2002; 122(1): 160-5.
42. Koning P. Spacer devices used with meter-dose inhalers: Breakthrough or gimmick? Chest 1985; 88: 276-84.
43. Wildhaber JH, Dore ND, Wilson JM, Devadason SG, LeSouef PN. Inhalation therapy in asthma: nebulizer or pressurized meter-dose inhaler with holding chamber? In vivo comparison of lung deposition in children. J Pediatr 1999; 135(1): 28-33.
44. Turner MO, Patel A, Ginsburg S, FitzGerald JM. Bronchodilator delivery in acute airflow obstruction. A meta-analysis. Arch Intern Med 1997; 157(15): 1736-44.
45. Cates CJ, Rowe BH. Holding chambers versus nebulisers for beta-agonist treatment of acute asthma (Cochrane Review). The Cochrane Library, Issue 4, 2001. Oxford. Update Software.Oxford: Cochrane Foundation, 2001. [Programa infromático].
46. Rodrigo GJ, Rodrigo C. Comparison of salbutamol delivered by nebulizer or metered-dose inhaler with a pear-shaped spacer in acute asthma. Curr Ther Res 1993; 54: 797-808.
47. Rodrigo C, Rodrigo GJ. Salbutamol treatment of acute severe asthma in the ED: MDI versus hand-held nebulizer. Am J Emerg Med 1998; 16(7): 637-42.
48. Newhouse MT. Asthma therapy with aerosols: are nebulizers obsolete? A continuing controversy. J Pediatr 1999; 135(1):5-8.
49. Kung M, Croley SW, Phillips BA. Systemic cardiovascular and metabolic effects associated with the inhalation of an increased dose of albuterol: influence of mouth rinsing and gargling. Chest 1987; 91(3): 382-7.
50. Jerrard DA, Olshaker J, Welebob E, Caraballo V, Hooper F. Efficacy and safety of a rapid-sequence metapro-terenol protocol in the treatment of acute adult asthma. Am J Emerg Med 1995; 13(4): 392-5.
51. Brown MI, Brown DC, Murphy MB. Hypokalemia from beta2-receptor stimulation by circulating epinephrine. N Engl J Med 1983; 309: 1414-9.
52. Scheinin M, Koulu M, Laurikainen E, Allonen H. Hypokalemia and other nonbronchial effects of inhaled fenoterol and Salbutamol: a placebo controlled dose-response study in healthy volunteers. Br J Clin Pharmacol 1987; 24(5): 645-53.
53. Crane J, Burguess C, Beasley R. Cardiovascular and hypokalaemic effects of inhaled Salbutamol fenoterol and isoprenaline. Thorax 1989; 44(2): 136-40.
54. Tal A, Pasterkamp H, Leahy F. Arterial oxygen desaturation following salbutamol inhalation in acute asthma. Chest 1984; 86(6): 868-9.
55. Roca J, Ramis LI, Rodriguez-Roisin R, Ballester E, Montserrat JM, Wagner PD. Serial relationships between ventilation-perfusion inequality and spirometry in acute severe asthma requiring hospitalization. Am Rev Respir Dis 1988; 137(5): 1055-61.
56. Rodriguez-Roisin R. Acute severe asthma: pathophysiology and pathobiology of gas exchange abnormalities. Eur Respir J 1997; 10(6): 1359-71.
57. Lin RY, Smith AJ, Hergenroeder P. High serum albuterol levels and tachycardia in adult asthmatics treated with high-dose continuously aerosolized albuterol. Chest 1993; 103(1): 221-5.
58. Rodrigo C, Rodrigo G. High-dose MDI salbutamol treatment of asthma in the ED. Am J Emerg Med 1995; 13(1): 21-6.
59. Rodrigo G, Rodrigo C. Effect of age on bronchodilator response in acute severe asthma treatment. Chest 1997; 112(1): 19-23.
60. Schuh S, Parkin P, Rajan A, Canny G, Healy R, Rieder M, et al. High versus low-dose, frequently administered nebulized albuterol in children with severe, acute asthma. Pediatrics 1989; 83(4): 513-8.
61. Wanner A. Effect of ipratropium bromide on airway mucociliary function. Am J Med 1986; 81(Suppl 5A): 23-7.
62. Rodrigo GJ, Rodrigo C. The role of anticholinergics in acute asthma treatment: An evidence-based evaluation. Chest 2002; 121(6):1977-87.
63. Plotnick LH, Ducharme FM. Combined inhaled anticholinergics agents and beta-2-agonists for initial treatment of acute asthma in children (Cochrane Review). In: The Cochrane Library, Issue 4, 2001. Oxford, United Kingdom: Update Software. Oxford: Cochrane Foundation, 2001. [Programa infromático].
64. Stoodley RG, Aaron SD, Dales RE. The role of ipratropium bromide in the emergency management of acute asthma exacerbation: a metaanalysis of randomized clinical trials. Ann Emerg Med 1999; 34(1): 8-18.
65. Rodrigo G, Rodrigo C. A meta-analysis of the effects of ipratropium bromide in adults with acute asthma. Am J Med 1999; 107: 363-70.
66. Rodrigo GJ, Rodrigo C. First-line therapy for adult patients with acute asthma receiving a multiple-dose protocol of ipratropium bromide plus albuterol in the emergency department. Am J Respir Crit Care Med 2000; 161(6): 1862-8.
67. Rowe BH, Keller JL, Oxman AD. Effectiveness of steroid therapy in acute exacerbations of asthma: a meta-analysis. Am J Emerg Med 1992; 10(4): 301-10.
68. Rodrigo G, Rodrigo C. Corticosteroids in the emergency department therapy of acute adult asthma: an evidence-based evaluation. Chest 1999; 116(2): 285-95.
69. Rowe BH, Spooner C, Ducharme FM, Bretzlaff JA, Bota GW. Early emergency department treatment of acute asthma with systemic corticosteroids (Cochrane Review). In: The Cochrane Library, Issue 4, 2001. Oxford, Update Software. Oxford: Cochrane Foundation, 2001. [Programa infromático].
70. Scarfone RJ, Loiselle JM, Wiley JF 2nd, Decker JM, Henretig FM, Joffe MD. Nebulized dexamethasone versus oral prednisone in the emergency treatment of asthmatic children. Ann Emerg Med 1995; 26(4): 480-6.
71. Singhi SC, Banerjee S, Nanjundaswamy HM. Inhaled budesonide in acute asthma. J Paediatr Child Health 1999; 35: 483-7.
72. Devidayal, Singhi S, Kumar L, Jayshree M. Efficacy of nebulized budesonide compared to oral prednisolone in acute bronchial asthma. Acta Paediatr 1999; 88(8): 835-40.
73. Rodrigo G, Rodrigo C. Inhaled flunisolide for acute severe asthma. Am J Respir Crit Care Med 1998; 157: 698-703.
74. Schuh S, Reisman J, Alshehri M, Dupuis A, Corey M, Arseneault R, et al. A comparison of inhaled fluticasone and oral prednisone for children with severe acute asthma. N Engl J Med 2000; 343(10): 689-94.
75. Edmonds ML, Camargo CA, Pollack CV, Rowe BH. The effectiveness of inhaled corticosteroids in the emergency department treatment of acute asthma. A meta-analysis. Ann Emerg Med 2002; 40(2): 145-54.
76. McFadden ER (Jr). Inhaled glucocorticoids and acute asthma: therapeutic breakthrough or non-specific effect? Editorial. Am J Respir Crit Care Med 1998; 157(3 Pt 1): 677-8.
77. Brown PH, Teelucksingh S, Matusiewicz SP, Greening AP, Crompton GK, Edwards CR. Cutaneous vasoconstrictor response to glucocorticoids in asthma. Lancet 1991; 337(8741): 576-80
78. Taylor DR, Hancox RJ. Interactions between corticosteroids and beta agonists. Thorax 2000; 55(7): 595-602
79. Roselló JC, Pla JC. Sulfato de magnesio en la crisis de asma. Prensa Med Argent 1936; 23: 1677.
80. Skobeloff EM, Spivey WH, McNamara RM, Greenspon L. Intravenous magnesium sulfate for the treatment of acute asthma in the emergency department. JAMA 1989; 262(9): 1210-3.
81. Green SM, Rothrock SG. Intravenous magnesium for acute asthma: failure to decrease emergency department treatment duration or need for hospitalization. Ann Emerg Med 1992; 21(3): 260-5.
82. Tiffany BR, Berk WA, Todd IK, White SR. Magnesium bolus or infusion fails to improve expiratory flow in acute asthma exacerbation. Chest 1993; 104(3): 831-4.
83. Bloch H, Silverman R, Mancherje N, Grant S, Jagminas L, Scharf SM. Intravenous magnesium sulfate as an adjunct in the treatment of acute asthma. Chest 1995; 107(6): 1576-81.
84. Rodrigo G, Rodrigo C, Burschtin O. Efficacy of magnesium sulfate in acute adult asthma: a meta-analysis or randomized trials. Am J Emerg Med 2000; 18(2): 216-21.
85. Rowe BH, Bretzlaff JA, Bourdon C, Bota GW, Camargo CA (Jr). Magnesium sulfate for treating exacerbations of acute asthma in the emergency department. (Cochrane Review). In: The Cochrane Library, Issue 4, 2001. Oxford Update Software. Oxford: Cochrane Foundation, 2001. [Programa infromático].
86. Mangat HS, D'Souza GA, Jacob MS. Nebulized magnesium sulphate versus nebulized salbutamol in acute bronchial asthma: a clinical trial. Eur Respir J 1998; 12(2): 341-4.
87. Nannini LJ Jr, Pendino JC, Corna RA, Mannarino S, Quispe R. Magnesium sulfate as a vehicle for nebulized salbutamol in acute asthma. Am J Med 2000; 108(3): 193-7.
88. Molfino NA. Near-fatal asthma. In: Hall JB, Corbridge T, Rodrigo C, Rodrigo GJ. Acute asthma. Assessment and Management. New York: McGraw-Hill, 2000: 29-47.
89. Chien JW, Ciufo R, Novak R, Skowronski M, Nelson J, Coreno A, et al. Uncontrolled oxygen administration and respiratory failure in acute asthma. Chest 2000; 117(3): 728-33.
90. Rodríguez-Roisin R. Gas exchange in acute asthma. In: Hall JB, Corbridge T, Rodrigo C, Rodrigo GJ. Acute asthma. Assessment and Management. New York: McGraw-Hill, 2000: 83-103.
91. Anderson M, Svartengren M, Bylin G, Philipson K, Camner P. Deposition in asthmatics of particles inhaled in air or in helium-oxygen. Am Rev Respir Dis 1993; 147(3): 524-8.
92. Carter ER, Webb CR, Moffit DR. Evaluation of heliox in children hospitalizad with acute severe asthma. A randomized crossover trial. Chest 1996; 109(5): 1256-61.
93. Henderson SO, Acharya P, Kilaghbian T, Pérez J, Korn CS, Chan LS. Use of heliox-driven nebulizer therapy in the treatment of acute asthma. Ann Emerg Med 1999; 332: 141-6.
94. Kudukis TM, Manthous CA, Schmidt GA, Hall JB Wylam ME. Inhaled helium-oxygen revisted: effect of inhaled helium-oxygen during the treatment of status asthmaticus in children. J Pediatr 1997; 130(2): 217-24.
95. Kass J, Terregino CA. The effect of heliox in acute severe asthma. A randomized controlled trial. Chest 1999; 116: 296-300.
96. Rodrigo GJ, Rodrigo C, Pollack C, Rowe B. Use of Heilium-Oxygen mixtures in the treatment of acute asthma. Asystematic Review. Chest 2003; 123: 891-6.