Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Médica del Uruguay
versión On-line ISSN 1688-0390
Rev. Méd. Urug. vol.18 no.2 Montevideo set. 2002
Una saga citogenética:
El descubrimiento de los métodos de bandeo cromosómico. Significado y proyección bio-médica
Dr. Máximo E. Drets1
Resumen
Se exponen, desde una perspectiva histórica y en forma sucinta, los sistemas de identificación de los cromosomas humanos y varios métodos de bandeo cromosómico desarrollados en las últimas cuatro décadas. Se relatan ámbitos y hechos acontecidos -varios de los cuales protagonizó el autor- que originaron la actual moderna citogenética estructural y molecular. Se mencionan, asimismo, algunos aspectos moleculares implícitos en estas metodologías con el propósito de contribuir al esclarecimiento de los variados aspectos revelados por dichos métodos sobre las estructuras cromosómicas subyacentes. Se describen también los procedimientos analíticos desarrollados en nuestro laboratorio para el estudio de núcleos y cromosomas como así los resultados obtenidos sobre el análisis cuantitativo de la región subtelomérica y su probable relación con las aberraciones crípticas, detectadas en dicho segmento cromosómico, productoras de retardo mental y malformaciones congénitas. Finalmente, se realiza un breve relato sobre las aplicaciones del bandeo cromosómico en el proyecto del genoma humano y su posible utilidad en los experimentos de síntesis artificial de núcleos celulares eucarióticos, de particular significado en biología.
Palabras clave: TÉCNICAS CITOLÓGICAS.
CARIOTIPADO.
BANDEO CROMOSÓMICO - métodos.
CROMOSOMAS - genética.
ABERRACIONES CROMOSÓMICAS.
Trabajo parcialmente financiado por el PEDECIBA (Uruguay).
1. Jefe del Departamento de Citogenética Humana y Microscopía Cuantitativa, Instituto de Investigaciones Biológicas Clemente Estable, Av. Italia 3318, CP 11.600 Montevideo-Uruguay.
E-mail: drets@chasque.apc.org
Recibido: 22/5/02.
Aceptado: 31/5/02.
Introducción
Importancia biológica de las bandas cromosómicas
El descubrimiento de las técnicas de bandeo cromosómico ha significado un considerable progreso tanto en citogenética humana como en citogenética general ya que, al poder obtenerse imágenes reproducibles de la existencia de estructuras cromosómicas transversales (bandas) de diferente tamaño a lo largo de los cromosomas, fue posible disponer de una herramienta de identificación de cada cromosoma humano, como así los de un importante número de otros organismos tanto animales como vegetales. Adicionalmente, esta metodología permitió localizar con certeza los puntos de fractura observados en la mayoría de los reordenamientos estructurales y establecer qué cromosomas estaban involucrados en dichas aberraciones.
Estas posibilidades citológicas produjeron un gran impacto especialmente a nivel clínico ya que permitieron diferenciar y caracterizar citogenéticamente un elevado número de nuevos síndromes de malformación y retardo mental congénitos. Asimismo, la más reciente y significativa aplicación de las bandas cromosómicas ha sido en el programa del genoma humano ya que, tanto genes como síndromes génicos, son ahora ubicados habitualmente en los mapas de bandas cromosómicas.
El gran valor de los diversos patrones de bandeo es que caracterizan a cada cromosoma de diversas especies de entidades biológicas superiores, excepto los vertebrados inferiores que no las poseen. En los vertebrados y en las plantas superiores las bandas se originaron a través de prolongadísimos procesos evolucionarios acaecidos a distintos niveles evolutivos constituyendo los componentes cromosómicos observables actualmente. Su estabilidad estructural es tan elevada que, cualquier cambio inducido o espontáneo ocurrido en ellos, se expresa como una mutación indeseable la cual, en el ser humano, o se elimina por muerte del individuo, o impide su reproducción, u origina una enfermedad hereditaria. Todos estos son mecanismos evolucionarios que aseguran la eliminación de la población de individuos portadores de alteraciones genéticas perjudiciales. Asimismo, estos extraordinarios avances citogenéticos han ocurrido en menos de cuatro décadas de investigaciones y perfeccionamientos metodológicos revolucionando profundamente la genética humana al esclarecer racionalmente el origen de un enorme número de enfermedades hereditarias.
La era prebandeo y el problema de la clasificación de los cromosomas humanos. Dos escuelas en pugna
Después del descubrimiento realizado por Tjio y Levan(1) del número correcto del cariotipo humano, logrado cuando ellos aplicaron, en células humanas normales, un número de refinamientos metodológicos desarrollados previamente en citogenética. Estos procedimientos permitieron la acumulación del número de metafases, una efectiva separación de los cromosomas y su adhesión al portaobjeto en un único plano óptico.
En esa época, Jérôme Lejeune (figura 1a), un médico de la Clinique des Maladies Infantiles del Hôpital Necker-Enfants Malades de París, dirigida por el profesor Raymond Turpin, estaba realizando detenidos estudios clínicos de niños con retardo mental y malformaciones congénitas, particularmente sobre pacientes portadores del síndrome de Down. Uno de los elementos que más intrigaba a Lejeune era la curiosa semejanza fenotípica de los pacientes, que ya había sido señalada mucho tiempo atrás por Seguin(2) y después por Langdon-Down(3). El hallazgo de Lejeune de la primera trisomía cromosómica del ser humano realizado en este tipo de pacientes no ocurrió por casualidad. La capacidad clínica, el profundo conocimiento del problema y el extraordinario talento de Lejeune lo indujeron a considerar como muy plausible la hipótesis de Waardenburg(4) de que el síndrome estaba determinado probablemente por una aberración cromosómica. Esta suposición ya imperaba en ese tiempo en el servicio de Turpin, quien analizando las diversas concepciones etiológicas de la enfermedad, supuso que la más probable era la de "una anomalía cromosómica"(5, 6).
Es, entonces, que Lejeune decide asociarse con una pediatra con grandes conocimientos sobre cultivos celulares, Marta Gauthier, comenzando a emplear la misma metodología utilizada por Tjio y Levan pero, en vez de usar fibroblastos embrionarios, comenzaron a cultivar fibroblastos de adultos obtenidos a partir de pequeñas biopsias cutáneas. Obviamente no se disponía, en la época, de la instrumentación actual para cultivar células a largo plazo (por ejemplo, estufas de CO2 , cámaras de flujo laminar, frascos para cultivo, etcétera) por lo que la técnica empleada se limitaba a depositar pequeños fragmentos de tejidos (explantos), en particular de fascia lata, sobre cubreobjetos untados con plasma de pollo, introducirlos en pequeños tubos que contenían el medio de cultivo, e inmovilizarlos in situ mediante coagulación por el agregado de una gota de extracto embrionario. Este simple pero ingenioso método de cultivo de fibroblastos humanos fue empleado por primera vez en nuestro país en el diagnóstico diferencial de un caso de síndrome de Klinefelter(7).
Durante la clase inaugural de la Cátedra de Genética Fundamental, que fuera creada especialmente para Lejeune por la Facultad de Medicina de París, él se refirió a las heroicas condiciones en las cuales desarrolló su labor precursora... "El cuarto destinado al estudio citológico era soberbio. Poseía dos grandes agujeros abiertos al cielo y no había agua, ni gas, ni mesa de trabajo. Nuestro microscopio, que fuera orgullo del Hospital Trousseau en los años 20, se comportaba bastante valientemente a pesar de los desgastados dientes de su cremallera que estaban recubiertos con una hoja de papel de chocolate cuidadosamente insertada entre los engranajes. Esta maravilla óptica tenía su trono sobre una camilla de enfermo que hacía de mesa de trabajo. Una silla alta, bastante parecida a aquellas que se ven aún en las iglesias de campaña detrás del viejo armonio, completaba el mobiliario"...(8).
En este increíble e inhóspito ámbito, Lejeune y Gauthier logran un activo crecimiento celular de fibroblastos a los pocos días a partir de los explantos, el cual aparecía en forma de una "corona" celular. Una vez retirado el explanto, aplicaron a las células remanentes crecidas in vitro el mismo protocolo de Tjio y Levan (colchicina, choque hipotónico, fijación con ácido acético y etanol y coloración con azul de Unna) para poder observar las células en división. Lo notable del caso es que, con este método, lograron obtener metafases increíblemente claras, con cromosomas largos y libres de distorsión mecánica (figura 1b) dado que todo el procedimiento se realizaba dentro del tubo, lo que evitaba cualquier perturbación celular o producción de indeseables artefactos y, lo cual era sumamente importante, impedir la mezcla de cromosomas provenientes de células vecinas asegurando un recuento e identificación precisos de los cromosomas de cada metafase. Al alcanzar este punto de perfeccionamiento tecnológico, Lejeune dedicó considerable tiempo a establecer con singular precisión el cariotipo humano de varones y mujeres(9). Sus inequívocas y admirables imágenes cariológicas lo impulsaron a intentar la identificación de cada par cromosómico. En particular, no existían dudas sobre los pares 1, 2, 3, 9, 16 y el Y, pero la clasificación de los miembros de los pares 4-5, 6-12 inclusive el X, 13-15, 17-18, 19-20 y 21-22, resultaba muchísimo más problemática. No obstante, Lejeune nos manifestó personalmente que "aunque era algo ilusoria la tarea de identificar esos grupos de cromosomas valía la pena esforzarse en diferenciarlos", aconsejándonos observar detenidamente pequeñas variaciones morfológicas orientadoras.
La minuciosa y exacta clasificación usada por Lejeu-ne(10) fue reiteradamente rebatida por muchos autores de aquella época. Es absolutamente sorprendente, en el contexto actual, la extensa polémica (122 páginas) que originó una de las presentaciones de Lejeune(11) controvertida particularmente por Klaus Patau, el descubridor de la trisomía 13 (figura 1c) (12-15). Durante la mencionada presentación, Lejeune expuso un nuevo método para identificar en particular cada par del grupo 6-12 cuyos pares carecían de marcadores cromosómicos especiales (a excepción del par Nº 9 que porta una constricción secundaria muy clara) empleando la longitud relativa y el índice centromérico. Lejeune empleó una técnica fotográfica de desenfoque de los puntos obtenidos pensando que las áreas de mayor concentración de dichos puntos representaban las localizaciones medias correspondientes a cada par inclusive el X. Aunque algunos de los fundamentos matemáticos que Patau empleó para oponerse a los puntos de vista de Lejeune eran en parte ciertos, debe señalarse que sus errores de apreciación se originaron principalmente por el empleo de cromosomas sumamente acortados debido al uso de dosis elevadas de colcemid (una colchicina sintética sumamente activa), lo cual le impedía detectar pequeñas variaciones morfológicas existentes entre los distintos pares cromosómicos (figura 1d). Era claro que en ese tiempo dos "escuelas citogenéticas" (la francesa y la anglosajona) se oponían generando encendidas polémicas. Por estas razones, a partir de nuestro retorno de París, ocurrido en mayo de 1966, hasta el presente, adoptamos en nuestro laboratorio la "metodología francesa" para el estudio del cariotipo humano basados en dichas convincentes razones citogenéticas.
Habiendo logrado tal perfeccionamiento tecnológico tanto en materia de cultivos de fibroblastos obtenidos de pequeñas biopsias como la identificación precisa de todos los pares cromosómicos, Lejeune decide estudiar nueve pacientes con síndrome de Down estableciendo inequívocamente que portaban 47 cromosomas en vez de 46, anomalía determinada por el exceso de un cromosoma del par 21(16,17). Este sensacional descubrimiento implicó una profunda y real comprensión del síndrome de la trisomía 21 determinando la inauguración formal de la citogenética humana como una nueva y trascendente disciplina bio-médica. Realizamos los primeros diagnósticos de trisomía 21 con Ramón-Guerra poco tiempo después(18). Su repercusión fue tan amplia que conmocionó el oscuro capítulo de las malformaciones y retardo mental congénitos tanto en la esfera somática como en la sexual, problemas no comprendidos racionalmente por nadie hasta esa fecha. Aun cuando este importantísimo descubrimiento abrió insospechadas rutas en múltiples áreas de la genética humana y de la bio-medicina, sorprendentemente todavía no se ha hecho justicia con el histórico aporte de Lejeune ya que la trisomía 21 continúa denominándose "síndrome de Down" en vez de designarlo justicieramente "síndrome de Down-Lejeune" aunque Lejeune fue, indiscutiblemente, el primer investigador en la historia de la medicina que esclareció, en forma definitiva, su origen genético.
Debido al enorme interés que despertó el conocimiento detallado del cariotipo humano, sobre todo a nivel de los clínicos, quienes estaban alejados de los laboratorios de citogenética, ideamos un simple método para la enseñanza de la identificación cromosómica destinado a numerosos grupos de estudiosos, basado en el recorte cromosómico de fotocopias y realización, en forma colectiva, de cariotipos. Este recurso docente lo empleamos en el primer curso sobre citogenética humana que desarrollamos en la Escuela de Graduados de nuestra Facultad de Medicina en 1970 y 1974(19).
Las bandas Q fluorescentes
La situación del problema de la identificación precisa de los cromosomas humanos parecía haber alcanzado un punto insuperable cuando Caspersson y colaboradores(20,21) publican sus memorables trabajos sobre la identificación cromosómica mediante métodos fluorescentes. Köhler había observado hace más de 100 años que los componentes nucleares eran capaces de fluorescer cuando eran iluminados con luz ultravioleta, pero el resultado era una fluorescencia uniforme de los cromosomas y, por ende, no informativa. Por tanto, Caspersson pensó que si era posible unir un agente alquilante con un fluorocromo, quizá podría lograrse su intercalación con las guaninas del ADN cromosómico. Como se conocía que el número y tipo de bases del ADN variaba localmente a lo largo del cromosoma metafásico, Caspersson supuso que el empleo de dicho agente podría permitir la diferenciación de los segmentos cromosómicos ricos en bases guanina-citosina (GC) de los compuestos por adenina-timina (AT) aguardando la producción de áreas más o menos brillantes lo que podría contribuir, eventualmente, a una más precisa identificación cromosómica. A pedido de Caspersson, E. Modest, un químico de Estados Unidos, sintetizó un nuevo compuesto, la mostaza de quinacrina y, para gran satisfacción de Caspersson y su grupo, después de teñir los cromosomas con este producto observaron que los cromosomas presentaban segmentos fluorescentes (o bandas) los cuales brillaban con diversos grados de intensidad. El aspecto más interesante del asunto fue que los segmentos fluorescentes siempre aparecían localizados en forma característica en cada cromosoma configurando patrones de bandeo específicos permitiendo una precisa identificación de cada par cromosómico(22).
Aunque los resultados obtenidos por Caspersson y su grupo fueron realmente impresionantes, su hipótesis de trabajo contenía algunos aspectos erróneos aclarados posteriormente: 1) el componente que producía la fluorescencia no era la fracción alquilante (la mostaza) sino la fluorocrómica (la quinacrina), y, 2) las bandas fluorescentes representaban los segmentos de ADN ricos en AT y no en GC (23). No obstante, las imágenes fluorescentes resultaron sumamente útiles ya que permitieron reconocer cada par cromosómico del cariotipo humano de acuerdo a su patrón de bandeo, un hecho no demostrado hasta esa fecha. Esta fue la primera clara evidencia de que cada brazo cromosómico poseía una estructura característica. Este descubrimiento permitió resolver numerosos problemas citogenéticos relacionados con portadores de afecciones hereditarias ya que pudieron detectarse aberraciones cromosómicas de muy difícil interpretación empleando métodos citológicos convencionales. Aunque, desde el punto de vista citogenético este descubrimiento fue altamente significativo, el método no se generalizó debido a que: 1) no todas las bandas obtenidas eran netas sino más bien ligeras gradaciones tintoriales; 2) las preparaciones teñidas con quinacrina no eran permanentes ya que la fluorescencia tiende a desvanecerse rápidamente, y, 3) los preparados una vez expuestos a la luz ultravioleta no podían usarse nuevamente debido a la degradación del fluorocromo y, por ende, pérdida total de la fluorescencia cromosómica.
La hibridación in vitro
La hibridación in vitro fue otra fundamental etapa que condujo al desarrollo de los diferentes métodos de bandeo cromosómico. A fines de 1969, la doctora Mary Lou Pardue presentó, durante la reunión anual de la American Society for Cell Biology (ASCB), un nuevo método citológico mediante el cual el ADN nativo cromosómico, formado por una doble cadena molecular, era desnaturalizado quedando inmóviles en el preparado las moléculas unifilares resultantes. En este estado, el preparado es expuesto a moléculas radioactivas de ARN, las cuales hibridan a lo largo del tiempo con el ADN desnaturalizado pudiendo detectarse los segmentos hibridados mediante autorradiografía. Era obvio que las moléculas que poseían un mayor número de copias hibridarían más precozmente que las de menor número(24). Este elegante experimento, desarrollado bajo la dirección del profesor Joseph Gall, jefe del Departamento de Biología de la Universidad de Yale, Estados Unidos, permitió detectar, con inigualable precisión, las secuencias de ADN altamente repetidas contenidas en las regiones heterocromáticas de los cromosomas del ratón localizadas principalmente en la región centromérica. Durante estos experimentos adicionalmente notaron que después de tratar a los cromosomas con hidróxido de sodio, esas regiones poseían una tendencia preferencial de teñirse con el colorante de Giemsa. La sesión de la ASCB fue presidida por el investigador chino Tao-Chiuh Hsu, jefe de la Sección Biología del M.D. Anderson Hospital & Tumor Institute de Houston, quien manifestó particular interés en el método, logrando convencer a Gall que aceptara recibir a su colaboradora, la doctora Frances Arrighi, en su laboratorio de Yale para aprender esa técnica.
Las bandas C
A su regreso a Houston, la doctora Arrighi repitió inmediatamente los experimentos confirmando que era posible detectar las regiones heterocromáticas tratando los cromosomas simplemente con hidróxido de sodio, incubación en una solución salina y tinción por el Giemsa. Como estos segmentos heterocromáticos (denominados "bloques" en la época) se hallan principalmente en las regiones centroméricas, se denominaron bandas C. Esta técnica aplicada a los cromosomas humanos permitió teñir específicamente los segmentos heterocromáticos localizados en las regiones pericentroméricas y en dos tercios distales del cromosoma Y(25). Sin embargo, como estos autores emplearon cromosomas muy acortados, no fueron capaces de detectar detalles pequeños en esas regiones heterocromáticas bandeadas C. Esta dificultad fue superada poco tiempo después, cuando Craig-Holmes y colaboradores(26) describen la detección de los primeros polimorfismos de los segmentos heterocromáticos bandeados C en cromosomas humanos usando cromosomas más largos.
Las bandas G
Cuando el autor de esta nota arribó al Instituto del Tumor del Hospital Anderson de Houston (setiembre, 1970) con la finalidad de realizar una estadía científica como investigador asociado por invitación de la jefe del Laboratorio de Citogenética Humana, doctora Margery Shaw*, el ambiente estaba ciertamente muy convulsionado por los recientes hallazgos de la técnica de la hibridación in vitro y por el descubrimiento de las bandas C. El objetivo primordial de nuestra estadía era procurar algún aporte al problema de la identificación cromosómica, basados en la idea de que cualquier nueva observación, por ínfima que ella pudiera ser, contribuiría significativamente en diversos problemas citogenéticos, en particular los relacionados con los síndromes hereditarios humanos. En el inicio de nuestra estadía nos polarizamos en familiarizarnos con las técnicas autorradiográficas debido a que la incorporación de timidina marcada con tritio radioactivo en la molécula del ADN ocurre durante el período de síntesis ,por lo que pensamos que podríamos lograr alguna información adicional útil para la identificación cromosómica debido a dicha incorporación diferencial de la timidina tritiada en el ADN dependiente del momento de la replicación cromosómica.
Los primeros experimentos fueron realmente desalentadores ya que, empleando los métodos citogenéticos del laboratorio de Houston, sólo se obtenían cromosomas muy poco informativos por su excesivo acortamiento. Por tanto, y enfrentando una clara incredulidad de nuestros colegas, nos dedicamos a examinar el método citogenético seguido en el laboratorio. Este proceder nos permitió detectar, en un par de semanas de trabajo, que todo el problema radicaba exclusivamente en un exceso del tratamiento colchicínico empleado.
Simplemente, sustituyendo el colcemid (Ciba) por colchicina cristalina para detener la división celular logramos obtener cromosomas tipo Lejeune de alta calidad(28), técnica que fuera empleada más adelante en el trabajo mencionado(26). Es así que, en esta etapa, comenzamos a explorar la técnica de las bandas C en nuestros largos y elegantes cromosomas "a la francesa" cuando, casi en forma inesperada, observamos la aparición de un patrón de bandeo constante y característico para cada cromosoma humano. La sorpresa y las dudas generadas por este hallazgo fueron considerables por lo que decidimos seleccionar a los cromosomas Nº 1 (los más grandes del cariotipo humano) provenientes de leucocitos de diversos individuos normales para juzgar la reproducibilidad del patrón de bandas hallado.
* Nuestra elección del laboratorio de la doctora Shaw como el lugar más adecuado para nuestra estadía de perfeccionamiento no ocurrió por azar, sino por consejo personal del profesor Curt Stern, un distinguido genetista humano de la Universidad de California. Tuvimos el placer de conocerlo personalmente en ocasión del Simposio Internacional sobre Fisiología y Diferenciación Nuclear desarrollado en Belo Horizonte, Brasil, en 1968. Nosotros ya habíamos intercambiado una profusa correspondencia con el profesor Stern debido a que tradujimos al español su libro "Principles of Human Genetics"(27) cinco años antes, por lo que nos conocíamos muy de cerca pero epistolarmente. Fue para nosotros una real fortuna recibir el acertado consejo del profesor Stern de ir a Houston, pues él era el investigador más indicado en aquella época para recomendar un lugar apropiado para desarrollar nuestros proyectos citogenéticos.
Numerosos experimentos fueron llevados a cabo por nosotros en el intento de desentrañar algún posible mecanismo productor de las bandas o de perfeccionar nuestro método, pero muchos de ellos no proporcionaron resultados satisfactorios. No obstante, en nuestros informes de progreso(29,30) afirmamos lo siguiente: "A pesar del número de experimentos que fracasaron, los cromosomas humanos reaccionan, en diferentes condiciones experimentales, en tal particular forma que producen patrones de bandeo cromosómico específicos no dependientes del método empleado. Este hecho pudiera significar que existe un ordenamiento estructural subyacente existente en cada cromosoma. Si esto es cierto, es previsible que debieran ser fácilmente detectables variaciones menores de los patrones afectando tanto el tamaño como la distribución de las bandas en los cromosomas de los seres humanos".
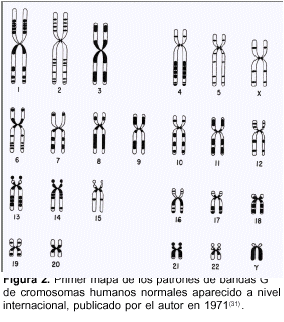
Una vez confirmado este punto, extendimos nuestro estudio a todo el cariotipo humano de modo de tratar de establecer si cada par cromosómico poseía un patrón de bandas característico. Uno de los problemas más difíciles de enfrentar era cómo diseñar un primer diagrama práctico que resumiera gráficamente los patrones de bandas más característicos observados en cada par cromosómico. El resultado fue un primer mapa que ilustró la localización y tamaño relativos por lo menos de las bandas principales halladas en cada brazo cromosómico (figura 2)(31). Tanto la técnica de dibujo elegida para representar las bandas como la asignación de las bandas más conspicuas de cada par cromosómico fue aceptada posteriormente sin modificaciones a nivel internacional.
El método de bandeo y nuestro primer mapa fueron denominados de las bandas G porque se obtenían tiñendo los cromosomas con el colorante de Giemsa. El mapa fue, obviamente, perfeccionado a lo largo de las siguientes décadas, pero básicamente es el que continúa usándose en la actualidad, ya que responde a los fundamentos gráficos de representación de las bandas que empleamos en nuestra primera publicación sobre el tema(32). El método de las bandas G, como otros métodos descritos posteriormente, popularizaron su empleo, en particular en los diagnósticos médicos, sobre todo porque no implicaba el empleo de un microscopio de fluorescencia más complejo y más costoso.
Las bandas R
Impregnados de comprensible entusiasmo decidimos enviarle una detallada carta a Lejeune sobre el hallazgo de los patrones de bandas. Sus primeras respuestas fueron más que interesantes: "Paris le 14 Mai, 1971, Mon cher ami, ...J'espère que vous avez reçu une lettre sur les "bandes" des chromosomes prier dénaturation. Il m'apparait que nous fairons la même chose de deux côtés de l'océan! Avril 30, 1971. ... Nous avons ici aussi mis au point une technique permettant de reconnaître chaque élement du caryotype". En una carta posterior (figura 3) Lejeune nos expresó que su técnica era, en parte, comparable a la nuestra y que en ciertos puntos las coloraciones eran exactamente "a la inversa" de lo que ellos obtenían desnaturalizando a los cromosomas con un buffer fosfato. Este brillante comentario de Lejeune fue evidentemente precursor, pues, poco después, se convino denominar, a nivel internacional, a los patrones de bandas que ellos obtenían como bandas R designación originada en el término "reverse"(33). En su carta del 8 de junio, Lejeune nos expresó además que él creía que la composición local de bases del ADN "no tenía nada que ver" con la producción de las bandas sino con la constitución química de los cromosomas. No cabe duda que esta afirmación se originó seguramente después de que Lejeune obtuviera bandas mediante el uso de una enzima proteolítica, la pronasa, sospechando brillantemente el papel adicional de las proteínas cromosómicas en la producción del bandeo. Esta técnica apareció publicada prácticamente en la misma fecha que la técnica de la digestión tríptica para producir bandas G(34).
Aparte de las diferentes soluciones desnaturalizantes empleadas, la diferencia fundamental entre la técnica de Dutrillaux-Lejeune y la nuestra era la temperatura de incubación: 60º C usada para obtener bandas G, y 86º C para las bandas R. Ahora sabemos que las uniones covalentes son dos para los pares de bases AT y tres para los pares de bases GC y que la desnaturalización de dichas uniones covalentes ocurren, precisamente, a esas temperaturas ya que implican diferentes niveles energéticos para separarlas. En otras palabras, los métodos de bandeo G y R nos estaban revelando estructuras cromosómicas dependientes de la composición segmentaria del ADN.
Las bandas T
Posteriormente, Dutrillaux(35) descubre que las regiones más distales de los brazos cromosómicos podían ser teñidas en forma selectiva. Este método se conoce como bandeo T y es una variante del bandeo R ya que las preparaciones son incubadas en el mismo buffer durante un período más prolongado. Como resultado, luego de la tinción con Giemsa, se obtienen cromosomas teñidos en forma débil excepto los segmentos terminales donde la tinción continúa siendo intensa.
El bandeo fluorescente multicolor y la técnica de la hibridación in situ fluorescente (FISH)
La técnica de la microscopía de fluorescencia se ha perfeccionado considerablemente en los últimos tiempos por lo que se está empleando ampliamente en investigaciones biomédicas. Estas nuevas posibilidades analíticas son el resultado de la combinación tecnológica de fluorocromos altamente eficientes, microscopía láser confocal (un sistema por el cual los objetos microscópicos son explorados por sucesivos planos bidimensionales mediante un láser, los cuales después se recomponen en forma computacional gráfica tridimensional) y procesamiento digital de imágenes. Este conjunto permite observar, al mismo tiempo, diferentes segmentos cromosómicos en distintos colores. Los nuevos fluorocromos abarcan el espectro visible desde el azul al rojo, suministrando un brillo de colores nunca logrado anteriormente empleando filtros apropiados para visualizarlos. Esto ha representado un avance sustancial para el estudio de las estructuras cromosómicas ya que permite teñir secuencias específicas del cromosoma, por lo que la técnica se denomina "pintado cromosómico" (chromosome painting) lo que facilita la detección de aberraciones cromosómicas, en particular translocaciones. Hasta el presente se dispone comercialmente de kits para estudios mediante FISH de células humanas y de ratón. Esta técnica permite visualizar estructuras moleculares pequeñas, como los telómeros, empleando inmunolocalización fluorescente e hibridación in situ.
Significado funcional y estructural de los principales bandeamientos
Resumidamente, deben distinguirse cuatro regiones desde el punto de vista funcional y estructural en las bandas de cromosomas de mamíferos, a saber:
1. Las bandas G se caracterizan por ser relativamente ricas en pares de bases adenina y timina, replicar su ADN tardíamente durante el período de síntesis, condensarse tempranamente durante la mitosis y reflejar el patrón cromomérico de los cromosomas meióticos.
2. Las bandas R son zonas relativamente ricas en guanina y citosina, replican su ADN en la primera mitad del período de síntesis y se condensan tardíamente durante la mitosis.
3. Las bandas C se componen de secuencias de ADN satélite altamente repetido que carecen, casi totalmente, de actividad génica. El ADN contenido en estas regiones se replica al final de la fase S(36).
4. Las bandas T son consideradas como un subconjunto de bandas R, ricas en GC(37) y poseen una concentración de genes más elevada que el resto de las bandas R encontrándose allí, además, el mayor número de oncogenes mapeados y donde se localizan preferentemente las lesiones inducidas por radiaciones ionizantes(38).
La uniformización internacional de los patrones de bandeo humanos y otros primates
La identificación cromosómica, planteada antes y después del descubrimiento de los procedimientos de bandeo, suscitó tanto interés y fue tan problemática que exigió la realización de reuniones periódicas para lograr uniformidad descriptiva entre los diversos laboratorios de citogenética. En abril de 1960 se reunieron, durante cuatro días, en Denver, Colorado(39), un grupo de investigadores que estaban trabajando con cromosomas humanos, pero empleando sus propios sistemas personales de nomenclatura para identificarlos. Dicha reunión fue respaldada por la presencia de muy destacados investigadores como, entre otros, HJ Muller (Premio Nobel, descubridor de la acción mutagénica de las radiaciones), Curt Stern, de la Universidad de California, el genetista humano mencionado anteriormente, y el famoso genetista inglés DG Catcheside que la presidió. Durante esa primera reunión sobre nomenclatura cromosómica se produjeron acaloradas discusiones en el intento de lograr consenso aun sobre pequeños detalles morfológicos de los cromosomas humanos. Aunque Lejeune propuso que los cromosomas podrían clasificarse empleando un método combinado de letras representativas de los tamaños relativos (por ejemplo G, M, P, de "grand, médian y petit") y de números correspondientes a cada par cromosómico, este criterio no fue aceptado admitiéndose solamente reunir a los cromosomas humanos en grupos 1-3, 4-5, 6-12, etcétera. Posteriormente, Patau(13) propuso diferenciar esos grupos usando letras (A para designar el grupo 1-3, B, para 4-5, C, para 6-12 y el cromosoma X, D, para 13-15, E, para 16-18, F, para 19 y 20 y G, para el 21-22 inclusive el sexual Y). Este criterio fue aceptado en la Conferencia de Londres(40) y en la reunión de Chicago(41). Estos fueron los primeros esfuerzos llevados a cabo para disponer de una nomenclatura uniformizada acordada para emplear a nivel internacional de modo de poder intercambiar una información precisa sobre las observaciones cromosómicas entre los laboratorios, un aspecto crucial en las primeras etapas del desarrollo de la citogenética humana. Con la aparición de los diferentes métodos de bandeo fue preciso realizar una reunión especial sobre la nueva nomenclatura durante el Congreso Internacional de Genética Humana llevado a cabo en París(32). Posteriormente, debido al desarrollo de los métodos de alta resolución cromosómica de Yunis(42) y de las aplicaciones de los bandeos en otros primates, se realizaron reuniones adicionales años después(43,44).
Nuevos métodos analíticos para la localización cuantitativa de las bandas cromosómicas
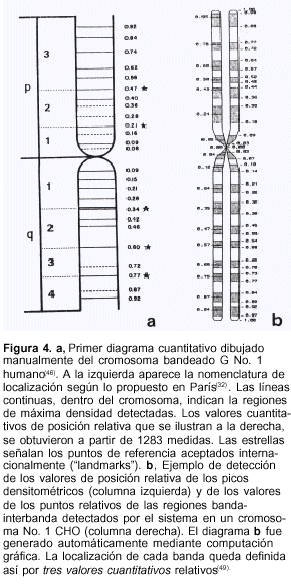
A nuestro retorno de Estados Unidos pensamos que, si bien el descubrimiento y mapeo de las bandas de los cromosomas humanos era significativo, no dejaba de ser solamente una interpretación subjetiva de lo observado al microscopio(45). Por tanto, consideramos que era necesario desarrollar un nuevo método para localizar los puntos de mayor concentración tintorial de las bandas a lo largo de las cromátidas. Para ello, adaptando el antiguo equipamiento existente en nuestro laboratorio, obtenido previamente por el profesor Francisco A. Sáez, Maestro introductor de la citogenética y la citofotometría en América, construimos un equipo de microscopía para exploración densitométrica analógica de los cromosomas capaz de detectar las bandas C y G en sus posiciones relativas con respecto al centrómero. Como estos valores relativos no se alteran ni por el estadio de contracción cromosómico ni por los tratamientos citogenéticos ya que, por definición, los cromosomas son afectados por ellos en forma uniforme, los datos cuantitativos obtenidos son, de este modo, citogenéticamente confiables. Para ello elegimos como modelos de estudio al cromosoma Nº 1 para localizar las bandas G y al cromosoma sexual Y para estudiar el segmento C heterocromático terminal. El resultado fue el diseño de un primer mapa cuantitativo de localización de las bandas de ambos cromosomas a nivel internacional (figura 4ª)(46). No obstante, este primer método de medida manual de localización de los picos de mayor densidad era trabajoso e insumía considerable tiempo. A fin de superar esta dificultad, desarrollamos un primer programa computacional denominado Bandscan que diseñamos especialmente para una calculadora programable WANG 720 C asociada al sistema microfotométrico de Zeiss MP01(47). Con este sistema logramos obtener mapas de localización relativa de los puntos de mayor densidad de las bandas G en forma automática de los cromosomas humanos.
Ulteriores incorporaciones instrumentales introducidas en nuestro sistema microfotométrico permitieron localizar en términos cuantitativos no sólo los puntos de máxima densidad mencionados, sino también las regiones de iniciación y finalización de cada banda. Por tanto, presentamos por primera vez en la literatura un método que aportaba tres parámetros cuantitativos definitorios de cada banda cromosómica (figura 4b), un hecho no descrito hasta esa fecha(48,49). Este sistema resultó extremadamente útil para localizar con elevada precisión los puntos de fractura inducidos a lo largo de las cromátidas por las endonucleasas de restricción(50,51). Hasta la fecha, nuestro método cuantitativo no ha podido ser superado por los métodos de observación microscópica directa de los puntos de fractura cromosómica inducidos, ya que éstos continúan siendo interpretaciones puramente subjetivas dependientes de la capacidad de observación del investigador(52).
La detección de los patrones de bandeo T subterminales y la existencia de intercambios subteloméricos mínimos de cromátidas hermanas
Los telómeros se caracterizan por presentar una secuencia telomérica repetida de ADN altamente conservada (TTAGGG)n tanto en los cromosomas humanos como en los de otros vertebrados(53). Mediante microscopía electrónica, los segmentos bandeados T aparecen como intrincadas estructuras fibrosas(54) altamente resistentes a la desnaturalización por calor o digestión por endonucleasas de restricción(55). La región telomérica es un complejo proteico y de ADN con proteínas que se unen específicamente al ADN telomérico proporcionándole un recubrimiento terminal que le confiere estabilidad al cromosoma y lo protege contra la degradación por las exonucleasas y por recombinación génica de los extremos cromosómicos(56). El estudio de la región telomérica ha sido motivo de creciente interés debido a que se ha observado la producción de un acortamiento progresivo en células neoplásicas. Se sabe además que el crecimiento de los fibroblastos in vitro es limitado y este hecho está determinado por el acortamiento del telómero que origina envejecimiento (cell senescence) y muerte celular. Solamente se halla una longitud estable de las regiones teloméricas en las células germinales y en las células inmortales que expresan la enzima telomerasa, una polimerasa que porta su propio molde de ARN y adiciona repetidos teloméricos a los extremos de los cromosomas para mantener su longitud protegiéndolo de la pérdida de secuencias que ocurre en cada ciclo de replicación cromosómica(57). El estudio molecular de la región subtelomérica ha indicado que las familias de ADN repetido, características de la región terminal del cromosoma o telómero, están también presentes en la región subtelomérica pero en forma dispersa. Por otra parte, se acepta ahora que ocurren muchos más reordenamientos cromosómicos en la región subtelomérica de todos los cromosomas humanos que en todas las demás regiones del genoma humano(58, 59).
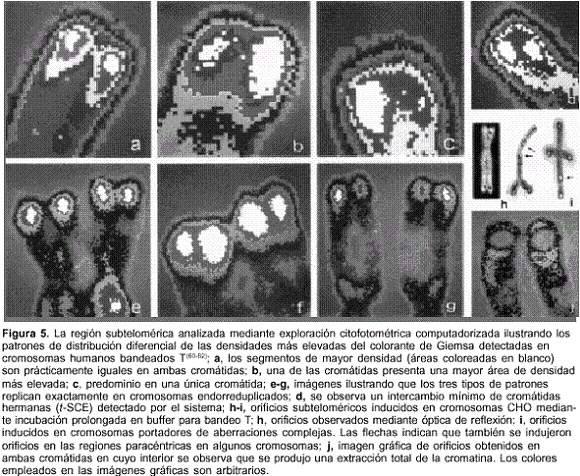
Empleando nuestro sistema computarizado de microfotometría de exploración cuantitativa en el análisis de la región subtelomérica de cromosomas humanos y del ovario del Hámster chino (CHO), hallamos que los segmentos subteloméricos presentaban patrones característicos de distribución de las densidades de la cromatina(60). Desarrollamos, asimismo, un procedimiento que extrae en forma específica ciertos segmentos de la región subtelomérica en forma de pequeños orificios que se localizan en las áreas donde se detectan los patrones de densidad en cromosomas humanos y CHO tanto normales como aberrantes(61). Pudimos confirmar, recientemente, la real existencia de estos patrones de densidad empleando, como modelo analítico, cromosomas endorreduplicados de la línea celular CHO, ya que ellos replican exactamente durante el proceso de endorreduplicación(62). Además, nuestro método de exploración microfotométrica computarizada permite detectar la existencia de muy pequeños intercambios de cromátidas hermanas en la región subtelomérica bandeada T, que denominamos t-SCE(60). La diferencia esencial de este hallazgo con respecto a los métodos convencionales usados para detectar los intercambios de cromátidas hermanas, es que en ellos se emplea bromodeoxiuridina y el nuestro no implica ninguna sustitución molecular por lo que revela hechos que ocurren espontáneamente dentro del cromosoma. Seguramente, los t-SCEs reflejan, en forma de imagen gráfica, los intercambios detectados en ese segmento cromosómico(63). La figura 5 ilustra, resumidamente, los hallazgos más destacables detectados en nuestro laboratorio mediante exploración microfotométrica cuantitativa de la región subtelomérica(64). En dicha figura se advierte la complejidad estructural como así la reactividad existente en esa región.
Muy probablemente, los patrones de densidad y la localización de los segmentos subteloméricos extraídos con nuestro método se relacionan con lo observado mediante sondas específicas para secuencias teloméricas y con la presencia de proteínas teloméricas que se localizan en esas áreas(65,66), ya que las imágenes obtenidas son comparables. Todos estos hallazgos sugieren que, aparte de la composición local de ADN repetido, las proteínas asociadas desempeñan también un importante papel y que todas las observaciones realizadas por nosotros en este segmento cromosómico estarían todas relacionadas entre sí.
La región subtelomérica y los síndromes de retardo mental y malformaciones congénitas
El estudio detallado de la región subtelomérica se ha incrementado considerablemente en el último quinquenio debido a que se ha detectado, en dicho segmento cromosómico, la presencia de un número considerable de muy pequeñas aberraciones cromosómicas denominadas "crípticas", las cuales se han relacionado con la producción de retardo mental y malformaciones congénitas (tabla 1) cuyas entidades clínicas fueran catalogadas como de naturaleza "idiopática" por ignorarse su origen. La detección de estas pequeñas aberraciones cromosómicas, cuyos tamaños lindan con el límite de resolución del microscopio óptico, ha sido posible por el perfeccionamiento ocurrido en el incremento de la eficiencia cuántica de las sondas fluorescentes teloméricas. Aun cuando el segmento cromosómico involucrado es, como se indicó, muy pequeño, el brillo fluorescente es lo suficientemente intenso como para permitir su visualización. Es plausible admitir que los pequeños intercambios de cromátidas hermanas t-SCE detectados con nuestros métodos pudieran reflejar la gran actividad de intercambio génico existente en la región estando relacionados, de algún modo, con la producción de las aberraciones crípticas halladas a nivel clínico.
Perspectivas citológicas
La estructura del cromosoma eucariótico
Las técnicas destinadas a la producción de las bandas cromosómicas C, G, R y T permitieron no sólo un avance extraordinario en el conocimiento sobre la organización estructural del cromosoma eucariótico, sino también una mejor descripción y localización de las alteraciones cromosómicas espontáneas e inducidas. En la actualidad, las técnicas de bandeo se clasifican en técnicas de bandeo morfológico y técnicas de bandeo dinámico. Los bandeos morfológicos reflejan la heterogeneidad de la cromatina a lo largo de los brazos cromosómicos. Los factores responsables de la heterogeneidad revelada mediante estos mecanismos de bandeo se relacionan particularmente con las proteínas cromosómicas, con las interacciones ADN-proteínas y con la composición de bases del ADN. Otros tipos de bandeo cromosómico se denominan bandeos dinámicos porque implican la incorporación al ADN de un análogo de la timina, la 5-bromo-2'-desoxiuridina (BrdU), durante el período de síntesis. Las bandas así obtenidas pueden clasificarse como bandas de replicación debido a la relación temporal existente entre la incorporación de BrdU y el patrón de replicación. Es evidente, por tanto, que una banda cromosómica es también una unidad de replicación. Por tanto, la presencia de los patrones de bandas a lo largo de los cromosomas de mamíferos obtenidos mediante las diferentes técnicas mencionadas anteriormente indica que la cromatina es heterogénea, lo que evidencia la existencia de una estructura y una funcionalidad diferente en cada uno de los segmentos cromosómicos(67).
El proyecto del genoma humano
En esta etapa de esta breve historia de sorprendentes avances citogenéticos hemos arribado a un aparente punto final. Una brillante nueva faceta se labró en la historia de la genética contemporánea cuando Watson y Crick(68) describieron la estructura del ácido deoxirribonucleico proporcionando las bases moleculares para la comprensión de la estructura génica de los seres vivos. Era evidente que este conocimiento conduciría, tarde o temprano, al igual que como ocurrió con el descubrimiento de la clonación en batracios(69), cuya aplicación en otros animales era sólo un problema de perfeccionamiento tecnológico, al ambicioso intento de decodificar el genotipo humano. El programa del genoma humano es, sin duda, un esfuerzo biológico y tecnológico trascendente estando recién en los comienzos de esta tarea de tan largo aliento.
Al presente, se ha logrado descifrar casi completamente su constitución génica conociéndose espacialmente las secuencias a nivel molecular pero no a nivel morfológico(70). Tampoco se conoce la representación de las secuencias en los límites de las bandas (la región banda-interbanda). De los 30.000 a 40.000 genes decodificados, un gran número se ha relacionado con síndromes hereditarios definidos, por lo que estas investigaciones están repercutiendo profundamente en múltiples aspectos de la medicina ya que contribuyen a perfeccionar el diagnóstico, el tratamiento mediante terapia génica y la prevención de muchas enfermedades congénitas, las cuales representan no sólo una tremenda carga socio-económica sino también un lamentable menoscabo de la vida humana(71,72). La biología de los seres vivos está siendo transformada drásticamente por la posibilidad de analizar y modificar la constitución molecular subyacente cromosómica (cambios transgénicos), un hecho casi impensable de lograr hace unos pocos años atrás.
Como en muchas otras ramas de la citogenética, los métodos de bandeo cromosómico han representado un aporte metodológico de considerable importancia porque han proporcionado una herramienta mediante la cual se pueden asignar los genes, no sólo en cromosomas individuales, sino también en determinadas regiones cromosómicas, siendo uno de los objetivos del proyecto del genoma humano definir las relaciones existentes entre el mapa molecular y el mapa cromosómico. Aunque hasta el presente se han registrado unos cuantos miles de genes autosómicos sólo una fracción de ellos ha sido localizada en segmentos específicos cromosómicos. Persiste también en un oscuro misterio qué significado posee un considerable número de genes aparentemente no funcionantes en las células adultas. Recién ahora se ha comenzado a investigar cómo funcionan, interactúan o dejan de expresarse los genes durante los complejos procesos de la diferenciación embrionaria que finaliza construyendo un ser armónicamente completo. Además, no se sabe todavía qué genes están involucrados en los procesos evolucionarios que originaron al ser humano actual aun cuando nuestra constitución génica sea sumamente similar a la de otros primates superiores o prácticamente igual a la del chimpancé (99%).
El gran experimento final: la síntesis artificial de células vivas
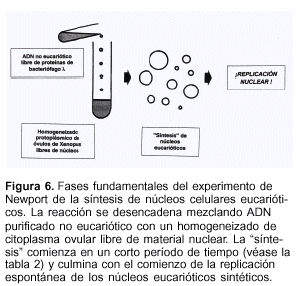
Puede afirmarse que la biología está recorriendo sendas comparables a las transitadas por la química orgánica. Cuando la frontera que la separaba de la inorgánica fue traspuesta por Kolbe (1845) y Berthelot (1855-1863) al sintetizar los primeros compuestos orgánicos, la química orgánica se tornó de una ciencia analítica en una sintética. Algo similar está ocurriendo, casi en silencio, en biología, donde se están realizando experimentos quizá más espectaculares y trascendentes que la propia clonación de los seres vivos y la manipulación génica, ya que su probable objetivo final será la creación in vitro de una célula viva eucariótica capaz de dividirse y perdurar. Esta línea de investigación constituirá un avance biológico cuya dimensión escapa a la imaginación más inspirada de cualquier ser humano. Parte de esta apasionante ruta la han construido los históricos experimentos llevados a cabo por Newport(73,74). Descritos resumidamente, éstos se basan en mezclar ADN de un organismo no eucariótico (bacteriófago ?) carente de proteínas con un homogeneizado de citoplasma de óvulos de Xenopus (un batracio) a los que se les extrajo previamente el núcleo (figura 6). En la tabla 2 se describen abreviadamente las etapas del armado de núcleos eucarióticos resultados de la mezcla mencionada empleada por Newport, en la cual se advierte que la "síntesis" de núcleos eucarióticos ocurre, como cualquier reacción bioquímica, en corto tiempo. En el diagrama se indica, además, que el tamaño de los núcleos "sintetizados" es diferente debido a que resultan de una "reacción" in vitro cuyo control aún no ha sido bien comprendido. Este avance científico tan impactante que está produciéndose en biología sólo es comparable con lo acontecido en física nuclear, ya que los progresos acaecidos en ambas áreas han cambiado de manera indeleble nuestra visión tanto de la estructura íntima de la materia "inerte" como la de la composición y estructura genética de los seres vivos. Es casi milagroso que estos progresos hayan ocurrido en tan poco tiempo y no es aventurado predecir que, en un plazo no muy largo, también se logrará sintetizar una célula eucariótica completa capaz de propagarse una vez que se conozcan detalladamente los componentes básicos del citoplasma a nivel molecular y se los puedan sintetizar. Sin duda, se ubicará cada componente sintetizado en los mapas de bandas. No es tampoco fantasioso afirmar que podrá lograrse la asociación de dichas células "sintéticas" mediante fusión celular artificial empleando instrumentos ya conocidos, por ejemplo, el electroporador, y obtener así entidades multicelulares sintéticas "vivientes". Sin duda, estos futuros experimentos -si se logra realizarlos éxitosamente- alterarán muchísimos puntos de vista científicos y filosóficos acerca de los seres vivos. Las próximas generaciones asistirán, de este modo, al desarrollo de un insospechado campo de la biología con el cual deberán enfrentar, repensar y convivir. El problema ético será extraordinariamente complejo, pero el histórico progreso experimental abrirá tantos innumerables caminos y tan colosales posibilidades acerca del origen de las distintas entidades vivientes y sobre los procesos evolucionarios que originaron la aparición del Homo sapiens en este planeta, todo lo cual, en este instante, es ciertamente casi imposible de imaginar.
Agradecimientos
El autor desea agradecer muy especialmente al Prof. Dr. Rodolfo Wettstein por la detallada revisión crítica y valiosas sugerencias que realizara sobre el manuscrito.
Summary
Human chromosome identification systems and several chromosome banding methods, developed during the last four decades, are briefly reviewed under a historical perspective. Numerous episodes that built the basis of the present modern structural and molecular citogenetics (the author took part in some of them) are reported. Some molecular aspects related to this methodology are also mentioned, in order to contribute to the understanding of different aspects of the underlying chromosomal structures revealed by these methods. The analytical procedures developed in our laboratory for the study of nuclei and chromosomes, the results of quantitative analysis of the subtelomeric region and its probable relationship with cryptic aberrations detected in this chromosomal segment and responsible for mental retardation and congenital abnormalities, are described. Finally, we also include a brief report about the application of chromosome banding in the Human Genome Project and on its potential usefulness in the development of experiments on the artificial synthesis of eukariotic cell nuclei, of considerable significance in biology, is also included.
Résumé
On montre, depuis une perspective historique, les systèmes d'identification des chromosomes humains et plusieurs méthodes de marquage chromosomique développées pendant les quatre dernières décades. On décrit des faits et des circonstances -dont l'auteur a été souvent protago-niste- qui ont été à l'origine de l'actuelle cytogénétique structurale et moléculaire. On fait aussi allusion à quelques aspects moléculaires implicites dans ces méthodologies afin de contribuer à expliquer de divers aspects des structures chromosomiques révélés par ces méthodes. On fait la description des procédés analytiques développés dans notre laboratoire pour l'étude de noyaux et de chromosomes ainsi que les résultats obtenus sur l'analyse quantitative de la région subtelomérique et son rapport avec les aberrations cryptiques repérées dans le segment chromosomique qui sont la cause de retard mental et de malformations congénitales. Finalement, on fait un bref descriptif sur les applications des bandes chromosomiques dans le projet du génome humain et sa possible utilité dans des expériments de synthèse artificielle de noyaux eucaryotes, de grande importance en biologie.
Bibliografía
1. Tjio JH, Levan A. The chromosome number in man. Hereditas 1956; 42:1-6.
2. Seguin E. Le traitement moral, l'hygiène et l'éducation des idiots. Paris: Baillière, JB, 1846: 1.
3. Langdon-Down JH. Observations on an ethnic classification of idiots. Clinical Lectures and Reports. London Hosp 1866; 3: 259-62.
4. Waardenburg PJ. Mongolismus. In: Das Menschliche Auge und seine Erhanlagen. La Haya: Nijhoff, 1932: 44-8.
5. Turpin R, Caratzali A, Rogier H. Étude étiologique de 104 cas de mongolisme et considérations sur la pathogénie de cette maladie. Congrès de la Federation Internationale Latine des Sociétés d'Eugénique, 1. Paris: Masson, 1937: 154-64.
6. Turpin R. L'hérédité des prédispositions morbides. Paris: Gallimard, 1951; p. 261.
7. Drets Me, Navarro A, Ravera J, Muxi J, Touya F. Estudio del cariotipo en algunas disgenesias gonadales. Ann Fac Med (Montevideo), 1964; 49: 411-6.
8. Lejeune J. Leçon Inaugurale par le Professeur Jérôme Lejeune. Chaire de Génétique Fondamentale. Faculté de Médecine de Paris. Sem Hopit 1965; 22: 1339-46.
9. Lejeune J, Gauthier M, Turpin R. Les chromosomes humains en culture de tissus. CR Acad Sci (Paris) 1959; 248: 602-3.
10. Lejeune J. Les chromosomes humains. Paris: Gauthier-Villars, 1965: 535.
11. Lejeune J. The study of gross chromosomal abnormalities. In: Krooth RS, ed. Somatics Cell Genetics Macy Conference of Genetics, 4. Ann Arbor: University Michigan Press, 1964: 1-10.
12. Patau K. The identification of individual chromosomes, especially in man. Am J Hum Genet 1960; 12: 250-76.
13. Patau K. Chromosome identification and the Denver report. Lancet 1961; I: 933-4.
14. Patau K. Polémica pública sobre la presentación de Lejeune J. "The study of gross chromosomal abnormalities". In: Krooth RS, ed. Somatics Cell Genetics Macy Conference of Genetics, 4. Ann Arbor: University Michigan Press, 1964: 11-122.
15. Patau K. Identification of chromosomes. In: Yunis JJ, ed. Human chromosome methodology. New York: Academic Press, 1965: 155-86.
16. Lejeune J, Gauthier M, Turpin R. Étude des chromosomes somatiques de neuf enfants mongoliens. CR Acad Sci (Paris) 1959; 248: 1721-2.
17. Lejeune J, Turpin R, Gauthier M. Le mongolisme, premier exemple d'aberration autosomique humaine. Sem Hopit 1959; 2: 41-9.
18. Ramón-Guerra AU, Drets ME. Recuento cromosómico en un caso de mongolismo y en un mongólico con anemia aplásica. Arch Pediatr Uruguay. 1962; 33: 224-30.
19. Drets ME, Cardoso H. Karyotyping in class. Lancet 1968; 1:1376.
20. Caspersson T, Farber S, Foley GE, Kudynowski J, Modest Ej, Simonsson E, et al. Chemical differentiation along metaphase chromosomes. Exp Cell Res 1968; 49: 219-22.
21. Caspersson T, Zech L, Johansson C. Differential binding of alkylating fluorochromes in human chromosomes. Exp Cell Res 1970; 60: 315-9.
22. Caspersson T, Lomakka G, Zech L. The 24 fluorescent patterns of the human metaphase chromosomes - distinguishing characters and variability. Hereditas 1971; 67: 89-102.
23. Weisblum B, De Haseth Pl. Quinacrine, chromosome stain specific for deoxyadenylate-deoxythymidylate-rich regions in DNA. Proc Natl Acad Sci USA 1972; 69: 629-32.
24. Pardue ML, Gall JG. Chromosomal localization of mouse satellite DNA. Science 1970; 168: 1356-8.
25. Arrighi FE, Hsu TC. Localization of heterochromatin in human chromosomes. Cytogenetics 1971; 10: 81-6.
26. Craig-Holmes AP, Moore FB, Shaw MW. Polymorphism of human C-band heterochromatin. I. Frequency of variants. Amer J Hum Genet 1973; 25: 181-92.
27. Stern C. Principles of Human Genetics. San Francisco: Freeman, Principios de Genética Humana. (Traducción: Drets, ME). Buenos Aires: El Ateneo, 1963: 1-830.
28. Drets ME. Methods of improvement of human chromosome morphology. Quaterly Research Report of Section of Medical Genetics. Houston: MD Anderson Hospital and Tumor Institute 1970: 9-10.
29. Drets ME. Specific Banding Patterns of Human Chromosomes Quaterly Research Report of Section of Medical Genetics. Houston: MD Anderson Hospital and Tumor Institute 1971a: 1.
30. Drets ME. Specific Banding Patterns of Human Chromosomes Quaterly Research Report of Section of Medical Genetics. Houston: MD Anderson Hospital and Tumor Institute 1971b:1-8.
31. Drets ME, Shaw MW. Specific banding patterns of human chromosomes. Proc Natl Acad Sci, USA, 1971: 68, 9: 2073-7.
32. Paris Conference. Standardization in human cytogenetics. Cytogenetics 1971; 11: 313-62.
33. Dutrillaux B, Lejeune J. Sur une nouvelle technique d'analyse du caryotype humain. Compt Rend Acad Sci Paris 1971; 272: 2638-40.
34. Seabright M. Rapid banding technique for human chromosomes. Lancet 1971; 2: 971.
35. Dutrillaux B. Nouveau système de marquage chromosomique: les bandes T. Chromosoma 1973; 41: 395-402.
36. Therman E, Susman, M. Human Chromosomes Structure, Behavior and Effects. Berlín:Springer, 3rd. ed. 1993: 1-376; Cromosomas Humanos. Estructura, Comportamiento y Efectos. Brasil: Soc Bras Gen, ed. (Traducción: Drets, ME) 1996: 1-383.
37. Blackburn EH, Gall JG. A tandemly repeated sequence at the termini of the extrachromosomal ribosomal RNA genes in Tetrahymena. J Mol Biol 1978; 120: 33-53.
38. Holmquist Gp. Chromosome bands, their chromatin flavors and their functional features. Am Hum Genet 1992; 51:17-37.
39. Denver Report. A proposed standard system of nomenclature of human mitotic chromosomes. J Hered 1960; 51: 221-41.
40. London Conference. The normal human karyotype. Cytogenetics 1963; 2: 264-8.
41. Chicago Conference. Standardization in human cytogenetics. Birth Defects, Original Article Series, New York: The National Foundation, March of Dimes, 1966; 2: 2.
42. Yunis JJ. High resolution of human chromosomes. Science 1976; 191: 1268-70.
43. ISCN An International System for Human Cytogenetic Nomenclature. High resolution banding. Cytogenet Cell Genet 1978; 21: 309-404.
44. ISCN An International System for Human Cytogenetic Nomenclature. In: Harnden DG, Klinger, HP eds. Report of the Standing Committee on Human Cytogenetic Nomenclature. Basel: Karger, 1981: 117.
45. Drets ME. Human Chromosome Band Mapping. Lancet 1975; 1035.
46. Drets ME, Seuanez H. Quantitation of heterogeneous human heterochromatin microdensitometric analysis of C- and G-bands. In: Coutinho EM, Fuchs F, eds. Physiology and Genetics of Reproduction. Part A, New York: Plenum, 1973: 29-52.
47. Drets ME, Bandscan - A computer program for on-line linear scanning of human banded chromosomes. Comp Progr Biomed 1978; 8: 283-94.
48. Drets ME, Monteverde FJ. Automated cytogenetics with modern computerized scanning microscope photometer systems. In: Obe G, Basler A, eds. Cytogenetics: basic and applied aspects. Berlin: Springer, 1987: 48-64.
49. Drets ME, Folle GA, Monteverde FJ. Quantitative detection of chromosome structures by computerized microphotometer scanning. In: Obe G, Natarajan AT, eds. Chromosomal aberrations: basic and applied aspects. Berlin: Springer, 1989: 1-12.
50. Drets ME, Folle GA, Martínez W, Bonomi R, Duarte JE, Mechoso BH, et al. Quantitative localization of chromatid breaks induced by Alu I in the long arms of chromosome number 1 of Chinese hamster ovary (CHO) cells by microphotometric scanning. In: Obe G, Natarajan AT eds. Chromosome Aberrations, Origin and Significance. Berlin: Springer, 1994; 169-83.
51. Martínez-López W, Bonomi R, Folle GA, Drets ME. Microphotometric scanning of chromatid gaps and breaks induced by AluI y BamHI in Chinese hamster ovary cells. Braz Jour Genet 1996; 19: 577-82.
52. Drets ME, Drets GA, Queirolo PJ, Monteverde FJ. Computer graphics as a tool in cytogenetic research and education. Comp Appl Biosci, CABIOS First Byte. 1995; 11: 463-68.
53. Meyne J, Ratliff RL, Moyzis RK. Conservation of the human telomere sequence (TTAGGG)n among vertebrates. Proc Natl Acad Sci USA 1989; 89: 7049-53.
54. Allen TD, Jack EM, Harrison CJ. The three dimensional structure of human metaphase chromosomes determined by scanning electron microscopy, in: KW Adolph ed. Chromosomes and Chromatin. Florida: CRC Press Inc, 1988; 51-72.
55. Ludeña P, Sentis C, De Cabo F, Velázquez M, Fernández-Piqueras J. Visualization of R-bands in human metaphase chromosomes by the restriction endonuclease MseI. Cytogenet Cell Genet 1991; 57: 82-6.
56. Zakian VA. Structure and function of telomeres. Ann Rev Genet 1989; 23: 579-604.
57. Blackburn EH, Greider CW. Telomeres. Monograph 29. Cold Spring Harbor Lab Press. 1995: 1-396.
58. Conforth MN, Eberle RL. Termini of human chromosomes display elevated rates of mitotic recombination. Mutagenesis 2001; 16: 85-9.
59. Riethman Hc, Xiang Z, Paul S, Morse E, Hu X-L, Flint J, et al. Integration of telomere sequences with the draft human genome sequence. Nature 2001; 409: 948-50.
60. Drets ME, Obe G, Monteverde FJ, Folle GA, Medina II, De Galvez MG, et al. Computerized graphic and light microscope analyses of T-banded chromosome segments of Chinese hamster ovary cells and human lymphocytes. Biol Zentbl 1992a; 111: 204-14.
61. Drets Me, Obe G, Folle Ga, Medina Ii, De Gálvez Gm, Duarte Je, et al. Appearance of "holes" in sub-telomeric regions of human and Chinese hamster ovary cell chromosomes by prolonged incubation in T-banding buffer followed by Giemsa staining. Braz J Genet 1992b; 15: 927-33.
62. Drets Me, Mendizábal M. The underlying structure of the subtelomeric segments detected by microphotometrical scanning and graphic image analysis. Fundamental and Molecular Mechanisms of Mutagenesis. Mutat Res 1998; 404: 13-6.
63. Obe G, Pfeiffer P, Savage JRK, Johannes C, Goedecke W, Jeppesen P, et al. Chromosomal Aberrations: Formation, Identification and Distribution. Mutat Res 2002 (en prensa).
64. Drets ME. Insights into the structure of the subtelomeric chromosome segments. Genet and Mol Biol 2000; 23: 1087-93.
65. Schubert I. Telomeric polymorphism in Vicia faba. Biol Zentrabl 1992; 111: 164-8.
66. Chong L, Van Steensel B, Broccoli D, Erdjument-Bromage H, Hanish J, Tempst P, et al. A human telomeric protein. Science 1995; 270: 1663-7.
67. Korenberg JR, Rykowski MC. Human genome organization: Alu, Lines and the molecular structure of metaphase chromosome bands. Cell 1988; 53: 391-400.
68. Watson JD, Crick FHC. Molecular structure of nucleic acids: A structure for deoxyribose nucleic acid. Nature 1953; 171: 737-8.
69. Gurdon JB. Transplanted nuclei and cell differentiation. Scient Am 1968; 219: 24-35.
70. The Human Genome. The Sequence of the Human Genome. Science 2001; 291: 1304-51; Initial sequencing and analysis of the human genome. Nature 2001; 409: 860-921.
71. Wettstein R. Genoma y Medicina. FEMI 2001; XI, 24-31.
72. Wettstein R. El impacto del conocimiento genómico en la Medicina. Biotecnología, ética médica y derecho. Los nuevos dilemas. Responsabilidad médica para el tercer milenio. Colección "Medicina y Derecho" II 2001; 107-24.
73. Newport J. Nuclear reconstitution in vitro: stages of assembly around protein-free DNA. Cell 1987; 48: 205-17.
74. Newport J, Spann T. Disassembly of the nucleus in mitotic extracts: membrane vesicularization, lamin disassembly, and chromosome condensation are independent processes. Cell 1987; 48: 219-30.
75. van Deutekom JC, Bakker E, Lemmers RJ, van der Wielen MJR, Bik E, Hofker MH, et al. Evidence for subtelomeric exchange of 3.3 kb tandemly repeated units between chromosomes 4q35 and 10q26: implications for genetic counselling and etiology of FSHD1. Hum Mol Genet 1996; 5: 1997-2003.
76. Bartsch O, Hinkel GK, Petersen MB, Konig U, Bugge M, Mikkelsen M, et al. A large family with subtelomeric translocation t(18;21;(q23;q22.1; and molecular breakpoint in the Down syndrome critical region. Hum Genet 1997; 100: 669-75.
77. Doheny KF, Mcdermid HE, Harum K, Thomas GH, Raymond GV. Cryptic terminal rearrangements of chromosome 22q13.32 detected by FISH in two unrelated patients. J Med Genet 1997; 34: 640-4.
78. Wong ACC, Ning Y, Flint J, Clark K, Dumanski JP, Ledbetter DH, et al. Molecular characterization of a 130-kb terminal microdeletion at 22 q in a child with mild mental retardation. Am J Hum Genet 1997; 60: 113-20.
79. Horsley SW, Knight SJ, Nixon J, Huson S, Fitchett M, Boone RA, et al. Del(18p) shown to be a cryptic translocation using a multiprobe FISH assay for subtelomeric chromosome rearrangements. J Med Genet 1998; 35: 722-6.
80. Precht KS, Lese CM, Spiro RP, Huttenlocher PR, Johnston KM, Baker JC, et al. Two 22q telomere deletions serendipituosly detected by FISH. J Med Genet 1998; 35: 939-42.
81. Jenderny J, Poetsch M, Hoeltzenbein M, Friedrich U, Jauch A. Detection of a concomitant distal deletion in an inverted duplication of chromosome 3. Is there an overall mechanism for the origin of such duplications/deficiencies? Eur J Hum Genet 1998; 6: 439-44.
82. Reddy KS, Fugate JK. A half cryptic derivative der 18;t(5;18);pat identified by M-FISH and subtelomere probes: clinical findings and review of subtelomeric rearrangements. Clin Genet 1999; 56: 328-32.
83. Holinski-Feder E, Reyniers E, Uhrig S, Golla A, Wauters J, Kroisel P, et al. Familial mental retardation syndrome ATR-16 due to an inherited cryptic subtelomeric translocation, t(3;16)(q29;p13.3);. Am J Hum Genet 2000; 66: 16-25.
84. Lorda-Sánchez I, López-Pajares I, Roche MC, Sanz R, Rodríguez de Alba M, González-González MC, et al. Cryptic 6q subtelomeric deletion associated with a paracentric inversion in a mildly retarded child. Am J Med Genet 2000; 95: 336-8.
85. Brown J, Horsley SW, Jung C, Saracoglu K, Janssen B, Brough M, et al. Identification of a subtle t(16;19;(p13.3;p13.3) in an infant with multiple congenital abnormalities using a 12-colour multiplex FISH telomere assay, M-TEL. Eur J Hum Genet 2000; 8: 903-10.
86. Speleman F, Callens B, Logghe K, Van Roy N, Horsley Sw, Jauch A, et al. Subtelomeric familial translocation t(2;7;(q37;q35; leading to partial trisomy 7q35(r)qter: molecular cytogenetic analysis and clinical phenotype in two generations. Am J Med Genet 2000; 93: 349-54.
87. Warburton P, Mohammed S, Ogilvie CM. Detection of submicroscopic subtelomeric chromosome translocations: A new case study. Am J Med Genet 2000; 91: 51-5.
88. Kleefstra T, van de Zande G, Merkx G, Mieloo H, Hoovers Jm, Smeets D. Identification of an unbalanced cryptic translocation between the chromosomes 8 and 13 in two sisters with mild mental retardation accompanied by mild dysmorphic features. Eur J Hum Genet 2000; 8: 637-40.
89. De Vries BB, Lees M, Knight SJ, Regan R, Corney D, Flint J, et al. Submicroscopic 8pter deletion, mild mental retardation, and behavioral problems caused by a familial t(8;20)(p23;p13) Am J Med Genet 2001; 99: 314-9.
90. Schultz Ln, Schmidt P, Tabor A, Bryndorf T, Christesen B, Ludsteen C. Cryptic familial t11;18;(q25;q23) incidentally detected by interphase FISH. Clin Genet 2001; 59: 279-83.
91. Turpin R, Lejeune J. Les anomalies humaines congénitales par aberrations chromosomiques. Maandschr Kindergenees-kunde 1961; 29: 149-73.