INTRODUCCIÓN
La alteración del intercambio gaseoso pulmonar provocado por las apneas del sueño es una de sus consecuencias más relevantes. Los episodios de desaturación de oxígeno de la sangre arterial han sido reconocidos desde la descripción del trastorno 1,2 y se ha profundizado extensamente en su estudio 3,4.
El aumento de la presión parcial de anhídrido carbónico arterial (PaCO2), provoca repercusiones fisiopatológicas conocidas en el sistema de control ventilatorio, en la función cardíaca y circulatoria, en el sistema nervioso simpático y en la función renal 5. Sólo recientemente, desde que estuvo disponible su medición transcutánea (PtCO2), ha sido posible estudiar el aumento de la PCO2, sin interferir con el sueño, El registro continuo se obtiene con electrodos cutáneos sensibles al CO2 que difunde desde los capilares a través de la piel. Es posible estimar la PCO2 arterial, teniendo en cuenta que la PtCO2 no es igual a la arterial ni a la capilar, ya que el calentamiento de la piel incrementa el metabolismo celular y el intercambio gaseoso subepidérmico 6. La digitalización de la señal mejora los datos obtenidos y reduce los tiempos de reacción y respuesta. Las características de este método (estabilidad, deriva por calibración, exactitud y precisión) han sido estudiados 7 y su uso normatizado para los estudios del sueño 8.
Las apneas del sueño por obstrucción orofaríngea (AOS) producen un trastorno heterogéneo, por lo que se han propuesto distintos tipos clínicos y fisiológicos, ya que el mejor conocimiento de sus mecanismos de enfermedad puede mejorar la respuesta al tratamiento 9. El objetivo de este estudio es presentar los hallazgos polisomnográficos con registro simultáneo de PtCO2, en un grupo de pacientes estudiados por AOS, describiendo sus características, la prevalencia del aumento de PtCO2, su cuantificación, sus formas de presentación y su posible aporte a la clasificación de fenotipos.
MATERIAL y METODOS
Pacientes
Se analizaron los datos de 242 pacientes que consultaron consecutivamente en la Unidad de Sueño del Hospital de Clínicas entre abril de 2018 y diciembre de 2024 (con 2 años de interrupción debidos a la pandemia de SARS-CoV-2). Los datos fueron recogidos en una historia clínica electrónica diseñada para esta patología (www.evimed.net). Se seleccionaron pacientes con los siguientes criterios de inclusión: mayores de 18 años; diagnóstico clínico de AOS; índice de apneas+hipopneas por hora de sueño (IAH) igual o mayor a 5. Los criterios de exclusión fueron: evidencia de enfermedad pulmonar obstructiva crónica; enfermedad neuromuscular o de la caja torácica. Clínicamente se tuvo especial cuidado en excluir a los pacientes con enfermedad metabólica descompensada, enfermedad cardíaca descompensada y en tratamiento con fármacos depresores del sistema nervioso central.
El protocolo fue aprobado por el Comité de Ética del Hospital de Clínicas. Se obtuvo consentimiento informado en todos los pacientes.
Medidas
Se realizó polisomnografía (PSG) completa atendida por técnico, que incluyó registro simultáneo de: video con luz infrarroja, posición corporal, electroencefalograma, electrooculograma, electromiograma mentoniano y de miembros, micrófono en el cuello, electrocardiograma, flujo aéreo nasal y bucal (termistor), flujo nasal (presión), movimientos respiratorios abdominales y torácicos (sensor piezoeléctrico), saturación de oxígeno del pulso (SpO2) con polígrafos ATI Delphos y Nihon Kodhen Neuoworkbench 04-32. La PtCO2 se registró con monitor SenTec Ag Digital Monitoring System, Therwil, Switzerland con V-STATS 4.01 software. El sensor fue colocado en región frontal de cara. Se utilizaron los valores de PtCO2 corregidos por deriva 10. La estadificación del sueño se realizó en forma manual mediante lectura del registro diferida, siguiendo criterios estandarizados de Rechtschaffen y Kales y la estadificación según el manual de la AASM 8.
La PtCO2 se registró en decúbito dorsal, en vigilia y durante el sueño. El valor en vigilia se determinó con el promedio de valores durante la vigilia previa al comienzo del sueño. Se cuantificaron los valores de: PtCO2 media (promedio en decúbito durante el tiempo total de registro); PtCO2 máxima (pico de PtCO2) y ∆PtCO2 (máxima -vigilia). Los períodos de aumento de PtCO2 se expresaron como porcentaje de tiempo acumulado con PtCO2 igual o mayor a 48mmHg, (TA48); PtCO2 igual o mayor a 50mmHg (TA50) y PtCO2 igual o mayor a 55mmHg (TA55). Se cuantificó la disminución de oxigenación tisular como: porcentaje de tiempo acumulado con SpO2 menor de 90% (TA90%) y por los episodios de desaturación de corta duración (segundos) ≥3% al valor pre-evento, cuantificados como índice de desaturaciones por hora (IDO).
Fue posible obtener gases en sangre arterial en 159 pacientes, en un día previo a la PSG, en vigilia, en posición sentada, respirando al aire. Se analizaron: pH, bicarbonato (HCO3¯), presión parcial de CO2 (PaCO2) y de O2 (PaO2) (ABL330, Radiometer). Se realizó espirometría a los pacientes que presentaron hipercapnia en vigilia, excluyendo del análisis a los que mostraron limitación del flujo espiratorio (Carefusion Vmax Encore y EasyOne® Air).
Análisis de datos
Los pacientes fueron divididos en las siguientes categorías, según los datos PaCO2 en vigilia y de de PtCO2 y en vigilia: normocapnia (PCO2 <45 mmHg) o hipercapnia (PCO2 ≥ 45mmHg). Estas categorías fueron a su vez subdivididas según si el tiempo acumulado con PtCO2 ≥ 48mhg, fuera menor o mayor a 20% del registro (Tabla 1).
Tabla 1: Criterios de categorización de los pacientes.
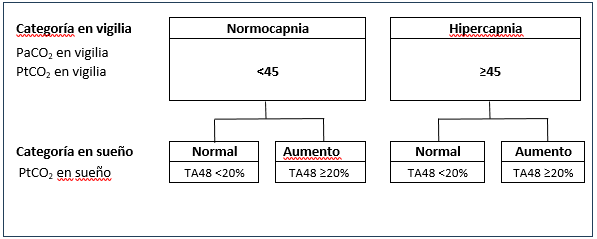
PtCO2: presión parcial transcutánea de anhídrido carbónico (mmHg). TA48<20%: tiempo acumulado con PtCO2 igual o mayor a 48mmHg, durante menos del 20% del registro. TA48≥20%: tiempo acumulado con PtCO2 igual o mayor a 48mmHg, durante más del 20% del registro.
Los datos cuantitativos se expresan en media ± desvío estándar. Los datos cualitativos se expresan en frecuencia absoluta y porcentaje. Se evaluó la distribución normal de las variables cuantitativas con test de Kolmogorov Smirnov (estadístico D). Se realizó el análisis estadístico de los datos con test de t, análisis de varianza, chi cuadrado y test de correlación-regresión lineal, utilizando Jamovi Software. Se aceptó como significativo un valor de P <0.05.
RESULTADOS
Datos de vigilia
Las características demográficas y los resultados en vigilia se observan en la Tabla 2.
Tabla 2: Datos demográficos y resultados en vigilia.
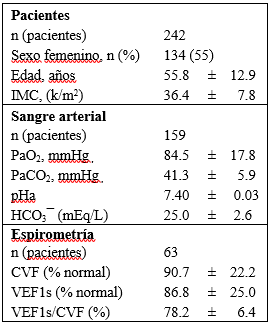
IMC: índice de masa corporal (k/talla2); n: número de pacientes. PaO2: presión parcial de oxígeno en sangre arterial (mmHg). PaCO2: presión parcial de anhídrido carbónico en sangre arterial (mmHg). HCO3¯: bicarbonato plasmático (miliequivalentes por litro). CVF: Capacidad vital forzada (% del normal). VEF1s: Volumen espirado en el primer segundo % del normal. Valores expresados en media ± desvío estándar.
El sexo femenino predominó en la muestra (55%). El índice de masa corporal (IMC, k/m2) promedio fue de 36.4 ± 7.8. Su distribución mostró a 126 pacientes (52%) con valor entre 30 y 40, y a 69 (29%) con valor mayor de 40.
La PaCO2 media de 159 pacientes, (41.3 ± 5.9mmHg) (K-S D = 0.0871), fue similar a la PtCO2 media en vigilia (41.9 ± 4.9mmHg) (K-S D = 0.052), sin diferencias significativas (p = 0.16).
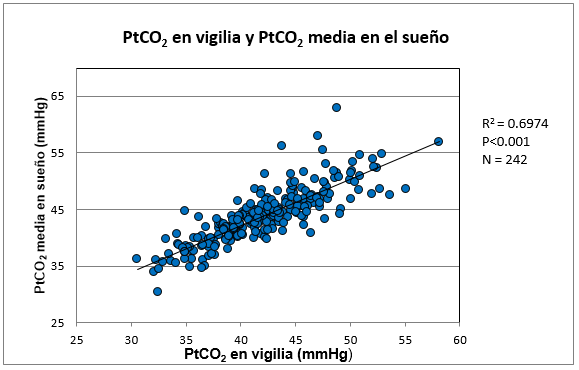
La PtCO2 media de vigilia de los 242 pacientes (42.9 ± 4.9) (K-S D = 0.053) mostró una correlación lineal significativa con la PtCO2 media en el sueño (r2 = 0.6974, p<0.001) (K-S D = 0.065) (Fig. 1).
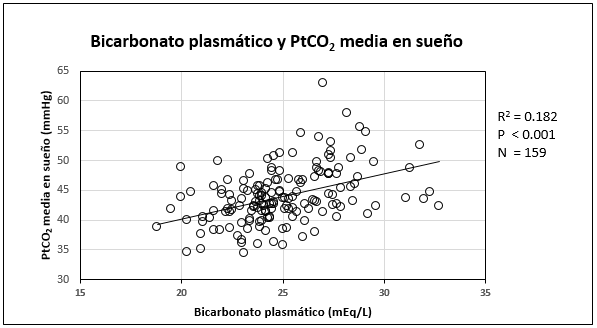
El valor medio de HCO3¯ arterial fue de 25.0 ± 2.6 mEq/L (K-S D = 0.086) y su distribución mostró valores ≥ 27 mEq/L en 35 pacientes (22.7%). El bicarbonato plasmático se correlacionó con la PtCO2 media durante el sueño, en forma lineal positiva moderada, significativa (r2: 0.1821, p <0.001) (Fig. 2).
El pH arterial promedio fue = 7.40 ± 0.03. La presión parcial de oxígeno arterial (PaO2, mmHg) media = 84.5 ± 17.8, fue normal para la calculada por la edad 11. Las espirometrías de los pacientes con hipercapnia en vigilia mostraron Capacidad Vital Forzada (CVF, % del normal) = 90.7 ± 22.2; Volumen espirado en el primer segundo (VEF1s, % del normal) = 86.8 ± 25.0; VEF1s/CVF (%) = 78.2 ± 6.4
Registro de PtCO2
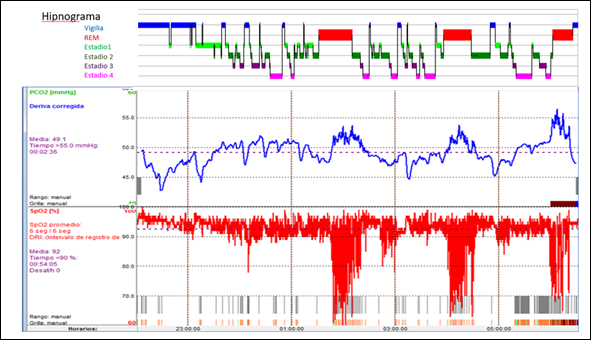
Los aumentos de PtCO2 se observaron en distintos estadios del sueño, con duración heterogénea. Mediante la observación de los registros en correlación con los hipnogramas, pudieron observarse:
a) incrementos significativos durante el sueño REM, coincidentes con los episodios de hipoxia-reoxigenación de las apneas e hipopneas;
b) incrementos progresivos significativos, independientes de los episodios de apneas y del estadio del sueño;
c) incrementos coincidentes con estadios del sueño 3 y 4, de menor entidad (Fig. 3).
Panel Superior: hipnograma. Vigilia y estadios de sueño S1, S2, S3, S4 y REM indicados por bandas de colores. Panel medio: registro de PtCO2. Se observa aumento lento y progresivo de PtCO2 durante estadios de sueño 3 y 4. Los valores máximos de PtCO2 son simultáneos a los episodios de hipoxia-reoxigenación inducidos por apneas, durante sueño REM. PtCO2 máx = 56mmHg. TA48≥20% = 68%; TA50≥20% = 37%. Panel inferior: registro de SpO2.
Polisomnografía y PtCO2
Los promedios de los datos de PSG fueron: Tiempo Total de Sueño = 355 ± 93 min; Eficiencia del sueño = 70.1 ± 18.9; Microdespertares por hora = 44.6 ± 24.5; Sueño NoREM = 85.4 ± 12.8%; Sueño REM = 14.0 ± 7.9%. El grado de severidad del AOS medido por IAH, resultó en promedio severo = 44.1 ± 28.5. La severidad de la hipoxia durante el sueño resultó moderada, medida por TA90% = 18.6 ± 33.6 y por IDO = 26.5 ± 25.4.
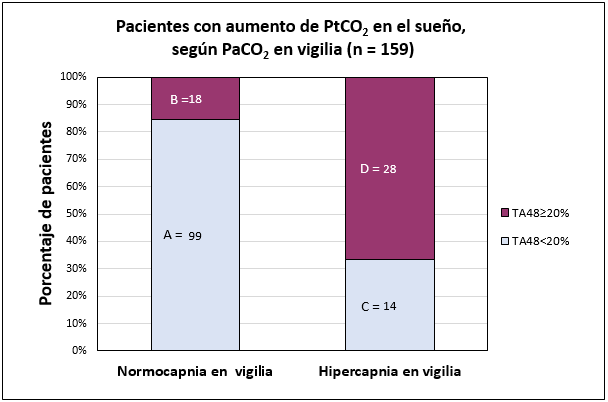
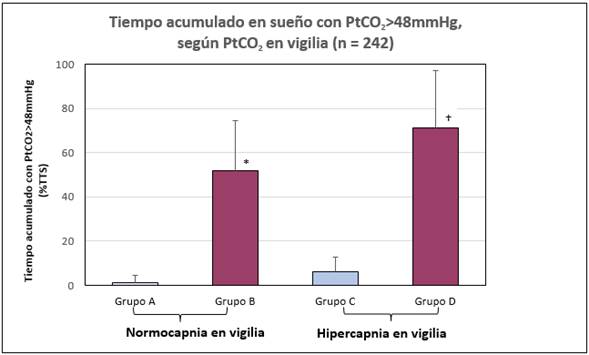
Los datos de los pacientes según PaCO2 de vigilia se muestran en la Figura 4. El aumento de PtCO2 durante el sueño, medido por TA48 se observó en 46 (Grupo B+D, 28.9%) de 159 pacientes. Estuvo presente en 28 (Grupo D, 66.7%,) de 46 pacientes con hipercapnia en vigilia (Grupo D+C). Sólo se presentó en 18 (Grupo B, 15.4%,) de 117 pacientes con normocapnia en vigilia (Grupo A+B) (x2 = 39.53, p<0.0001).
Porcentaje de pacientes y PtCO2 durante el sueño. Barras oscuras: TA48≥20%. Barras claras: TA48<20%. El aumento se observó en 28 (Grupo D, 66.79%,) de 42 pacientes (Grupo D+C) con hipercapnia en vigilia. Sólo estuvo presente en 18 (Grupo B, 15.4%,) de 117 pacientes (Grupo A+B) con normocapnia en vigilia (x2= 39.53, p<0.0001).
Los datos de los pacientes divididos en categorías según su PtCO2 en vigilia y según el comportamiento de PtCO2 durante el sueño se muestran en la Tabla 3.
Tabla 3: Datos polisomnográficos según categorías de pacientes.
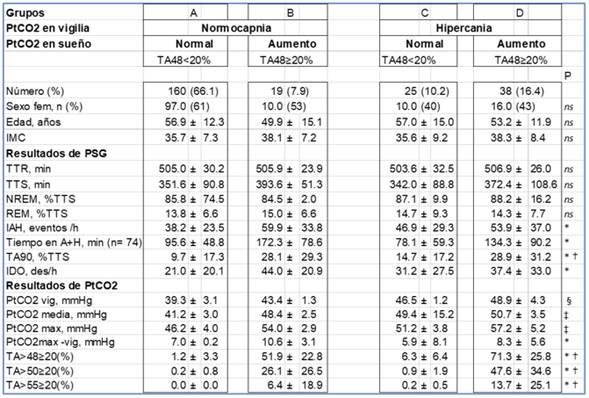
IMC: índice de masa corporal k/m2. TTR: tiempo total de registro. TTS: tiempo total de sueño. NREM: estadios de sueño superficial S1, S2 y N3 (en porcentaje de TTS). REM: Estadio de sueño REM. IAH: índice de apneas+hipopneas por hora de sueño. Tiempo en A+H: minutos en apneas e hipopneas. TA90: tiempo acumulado con SpO <90%. IDO: episodios de desaturación de O2≥3% por hora. PtCO2: presión transcutánea de anhídrido carbónico. vig: en vigilia. máx: máxima. TA48≥20%: porcentaje del tiempo de registro con PtCO2 igual o mayor a 48 mmHg; idem para 50 y 55 mmHg. *: p<0.005 para la comparación entre grupos A y B. ✝: p<0.05 para la comparación entre grupos C y D. §: p<0.05 para la comparación entre grupos A, B, C y D. ‡: p<0.05 para la comparación entre grupos A, B, y D. Valores expresados en media ± desvío estándar.
El aumento de PtCO2 durante el sueño, medido por TA48≥20%, se observó en 57 (Grupos B+D, 23.6%) de 242 pacientes. Se observó el aumento en 38 (Grupo D, 60.3%) de 63 pacientes con hipercapnia en vigilia (Grupo C+D). Sólo se encontró en 19 (Grupo B, 11.9%) de 179 (Grupos A+B) pacientes con normocapnia en vigilia (x2 =63.93 p<0.0001).
El TA48 fue mayor en fue mayor en el grupo B que en el A (51.9 ± 22.8% vs. 1.2 ± 3.3%) y en el grupo D (71.34 ± 25.8% vs. 6.32 ± 6.41%) que en el grupo C (P <0.05) (Figura 5).
En 41 pacientes (16.9%) se observó TA50≥20% y en 10 pacientes (4.1%) se observó TA55≥20%.
La PtCO2 media y máxima fueron mayores cuando se comparó el grupo B y D vs A. La diferencia entre la PtCO2 máxima y la de vigilia fue mayor en el grupo B vs A. El tiempo en apnea+hipopnea se encontró significativamente aumentado en el grupo B vs A. El tiempo en hipoxia medido por TA90% fue significativamente mayor en los grupos con aumento B vs A y D vs C. El IDO fue mayor en grupo B vs A.
DISCUSION
Características de la muestra
Este estudio se realizó en una muestra de pacientes consecutivos, que resultó con características similares a las previamente descritas para pacientes que consultan por AOS en la Unidad del Sueño de nuestro hospital 12. El predominio de sexo femenino es común en la población que se asiste en nuestro hospital, probablemente por menor vínculo formal con el sistema de previsión social y difiere de otros estudios publicados 13. La edad resultó la habitual para presentación del trastorno en la edad media de la vida, de la misma manera que la obesidad 14.
PCO2 en vigilia
La hipercapnia en vigilia de pacientes con AOS y sus factores asociados con ha sido revisada sistemáticamente 15, aunque no siempre se ha excluido la comorbilidad con enfermedad pulmonar obstructiva crónica. En nuestra muestra encontramos prevalencia de hipercapnia en vigilia considerable sin vinculación estadística con el IMC. Si bien el IMC ha sido clásicamente vinculado a la hipercapnia 16, es muy posible que otros índices antropométricos o imagenológicos de obesidad 17,18 puedan estar vinculados más específicamente. Otros estudios han encontrado una relación no linear entre el IMC y la hipercapnia de vigilia y durante el sueño 19. Existen además otros factores, distintos de la medición por IMC, que relacionan a la obesidad con la PCO2. Los depósitos de grasa pueden ser no homogéneos, afectando en distinto grado a la motilidad diafragmática, la distensibilidad pulmonar y la resistencia de la pequeña vía aérea 20. Los pacientes obesos pueden también presentar, en forma no homogénea, una respuesta disminuida a los estímulos químicos normales 21. La hipercapnia en vigilia y en sueño puede ser intermitente o sostenida, por lo que se ha propuesto clasificar a los pacientes obesos con bicarbonato ≥27 mEq/L, en el estadio II del síndrome de hipoventilación-obesidad 22. Sin embargo, la discriminación de pacientes con respuesta ventilatoria normal o anormal al CO2 persiste como un objetivo clínico aún no concluido 23.
Aumento de la PtCO2 durante el sueño
Durante el sueño normal, la sensibilidad y la respuesta ventilatoria al CO2 disminuyen durante el sueño lento y el sueño REM. El aumento del CO2 arterial y la acidosis leve, pueden ser fisiológicos. En los estudios publicados revisados, los pacientes con AOS presentan aumentos de PtCO2 variables según criterios de inclusión 24,25. No todos los pacientes lo desarrollan y esto puede explicarse porque el intervalo inter-apneas se acompaña de hiperventilación. Muchas veces se acompaña de despertar, que responde a la presión negativa pleural y en menor grado a la hipercapnia 21. Se han establecido límites arbitrarios para estadificar pacientes y para diagnosticar “hipoventilación” durante el sueño, basados en experiencias de expertos y en escasos estudios disponibles 8. Los niveles utilizados para esta definición han pasado por el mismo proceso que los límites que definen hipoxia significativa durante el sueño o el valor de PaO2 requerido para indicar oxigenoterapia en enfermedades pulmonares crónicas 26. Este proceso transcurre sucesivamente por experiencia de expertos, estudios retrospectivos y ensayos clínicos prospectivos, tras los cuales sus valores se modifican de acuerdo a la evidencia. Su uso por agencias regulatorias implica tanto datos científicos 27, como cuestiones éticas 28. Para este estudio hemos adoptado el término “aumento” de la PtCO2 durante el sueño, por considerarlo fisiológicamente más exacto que “hipoventilación” 29.
Los criterios para diagnosticar hipercapnia durante el sueño pueden estar basados en límites arbitrarios de PtCO2 media o máxima o basados en tiempo transcurrido con un valor elegido. La medida de la “carga de CO2”, similar a la “carga hipóxica” 4, parecería más adecuada, pero aún no está disponible clínicamente. El software utilizado permitió cuantificar los aumentos mayores a 48, 50 y 55 mmHg, así como el valor medio y máximo. Por el criterio basado en tiempo, (57 pacientes, 23.6%) mostró aumento de PtCO2 medido por TA48≥20%. La aplicación de los criterios más específicos, TA50≥20% (41 pacientes,16.9%) y TA55>20% (10 pacientes, 4.1%), reduce la sensibilidad diagnóstica e indica la severidad de trastorno. Para la interpretación clínica del registro de PtCO2 se ha propuesto la determinación de una línea de base (similar a la que en este estudio establecimos para determinar la PtCO2 de vigilia), para luego fijar los límites de 5 y 10 mmHg superiores a este valor 30.
Cualitativamente, la observación del registro de PtCO2 con la polisomnografía aporta otros datos. El aumento de PtCO2 durante el sueño REM, que se acompaña de desaturación de oxígeno, sin re-oxigenación a la SpO2 previa, puede indicar hipercapnia debida a disminución de la ventilación minuto 31.
Correlaciones
La PtCO2 en vigilia fue el factor predictor más importante vinculado al aumento de PtCO2 en el sueño. Si bien no fue posible obtener sangre arterial en todos los pacientes (como sucede habitualmente en la actividad clínica), la PaCO2 en vigilia fue similar a la PtCO2 de vigilia en 159 pacientes. La PtCO2 de vigilia mostró una correlación lineal significativa con la PtCO2 media en el sueño. Otros estudios han encontrado que la PaCO2 y la PtCO2 de vigilia en posición supina predicen el aumento de PtCO2 en el sueño en pacientes sin hipercapnia en vigilia 25. El bicarbonato plasmático, que puede estar vinculado a la hipercapnia permanente, se correlacionó con el aumento de PtCO2 media durante el sueño.
Los niveles de PaCO2, de IMC y de HCO3¯ han sido utilizados en la definición de síndrome de hipoventilación-obesidad, con límites arbitrarios. Los estudios realizados con PtCO2 son escasos, por lo que aún no hay certeza para incluir el registro de PtCO2 en la clasificación 32.
El tiempo transcurrido en apneas e hipopneas fue mayor en el grupo B vs A, indicando la posibilidad de su acción determinante en el aumento de PtCO2. La disponibilidad limitada del software de nuestros equipos hizo que esta muestra fuera reducida (n = 74), por lo que este dato deberá analizarse en el futuro para profundizar este aspecto, y debería incluirse en la recomendación de los manuales de estadificación 33.
Fenotipos
La propuesta de subclasificar a los pacientes con SAOS es un área de investigación reciente 9. Existen evidencias de agregación familiar y de síndromes hereditarios asociados, por lo que se buscan polimorfismos de nucleótido único que justifiquen esta asociación y permitan acercarse a un genotipo de la enfermedad 34.
Los “endotipos respiratorios” se han definido como características fisiopatológicas particulares 35 mediante las cuales se han descrito tres categorías de acuerdo a la presión de oclusión, al umbral de despertar, a la respuesta inadecuada de los músculos dilatadores de la vía aérea superior y a la ganancia de asa aumentada del sistema de control respiratorio 36. Algunas consecuencias fisiopatológicas de relevancia, como la pérdida de la reducción de la presión arterial durante el sueño, han sido menos estudiadas 37,38.
Los fenotipos se han definido para este trastorno como “categorías de pacientes con SAOS que se distinguen de otras por una característica única o una combinación de características de la enfermedad, en relación con un atributo clínicamente significativo” 39. De acuerdo a las características clínicas y hallazgos polisomnográficos, utilizando distintas metodologías estadísticas se han propuesto desde tres hasta a ocho fenotipos 31,40,41.
Si bien se han clasificado por grupos a los pacientes con AOS, de acuerdo su CO2 en vigilia 42 el aumento de CO2 en el sueño no se ha utilizado sistemáticamente para categorizar a los pacientes. Nuestra división en cuatro grupos (A, B, C y D) intenta pronosticar la ocurrencia de aumento de CO2 a partir de los datos en vigilia, anticipando la necesidad de utilizar el registro de PtCO2. No se contrapone, sino que es complementaria a la clasificación actualmente en uso de la hipoventilación de la obesidad en cinco estadios 22. Los pacientes de nuestros grupos C y D, con hipercapnia en vigilia, puede ubicarse en los estadios II y III (hipercapnia en vigilia y bicarbonato aumentado).
La respuesta terapéutica ha sido aún menos estudiada, por lo que el uso de presión positiva continua o de ventilación no invasiva deberá personalizarse de acuerdo a la hipercapnia durante el sueño 32. Es razonable anticipar que muchas de estas situaciones se corrigen con la eliminación de las apneas y que otras dependerán exclusivamente de ventilación inadecuada, que requiera apoyo ventilatorio.
Limitaciones
Algunas limitaciones de este estudio están vinculadas a la selección de la muestra, que no fue aleatoriamente elegida. La interrupción de la consulta debida a la pandemia de COVID y su reinstalación pueden haber sesgado la muestra. Por otra parte, los gases en sangre, el pH y el bicarbonato pudieron obtenerse solamente en 159 de 244 pacientes, lo cual debilita la correlación de datos.
El registro de la PtCO2 (Figura 3) sugiere que el comportamiento de esta variable es distinto según los estadios del sueño, con aumento más pronunciada durante el sueño REM. No ha sido posible cuantificar este aspecto, debido a que los softwares utilizados para la estadificación del sueño y para la cuantificación de PtCO2, pertenecieron a equipos distintos. Realizarlo en forma manual hubiera conducido a errores significativos.
Conclusiones
El aumento de PtCO2 durante el sueño en pacientes con SAOS resultó en un hecho fisiopatológico presente en 23.6 % de los pacientes estudiados. El valor de CO2 en vigilia resultó el factor predictor más importante. Su ocurrencia se produjo acompañando a los acúmulos de apneas e hipopneas, más frecuentemente con las de larga duración y durante el sueño profundo. La división de pacientes en grupos de acuerdo a los valores de vigilia y a su comportamiento durante el sueño, puede colaborar a describir fenotipos de este trastorno. Debido a lo significativo de los valores de aumento de PtCO2 encontrados, es posible que órganos y sistemas sufran consecuencias fisiopatológicamente vinculadas a la hipercapnia en forma directa, y que su corrección sea tan necesaria como la corrección de la hipoxia. El tratamiento de estos pacientes puede requerir estrategias individualizadas, así como la monitorización de su eficacia.