Introducción
En América del Sur, la producción de ovinos lanados se concentra en los países del Cono Sur (Argentina, Uruguay, Chile y sur de Brasil), siendo desarrolladas mayoritariamente en sistemas pastoriles extensivos a cielo abierto (Abella et al., 2010). La producción y la calidad del forraje tiene cambios estacionales y disminuye marcadamente en cantidad y calidad durante el invierno (Carámbula, 1991), lo que coincide con el periodo en que las ovejas están gestando. Es decir, en el periodo en que aumentan los requerimientos de la oveja, normalmente la pastura disponible no es suficiente para cubrirlos si no se ofrece algún tipo de suplemento nutricional (Freitas-de-Melo et al., 2018; Sales et al., 2020). En estos sistemas, la mortalidad de corderos alcanza hasta el 30 % anual (Francolino, 2018; Montossi et al., 2013), la mayor parte de las muertes ocurren en los tres primeros días de vida (Mari, 1979). Si bien no existe información sistematizada actualizada, las principales causas de mortalidad temprana de los corderos son el síndrome de inanición-exposición al clima, los ataques de predadores y el abandono de corderos (Mari, 1979), al igual que ocurre en el sur de Brasil (Hancock et al., 1996).
El ovino es una especie social y precocial, que normalmente tiene 1-2 crías capaces de ver, oír, ponerse en pie y seguir a la madre momentos después de nacidos. Antes de ingerir calostro, los corderos deben generar energía para mantener sus funciones fisiológicas, lo que incluye realizar sus primeros movimientos para buscar la ubre, seguir a su madre e ingerir calostro. Esto lo realizan principalmente a partir de la oxidación de la glucosa, proveniente de las reservas de glucógeno hepático y muscular, acumuladas durante la gestación, y de la gluconeogénesis (Bienboire-Frosini et al., 2023). La homeostasis de la glucemia en el neonato depende esencialmente de la activación de la glucogenólisis y de la gluconeogénesis hepática, así como de la ingestión de glúcidos a través de la dieta (Girard et al., 1992). La capacidad de regular la glucemia es importante para los neonatos, ya que hay tejidos que oxidan exclusivamente glucosa para poder generar energía y, por tanto, deben recibirla en forma continua, como el caso de los eritrocitos (Donkin y Hammon, 2005). Además, el neonato también debe tener cantidades adecuadas de grasa parda, principal vía para generar calor metabólico y evitar la hipotermia, como se explicará más adelante.
En general, en Uruguay las ovejas paren a fines de invierno o inicio de la primavera, cuando las temperaturas ambientales pueden llegar a promedios mínimos de 4,5 °C (Instituto Uruguayo de Meteorología (Inumet, 2022) o incluso menos, con la presencia frecuente de vientos o precipitaciones. La temperatura rectal del neonato es igual o mayor que la de su madre, alrededor de 39 °C, pero a los 15 min ya descendió 1-2 °C (Nowak y Poindron, 2006), para llegar rápidamente hasta 32 °C (Alexander y McCance, 1958). Por tanto, los neonatos deben activar de inmediato mecanismos que disminuyan la transferencia de calor para el ambiente y aumentar la producción de calor metabólico.
Luego del nacimiento, en el neonato se produce una importante respuesta autonómica simpática, lo que promueve la activación de la lipólisis y la consecuente producción de calor a partir de la degradación de la grasa parda, principal vía por la que los neonatos aumentan su tasa metabólica. Este tejido es responsable de aproximadamente el 50 % de la producción de calor en el cordero neonato (Gemmell et al., 1972), utilizando como principal fuente de energía la degradación de los ácidos grasos. En el neonato también se produce una importante vasoconstricción periférica, por estimulo del sistema simpático, que en asociación con el despliegue de comportamientos-por ejemplo, agrupamiento con otros animales y búsqueda de refugio- (Fonsêca et al., 2022; Mota-Rojas et al., 2021) permiten disminuir la pérdida de calor al ambiente. En resumen, el neonato debe contar con cantidades adecuadas de glucógeno muscular y hepático y de grasa parda, que, junto con la capacidad de activar la gluconeogénesis y la lipólisis, sean capaces de generar energía suficiente para mantener sus funciones fisiológicas y celulares sin caer en hipotermia.
El estatus metabólico de las ovejas durante la gestación es determinante de la cantidad de energía que el feto pueda haber almacenado en forma de glucógeno y de grasa parda. Los desbalances energéticos de las ovejas gestantes, situación frecuente en los sistemas de producción ovina extensivos de Uruguay (Freitas-de-Melo et al., 2018), impactan en el desarrollo fetal (Abud et al., 2020), determinando que los corderos nazcan más chicos, tengan una menor cantidad de grasa parda y vitalidad (Budge et al., 2004; Dwyer et al., 2003; Freitas-de-Melo et al., 2015). Además, las ovejas subnutridas tienen menor motivación maternal hacia su cría al parto (Freitas-de-Melo et al., 2015; 2018), menor volumen de la ubre y menor producción de calostro (Freitas-de-Melo et al., 2018; O’Doherty y Crosby, 1996), todo lo que, finalmente, aumenta la frecuencia de abandono de corderos y las muertes por inanición y exposición al frío (Dwyer, 2008). Una de las principales estrategias implementadas en los sistemas extensivos para modificar el estatus metabólico de las ovejas preñadas es la esquila invernal preparto.
En Uruguay, la esquila de ovejas gestantes se aplica principalmente en el tercio final de la gestación, coincidiendo con el periodo de crecimiento exponencial del feto. La exposición al frío durante los días siguientes a la esquila preparto genera una importante lipomovilización, disponiendo ácidos grasos como fuente de energía para las ovejas (Symonds et al., 1988; 1989). Además, previene la disminución de la concentración de la glucosa plasmática materna en las dos últimas semanas de gestación, ya que ocurre una disminución de la acción de la insulina en la mayoría de los tejidos (Symonds et al., 1986, 2011). Por tanto, esto permite que la glucosa sea utilizada principalmente por la unidad feto-placentaria, ya que esta captación es independiente de la insulina (Revella et al., 2000). Dado que la glucosa es el principal sustrato metabólico para el metabolismo y el crecimiento fetal (Hay, 1995), el aumento en el aporte de glucosa al feto promueve el almacenamiento de las reservas de glucógeno hepático y muscular (Symonds et al., 2011) y de grasa parda fetal (Stevens et al., 1990) y aumenta el peso de los corderos al nacimiento (Kenyon et al., 2002a). La esquila preparto también determina una mayor vitalidad de los neonatos, adelantando la primera ingestión de calostro (López-Mazz et al., 2017) y aumentando la tasa de supervivencia perinatal (Van der Merwe et al., 1993). Por tanto, los neonatos hijos de ovejas esquiladas durante el preparto nacen con características metabólicas y morfológicas que posibilitan una mayor capacidad para aumentar su tasa metabólica y así evitar muertes por hipotermia. Además, potencialmente, mejora el estatus metabólico de los neonatos y su capacidad de regular la glucemia, evitando muertes por inanición. El objetivo de esta revisión fue sintetizar y discutir información disponible sobre los cambios en el metabolismo energético de ovejas gestantes y sus crías recién nacidas y la influencia de la esquila preparto en el metabolismo energético y la termorregulación de ovejas gestantes y sus corderos neonatos.
Metabolismo energético en ovejas gestantes
El metabolismo energético del neonato está íntimamente relacionado con la cantidad de reservas energéticas almacenadas durante la gestación, principalmente en forma de glucógeno y de grasa parda, por lo que es necesario entender el desarrollo de estos tejidos en la vida fetal y los principales cambios metabólicos en ovejas gestantes que permiten la transferencia de nutrientes al feto promoviendo un desarrollo apropiado. La gestación de la oveja dura alrededor de 150 días (Zeleznik y Pohl, 2006) y puede ser dividida en diferentes etapas de acuerdo al desarrollo de las diferentes estructuras. Desde la concepción hasta aproximadamente el día 30 de gestación se ubica la fase de desarrollo embrionario (Spencer et al., 2017). Entre los días 30 y 90 de gestación ocurre el máximo desarrollo placentario (Mellor, 1983). El mayor crecimiento fetal se da entre los 100 y 150 días de gestación (Redmer et al., 2004) y el de la ubre luego de los 140 días de finalizada la etapa de mayor crecimiento de la placenta (Davis, 2017). Durante el tercio final de la gestación ocurre alrededor del 90 % del crecimiento en masa del feto, por lo que en este periodo aumentan los requerimientos energéticos de la madre (Redmer et al., 2004). Este crecimiento exponencial del feto genera cambios en el metabolismo energético de las ovejas gestantes, principalmente el aumento de la disponibilidad de glucosa en la sangre materna para ser dirigida a la unidad feto-placentaria. En rumiantes, la glucemia depende esencialmente de la gluconeogénesis, que es la principal vía de aporte de glucosa a la sangre. El principal precursor para la síntesis de nueva glucosa en los rumiantes es el propionato, ácido graso volátil producto de los procesos digestivos de la fermentación ruminal (Kozloski, 2017). Los mayores requerimientos energéticos de la oveja en el último tercio de la gestación deberían compensarse con un aumento en la ingesta de energía que permita cubrir el aumento de demanda que implica el desarrollo fetal (Koong et al., 1975). Sin embargo, al final de la gestación, ocurre una disminución en el consumo voluntario de forraje debido a la compresión del rumen por el útero (Forbes, 2007). Por ello, la oveja normalmente moviliza reservas corporales en forma de triacilglicéridos, aumentando las concentraciones de ácidos grasos no esterificados (AGNEs) (Rego et al., 2017) y de β-hidro-butirato en sangre (Araujo et al., 2014; Brito et al., 2006). Acompañado a eso, en condiciones de producción extensiva a campo natural, ocurre una reducción en la condición corporal de las ovejas al final de la gestación (Sales et al., 2020). Al mismo tiempo, se ha reportado que en las últimas semanas de la gestación se produce un aumento de la concentración de insulina (Santarosa et al., 2022) que se asocia, a su vez, con un aumento de la glucemia alrededor del momento del parto (Araujo et al., 2014; Rego et al., 2017; Santarosa et al., 2022), indicativo de una situación de resistencia a la insulina (Regnault et al., 2004).
Metabolismo energético en corderos neonatos
La tasa de mortandad de corderos neonatos se relaciona directamente con la hipoglucemia de estos (Alexander, 1984; Eales et al., 1982). Durante la vida intrauterina, el contenido de glucosa que llega a la placenta a través de la arteria uterina mantiene los niveles de glucosa fetal (Aldoretta y Hay, 1999), pero desde el nacimiento, los corderos deben regular su glucemia de manera independiente, ya que el acceso a la glucosa materna cesa abruptamente (Cowett y Farrag, 2004). Al nacimiento, se registra una disminución de la glucemia, asociada con concentraciones bajas de insulina y altas de glucagón, hormonas hipo e hiperglucemiantes, respectivamente (Girard et al., 1992). Antes de la ingestión de calostro, los recién nacidos dependen principalmente de las reservas de glucógeno y de la gluconeogénesis para mantener la glucemia o generar energía para mantener las funciones fisiológicas del organismo (Girard, 1990; Mota-Rojas et al., 2022). De hecho, en el feto ovino de 125 días de gestación ya están activas las enzimas hepáticas involucradas en la gluconeogénesis y en el metabolismo del glucógeno, permitiendo la regulación de la glucemia fetal en el caso de que se produzca una hipoglucemia materna (Kaneta et al., 1991; Lemons et al., 1986). En los corderos recién nacidos, la mayor cantidad de glucógeno está almacenada en la musculatura esquelética y en el hígado, conteniendo 9,6 y 1,5 g/kg, respectivamente (Mellor y Cockburn, 1986). Sin embargo, aunque el 90 % del glucógeno hepático puede ser movilizado durante el primer día de vida, solamente es posible movilizar el 60 % del glucógeno almacenado en los músculos (Mellor y Cockburn, 1986). A pesar de que hay un aporte directo de glucosa suministrada por la lactosa del calostro/leche, esta representa aproximadamente el 25 % de la utilizada por el neonato (Girard, 1986), por lo cual la glucogenólisis hepática y la gluconeogénesis son imprescindibles para mantener la homeostasis de la glucosa (Donkin y Hammon, 2005). Por lo tanto, el hígado asume un rol central en el metabolismo de los carbohidratos luego del parto, ya que debe movilizar glucógeno y activar la gluconeogénesis. Como se mencionó, el contenido de glucógeno hepático aumenta recién hacia el final de la gestación, al tiempo que aumenta la actividad de las enzimas gluconeogénicas (por ejemplo, la piruvato carboxilasa, la fosfoenolpiruvato quinasa y la glucosa-6 fosfatasa) y del metabolismo de glucógeno (Forhead et al., 2003; Fowden et al., 1993; Girard, 1990; Shelley, 1961), preparándose para sostener el aporte de glucosa a los tejidos a partir de dichas vías metabólicas. Los neonatos también presentan reservas de lípidos en forma de grasa blanca y parda, la primera es una reserva energética y la segunda esencialmente termogénica (Noble, 1981). Al parto, ocurre un aumento importante de la lipólisis en el neonato, principalmente si el parto ocurre en ambientes fríos, lo que genera un aumento marcado en las concentraciones de AGNEs en sangre (Vernon, 1981).
Depósitos de glucógeno, funcionalidad y desarrollo de la grasa parda en el feto y en el neonato
Al momento del parto, los corderos de peso normal tienen 60-70 % de la energía disponible en forma de grasa, alrededor de 15 % como glucógeno y el resto derivado del catabolismo proteico (Alexander, 1962). Como se mencionó antes, los depósitos de glucógeno y las reservas de grasa parda son sustratos para la generación de energía y de calor metabólico, por lo que son esenciales para el mantenimiento de los procesos celulares y fisiológicos.
Depósitos de glucógeno en el feto y en el neonato
El contenido de glucógeno hepático en el feto aumenta al final de la gestación, cuadruplica al día 144 las cantidades presentes hasta el día 130 (Forhead et al., 2009). Por el contrario, los mismos autores determinaron que la cantidad de glucógeno en los músculos esqueléticos aumenta entre los 100 y 115 días de gestación, y se mantiene estable hasta el final de la gestación, lo que no va en concordancia con reportes antiguos de que también existe un aumento de glucógeno muscular al final de la gestación (Shelley, 1961). Durante la mayor parte de la gestación, la glucosa que utiliza el feto proviene de la madre, llega a través de la placenta por difusión facilitada por gradiente de concentración (Battaglia y Meschia, 1978). La tasa de producción de glucosa fetal es insignificante hasta los 143-145 días de gestación si la madre recibe una alimentación normal. Posteriormente, aumenta recién en los últimos 2-3 días de la gestación y alcanza el 50 % de la glucosa utilizada por el feto (Fowden et al., 1998), asociado al aumento de cortisol que desencadena el parto. En los neonatos, incluso luego de la ingestión de calostro, hay una disminución rápida de la cantidad de glucógeno hepático, pudiendo alcanzar el 10 % o menos de su valor inicial en 2-3 h (Shelley, 1961).
Grasa parda como tejido especializado en la producción de calor
La grasa parda es un tejido especializado en la producción de calor, con características morfológicas y funcionales diferentes a las de la grasa blanca. La capacidad de producción de calor de la grasa parda es muy alta, puede llegar a producir 300 W/kg, frente a alrededor de 1 W/kg de la mayoría de los otros tejidos (Symonds et al., 2011). En el cordero, 80 % del depósito de grasa parda se encuentra en la región perirrenal, con cantidades menores encontradas en la región esternal-clavicular y en el pericardio (Bienboire-Frosini et al., 2023; Symonds et al., 2003) (figura 1). El color marrón de este tejido se debe a su alta vascularización y alto contenido de citocromo C (Hahn y Novak, 1975; Plush et al., 2016). Las células de la grasa parda son pequeñas, con un núcleo central, con gotitas de triacilglicéridos multiloculares (Alexander, 1978; Xu et al., 2020) (figura 1) y un alto grado de vascularización que permite recibir abundante aporte de oxígeno y redistribuir el calor producido hacia los demás tejidos. Los adipocitos de la grasa parda presentan abundantes mitocondrias con densas crestas, están situadas muy cerca de las gotitas de grasa, lo que posibilita su rápida oxidación (Hull, 1966). La grasa parda tiene una gran cantidad de proteínas debido a la presencia de los transportadores de electrones presentes en la cadena transportadora de electrones y de la proteína desacoplante (UCP-1 o termogenina) en la membrana mitocondrial interna (Cannon et al., 1977; Hahn y Novak, 1975). El UCP-1 es un transportador de protones que cortocircuita el gradiente de protones generado por la cadena respiratoria, desacoplando así la fosforilación oxidativa y la síntesis de ATP (Arechaga et al., 2001). Esto permite que se produzca y libere calor en lugar de que la energía se utilice para la síntesis de ATP (Plush et al., 2016).
Tanto la grasa parda como los vasos sanguíneos de su alrededor están inervados por nervios simpáticos, por lo que su termogénesis está controlada por el sistema nervioso simpático (Himms-Hagen, 1985), y siendo la termogénesis de la grasa parda muy sensible a la acción de la noradrenalina. La capacidad de generar calor de la grasa parda está directamente relacionada con la sensibilidad del tejido para responder a un aumento de noradrenalina, la cantidad de mitocondrias, de UCP-1 y de triacilglicéridos almacenados (Satterfield y Wu, 2011; Seron-Ferre et al., 2015). El frío es un estímulo para que el hipotálamo active el sistema simpático generando liberación de noradrenalina, la que se une a receptores β3-adrenérgicos (ADBR3) ubicados en la membrana plasmática del adipocito, activando la lipólisis y la acción de la UCP-1 (Cannon y Nedergaard, 2011). De lo contrario, la acción de la UCP-1 es bloqueada por los nucleótidos de purina citosólica (por ejemplo, el ATP, ADP y GTP) (Cannon y Nedergaard, 2011). El aumento de la lipólisis genera un aumento en las cantidades de ácidos grasos y glicerol en el citosol del adipocito (Nelson y Cox, 2022). Los ácidos grasos sufren un proceso de activación antes de ingresar en la matriz mitocondrial para ser oxidados. Las enzimas carnitina palmitoil-transferasa-1 y 2 median el ingreso del ácido graso activado a la matriz mitocondrial, la primera es un punto de regulación de la lipólisis (Nelson y Cox, 2022). Una vez ingresado en la matriz mitocondrial, los ácidos grasos son degradados a través de la β-oxidación, en una secuencia de reacciones que generan como productos finales acetil-CoA y coenzimas reducidas (NADH + H+ y FADH2). Esto estimula el flujo de electrones a través de la cadena de transporte de electrones y, por lo tanto, el bombeo de protones hacia el espacio intermembrana y el consumo de oxígeno mitocondrial, así como la producción de anhídrido carbónico celular (Nelson y Cox, 2022). A su vez, esto estimula el pasaje de protones hacia la matriz mitocondrial a través de la UCP-1 y, por lo tanto, la producción de calor (Cannon y Nedergaard, 2011). Por otro lado, la hormona T3 (triyodotironina) aumenta la abundancia (Heasman et al., 2000) y expresión de UCP-1 (McCoard et al., 2014) y también la actividad del citocromo C (Goglia et al., 1999). La noradrenalina también aumenta la abundancia de UCP-1, mientas que el cortisol y la prolactina estimulan su actividad (Budge et al., 2002; Symonds et al., 2000). En la figura 1 se presenta una síntesis de las vías de producción de calor a través de la grasa parda.
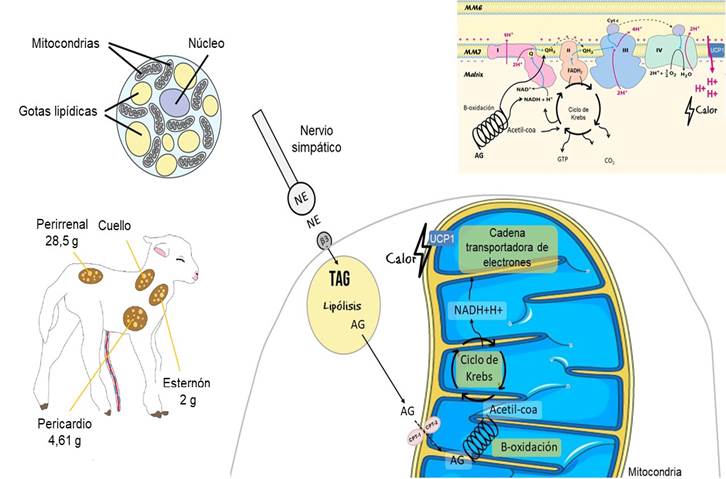
Figura 1: en el neonato. (A) Ubicación de las reservas de grasa parda en los corderos los primeros días de vida. (B1 y B2) Esquema de la morfología y funcionamiento de la grasa parda como tejido con función termogénica; (B2) Esquema que resume las principales etapas para la generación de calor en la grasa parda, incluyendo la activación del sistema simpático, liberación de noradrenalina y su unión al receptor β3-adrenérgico (ADBR3), activación de la lipólisis, oxidación de los ácidos grasos con posterior formación de acetil-coa y coenzimas reducidas, estimulo del flujo de electrones a través de la cadena de transporte de electrones y generación de calor a partir de la acción de la UCP-1. (C) Diferentes ingresos de electrones en la cadena transportadora de electrones, transferencia de electrones a través de esta, bombeo de protones hacia el espacio intermembranas y generación de calor a partir del reingreso de protones hacia la matriz mitocondrial a través de la proteína desacoplante (UCP-1) con concomitante generación de calor. Abreviaturas: Triacilglicéridos (TAG); ácidos grasos (AG); carnitina palmitoil-transferasa-1 y 2 (CPT-1 y CPT-2); Complejo I: NADH deshidrogenasa; Complejo II: succinato deshidrogenasa; Complejo III: Ubiquinona: citocromo c oxidorreductasa; Complejo IV: citocromo oxidasa; Coenzima Q (Q) y citocromo c (Cyt c). Imágenes tomadas y adaptadas de Bienboire-Frosini et al. (2023); Cannon y Nedergaard (2011) y Nelson y Cox (2022).
La acumulación de lípidos en el feto comienza antes del día 50 de gestación, el aumento de grasa parda es mayor luego del día 70, mientras que el crecimiento del tejido adiposo subcutáneo (grasa blanca) comienza 2-3 semanas después (Alexander, 1978). En los fetos ovinos comienza a detectarse la presencia de grasa parda perirrenal a los 70-80 días de gestación, y está caracterizada por una rápida multiplicación celular (Alexander, 1978; Pope et al., 2014). Los depósitos de grasa parda crecen a un ritmo más acelerado que el crecimiento fetal entre los 70 y 120 días de gestación (Alexander, 1978). Luego, hasta el parto, este crecimiento continúa a la misma tasa de crecimiento del feto, enlenteciéndose hacia el final de la gestación (Alexander, 1978). Por tanto, la cantidad de grasa parda es máxima cerca del parto (Symonds et al., 2003), y es el 80 % de la grasa del cordero neonato (Mostyn et al., 2004). La expresión de UCP-1 aumenta gradualmente junto con el aumento en el depósito de triacilglicéridos desde los 140 días de gestación hasta los primeros días de vida (Pope et al., 2014; Symonds et al., 2015). Durante el tercio final de la gestación, hay un aumento de la inervación simpática (Gemmell y Alexander, 1978) y de la densidad de los receptores ADBR3 (Casteilla et al., 1994) en la grasa parda. Estos cambios, en asociación con el aumento en las concentraciones de catecolaminas en plasma (Eliot et al., 1981), permiten estimular la expresión de la UCP-1. Durante la gestación tardía también aumentan las concentraciones de prolactina plasmática (Houghton et al., 1995) y la cantidad de receptores de prolactina en la grasa parda (Symonds et al., 1998), cambios que estimulan directamente una mayor expresión de UCP-1. El aumento de las hormonas tiroideas en plasma (Fraser y Liggins, 1989) y una mayor capacidad para convertir la T4 (tiroxina) en T3, vía un aumento en la expresión de la enzima 5´-monodeiodinasa (Clarke, Bryant et al., 1997), da lugar a un aumento de T3 dentro del adipocito que regula la expresión y la cantidad de UCP-1 (Heasman et al., 2000; Symonds et al., 2003). Durante el periodo perinatal, la expresión de UCP-1, así como la funcionalidad y el potencial termogénico de la grasa parda son reguladas por hormonas, como la noradrenalina, la T3, el cortisol, la prolactina y la leptina (Budge et al., 2002; Symonds et al., 2003, 2011). El aumento de catecolaminas y de T3 al parto son críticos para la activación máxima de la UCP-1 en el cordero recién nacido (Symonds et al., 2003).
El peso total de la grasa parda y su contenido de lípidos permanece inalterado durante los dos primeros días de vida, luego aumenta hasta al menos las dos primeras semanas de vida (Clarke, Buss et al., 1997), para luego disminuir hasta ser indistinguible del tejido adiposo blanco a las 4 semanas de vida (Mostyn et al., 2004). Los mismos autores reportaron que existe una relación positiva entre las concentraciones de IGF-1 y los contenidos de lípidos en la grasa parda desde las 24 h de vida hasta los 30 días de edad. El contenido de proteínas presente en la grasa parda tiene una dinámica diferente, ya que aumenta durante los cuatro primeros días de vida, disminuye a la semana y permanece inalterado hasta los 30 días de edad (Clarke, Buss et al., 1997). La cantidad de RNAm para UCP-1 no cambia durante los cuatro primeros días de vida y disminuye entre los siete y 14 días (Clarke, Buss et al., 1997). De manera general, existe un pico en la capacidad termogénica de la grasa parda perirrenal a los cuatro días de edad, seguido de una rápida disminución a los siete días y luego permanece inalterada hasta el mes de edad (Clarke, Buss et al., 1997).
Termorregulación neonatal
La generación del calor metabólico, conjuntamente con otros procesos de intercambio de calor con el medio ambiente, posibilitan mantener la temperatura corporal dentro de un rango considerado normal para la especie (Fonsêca et al., 2022). El nacimiento es un evento altamente estresante para el cordero, ya que cambia del ambiente uterino al medio extrauterino, lo que incluye una mayor demanda termorregulatoria, la que además pasa a depender en mayor medida de sus propias capacidades. Cuando los corderos neonatos nacen en ambientes fríos, deben mantener su temperatura corporal en rangos normales (normotermia) a partir de procesos que minimicen la pérdida de calor corporal y a través de la generación de calor metabólico. En este sentido, mientras que la temperatura promedio del ambiente uterino es de 39 °C, luego del parto el neonato se enfrenta a temperaturas ambientales que pueden llegar a promedios mínimos de 4,5 °C en las condiciones de cría extensiva en Uruguay, incluyendo muchas veces, la presencia de vientos o precipitaciones (Inumet, 2022).
Luego del parto, ocurre la activación del sistema simpático y de los ejes hipotálamo-pituitario-tiroideo y adrenal en el neonato (Symonds, 2013). Por tanto, aumenta la secreción de catecolaminas (adrenalina y noradrenalina) en las terminaciones de los nervios simpáticos, y en sangre, además de aumentar la secreción de cortisol por parte de la glándula adrenal y de las hormonas tiroideas T3 y T4 (Symonds, 2013). Tanto el aumento de noradrenalina como la exposición al frío estimulan la actividad de la enzima hepática 5' deiodinasa, que es la responsable de la conversión de T4 a su forma más activa, la T3 (Silva y Larsen, 1983), aumentando por tanto la concentración sanguínea de T3 y la tasa metabólica. El frío estimula la activación del sistema autonómico simpático y, por tanto, mecanismos de vasoconstricción periférica que disminuyen las pérdidas de calor corporal hacia el medio ambiente. Los neonatos también pueden cambiar su conducta para evitar pérdidas de calor corporal hacia el medio ambiente agrupándose con otros animales o buscando refugios (Fonsêca et al., 2022). La generación de calor metabólico se da principalmente a partir de la activación del metabolismo de la grasa parda. Este tejido es responsable de aproximadamente el 50 % de la producción de calor metabólico en el neonato (Gemmell et al., 1972), utilizando como principal fuente de energía la degradación de los ácidos grasos.
Los mecanismos termogénicos dependientes de temblores musculares se activan en los casos en que el neonato tiene bajas reservas de grasa parda, demora en ingerir calostro u ocurren situaciones meteorológicas extremas (Plush et al., 2016). Estos temblores musculares son contracciones descoordinadas del músculo esquelético que conducen a un rápido consumo de las reservas energéticas de la cría, ya que la gran mayoría de la energía liberada a partir de la hidrólisis del ATP es perdida en forma de energía térmica (Bienboire-Frosini et al., 2023). Las principales fuentes de obtención de energía para la contracción muscular del neonato dependen del tipo de fibra muscular que participa en la contracción, y pueden provenir de la degradación del glucógeno y de los ácidos grasos (Bienboire-Frosini et al., 2023; Plush et al., 2016). Los corderos tienen una mayor proporción de fibras musculares del tipo II que del tipo I (Suzuki y Cassens, 1983). Las fibras del tipo II son glucolíticas, de contracción rápida, y utilizan como principal fuente de energía la degradación del glucógeno muscular vía metabolismo anaeróbico, lo que da como producto final lactato (Mota-Rojas et al., 2022). Por ello, las concentraciones de lactato (Kuchel et al., 1990) y lactato deshidrogenasa (Carnovale et al., 2021) aumentan en sangre luego de periodos de temblores musculares. Este lactato puede ser utilizado como precursor en la vía de la gluconeogénesis en el hígado, formando nueva glucosa, la que puede ser utilizada para reponer las reservas de glucógeno musculares a través del ciclo de Cori (Nelson y Cox, 2022). Por otro lado, las fibras musculares del tipo I son de contracción lenta, presentan una mayor cantidad de mitocondrias y producen ATP, principalmente a través del metabolismo aeróbico, consumiendo una mayor cantidad de oxígeno y elevando en mayor grado la tasa metabólica (Zumbaugh et al., 2022).
Como se mencionó, en los sistemas de producción extensivo de Uruguay una gran proporción de los corderos nace con peso bajo, con pocas reservas energéticas para incrementar la producción de calor metabólico, por lo que son mucho más susceptibles a la hipotermia. Además, los neonatos de bajo peso tienen mayor superficie relativa en relación a su masa corporal, por lo que pierden más calor por unidad de peso corporal que los neonatos de mayor tamaño corporal (Mitchell et al., 2018; Nowak y Poindron, 2006). Por ello, los corderos deben ingerir calostro lo antes posible luego del nacimiento, ya que este es una importante fuente de sustrato energético para la producción de calor y, por tanto, la rápida y mayor ingestión de este es esencial para aumentar la resiliencia térmica de los neonatos (Nowak y Poindron, 2006; Plush et al., 2016). Sin embargo, los neonatos de bajo peso o los hijos de madres subnutridas durante la gestación demoran más tiempo para consumir calostro (Dwyer et al., 2003; Fonsêca et al., 2014; Freitas-de-Melo et al., 2015), lo que se relaciona con un aumento de la tasa de mortalidad (Dwyer, 2008). En resumen, en sistemas extensivos de producción, los corderos normalmente nacen con menor tamaño y peso corporal, con menores cantidades de reservas energéticas, por lo que tienen menores capacidades para mantener su temperatura corporal en rangos normales (normotermia), establecer adecuadamente un vínculo con su madre y, por tanto, menores probabilidades de sobrevivir.
Termorregulación en ovejas esquiladas durante la gestación
Luego de la esquila, la temperatura critica inferior de las ovejas aumenta de -4 °C a 20 °C (Nicol y Brookes, 2007). La temperatura crítica inferior es aquella por debajo de la cual el animal necesita aumentar la producción y disminuir las pérdidas de calor para mantener su equilibrio térmico (Fonsêca et al., 2019). Por ello, las ovejas gestantes esquiladas durante el invierno desarrollan estrategias para aumentar su producción de calor metabólico y disminuir las pérdidas de calor. Durante los primeros días luego de la esquila invernal, estos mecanismos son insuficientes para mantener la normotermia. De hecho, se ha observado que la temperatura rectal de las ovejas disminuye los primeros días luego de la esquila invernal (Dýrmundsson, 1991). Además, ocurre una disminución de la temperatura superficial en zonas deslanadas durante varios días, incluyendo el hocico, oreja, ojo y vulva, lo que indica un mayor nivel de vasoconstricción periférica (Corrales-Hlinka et al., 2023). Para disminuir las pérdidas de calor, durante los días siguientes a la esquila, el animal disminuye la frecuencia respiratoria y el consumo de agua (Al-Ramamneh et al., 2011). La disminución de la frecuencia respiratoria reduce las tasas de transferencia de calor evaporativo por medio de la superficie del tracto respiratorio superior en las ovejas (Fonsêca et al., 2017). La exposición crónica al frío genera un aumento en el consumo de oxígeno, en la frecuencia cardíaca y en la tasa metabólica (Hales et al., 1976; Kenyon et al., 2003). Por otro lado, luego de la esquila, la oveja gestante aumenta el consumo voluntario de alimento (Kenyon et al., 2002b; Revell et al., 2002; Russel et al., 1985), lo que permite aumentar la producción de calor metabólico. En sistemas pastoriles, luego de la esquila preparto, el consumo de pasturas aumenta (Dabiri et al., 1995; Kenyon et al., 2002b; Revell et al., 2002), lo que podría asociarse con incrementos en el tiempo dedicado a pastorear (Ungerfeld et al., 2018). En el caso de acceder a suplementos, su consumo también aumenta luego de la esquila (García-Rodríguez et al., 2012).
Cambios metabólicos en ovejas esquiladas durante la gestación
La esquila preparto frecuentemente desencadena aumentos en las concentraciones sanguíneas de tiroxina (T4), T3, cortisol y GH (Carcangiu et al., 2008; Clarke, Bryant et al., 1997; Morris et al., 2000; Symonds et al., 1988;). Esto determina una mayor movilización y utilización de sus reservas de grasa, lo que determina una mayor producción de calor metabólico, concentraciones sanguíneas de glicerol, AGNE y β-hidroxi-butirato (Cantou et al., 2024; Clarke, Bryant et al., 1997; Symonds et al., 1986, 1988; Thompson et al., 1982). Luego de un desafío por frío de corta duración en ovejas esquiladas durante la gestación, se produce un aumento rápido de las concentraciones sanguíneas de cortisol, leptina, insulina, glucosa, β-hidroxi-butirato y AGNEs (Verbeek et al., 2012). Estos cambios están relacionados con la activación de la respuesta aguda de estrés y la movilización y el uso de reservas energéticas corporales, lo que indicaría que las ovejas esquiladas desencadenan rápidamente los mecanismos necesarios para adaptarse a la pérdida de la lana. Por otra parte, probablemente por efecto del aumento de cortisol (Ungerfeld y Freitas-de-Melo, 2019), la esquila se asocia a un aumento de la glucemia (Symonds et al., 1986), pero al mismo tiempo disminuye la secreción de insulina (Cantou et al., 2024; Symonds et al., 1986), lo que podría deberse a un adelanto de la resistencia a la insulina observado normalmente hacia el final de la gestación (Regnault et al., 2004). Esto se asocia con un aumento de la captación de glucosa por la unidad feto-placentaria independiente de la insulina, lo que potencia el efecto de la glucosa como fuente de energía para el feto (Revella et al., 2000). Globalmente, la esquila preparto disminuye las reservas energéticas de las ovejas y aumenta la oferta de nutrientes para la unidad feto-placentaria. El cambio metabólico de las ovejas preñadas luego de la esquila favorece el desarrollo fetal, pero el estado nutricional de las madres debe ser controlado para evitar aumentos desmedidos de la lipólisis y cetogénesis, y consecuentes episodios de cuadros patológicos como la toxemia de la preñez, y ocurrencia de muertes de ovejas y fetos.
Metabolismo de corderos neonatos hijos de ovejas esquiladas durante la gestación
Los cambios endócrinos y metabólicos generados por la esquila durante la gestación están bien descritos en ovejas, pero la información en la literatura sobre su repercusión en el metabolismo de los corderos es dispersa, con importantes áreas no dilucidadas. En los fetos de 140 días, la esquila preparto aumenta la cantidad de glucógeno hepático y en el músculo femoral (Morini et al., 2018), así como la cantidad de glucógeno hepático en el neonato (Clarke, Bryant et al., 1997). En acuerdo con lo anterior, la esquila preparto disminuye la actividad de la glucosa-6-fosfatasa y el RNAm de la enzima PEPCK presente en el hígado del neonato (Hyatt et al., 2008). Este resultado podría indicar que los corderos nacidos de ovejas esquiladas tienen una menor necesidad de generar glucosa a partir de la gluconeogénesis debido a que cuentan con una reserva de glucógeno hepático mayor. Además, la esquila invernal preparto realizada en el tercio final de la gestación en ovejas subnutridas aumenta la masa de grasa parda perirrenal de los corderos, así como de su contenido de lípidos, de proteínas y las concentraciones de adrenalina y de noradrenalina (Clarke, Bryant et al., 1997). Asimismo, la cantidad, irrigación y actividad de la grasa parda perirrenal de los neonatos nacidos de ovejas esquiladas durante el preparto es mayor que la de los hijos de las ovejas sin esquilar (Clarke, Bryant et al., 1997, Clarke, 1998 y Symonds, 1998; Encinias et al., 2004; Gate et al., 1999; Stott y Slee, 1985; Symonds y Lomax, 1992). La mayor cantidad de grasa parda en los corderos hijos de madres esquiladas permite que estos tengan una mayor capacidad de generar calor, aunque la capacidad de generar calor en relación a la masa de grasa parda puede variar de acuerdo al estatus metabólico del neonato (Budge et al., 2000). La tasa de consumo de oxígeno/kg es mayor en los corderos nacidos de ovejas esquiladas que en los nacidos de ovejas no esquiladas al día de nacidos, lo que indica que estos tendrían una mayor capacidad metabólica, ya que es independiente del peso (Symonds y Lomax, 1992). Más aún, esta respuesta no se asocia a los temblores involuntarios generadores de calor (escalofríos), a diferencia de lo que ocurre en los corderos nacidos de madres no esquiladas. Una explicación parcial de esta respuesta es que los corderos nacidos de ovejas esquiladas tenían mayor cantidad de grasa parda, la que a su vez contenía mayor cantidad de proteína y proteína mitocondrial que los corderos nacidos de ovejas no esquiladas, lo que les permitiría responder más eficientemente a las necesidades termorregulatorias, sin necesidad de desplegar temblores musculares involuntarios. Otra diferencia es que los corderos nacidos de ovejas esquiladas al final de la gestación tienen una mayor actividad de la enzima hepática 5' deiodinasa, lo que permite aumentar en mayor medida las concentraciones sanguíneas de T3 (Clarke, Bryant et al., 1997). Entre el final de la gestación y el nacimiento hay una mayor actividad de transporte de protones vía UCP-1 en fetos de ovejas esquiladas durante el tercio final de la gestación (Clarke, Bryant et al., 1997). Además, la esquila preparto aumenta el porcentaje de lactosa en el calostro (Banchero et al., 2010), lo que potencialmente podría influir sobre la glucemia del neonato. Sin embargo, aparentemente la esquila preparto invernal no modifica las concentraciones sanguíneas de glucosa, AGNE, lactato y cortisol de los corderos al nacimiento (Guyoti et al., 2015; Hyatt et al., 2008). Esto indicaría que el impacto de la esquila preparto sobre el metabolismo del feto facilita la adaptación metabólica del neonato luego del parto.
Consideraciones de manejo al realizar la esquila preparto
La esquila preparto genera beneficios productivos claros en términos de peso y supervivencia neonatal. Sin embargo, debe ser aplicada con precauciones dado que implica un desafío térmico y metabólico importante para las madres, ya que puede generar problemas de salud, como la toxemia de la preñez o incluso la muerte de hembras preñadas. Antes de realizar este manejo, se debe considerar la condición corporal de las ovejas gestantes, seleccionando hembras con una condición corporal de al menos 2,5 en una escala de 1 a 5. El pronóstico del tiempo debe ser revisado con cautela para evitar realizar la esquila en condiciones climáticas muy desfavorables. También es importante aumentar la oferta de alimento antes y después de la esquila preparto para asegurar que las ovejas puedan responder a la mayor demanda metabólica, manteniendo a su vez su temperatura corporal y evitando grandes pérdidas de la condición corporal. Asimismo, se debe ponderar el tiempo y la cantidad de alimento ofrecido a las ovejas gestantes alrededor de la esquila para minimizar los riesgos de distocias debido a un crecimiento desmedido de los fetos (Kenyon et al., 2002a). La realización de prácticas que favorezcan la adecuada termorregulación de las ovejas también es indicada para mejorar sus condiciones de salud y de bienestar. Por ello, alternativas como utilizar peines especiales al esquilar, dejando un remanente de lana equivalente a 1 mes de crecimiento, reducen las pérdidas de calor al ambiente. El uso de refugios vegetales (arboles, pasto alto), artificiales (galpones, materiales en madera) o topográficos (presencia de valles) (Fisher, 2007), evitan pérdidas de calor en ovejas esquiladas, ya que estas buscan protección más activamente en condiciones climáticas desfavorables (Taylor et al., 2011).















