Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Archivos de Medicina Interna
versión impresa ISSN 0250-3816versión On-line ISSN 1688-423X
Arch. Med Int vol.36 no. supl.1 Montevideo mar. 2014
Academia Nacional de Medicina
Gran Premio Nacional de Medicina 2013
Normativas para medicamentos de alto costo
Experiencia del Fondo Nacional de Recursos con rituximab e imatinib: desarrollo, resultados e impacto en la asistencia médica en Uruguay.
Regulations for high cost drugs
Experience of the National Resource Fund with rituximab and imatinib: development, outcomes and impact on medical care in
Dr. Pablo Juan Muxí Martínez
Doctor en Medicina. Especialista en Medicina Interna y Hematología. Profesor Agregado de la Cátedra de Hematología. UdelaR.
Asesor Honorario Externo del Fondo Nacional de Recursos en Medicamentos de Alto Costo en hemato-oncología. Montevideo.
Dr. Fernando Correa Yackes
Doctor en Medicina. Especialista en Medicina Interna y Hematología. Profesor Agregado de Clínica Médica, Facultad de Medicina, UdelaR.
Médico Asistente del Fondo Nacional de Recursos. Montevideo
Dr. Henry L. Albornoz da Silva
Doctor en Medicina. Especialista en Medicina Intensiva y Enfermedades Infecciosas. Médico Asistente del Fondo Nacional de Recursos.
Integrante de la Comisión Nacional de Infecciones Hospitalarias MSP. Montevideo
Dr. Lem Pedro Martínez Queirolo
Doctor en Medicina. Especialista en Hematología.
Jefe Servicio de Hematología Médica Uruguaya Corporación de Asistencia Médica.
Coordinador General de Hematología y Jefe de la Unidad de Trasplante de Médula Ósea de la Asociación Española Primera de Socorros Mutuos. Asesor Honorario Externo del Fondo Nacional de Recursos en Medicamentos de Alto Costo en hemato-oncología. Montevideo
Dr. Abayubá Perna Ramos
Doctor en Medicina. Especialista Neurología. Profesor Adjunto Cátedra de Neurología. Instituto de Neurología. Facultad de Medicina. UdelaR.
Medico Asesor en Metodología de la Investigación y Estadística.
Fondo Nacional de Recursos. Montevideo.
Este trabajo es distinguido con el Gran Premio Nacional de Medicina según consta en Acta de la Academia Nacional de Medicina del día 30 de agosto de 2012, hora 16. En la sede de la Academia Nacional de Medicina el tribunal que entiende en la adjudicación del Gran Premio Nacional de Medicina es presidido por el Ac. Hernán Artucio e integrado por los Acs. Carmen Álvarez, Gloria Ruocco, Luis García Guido y José Gumberg. El tribunal resuelve por unanimidad otorgar un segundo Gran Premio al trabajo presentado “Normativas para medicamentos de alto costo.” Experiencia del Fondo Nacional de Recursos con rituximab e imatinib: desarrollo, resultados e impacto en la asistencia médica en Uruguay.
Los autores declaran que no tienen conflictos de intereses relacionados con el presente trabajo.
Correspondencia: Dr. Pablo Muxi, E-mail: muximeth@adinet.com.uy
Resumen:
El Fondo Nacional de Recursos es una persona pública no estatal que brinda cobertura financiera a procedimientos de medicina altamente especializada, fue creado por ley en el año 1979 para brindar dichas prestaciones con equidad y con la máxima calidad, asegurando su sustentabilidad. En el año 2004, el Fondo Nacional de Recursos decidió iniciar la cobertura financiera de dos medicamentos de alto costo para patologías con indicación de técnicas financiadas por la institución y que en ese momento no estaban incluidos en la canasta básica de prestaciones de las instituciones de asistencia sanitaria. Esto generaba una inequidad en el acceso a las mismas. Con la evidencia científica disponible hasta ese momento, decidió iniciar la cobertura financiera de rituximab e imatinib para el tratamiento del linfoma no Hodgkin B y de la leucemia mieloide crónica, respectivamente. Se describe en esta publicación las bases científicas que avalaron las normativas de cobertura, el desarrollo de las mismas y la metodología de trabajo utilizada para su implementación.
Se analiza los resultados obtenidos con estas dos normativas, el impacto generado en la asistencia y su rol como modelo para la cobertura de otros medicamentos de alto costo. De dicho análisis surge que las normativas de cobertura del imatinib y el rituximab brindaron la posibilidad del uso universal y equitativo de estas drogas y mejoraron la calidad de asistencia de las patologías contempladas. En los pacientes tratados se obtuvieron resultados comparables con los estándares internacionales. La supervivencia a dos años en linfomas no Hodgkin agresivos fue 74,7%, en linfomas no Hodgkin indolentes fue 88,4% y en leucemia mieloide crónica fue 92,7%. Las normativas sirvieron además como modelo operativo para la implementación de la cobertura financiera de otros medicamentos de alto costo generando un impacto en la medicina nacional. En el año 2011 el Fondo Nacional de Recursos dio cobertura financiera para medicamentos de alto costo a más de 1500 pacientes, estas prestaciones constituyeron aproximadamente el 30% del presupuesto anual de la institución.
Palabras clave: Linfomas no Hodgkin, leucemia mieloide crónica, rituximab, imatinib, financiamiento, gestión, medicamentos de alto costo, normativa, calidad asistencial, supervivencia.
Abstract:
The National Resource Fund is a non-state legal entity that provides financial coverage to highly specialized medical procedures; it was created by law in 1979 to provide such care with equality and the best quality, while ensuring sustainability. In 2004, the National Resource Fund decided to start providing financial coverage for two high-cost medications for conditions with techniques funded by the agency, which at the time were not included in the core listing of care of the health care centers. That led to inequity in people’s access to such care. With the scientific evidence available at the time, the Fund decided to start covering rituximab and imatinib for the treatment of non Hodgkin B lymphoma and chronic myeloid leukemia, respectively. This paper describes the scientific grounds that supported the coverage regulations, their development and the methodology applied for their implementation. We discuss the results obtained with these two regulations, their impact on care and their role as a model for coverage of other high-cost drugs. Based on the analysis, it becomes apparent that the regulations for coverage of imatinib and rituximab made it possible to provide universal and equitable administration of these drugs and improved the quality of care of the above conditions. The results observed in the patients treated were consistent with international standards. Two-year survival of aggressive non-Hodgkin lymphomas was 74.7%, in smoldering non-Hodgkin lymphomas was 88.4% and chronic myeloid leukemia was 92.7%. The regulations also acted as an operative model for the implementation of financial coverage of other high-cost drugs, impacting the country’s medicine. In 2011 the National Resource Fund provided financial coverage to pay for high cost medicine of over 1,500 patients, which accounts for about 30% the agency’s annual budget.
Key words: Non Hodgkin lymphoma, chronic myeloid leukemia, rituximab, imatinib, funding, management, high cost drugs, regulations, quality of care, survival.
Abreviaturas y siglas
BL Abelson proto-oncogen.
ASSE Administración de Servicios de Salud del Estado.
BCCA Agencia del Cáncer de la Columbia Británica.
BCR ABL.
BCR Breakpoint cluster region.
CHLCC Comisión Honoraria de Lucha contra el Cáncer.
CHOP Ciclofosfamida, Doxorrubicina, Vincristina y Prednisona.
CHOP-R Ciclofosfamida, Doxorrubicina, Vincristina, Prednisona y Rituximab.
CHVP Ciclofosfamida, Doxorrubicina, Vincristina y Prednisona.
CLSG Grupo de Estudio Alemán de Linfoma de bajo grado.
CV Ciclofosfamida, Vincristina y Prednisona.
DE Desvío estándar.
DHAP Dexametasona, Citarabina y Cisplatino.
EE Error estándar
ECOG Eastern Cooperative Oncology Group.
ESHAP Etopósido, Hidrocortisona, Citarabina y Cisplatino.
FCM Fludarabina, Ciclofosfamida y Mitoxantrona.
FLIPI Índice Pronóstico Internacional para Linfomas Foliculares.
FNR Fondo Nacional de Recursos.
FONASA Fondo Nacional de Salud.
GELA Grupo de Estudio de Linfomas del Adulto.
IAMC Instituciones de Asistencia Médica Colectiva.
ICE Ifosfamida, Carboplatino y Etopósido.
IHQ Inmuno-Histo-Química.
INF Interferón.
IPI Índice Pronóstico Internacional.
IRIS International Randomized Study of Interferon and STI571
LDGCB Linfoma Difuso a Grandes Células B.
LF Linfoma Folicular.
LMC Leucemia mieloide crónica.
LNH Linfomas no Hodgkin.
MAC Medicamentos de Alto Costo.
MACOP-B
Metotrexate, Bleomicina, Ciclofosfamida, Vincristina y Prednisona.
m-BACOD
Metotrexate, Bleomicina, Ciclofosfamida, Vincristina y Dexametasona.
MCP Mitoxantrona, Clorambucil y Prednisona.
MSP Ministerio de Salud Pública.
OMS Organización Mundial de Salud.
P25 Percentil 25.
P75 Percentil 75.
Ph+ Cromosoma Philadelphia Positivo.
PQT Poliquimioterapia.
ProMACE-CytaBOM
Ciclofosfamida, Doxorrubicina, Etopósido, Bleomicina, Vincristina, Metrotexate y Prednisona.
R Rituximab
RC Respuesta Citogenética Completa.
R-CVP Rituximab, Ciclofosfamida, Vincristina y Prednisona.
RM Respuesta Citogenética Mayor.
RMM Respuesta Molecular Mayor.
SG Supervivencia Global.
TFT Tiempo al fracaso del tratamiento.
UDELAR Universidad de la República.
Introducción
El Fondo Nacional de Recursos (FNR) es una persona pública no estatal que brinda cobertura financiera a procedimientos de medicina altamente especializada para toda la población, sin distinciones(1,2).
La Facultad de Medicina de la Universidad de la República, definió a la medicina altamente especializada como aquella que requiere una gran concentración de recursos humanos y materiales para un escaso número de pacientes en los que está en juego el pronóstico vital o funcional, articulados en forma tal que permitan obtener la excelencia asistencial(1,2).
El FNR comenzó a funcionar el 1º de diciembre de 1980 en aplicación del decreto-ley N° 14.897 de 23 de mayo de 1979 y su decreto reglamentario. Se estableció un órgano colegiado encargado de su administración, la Comisión Honoraria Administrativa. El marco normativo fue modificado posteriormente con la aprobación de la ley 16.343 de 24 de diciembre de 1992(1,2).
La nueva ley modificó la conformación de la Comisión Honoraria Administradora incrementando la representación del sector privado y estableció la cobertura de tratamientos en el exterior cuando se cumplen determinadas condiciones.
La misión del Fondo Nacional de Recursos es otorgar financiamiento a prestaciones médicas altamente especializadas, de demostrada efectividad, permitiendo que las mismas estén disponibles con EQUIDAD para toda la población del país. Asegurando que se realicen con el máximo de CALIDAD y en condiciones de SUSTENTABILIDAD económica y financiera(1).
Equidad, eficacia, efectividad y eficiencia, las que, junto a la calidad, han sido los criterios más utilizados para evaluar los sistemas de salud (3).
La equidad es ofrecer similar recurso frente a la misma necesidad. Su primera condición es garantizar igual accesibilidad para todos. No es sólo una relación numérica ya que implica acceso a procedimientos efectivos y de igual calidad.
La eficacia mide el efecto de una técnica o procedimiento utilizado en condiciones ideales. Se emplea para definir la probabilidad de que un individuo se beneficie de la aplicación de una tecnología sanitaria.
La efectividad se orienta en el mismo sentido pero bajo condiciones reales de aplicación de la tecnología (sus resultados tienen limitada su validez externa y no pueden ser generalizados).
Siguiendo esta terminología, se ha definido la calidad como la reducción de las diferencias entre eficacia y efectividad atribuible a la atención médica.
La eficiencia es la relación existente entre los recursos destinados a una intervención sanitaria y la efectividad de la misma.
Los objetivos del Fondo Nacional de Recursos son los siguientes(2):
- Permitir el acceso equitativo de toda la población del país a un conjunto de técnicas médicas de alta especialización, asegurando su financiamiento
- Evaluar la calidad de la atención que se brinda a los pacientes, controlando los procesos y los resultados de los actos financiados.
- Mejorar la eficiencia del sistema mediante la aplicación de metodologías de análisis de costos
- Administrar la atención de pacientes en el exterior en los casos en que ese extremo se justifique, de acuerdo a los criterios establecidos en el marco normativo aplicable
- Contribuir al mejoramiento de la calidad de vida de los uruguayos y abatir la demanda de tratamientos, mediante la aplicación de programas preventivos y la difusión de hábitos saludables
- Apoyar el desarrollo y el conocimiento de la medicina basada en evidencias mediante actividades de capacitación, aporte de estudios, evaluaciones y guías para la práctica clínica
Beneficiarios
Todas las personas que acrediten su residencia en el país tienen derecho a la cobertura del Fondo Nacional de Recursos si reúnen alguna de las siguientes condiciones: poseer Carné de Asistencia otorgado por la Administración de Servicios de Salud del Estado como usuario del sistema público, ser beneficiario del Fondo Nacional de Salud (Seguridad Social) o ser afiliado de una Institución de Asistencia Médica o Seguro Integral como aportante individual.
En suma: toda la población del país que cuente con cobertura formal de salud, es beneficiaria del Fondo Nacional de Recursos.
Acceso
El médico tratante del paciente en el Hospital o Institución de Asistencia Médica Colectiva (IAMC) donde el mismo se asiste, puede realizar la indicación de tratamientos que son cubiertos por el FNR y la remite a la Dirección Técnica de dicho prestador de salud.
El prestador integral de salud se hace cargo de presentar ante el FNR la solicitud de cobertura acompañada de la documentación correspondiente para que sea estudiada en base a los protocolos y guías de tratamiento vigentes.
Una vez estudiada y analizada la solicitud en el FNR, se adopta una resolución evaluando la pertinencia de la solicitud en todos sus aspectos, en función del marco normativo vigente.
La resolución adoptada, se comunica a la institución de asistencia (prestador integral) y al médico tratante, tanto si la misma es aceptada, rechazada o se solicita información adicional. La comunicación se realiza a través de una nota firmada por uno de los técnicos del FNR, de tal manera que la misma pueda ser incorporada a la historia clínica del paciente.
El proceso de autorización de cobertura de actos del FNR y el sistema informático que lo respalda, se encuentran en este momento en un nivel significativo de consolidación y constituye un modelo de gestión clínica relevante en nuestro medio, con una buena articulación de los componentes médicos y administrativos.
El funcionamiento de este sistema sitúa al Uruguay entre los países en el mundo que más han avanzado en solucionar el acceso de toda su población a la medicina de alto costo. Se trata de un sistema solidario, que posibilita la atención de todas las personas, sin tener en cuenta su procedencia, que ha crecido y se ha desarrollado gracias al esfuerzo mancomunado del sector público y privado.
¿Cómo se financia?
El Fondo Nacional de Recursos recibe los recursos que vuelcan diversas instituciones:
- El aporte del Estado para cubrir la atención de los habitantes con cobertura a través del Ministerio de Salud Pública - ASSE
- El aporte de los Entes autónomos, Servicios Descentralizados y Administraciones Departamentales para cubrir la atención de aquellas personas cuya asistencia se encuentra directamente a su cargo
- El aporte del Fondo Nacional de Salud (FONASA) por todas las personas que tienen cobertura de salud a través de la Seguridad Social
- El aporte de las IAMC, que transfieren el aporte mensual de sus afiliados individuales
- El producido de impuestos que se aplican a determinados juegos de azar previstos especialmente por la ley
El FNR y los Medicamentos de Alto Costo (MAC)
Antecedentes
El problema del acceso a los medicamentos, y en particular su impacto creciente sobre las finanzas de los sistemas de salud, se ubica entre los de alta prioridad en buena parte de los países del mundo. A una situación histórica de inequidad, se suma actualmente la irrupción de una nueva generación de medicamentos con una efectividad que todavía es objeto de debate y cuyo elevadísimo costo es una amenaza grave para la estabilidad de los sistemas y la sustentabilidad de las políticas(4). Estos nuevos medicamentos presentan algunas características que ameritan ser consideradas.
En primer lugar, son drogas dirigidas al tratamiento de enfermedades de baja prevalencia pero que implican un alto riesgo de vida para los pacientes que las padecen. Estos, además, suelen ser jóvenes lo que incrementa el significado social del problema y vuelve a los sistemas de salud muy vulnerables a las presiones.
Un segundo aspecto, en general poco difundido, es que los medicamentos en cuestión son de incorporación muy reciente y, si bien han superado formalmente las etapas de investigación (ensayos clínicos fase III) que habilitan su registro por parte de las agencias regulatorias, la experiencia todavía es escasa para poder afirmar cuál es la ganancia de vida que otorgan y en qué condiciones de calidad.
La literatura disponible suele anunciar beneficios en términos de eficacia pero los seguimientos todavía son cortos (evaluación de la efectividad, estudios de fase IV y de evaluación económica).
Una tercera característica de estas nuevas drogas que también debe ser tenida en cuenta es que existen estrategias de comunicación e implantación de gran despliegue, desarrolladas por la industria farmacéutica en general muy relacionada con grupos restringidos de especialistas y con asociaciones de pacientes.
En el año 2004 bajo el concepto de gestionar sus propios riesgos, el FNR decidió incorporar el tratamiento medicamentoso para patologías con indicaciones de técnicas financiadas por la institución (trasplante de médula ósea)(4). El imatinib y el rituximab eran dos medicamentos de alto costo que generaban reclamos permanentes de la población a las instituciones de asistencia. El FNR decidió implementar una normativa de cobertura financiera de estas drogas.
• Rituximab para el tratamiento de linfomas no Hodgkin (LNH).
• Imatinib para el tratamiento de leucemia mieloide crónica (LMC).
La implementación de la cobertura comenzó en enero de 2005, la modalidad de trabajo fue la formación de equipo médico con asesores externos al FNR, el elaborar marco normativo de cobertura basado en la mayor evidencia disponible, estableciendo requerimientos claros sobre confirmación fehaciente de cada diagnóstico con el objetivo de lograr la mayor precisión en el mismo, obteniendo de esa manera un resultado de calidad camino hacia la excelencia.
La información recibida es incorporada al sistema informático del FNR con lo cual se genera una base de datos que permite el análisis posterior de los resultados obtenidos.
Con el trascurrir de estos años, este modelo de cobertura, con un marco normativo claro, con alcance a toda la población cubierta por el FNR, con evaluaciones periódicas de los resultados y su posterior presentación en diversos eventos científicos, ha generado un impacto en el sistema de salud en nuestro país, que llevó a un cambio en la práctica de la hemato-oncología.
Bases Técnico-Científicas
Rituximab
El rituximab es un anticuerpo monoclonal constituido por las porciones constantes de una inmunoglobulina humana, IgG, unida a porciones variables anti CD20 de origen murino, por este motivo es definido como un anticuerpo quimérico murino/humano. Este anticuerpo se une en forma específica al antígeno CD20 expresado en los linfocitos B, este antígeno de superficie es un marcador del linfocito B adquirido en la etapa de linfocito pre-B y presente hasta casi el final de su proceso evolutivo.
La unión del rituximab al antígeno CD20 determina lisis del linfocito B por distintos mecanismos. Además de tener acción antiapoptótica directa, tiene un mecanismo de acción indirecto a través del complemento y de la activación de la citotoxicidad celular; esto provoca una depleción de los linfocitos B que expresan el antígeno CD20 en su superficie celular.
El antígeno antiCD20 con mayor o menor intensidad se expresa en el 95% de los linfomas de origen B. En el año 1997 el rituximab fue aprobado por la Food and Drug Administration para el tratamiento de los linfoma foliculares (LF) en recaída.
El rituximab se encuentra disponible en Uruguay, con registro y uso aprobado por el MSP para pacientes con LNH.
Imatinib
El mesilato de imatinib es un inhibidor selectivo y potente de las abl tirosino quinasas.
En la LMC, la traslocación recíproca 9;22 produce la unión de los genes ABL (Abelson proto-oncogene) del cromosoma 9 con el BCR (breakpoint cluster region) del cromosoma 22. Se genera así un gen quimérico llamado BCR-ABL. Esta proteína híbrida BCR-ABL tiene una potente actividad de tirosino quinasa. Las tirosino quinasas transfieren fosfato del ATP a otras proteínas que regulan los procesos celulares de duplicación, supervivencia y diferenciación. El gen quimérico BCR-ABL tiene una actividad no regulada de la tirosino-quinasa lo que lleva a una proliferación mieloide no controlada, y a una inhibición de la apoptosis y de la adhesión celular generando la LMC.
El imatinib bloquea la unión del ATP a la tirosino quinasa BCR-ABL impidiendo la transferencia de fosfatos a los residuos de tirosina. Al inhibir la fosforilación se detiene el proceso de proliferación no controlada.
El imatinib se encuentra disponible en Uruguay, con registro y uso aprobado por el MSP para pacientes con LMC.
Evidencia científica para la inclusión de la cobertura financiera de Rituximab y de Imatinib
Rituximab en linfomas no Hodgkin B
En el año 2004 el rituximab era utilizado en prácticamente cualquier tipo de linfoma de origen B; sin embrago, en las dos entidades más frecuentes, el linfoma difuso a grandes células B (LDGCB) y en el linfoma folicular (LF), era donde existían estudios científicos que demostraban el beneficio de la inmunoquimioterapia en estas patologías. En la clasificación de la Organización Mundial de Salud ambas entidades están dentro del grupo de neoplasias de células B maduras. La prevalencia de estas dos entidades en estudios internacionales es del 30-40% de los LNH para el LDGCB y del 20-30% para los LF. En nuestro país Gualco et al publicaron una revisión de LNH del Hospital Militar, ellos encontraron que el 34,6% eran LDGCB y que el 22,1% eran LF(7).
En la clasificación de la OMS se agrupan entre los LDGCB distintas patologías, el LDGCB mediastínico, el LDGCB rico en células T, el LDGCB asociado a derrame de serosas, el LDGCB anaplásico y el LDGCB ALK+. El diagnóstico requiere un estudio patológico convencional y debe contar con técnicas de IHQ (CK-, CD45+, CD3-, CD5-, CD19+, CD20+, CD10+/-) que confirmen la entidad.
La respuesta al tratamiento y la supervivencia global de estos pacientes está determinada por distintos factores de riesgo: edad mayor a 60 años, LDH elevada, performance status ECOG igual o mayor a 2, estadio Ann Arbor III o IV, y compromiso extra-ganglionar en dos o más sitios. Con estos factores se elaboró y validó un escore de riesgo, el Índice Pronóstico Internacional (IPI). Evaluado el número de factores se determinan 4 grupos de riesgo, bajo riesgo con 0-1 factor presente con una supervivencia global (SG) a 5 años de 73%, riesgo bajo-intermedio con 2 factores presentes y SG a 5 años de 51%, riesgo intermedio-alto con 3 factores presentes y una SG a 5 años de 43%, y riesgo alto con 4 o más factores presentes con una SG a 5 años de 26%. El IPI tiene una modificación en la que se ajusta el mismo en pacientes menores de 60 años(8).
Los micro-arreglos moleculares identifican 3 variedades de LDGCB, se denominan LDGCB del Centro Germinal, LDGCB de linfocitos B activados y Tipo 3. La expresión génica distinta de estas entidades sugiere distinto origen de célula B, estos 3 subtipos de LDGCB presentan un pronóstico diferente(9). Esta técnica de estudio no está disponible en nuestro país y si bien es reconocida su importancia pronóstica no forma parte del estándar de evaluación de esta entidad fuera de trabajos clínicos de investigación.
Los LF son neoplasias linfoides de curso indolente con supervivencia media estimada de 10 años. Hay tres variantes patológicas, se sub-clasifica de acuerdo al porcentaje de centroblastos por campo de alto poder; el grado I tiene de 1 a 5 centroblastos por campo y el grado II 6 a 15 centroblastos, son considerados LNH indolentes o de bajo grado de malignidad. El grado III con más de 15 centroblastos se subdivide en IIIa (con centrocitos) y IIIb (sin centrocitos) y es un LNH de curso agresivo.
La alteración citogenética característica de estos linfomas es una t (14; 18), está presente en el 90% de los casos y genera un re-arreglo BCL2-IGH. El estudio de IHQ suele mostrar sobre-expresión BCL2, CD19+, CD20+, CD5-, CD23-/+, bcl2++, CD10+.
En pacientes con LF se evaluó y validó un índice pronóstico, el FLIPI. Los 5 factores de riesgo utilizados para este índice pronóstico son: edad mayor a 60 años, hemoglobina menor a 12 g/dl, LDH elevada, estadio de Ann Arbor III/IV, y compromiso de 5 o más regiones ganglionares. Se considera FLIPI de bajo riesgo si hay 1 factor o menos, en este caso la SG a 5 años es de 91% y a 10 años de 71%, un FLIPI de riesgo intermedio lo define la presencia de 2 factores de riesgo, esto pronostica una SG a 5 años de 78% y a 10 años de 51% y un FLIPI de riesgo alto es cuando el paciente se presenta con 3 o más factores de riesgo, esto implica un pronóstico de SG a 5 años de 53% y a 10 años de 36%. El FLIPI fue inicialmente evaluado en pacientes tratados con PQT, luego fue validado con la asociación de rituximab(10,11).
Linfoma difuso a grandes células B (LDGCB) y linfoma folicular grado III, evidencia científica que avalaba el uso de rituximab en el año 2004
Tratamiento al debut de la enfermedad
Fisher RI et al en el año 1994 demostraron que no había diferencias significativas de resultados entre las distintas combinaciones de drogas quimioterápicas como CHOP, m-BACOD, ProMACE-CytaBOM y MACOP-B para el tratamiento de pacientes con LNH de grado intermedio o alto. Desde entonces el CHOP pasó a ser el estándar para el tratamiento de estos linfomas(12).
En el año 2004 los estudios GELA, Intergroup US, y MInT, demostraron beneficio de asociar rituximab al CHOP en el tratamiento de los LDGCB en lo referido a supervivencia libre de enfermedad o de progresión así como en supervivencia global. En los años siguientes estos estudios confirmaron los resultados y junto a otros estudios como el RICOVER-60, y el HOVON/NORDIC detallaron el beneficio en distintos subgrupos de edad y riesgo(13-18).
El estudio del GELA fue el primero en demostrar impacto en respuesta completa, supervivencia global y en supervivencia libre de eventos con la asociación de rituximab al CHOP. Pacientes entre 60 y 80 años con diagnóstico de LDGCB, estadio II, III, IV fueron elegidos y aleatorizados para recibir CHOP por 8 series o CHOP asociando rituximab 375 mg/m2 (CHOP-R) en el día uno de cada serie por un total de 8 ciclos. Con una media de seguimiento de 24 meses la respuesta completa fue de 76% en el grupo CHOP-R contra 63% en el grupo que recibió CHOP (p = 0,005). La supervivencia libre de eventos (progresión, recaída o muerte) también fue superior en el grupo asignado a CHOP-R, 61% contra 43%, (p < 0,001). La supervivencia global fue de 70% en el grupo con CHOP-R y de 63% en el grupo con CHOP (p = 0,005). Estos resultados se lograron sin diferencias significativas de toxicidad entre los dos tratamientos.13 Estos datos fueron actualizados sucesivamente manteniéndose la ventaja en el grupo que recibió CHOP-R(14).
El Intergroup US Study con 632 pacientes mayores de 60 años con LDGCB comparó CHOP y CHOP-R con una segunda randomización a realizar comparando mantenimiento con rituximab o seguimiento. Se demostró una ventaja en supervivencia libre de progresión (p=0,059) sin claro beneficio en supervivencia global, esto último se debió probablemente al uso de rituximab como mantenimiento en la segunda fase del protocolo de estudio (15).
El estudio MInT, fase III, fue realizado en pacientes menores de 60 años, estadios II-IV, IPI 0 o 1, o estadio I bulky. Con una media de seguimiento de 22 meses un reporte preliminar presentado en el congreso del ASH del año 2004 demostró beneficio en supervivencia global y tiempo a la falla del tratamiento, para el grupo con CHOP-R, 94% versus 87% (p = 0.001), y 76% versus 60% respectivamente, (p > 0,00001)(16).
El estudio Ricover-60, comparó cuatro grupos, seis u ocho series de CHOP cada 14 días y seis u ocho series de CHOP 14 con rituximab asociado. Este estudio realizado en pacientes mayores de 60 años, confirmó para la inmuno-quimioterapia una ventaja en supervivencia libre de eventos y supervivencia global(17).
El Grupo Hovon-Nordic presentó en el año 2006 los resultados de un estudio aleatorio fase III en pacientes con LDGCB mayores de 65 años, el mismo comparó CHOP 14 con CHOP-R 14. Con 261 pacientes reclutados de 400 planeados el estudio fue suspendido por haberse demostrado el objetivo primario del ensayo. A dos años había una ventaja en supervivencia libre de progresión de 55% contra 33% (p = 0,007) para el grupo con CHOP-R 14. También el grupo con inmunoquimioterapia tuvo mejor supervivencia global(18).
La Agencia del Cáncer de la Columbia Británica (BCCA) publicó en el año 2005 un estudio comparando los resultados en pacientes con LDGCB tratados 18 meses antes de la introducción del rituximab con los pacientes tratados en los 18 meses siguientes. Supervivencia libre de progresión (p = 0,002) y supervivencia global (p < 0,0001) fueron superiores en el grupo tratado luego de la introducción del rituximab. A dos años la supervivencia global en el grupo con rituximab fue 78%(19). Este trabajo no es un protocolo de investigación sino que refleja la práctica médica diaria.
En el mismo contexto el Czech Lymphoma Study Group, analizó los resultados en 376 pacientes menores de 60 años registrados tratados con un régimen basado en antracíclicos con o sin rituximab asociado. La supervivencia libre de progresión estimada a 2 años fue de 85,5% para el grupo con rituximab y de 66,4% para el grupo que no recibió anticuerpos monoclonales (p = 0,0001). La supervivencia global estimada a dos años fue 90,7% y 77,6% respectivamente (p = 0,0007(20).
Con la evidencia aportada por estos estudios el CHOP-R se convirtió en el tratamiento estándar para los LDGCB en debut se enfermedad.
Tratamiento en recaída de la enfermedad
El trasplante autólogo de médula ósea en comparación con la PQT, en los pacientes con LDGCB que lograban una respuesta al tratamiento luego de una recaída, mostró un claro beneficio en respuesta, duración de la misma y supervivencia global(21). Los tratamientos aceptados de inducción eran ICE, DHAP y ESHAP, en ese momento no había ningún estudio aleatorio que valorara el impacto de la asociación del rituximab a estos 3 planes de quimioterapia, pese a eso se aceptó internacionalmente como estándar la asociación del anticuerpo monoclonal en los planes de re-inducción.
Basado en esta evidencia desde el 1 de enero de 2005 se comenzó con un protocolo para el tratamiento de los LDGCB y para los LF grado III en primera línea y recaída.
Linfoma folicular (LF) evidencia científica que avalaba el uso de rituximab en el año 2004
Tratamiento al debut de la enfermedad
Al inicio de la cobertura financiera del rituximab no había suficiente evidencia científica para asociarlo a la quimioterapia en el tratamiento al debut de los LF indolentes. Entre el final del año 2004 y el año 2007 distintos estudios demostraron la evidencia científica del beneficio de la inmuno-quimioterapia al debut en estos linfomas.
A diferencia de lo que ocurría con el LDGCB no había un estándar en que quimioterapia se debía asociar al rituximab en el tratamiento de estos linfomas, planes tipo CHOP, CVP y asociados a fludarabina eran igualmente aceptados.
El Grupo de Estudio Alemán de Linfomas de Bajo Grado (GLSG) comparó 4 a 6 ciclos de CHOP con o sin rituximab en primera línea en LF en estadio avanzado. La respuesta global fue de 90% para CHOP y 97% para la asociación con rituximab (p = 0,011). Se valoró la media de tiempo al fracaso del tratamiento (TFT) que fue de 31 meses para CHOP y no se había alcanzado para R-CHOP (p < 0,0001)(22).
Marcus R et al, demostraron la ventaja de R-CVP (n = 159) comparado con CVP (n = 162) en pacientes con LF avanzado; con una media de seguimiento de 30 meses todos los resultados confirmaron un beneficio en la asociación con rituximab, la tasa de respuesta fue de 80% contra 57% (p < 0,0001), la mediana de tiempo a la progresión 32 meses contra 15 (p < 0,0001) y la media del TFT 27 meses contra 7 meses (p < 0,0001)(23). En el año 2008 en un seguimiento de los resultados del estudio los mismos autores publicaron con una mediana de seguimiento de 4 años una diferencia en supervivencia global de 83% contra 77% (p = 0,029)(24).
Herold et al, compararon MCP (mitoxantrona clorambucil prednisona) con o sin rituximab. El grupo que asoció rituximab obtuvo una respuesta global del 92% contra 75% en el grupo que solo recibió quimioterapia. (p < 0,001). Al igual que en los trabajos del GLSG y de Marcus R, el TFT también mostró una diferencia significativa a favor del grupo con inmuno-quimioterapia(25).
El Grupo de Estudio de los Linfomas (GELA), comparó en 359 pacientes, CHVP + Interferón con o sin rituximab asociado. Se evaluó en una población de LF avanzados en debut de la enfermedad. Se obtuvo una diferencia significativa en tasa de respuesta 94% contra 85% (p = 0,001), remisión completa y remisión completa no confirmada(26).
Analizando un meta-análisis de 7 trabajos con 1943 pacientes con linfomas indolentes el grupo Cochrane de hemopatías malignas concluyó que los pacientes tratados con rituximab y quimioterapia tuvieron mejor supervivencia global (riesgo relativo de mortalidad = 0,65; IC 95%: 0,54 a 0,78) respuesta global (riesgo relativo de respuesta tumoral = 1,21; IC 95%: 1,16 a 1,27), y de control de enfermedad (riesgo de evento de enfermedad = 0,62; IC 95%: 0,37 - 0,98) que los pacientes que solo recibieron poliquimioterapia(27).
Tratamiento en recaída de la enfermedad
El primer estudio que demostró la ventaja de asociar rituximab a los LF en recaída fue realizado por el German Low-Grade Lymphoma Study Group. Este estudio fue realizado en pacientes con LF o linfomas del Manto en recaída o resistencia. Se demostró ventaja en remisión completa y SG con el agregado de Rituximab a un plan de PQT con Fludarabina, Ciclofosfamida y Mitoxantrona (FCM). En el subgrupo de LF la ventaja de remisión completa fue de 94% contra 70% para los pacientes que recibieron rituximab asociado. A 2 años la SG estimada para el grupo que recibió rituximab fue de 90% contra 70% en el grupo que solo recibió quimioterapia(28).
Basado en esta evidencia desde el 1º de enero de 2005 se comenzó con un protocolo para el tratamiento de los LF en recaída y luego con los trabajos publicados en el año 2006 se incorporó el tratamiento con rituximab al debut.
Imatinib en leucemia mieloide crónica
En la clasificación de la OMS de los tumores de origen hematopoyético y linfoide, la leucemia mieloide crónica (LMC) está dentro del grupo de las neoplasias mieloproliferativas. Este síndrome mieloproliferativo crónico, tiene un marcador citogenético el Cromosoma Philadelphia t(9;22) que determina un rearreglo molecular, que forma el gen quimérico BCR-ABL, este gen quimérico formado tiene una actividad de tirosino quinasa no regulada que lleva a la proliferación mieloide. Hay distintas isoformas del gen quimérico BCR-ABL, la más frecuente es la p210 pero se describen también la p190 fundamentalmente en las leucemias agudas linfoblásticas y la p230.
La historia natural de esta enfermedad sin tratamiento cursa por tres fases. La fase crónica, la fase acelerada y la fase blástica. La fase crónica es la forma de presentación habitual de la enfermedad, se caracteriza por hiperleucocitosis con mielemia sin aumento del número de blastos en sangre o médula ósea, suele asociar una esplenomegalia y ocasionalmente síntomas constitucionales. La fase acelerada se diagnostica por: 1) persistencia o aumento de la leucocitosis (> 10 x 109/L) y/o la esplenomegalia que no responden al tratamiento, 2) persistencia de trombocitosis (> 1000 x 109/L) bajo tratamiento, 3) persistencia de trombocitopenia (< 100 x 109/L) no relacionada al tratamiento, 4) evolución citogenética clonal luego del primer cariotipo, 5) más de 20% de basófilos en sangre periférica, y 6) 10-19% de blastos en sangre periférica. La fase blástica se define cuando 1) cuando hay más de 20% de blastos en sangre periférica o en médula ósea, y 2) cuando hay proliferación blástica extramedular(29).
El tratamiento de la LMC pasó por distintas etapas, en primer lugar se controló la proliferación mieloide y el crecimiento esplénico con la radioterapia y el busulfán; la hidroxiurea además de controlar la proliferación mieloide tuvo un impacto en la supervivencia. Luego se iniciaron los trasplantes alogénicos de médula ósea, este tratamiento tiene múltiples dificultades que van desde la necesidad de contar con un donante a complicaciones agudas y crónicas del procedimiento que se acompañan de elevada morbilidad y mortalidad. La otra opción terapéutica utilizada era el uso de interferón alfa recombinante asociando o no citarabina, con estos fármacos se llevo la vida media de los pacientes con LMC a 7 años(29-32).
Leucemia mieloide crónica, evidencia científica que avalaba el uso de imatinib en el año 2004
Tratamiento de la fase crónica
En el año 1995 Druker B et al presentaron por primera vez la evaluación preclínica de un inhibidor selectivo de tirosina-quinasa, el imatinib. En este ensayo se demostró la capacidad del imatinib en disminuir el número de colonias BCR-ABL positivas en un cultivo de sangre de pacientes portadores de LMC(33).
En el año 2002 Kantarjian et al utilizando imatinib demuestran en pacientes con LMC en fase crónica con falla al tratamiento con interferón 95% de respuesta hematológica y 60% de respuesta citogenética mayor(34).
En el año 2003 el estudio clínico IRIS comparó imatinib con lo que era el estándar de tratamiento, interferón con bajas dosis de citarabina en pacientes con LMC en fase crónica al debut de la enfermedad. A 12 meses, 85,2% de los pacientes en el grupo con imatinib obtuvo una respuesta citogenética mayor contra 22,1% en el grupo con interferón y citarabina (p < 0,001), y 96,6% no habían progresado en su enfermedad contra 79,9% en el grupo con terapia combinada (p < 0,001)(35).
En el mismo año se publicaron los datos de Respuesta Molecular Mayor (RMM), la misma se define como el logro de una reducción igual o mayor a 3 logaritmos en el estudio cuantitativo del BCR-ABL. Con 12 meses de seguimiento la RMM fue 39% en el grupo tratado con imatinib contra 2% en el grupo sin esta droga (p < 0,001)(36).
El estudio IRIS presentó una actualización de los datos en el año 2006, la supervivencia global estimada a 60 meses fue de 89% (IC 95%: 86-92). La respuesta citogenética completa estimada fue de 69% a los 12 meses y 87% a los 60 meses. Los datos presentados demostraron además la importancia de la evaluación de respuesta citogenética y molecular, en esta publicación quedó comprobado que el 97% de los pacientes que logran una respuesta citogenética completa a 12 meses no progresaron a 60 meses de control, y que la RMM obtenida a los 12 meses de tratamiento se asoció con un 100% de probabilidad de supervivencia libre de transformación a 60 meses(37).
Tratamiento de las fases acelerada y blástica
En el año 2002 se publicaron dos trabajos fase II con los resultados del imatinib en fase acelerada y fase blástica. Los resultados obtenidos fueron superiores a cualquier tratamiento utilizado previamente en estas etapas evolutivas de la enfermedad.
En fase acelerada se enrolaron 235 pacientes para recibir imatinib. El 82% presentó respuesta hematológica y el 34% respuesta hematológica completa. La respuesta citogenética se obtuvo en un 24% de los casos con 17% de respuestas citogenéticas completas. La supervivencia libre de progresión y la supervivencia global estimadas a 12 meses fueron 59% y 74%, excelentes resultados con un buen perfil de tolerancia y seguridad del tratamiento(38).
En fase blástica se enrolaron en un estudio fase II 260 pacientes, la respuesta global fue 52% con una respuesta hematológica que duró al menos cuatro semanas en el 31% de los pacientes. Se obtuvo respuesta completa en 8% de los pacientes y 18% de los pacientes volvieron a fase crónica. La respuesta citogenética mayor se observó en 16% de los pacientes y 7% obtuvo respuesta citogenética completa. La supervivencia media fue de 6,9 meses. Estos resultados son superiores a los históricos donde se obtenía con poliquimioterapia una supervivencia media de tres meses(39).
Basado en esta evidencia desde el 1º de enero de 2005 se comenzó con una normativa de cobertura financiera del imatinib para pacientes con LMC.
Ambos medicamentos habían sido evaluados desde el punto de vista fármaco-económico en el año 2004 por distintas agencias gubernamentales, para los dos se concluyó que el perfil de costo-efectividad era favorable.
Objetivos
• Analizar una metodología de trabajo generada desde un financiador del sistema de salud (FNR) para el desarrollo de normativas de cobertura basadas en la mejor evidencia científica disponible, para rituximab e imatinib.
• Evaluar sus resultados en lo referido a acceso equitativo, analizando la población de acuerdo a su origen según sea del sector público o privado y según sea procedente de Montevideo o del Interior.
• Evaluar la respuesta terapéutica a ambas drogas, y valorar la misma considerando los trabajos de referencia utilizados para la implementación de la normativa.
• Evaluar el impacto de la normativa en la asistencia hematológica del país y su rol como modelo para la implementación de cobertura financiera de otros MAC.
Material y Métodos
La decisión de la cobertura de los MAC por el FNR requirió un análisis que culminó con el establecimiento de los siguientes criterios de trabajo.
• Exigir un adecuado nivel de evidencia científica para la inclusión de drogas y de indicaciones
• Exigir que estén disponibles estudios de costo-efectividad que comparen los resultados alcanzados con las diversas opciones de tratamiento
• Establecer un grupo de profesionales responsables con independencia técnica y económica
• Contar con un protocolo de indicaciones
• Realizar la autorización de cada tratamiento en un ámbito colectivo (ateneo)
• Establecer que las solicitudes de autorización para utilizar estos medicamentos llegaran acompañadas de un consentimiento informado firmado por el paciente y el médico tratante.
• Implantar un estricto control de que asegure que el paciente ha sido estudiado y analizado completamente desde el punto de vista clínico y para-clínico
• Establecer que las dosis posteriores del medicamento sólo pueden dispensarse luego de recibir un informe médico actualizando la situación del paciente.
• Adherencia del paciente y de la institución de asistencia a aportar datos para la evaluación y seguimiento
• Los especialistas que se integren al sistema deben reunir las siguientes condiciones:
- No mantener vínculos económicos ni dependencia laboral con la industria farmacológica.
- Tener antecedentes suficientes de compromiso con la gestión administrativa y económica en el área de la salud.
• Se estableció además la posibilidad de convocar a consultores extranjeros de corto plazo, especialmente clínicos e investigadores de la región (Argentina, Brasil, Chile). Se establecieron también programas de intercambio de información con agencias de evaluación de tecnología sanitaria de países europeos de referencia (España, Suecia, Francia, Inglaterra).
Metodología para la evaluación de los resultados
Metodología para la evaluación de Rituximab en LNH
Se realizó un estudio prospectivo de la cohorte de pacientes con linfomas no-Hodgkin que iniciaron tratamiento bajo cobertura del FNR entre el 1º enero de 2005 (fecha de inicio de la cobertura por el FNR) y el 30 de junio de 2010.
Fuente de datos
La información se obtuvo de los formularios pre-codificados enviados al FNR por los médicos tratantes. El formulario de solicitud de inicio de tratamiento contiene la información referente al diagnóstico (tipo de linfoma), a la situación clínica de la enfermedad (debut, recaída, remisión parcial, resistencia a tratamiento, progresión lesional u otra situación), estadificación de Ann Arbor, estadificación pronóstica (IPI o IFI para linfomas agresivos o indolentes, respectivam), los antecedentes personales, los tratamientos previos recibidos y el tratamiento propuesto en el protocolo actual con las dosis correspondientes. El formulario de solicitud de dosis posterior contiene la información sobre el número ordinal de dosis a la que corresponde la solicitud, la tolerancia a las dosis anteriores y eventuales efectos secundarios, y la quimioterapia recibida en la serie previa y la propuesta para la serie correspondiente a la dosis de rituximab solicitada en ese formulario.
Para el seguimiento de los pacientes se diseñaron formularios que recogen información al finalizar la tercera serie de tratamiento, al finalizar el tratamiento, a los seis meses de finalizado y luego una vez al año por cinco años. La información establecida en los formularios de seguimiento consiste en la situación del paciente (vivo, fallecido o perdido en el seguimiento), eventualmente causa de fallecimiento, situación de la enfermedad a ese momento (remisión completa, remisión parcial, recaída, progresión lesional u otra), resultado de paraclínica (hemograma, LDH, Beta2 microglobulina y estudios imagenológicos) y la realización de nuevos tratamientos desde el seguimiento anterior.
Toda la información fue ingresada prospectivamente en la base de datos de registros médicos del FNR.
Para la información del fallecimiento y del seguimiento se obtuvo información del registro de fallecimientos del MSP, de la seguridad social y de los formularios de seguimiento. En julio 2011 se realizó una revisión de todos los pacientes de quienes no se tenía información del seguimiento y se envió a la institución prestadora correspondiente un formulario solicitando la actualización de los datos; la fecha de corte establecida para dicho seguimiento fue el 1ro de julio de 2011. De los pacientes que no se obtuvo información se realizó un seguimiento mediante llamadas telefónicas, realizadas por Licenciadas en Enfermería desde el FNR.
Resultados evaluados
Se analizaron los siguientes resultados:
- Supervivencia global, definida como el tiempo desde el inicio del tratamiento por el FNR (Fecha de autorización) hasta la fecha de fallecimiento (evento) o hasta la fecha del último contacto (censura).
- Proporción de pacientes autorizados por año.
- Proporción de pacientes en quienes la autorización quedó pendiente en la primera evaluación realizada por el ateneo; esta proporción se analizó según el año de la solicitud.
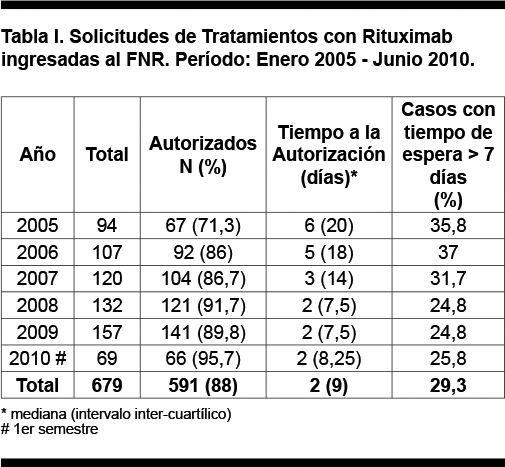
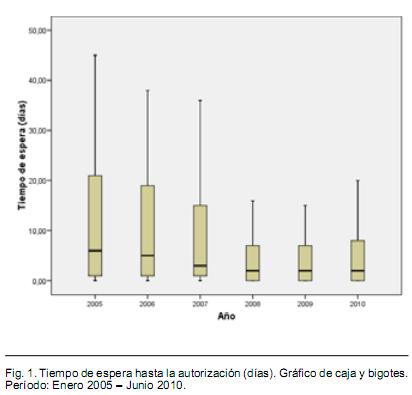
- Tiempo de espera para la autorización, definido como el tiempo entra la fecha de ingreso de la solicitud al FNR y la fecha de autorización. También se analizó la proporción de pacientes con tiempo de espera mayor a 7 días.
- Distribución de los pacientes según la procedencia geográfica (interior o Montevideo) y asistencial (sector público o privado).
Metodología para la evaluación de resultados en Imatinib en LMC
Se realizó un estudio prospectivo de la cohorte de pacientes con Leucemia Mieloide Crónica que iniciaron tratamiento bajo cobertura del FNR entre el 1 enero de 2005 (fecha de inicio de la cobertura por el FNR) y el 31 de diciembre de 2010.
Fuente de datos
La información se obtuvo de los formularios de solicitud enviados al FNR por los médicos tratantes, el cual contiene la información referente al diagnóstico, a la fase de la enfermedad (crónica, acelerada o crisis blástica), a la situación clínica al inicio del tratamiento (debut u otra situación), los datos del hemograma inicial, del mielograma, del estudio citogenético y del estudio molecular. Contienen además la información sobre la estadificación según el índice Sokal al debut de la enfermedad(40), tratamientos previos recibidos y comorbilidades. El formulario de solicitud de dosis mensual informa sobre la situación del paciente (vivo o fallecido), la continuidad o suspensión del tratamiento, la tolerancia y los efectos adversos durante el mes en curso y reporta los datos del hemograma correspondientes a dicho mes. El formulario de solicitud de cambio de tratamiento informa sobre el motivo del cambio (intolerancia/toxicidad o falla al tratamiento).
El seguimiento estuvo protocolizado en el documento de la normativa establecida por el FNR. Dicho protocolo estableció la realización de controles trimestrales o semestrales (de acuerdo a la evolución del paciente), que incluyeran la situación del paciente (vivo o fallecido), la situación clínica (respuesta hematológica, respuesta citogenética y molecular) y el envío de la información correspondiente al FNR en el formulario de seguimiento.
Toda la información fue ingresada prospectivamente en la base de datos de registros médicos del FNR.
Para la información de fallecimiento se obtuvo información del registro de fallecimientos del MSP, de la seguridad social y de la suspensión de los tratamientos (formulario de dosis posterior).
Resultados evaluados
Se analizaron los siguientes resultados:
- Supervivencia global, definida como el tiempo desde el inicio del tratamiento por el FNR (Fecha de autorización) hasta el fallecimiento (evento) o hasta el abandono, suspensión o pérdida de contacto (censura).
- Proporción de pacientes con respuesta citogenética completa y la mejor respuesta citogenética lograda.
La respuesta citogenética se valoró según el número de células en metafase que fueron positivas para el cromosoma Philadephia (Ph+) en la médula ósea. Se consideró respuesta completa a la ausencia de células Ph+, respuesta mayor a la presencia de menos de 35% de células Ph+, respuesta menor a la presencia de 35 a 65% de células Ph+, respuesta mínima a la presencia de 65 a 99% de células Ph+ y respuesta nula a la presencia de 100% de células Ph+.
Análisis Estadístico
Para la descripción de las variables se calcularon proporciones para las variables cualitativas, y medias, desvío estándar, medianas y percentiles para las variables cuantitativas. Para la comparación de proporciones se utilizó el test de chi cuadrado. Para la comparación de medias se utilizaron los test de t y Anova y para la comparación de medianas se utilizaron test no paramétricos (Mann Whitney o Kruskal - Wallis).
Para la estimación de la supervivencia se utilizó el método de Kaplan-Meier y para la comparación se realizaron los test de log rank.
Se utilizó un nivel de significación de alfa = 0,05.
Resultados
Diseño de las normativas para la cobertura financiera de rituximab e imatinib - Modelo operativo de funcionamiento
Se conformó en octubre de 2004 un equipo integrado por un médico del FNR y dos médicos hematólogos asesores externos. Este equipo evaluó la evidencia científica respecto a la efectividad de los tratamientos con rituximab para LNH e imatinib para LMC y, basado en ella, elaboró las normativas de cobertura para dichos tratamientos.
Estas normativas de cobertura, basada en la mejor evidencia disponible enfatizaron como requisito para la aprobación de un tratamiento los siguientes aspectos:
Rituximab en LNH:
• Diagnóstico fehaciente con estudio completo anatomía patológica y utilización del panel de Inmunohistoquímica (IHQ) correspondiente, en consulta con la Sociedad de Anatomía Patológica.
• Evaluación completa, humoral, imagenológica y de médula ósea, que permitiera una correcta estadificación y una evaluación integral del paciente.
• Serología para hepatitis B y C.
• Evaluación cardiovascular, con Ecocardiograma que habilitara el uso de drogas potencialmente cardiotóxicas.
• Planteo y adhesión a plan de quimioterapia validado para la indicación realizada en uso conjunto con Rituximab, con intensidad de tratamiento a dosis plenas y frecuencia adecuada.
• Pautas de seguimiento clínico y paraclínico durante 5 años, con carácter obligatorio y periodicidad establecida.
Imatinib en LMC:
• Diagnóstico fehaciente con mielograma, estudio citogenético y estudio molecular cualitativo.
• Evaluación humoral completa.
• Pautas de seguimiento clínico y paraclínico, con estudio citogenético y molecular (al inicio cualitativo y en la evolución cuantitativo cuando estuviera disponible en el país), de carácter obligatorio con periodicidad establecida por pautas internacionales.
• Posteriormente, ante la aparición de fármacos de segunda línea indicados ante la falla o intolerancia al imatinib, se estableció la obligatoriedad de realizar test de mutaciones que descartaran la presencia de la mutación T315I (mutación que determina resistencia también a las drogas de segunda línea disponibles).
Se elaboraron formularios pre-codificados de solicitud inicial del tratamiento, solicitud de dosis posteriores, de seguimiento y consentimiento informado.
Todos los formularios de solicitudes iniciales, dosis posteriores y seguimiento se ingresaron al sistema informático del FNR, su contenido
forma parte del sistema de bases de datos de la institución y proporciona la información necesaria para el análisis y evaluación de los
resultados.
El sistema estuvo operativo y comenzó a funcionar el 1° de enero de 2005, el modelo de funcionamiento para la evaluación de las solicitudes
recibidas, fue el siguiente:
• Recepción de la misma en secretaría del FNR.
• Ingreso al sistema informático del FNR.
• Consideración de la pertinencia de la indicación por parte de equipo técnico conformado por médicos del FNR y dos hematólogos asesores en reuniones semanales, dónde se acepta, se rechaza o queda pendiente por considerarse necesaria la ampliación de información.
• La resolución adoptada es comunicada por escrito y enviada en el día a la Institución de Asistencia Médica del paciente.
Resultados de la cobertura financiera del rituximab
El 1º de enero de 2005 se inició con la cobertura financiera del rituximab en los LDGCB y en los LF. Para el presente análisis se consideró los pacientes ingresados hasta el 30 de junio de 2010, de manera todos los pacientes tuvieron un seguimiento mínimo de 12 meses.
En el período analizado ingresaron al FNR 679 solicitudes de cobertura financiera de rituximab, se autorizaron 591 (88%) pacientes de los presentados. El número de solicitudes anuales creció en forma progresiva, de 94 casos en el año 2005 a 157 en el año 2009, incremento del 67%. En el año 2005 el 38% de las solicitudes quedaron pendientes de autorización en primera instancia (necesidad de ampliación de información), esta proporción descendió a 24% en el año 2009. El número de pacientes rechazados descendió progresivamente en el período, desde 28,7% en 2005 a 4% en el año 2010 (p < 0,001, test de chi cuadrado de tendencia). La mayor parte de los rechazos de ingreso a la normativa o de retraso en la autorización se debió a estudio de anatomía patológica incompleto, especialmente a falta de diagnóstico inmuno-histoquímico adecuado, como ya fue publicado por Muxí y col.(41). El número de pacientes aprobados para la cobertura financiera del tratamiento creció progresivamente cada año. El tiempo de espera y su dispersión disminuyeron progresivamente en el período. La proporción de pacientes con tiempo de espera mayor a 7 días disminuyó significativamente en el período (p = 0,017, test de chi cuadrado de tendencia). Tabla I y Figura 1.
En lo referido a la procedencia asistencial de los autorizados, 447 (75,6%) pacientes fueron usuarios del sector privado del sistema de salud y 144 (24,4%) del sector público, esta relación se mantuvo constante a lo largo del período de análisis.
Respecto a la procedencia geográfica, 306 (51,8%) pacientes fueron de Montevideo y 285 (48,2%) del interior. El análisis por año de las autorizaciones en lo referido al origen geográfico del paciente muestra que en el 2005 el 64,2% de los pacientes eran de Montevideo y el 35,8% era del interior del país; en los años siguientes prácticamente se igualó el número de pacientes que venían de la capital del país con los del interior, esto queda detallado en la Tabla II.
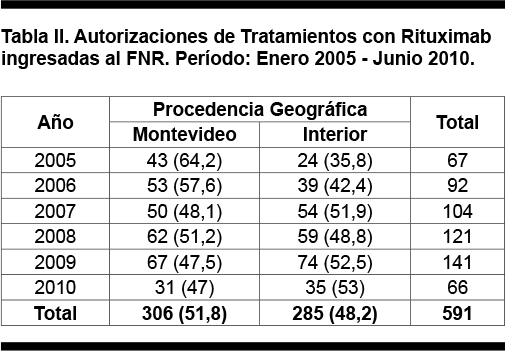
De los 591 pacientes autorizados, 317 fueron de sexo masculino (53,6%) y 274 de sexo femenino (46,4%). La media de la edad fue 55 años (IC 95%, 54-56 años) con un rango entre 9 y 84 años. Doscientos sesenta y ocho pacientes (45,3%) eran mayores de 60 años al momento de la solicitud.
En lo que se refiere al diagnóstico por el cual fueron aprobados, 360 (60,9%) fueron LDGCB, 52 (8,8%) fueron LF grado III y 179 (30,3%) eran LF grados I y II. Por lo tanto 412 (69,7%) pacientes fueron catalogados como linfomas agresivos por ser LDGCB o LF grado III y 179 (30,3%) fueron considerados linfomas indolentes.
Respecto a la situación al momento de la solicitud, 468 (79,2%) se presentaron como debut de la enfermedad y 123 (20,8%) en situación de recaída, progresión o refractarios al tratamiento instituido.
Dada las diferencias en carácter biológico de cada tipo de linfoma (agresivo o indolente), así como en características de los pacientes y oportunidad de tratamiento, se analizaron por separado ambos grupos de pacientes.
Linfomas Agresivos
Se autorizaron 412 pacientes con linfoma agresivo para la cobertura financiera del rituximab, de ellos 360 (87,4%) eran LDGCB y 52 (12,6%) fueron catalogados por el patólogo como LF grado III. La media de la edad fue 54,6 años (rango: 9-84 años), 225 (54,6%) fueron de sexo masculino y 187 (45,4%) de sexo femenino.
Respecto a la situación al momento de la solicitud, 351 (85,2%) se presentaron como debut de la enfermedad y 61 (14,8%) en situación de recaída, progresión o refractarios al tratamiento instituido.
Los pacientes que no estaban en debut de la enfermedad agrupaban a una gran variedad de situaciones clínicas que hacen difícil su análisis, por este motivo se evaluaron los resultados en los pacientes que se autorizaron para primera línea de tratamiento.
En los 351 pacientes en situación de debut de la enfermedad la edad media fue de 54,9 años (rango: 18-84 años) y 163 (46,4%) fueron mayores de 60 años. Ciento ochenta y ocho pacientes (53,6%) fueron de sexo masculino y 163 (46,4%) de sexo femenino.
De acuerdo al informe del patólogo se presentaron como LDGCB 312 pacientes (88,9%) y como LF grado III 39 pacientes (11,1%).
La distribución por estadio de la clasificación de Ann Arbor se presenta en la Tabla III; 60,7% de los pacientes se presentaron al debut de la enfermedad con un estadio III o IV, y el 34,5% se presentó con síntomas B.
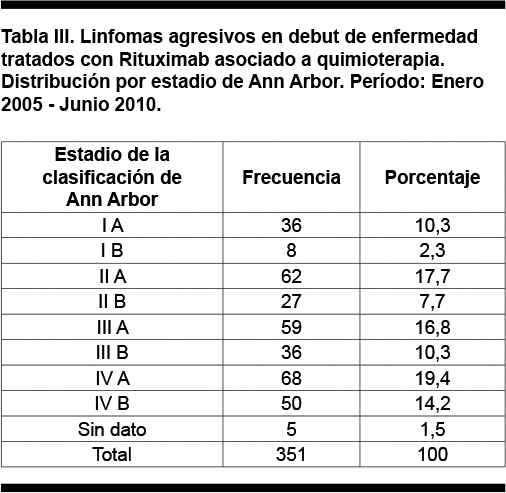
En 52 pacientes no se obtuvo el dato sobre la presencia de enfermedad bulky, de los 299 pacientes con los que se cuenta con el dato, 120 (40,1%) se presentaron con una masa bulky.
Agrupados los pacientes de acuerdo al escore pronóstico IPI, 134 (38,2%) tenían IPI de bajo riesgo con 0-1 factor presente, 107 (30,5%) con IPI de riesgo bajo-intermedio con 2 factores presentes, 79 (22,5%) con IPI de riesgo intermedio-alto con 3 factores presentes y 29 (8,3%) IPI de riesgo alto con 4 o más factores presentes. En 2 casos (0,6%) no se tuvo la información del escore IPI.
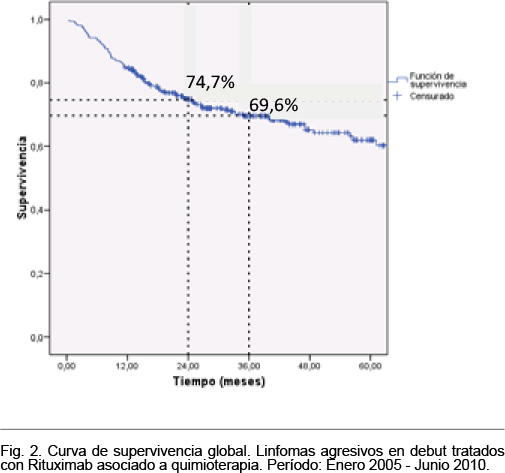
La mediana del período de seguimiento se situó en 38,6 meses (IC 95%: 35,6-41,7); en dicho período ocurrieron 109 fallecimientos. La supervivencia global a 24 y 36 meses fue 74,7% y 69,6%, respectivamente. En la figura 2 se muestra la curva de supervivencia y se señala la supervivencia a 24 y 36 meses.
En el subgrupo de pacientes menores de 60 años la supervivencia global a 2 años fue 76,5% y para los mayores de 60 años fue 72,8%, a 3 años la supervivencia fue 72,5% y 66,3%, respectivamente. La media del tiempo de supervivencia global fue 54 meses, siendo de 57 meses para los menores de 60 años y de 50 meses para los mayores de 60 años (test de log rank, p = 0,074).
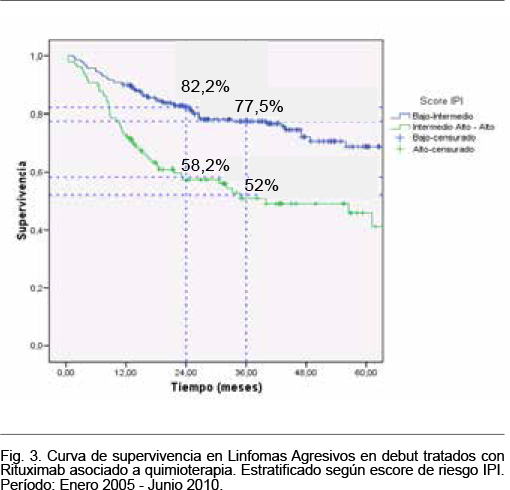
La media del tiempo de supervivencia global de acuerdo al escore de riesgo IPI al debut fue 59,4, 59, 43,3 y 38,2 meses para el subgrupo de pacientes con IPI bajo, bajo intermedio, intermedio-alto y alto, respectivamente. Agrupados los pacientes con escore de riesgo IPI bajo e intermedio bajo tuvieron una media del tiempo de supervivencia global de 59,3 meses, mientras que los pacientes con escore IPI intermedio- alto y alto tuvieron una media del tiempo de supervivencia de 42,9 meses, significativamente menor (test de log rank, p = 0,0001). En la figura 3 se muestra las curvas de supervivencia para los pacientes con linfomas agresivos, agrupados en los dos estratos de riesgo referidos.
Linfomas indolentes
Se autorizó la cobertura financiera para 179 pacientes con linfomas de tipo indolente, todos tenían diagnóstico de LF grado I o II. La media de la edad fue 56,3 años (rango: 19-76 años), 92 pacientes (51,4%) fueron de sexo masculino y 87 (48,6%) de sexo femenino.
De los 179 pacientes autorizados, 117 (65,4%) se encontraban en debut de la enfermedad al momento de la solicitud de cobertura financiera y 62 (34,6%) en situación de recaída, progresión o refractarios al tratamiento instituido.
Linfomas indolentes en debut de enfermedad
Se analizan solamente los 117 pacientes con linfomas foliculares grados I y II en debut de enfermedad. La media de la edad fue de 55,1 años (rango: 19-75) y 69 (59%) tuvieron más de 60 años de edad.
La distribución por sexo mostró que 70 pacientes (59,8%) fueron de sexo masculino y 47 (40,2%) de sexo femenino.
La distribución por estadio de Ann Arbor de los pacientes con linfomas indolentes en debut se presenta en la Tabla IV. El 89,7% de los pacientes se presentó al debut de la enfermedad con un estadio III o IV y el 10,3% se presentó con estadio II. Los síntomas B estuvieron presentes en el 34,2% de los pacientes.
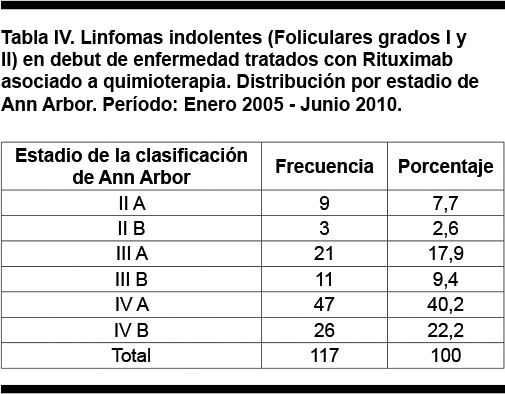
En 101 pacientes se tiene dato sobre la presencia de enfermedad bulky o no, de ellos 28 (23,9%) tenían masa bulky.
Agrupados los pacientes de acuerdo al escore pronóstico FLIPI, 30 (25,6%) tuvieron un valor de FLIPI de bajo riesgo con 0-1 factor de riesgo, 34 (29,1%) un valor de FLIPI de riesgo intermedio con 2 factores de riesgo y 52 (44,4%) un valor de FLIPI de riesgo alto con 3 o más factores de riesgo. En 1 caso (0,9%) no se dispuso del dato del estrato de riesgo de acuerdo al escore FLIPI.
En los 117 pacientes se utilizaron tres planes distintos de quimioterapia asociados al rituximab, en 94 (80,3%) asoció CHOP, en 12 (10,3%) se asoció planes con fludarabina y en 11 (9,4%) asoció CVP.
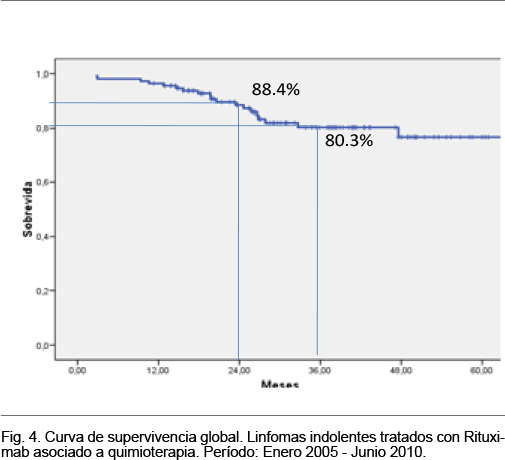
La mediana del período de seguimiento se situó en 34,7 meses (IC 95%: 28,2-41,3); en dicho período ocurrieron 19 fallecimientos. La supervivencia global a 24 y 36 meses fue 88,4% y 80,3%, respectivamente. En la figura 4 se muestra la curva de supervivencia y se señala la supervivencia a 24 y 36 meses.
En el subgrupo de pacientes menores de 60 años la supervivencia global a 2 años fue 90,4% y para los mayores de 60 años fue 85,8%, a 3 años la supervivencia fue 83,8% y 75,5%, respectivamente. La media del tiempo de supervivencia global fue 56 meses, siendo de 57 meses para los menores de 60 años y de 49 meses para los mayores de 60 años (test de log rank, p = 0,53).
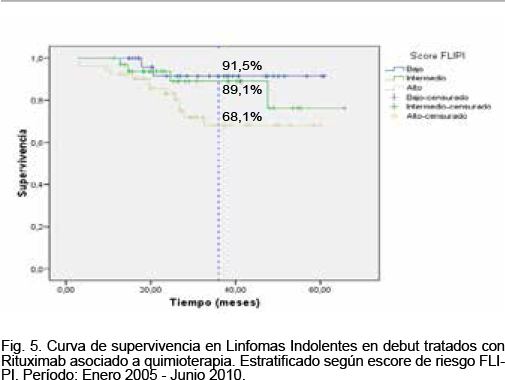
La media del tiempo de supervivencia global de acuerdo al escore de riesgo FLIPI al debut fue 57,3, 58,2 y 47,4 meses para el subgrupo de pacientes con FLIPI bajo (0-1), intermedio (2) y alto (3 o más), respectivamente. La supervivencia a 3 años fue 91,5%, 89,1% y 68,1% para los pacientes con FLIPI de bajo, intermedio y alto riesgo, respectivamente (test de log rank (Mantel-Cox), p = 0,025). En la figura 5 se muestra las curvas de supervivencia para los pacientes con linfomas indolentes en debut, agrupados en los tres estratos de riesgo referidos.
Agrupados los pacientes con escore de riesgo FLIPI bajo e intermedio tuvieron una media del tiempo de supervivencia global de 60 meses, mientras que los pacientes con escore FLIPI alto tuvieron una media del tiempo de supervivencia de 49 meses, significativamente menor. La supervivencia a 3 años fue 90,4% y 68,1% para los pacientes con FLIPI de bajo-intermedio (0-2) y de alto riesgo (3 o más), respectivamente (test de log rank [Mantel-Cox], p = 0,027).
Resultados de la cobertura financiera del imatinib
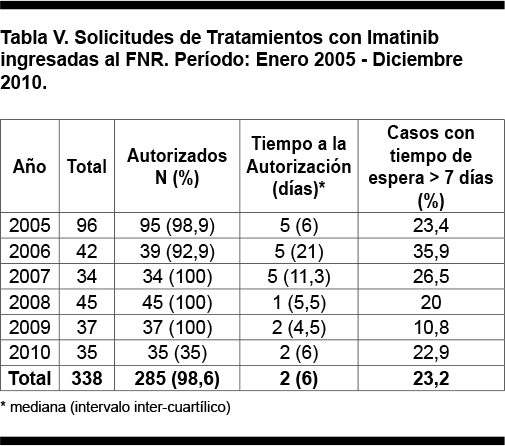
En el período analizado ingresaron al FNR 289 solicitudes de cobertura financiera de tratamiento con imatinib en pacientes con LMC, se autorizaron 285 (98,6%) pacientes de los presentados. El número de solicitudes anuales fue mayor durante el primer año y luego se mantuvo estable. La mediana del tiempo de espera y su dispersión disminuyeron progresivamente en el período (p = 0,032, test de Jonckheere-Terpstra), como se observa en la Tabla V.
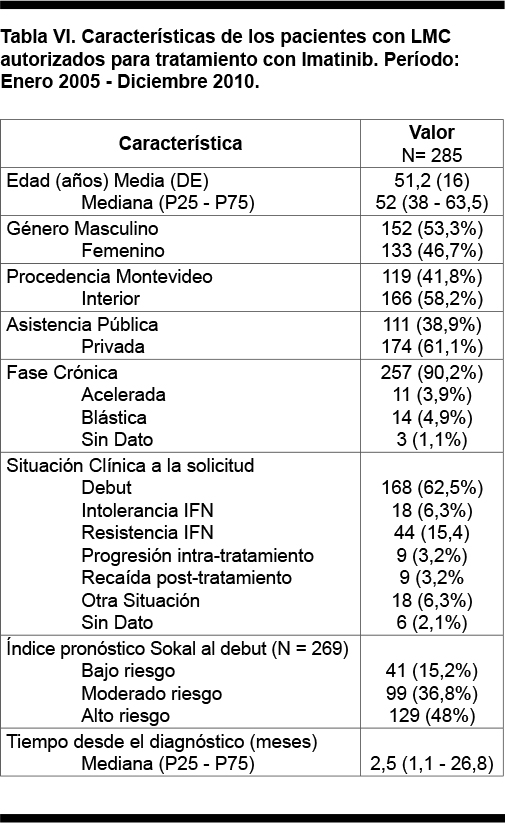
Las características de los pacientes autorizados se muestran en la Tabla VI. En lo referido a la procedencia de los autorizados, 174 (61,1%) pacientes fueron usuarios del sector privado del sistema de salud y 119 (41,8%) pacientes provenían de Montevideo.
De los 285 pacientes autorizados, 152 fueron de sexo masculino (53,3%) y 133 de sexo femenino (46,7%). La media de edad fue de 51,2 años con una mediana de 52 años.
El cromosoma Philadelphia fue positivo en 251 pacientes (88,1%), en 14 (4,9%) fue negativo y en 20 (7%) no se dispuso del dato. El estudio de biología molecular fue positivo para el gen BCR-ABL en 252 (88,4%), negativo en 2 (0,7%) y no se realizó o no se dispuso del dato en 31 pacientes (10,9%). Se dispuso de la información de la isoforma del gen BCR-ABL en 238 pacientes, predominó la isoforma P210 (213 pacientes, 89,5%), seguida por la P190 (16, 6,7%) y otras isoformas en 9 (3,8%).
La mediana desde el diagnóstico hasta el inicio del tratamiento con imatinib bajo cobertura del FNR fue 2,52 meses (1,1 - 26,8). La mayoría de los pacientes (90,2%) se encontraban en fase crónica, 3,9% en fase acelerada y 4,9% en crisis blástica.
De los 285 pacientes, 180 (63,2%) se trataron al debut de la enfermedad y 105 (36,8%) en otra situación.
Doscientos treinta y ocho pacientes recibieron otros tratamientos antes de iniciar el imatinib y en 47 no se informó de otros tratamientos previos. Los tratamientos previos recibidos fueron, interferón en 101 pacientes (35.4%), hidroxiurea en 214 pacientes (75,1%), citarabina en 29 pacientes (10,2%), busulfán en 2 pacientes (0,7%), trasplante alogénico de progenitores hematopoyéticos en 5 pacientes (1,8%) y otros entre los que se cuenta imatinib en 19 pacientes (6,6%).
De los 285 pacientes autorizados, 276 recibieron tratamiento y 9 no fueron tratados (no retiraron el medicamento). De los 276 pacientes tratados, se recabó información de la supervivencia en 274 (99,3%).
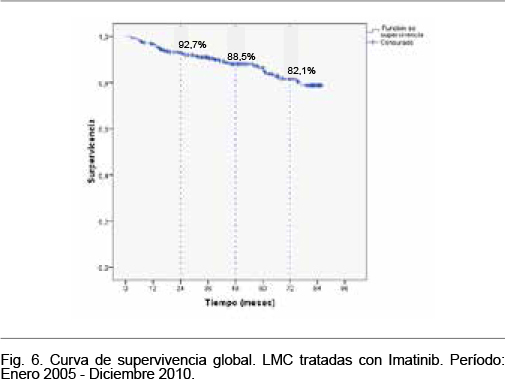
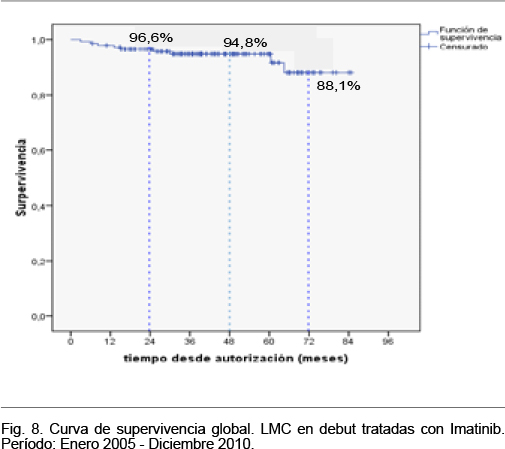
La mediana del tiempo de seguimiento se ubicó en 50,2 meses (P25 33,7 - P75 75,2) y el rango del tiempo de seguimiento varió desde 3 a 85,8 meses. En el período de seguimiento ocurrieron 37 fallecimientos, la supervivencia a diferentes intervalos de tiempo desde la autorización se muestra en la Tabla VII y la curva de supervivencia se muestra en la figura 6.
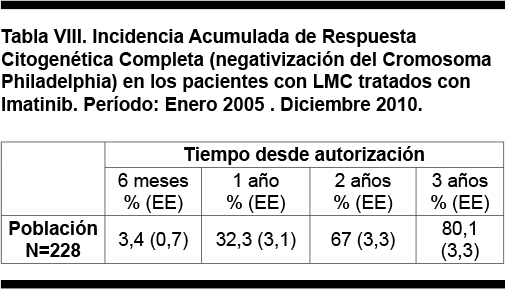
Se obtuvo información del grado de respuesta citogenética en 228 pacientes (82,6%). La mejor respuesta citogenética alcanzada fue Completa en 185 pacientes (81,1%), Mayor en 13 pacientes (4,7%), Menor en 8 pacientes (2,9%), Mínima en 4 pacientes (1,4%) y Nula en 18 pacientes (6,5%).
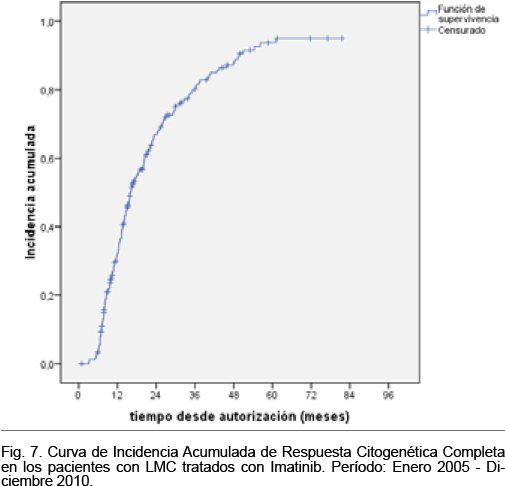
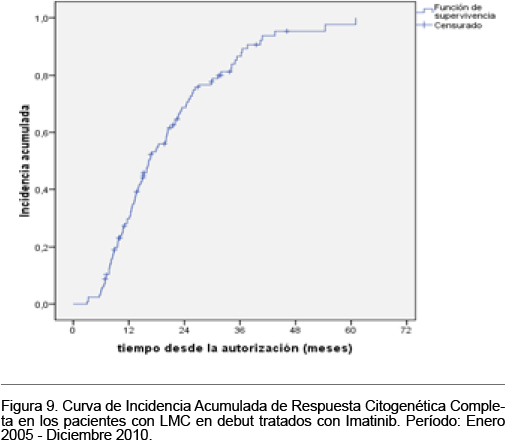
La incidencia acumulada de respuesta citogenética completa a diferentes intervalos de tiempo desde la autorización del tratamiento se muestra en la Tabla VIII y se representa en la figura 7.
Leucemia Mieloide Crónica en debut
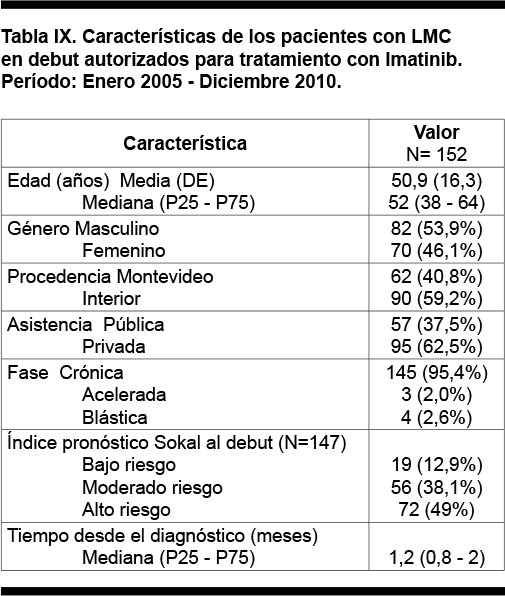
Se consideraron en debut a los 152 pacientes que a la solicitud se encontraban en debut de la enfermedad, con un tiempo de evolución desde el diagnóstico menor a 6 meses y que no hubieran recibido tratamientos previos con excepción de hidroxiurea. En la Tabla IX se muestra las características de este grupo de pacientes.
La edad media fue de 50,9 años (DE 16,3) con una mediana de 52 años, 82 pacientes fueron de sexo masculino (53,9%) y 70 de sexo femenino (46,1%).
Ciento cuarenta y cinco pacientes (95,4%) se encontraban en fase crónica, 3 en fase acelerada (2%) y 4 en fase blástica (2,6%). El 12,9% se presentó con un índice Sokal de bajo riesgo, el 38,1% con uno de riesgo moderado y el 49% con un índice Sokal de riesgo alto. La mediana desde el tiempo del diagnóstico fue de 1,2 meses (P25: 0,6 , P75: 2).
Se muestra los resultados de los 147 pacientes en debut de la enfermedad que recibieron tratamiento, se recabó información de la supervivencia en la totalidad de los mismos.
La mediana del tiempo de seguimiento se ubicó en 42,4 meses (P25: 29,1, P75: 37,5) y el rango del tiempo de seguimiento varió desde 6,6 a 84,8 meses. La supervivencia a diferentes intervalos de tiempo desde la autorización se muestra en la Tabla X y se representa en la figura 8.
Se obtuvo información del grado de respuesta citogenética en 125 pacientes (85%). La mejor respuesta citogenética alcanzada fue Completa en 104 pacientes (83,2%), Mayor en 7 pacientes (5,6%), Menor en 4 pacientes (3,2%), Mínima en 3 pacientes (2,4%) y Nula en 7 pacientes (5,6%).
La incidencia acumulada de respuesta citogenética completa a diferentes intervalos de tiempo desde la autorización del tratamiento se muestra en la Tabla XI y se representa en la figura 8.
Incorporación de otros MAC
Luego de la experiencia inicial con estas dos drogas y siguiendo el mismo modelo operativo se incorporaron otros MAC.
En la hematología se incorporaron:
• Nuevas indicaciones para rituximab, mantenimiento en Linfomas Foliculares y Linfoma del Manto.
• Bortezomib para el Mieloma Múltiple de alto riesgo, refractarios y en insuficiencia renal.
• Timoglobulina para la Aplasia de Médula Ósea.
• 2-Cloro Deoxiadenosina para la Tricoleucosis.
En otras especialidades se incorporaron:
• Sunitinib y Sorafenib para el Cáncer Renal Metastásico.
• Interferon pegylado y Ribavirina para la infección por virus de la Hepatitis C.
• Palivizumab para la profilaxis de la infección por Virus Sinicial Respiratorio (VRS) en niños.
• Bevacizumab para el Cáncer Colo-rectal avanzado.
• Análogos de insulina de acción prolongada para el tratamiento de la Diabetes Mellitus.
• Trastuzumab, Lapatinib y Fulvestran para el tratamiento de Cáncer de Mama.
• Tobramicina inhalatoria y Alfa-dornasa para el tratamiento de la Fibrosis Quística.
• Interferón Beta y Acetato de Glatiramer para el tratamiento de la Esclerosis Múltiple.
• Temozolamida para el tratamiento del Glioblastoma Multiforme.
• Anti-TNF para el tratamiento de la Artritis Reumatoidea y la Enfermedad de Crohn.
• Erlotinib y Gefitinib para el tratamiento del Cáncer de Pulmón.
• Bosentan e Iloprost para el tratamiento de la Hipertensión Pulmonar.
• Valganciclovir en el tratamiento y profilaxis de infecciones por Citomegalovirus (CMV) en pacientes trasplantados de órganos sólidos.
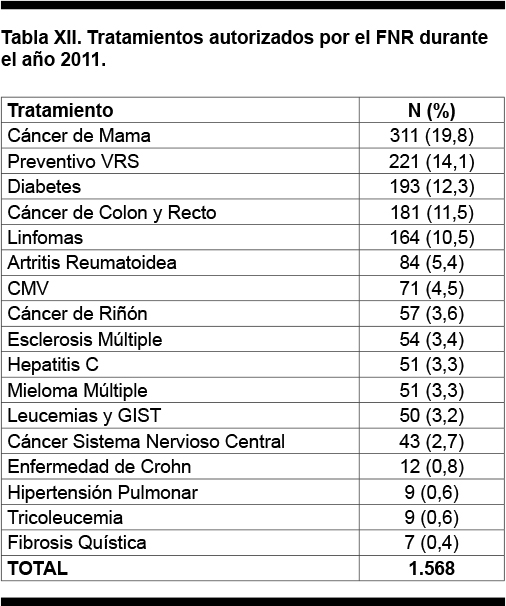
En la Tabla XII se muestra los tratamientos autorizados por el FNR durante el año 2011.
Discusión
La sistemática de trabajo desarrollada para la gestión de la cobertura de medicamentos por el FNR se engloba dentro de los sistemas de autorización previa y sigue en algunos aspectos el modelo de gestión histórica del FNR. Sin embargo, en muchos otros aspectos fue innovador, centralizando en un prestador del sistema parte del proceso de cuidado de algunas enfermedades y promoviendo desde ese prestador la aplicación de protocolos de diagnóstico, tratamiento y seguimiento alineados con la mejor evidencia científica disponible. Estos sistemas de autorización previa se han utilizado para la gestión de medicamentos, especialmente para los de alto costo, en otros sistemas e instituciones de salud y también han mejorado los resultados y la calidad de la utilización de los algunos MAC42,43. La aplicación inicial de este sistema al imatinib y al rituximab, además de mejorar el acceso a estos medicamentos y obtener los resultados que se discuten más adelante, generó un modelo que se aplicó luego a los otros MAC incluidos actualmente bajo la cobertura financiera del FNR.
Discusión sobre los resultados de la población autorizada para cobertura financiera de rituximab
La Comisión Honoraria de Lucha Contra el Cáncer (CHLCC) publicó para el período 2002/2005 una tasa ajustada anual de incidencia de LNH en el Uruguay de 9,1/100.000 habitantes de sexo masculino y de 6,3/100.000 habitantes de sexo femenino, esto sugiere que en el Uruguay debería haber unos 350-400 casos nuevos de LNH por año. La cobertura del FNR abarca aproximadamente a 3.100.000 de personas, por lo que se podía estimar que para la población cubierta por el FNR habría unos 320 LNH/año. No hay un estudio de la CHLCC sobre la incidencia de los distintos tipos de linfoma. El estudio de Gualco y colaboradores sobre 104 pacientes en el Hospital Militar encontró una incidencia de LF y LDGCB similar a la referida en los estudios internacionales.7 Según este estudio los LF y LDGCB constituyen aproximadamente el 56% de los LNH. Se puede estimar de acuerdo a estos datos que debería haber unos 160-180 casos nuevos por año de LF y LDGCB. Todos los LDGCB deberían ser tratados con inmunoquimioterapia, pero en el grupo de los LF sólo deberían recibir la medicación los estadios III y IV sintomáticos o algún estadio II bulky abdominal de difícil acceso a la radioterapia. Al debut, 70% de los LF se encuentran en estadio III o IV, pero no todos ellos requieren tratamiento, es difícil estimar cuántos de estos LF estadio III-IV tienen indicación de iniciar terapia oncoespecífica, ya que el deseo del paciente a ser tratado y otras variables clínicas son también determinantes en la decisión.
En el período considerado desde el 1 de enero de 2005 al 30 de junio de 2010 (66 meses) se presentaron ante el FNR 679 solicitudes de tratamiento con rituximab para LDGCB, o LF y se autorizaron 591 tratamientos. Previo a esta normativa se realizaban en el Uruguay aproximadamente 20 tratamientos con rituximab por año.
El número de solicitudes anuales creció en forma progresiva, de 94 casos en el año 2005 se llegó a 157 en el año 2009, incremento del 67% en las solicitudes anuales. De acuerdo a los datos de incidencia de estas patologías y a la pertinencia o no de indicar un tratamiento, 157 casos por año está dentro de lo que fue estimado por el FNR en la previsión de casos anuales. El crecimiento de solicitudes con respecto al inicio de la normativa refleja, por un lado la incorporación en el año 2006 de los LF en primera línea de tratamiento, con un promedio de 23 casos por año, y por otro lado, la progresiva adhesión del cuerpo médico y de las instituciones de asistencia a las normativas que exigía el FNR para la cobertura financiera del rituximab. Fue necesaria la adaptación de los médicos a trabajar siguiendo una normativa que exigía un diagnóstico y evaluación acorde a los estándares internacionales, un tratamiento quimioterápico ajustado a la normativa del FNR y un seguimiento programado. A su vez las instituciones de asistencia debieron ceñirse a las exigencias de la normativa en lo referido a soporte diagnóstico y de evaluación del paciente. El porcentaje de rechazos cayó progresivamente del 28% en el 2005 al 4% en el año 2010, a su vez en el año 2005 el 38% de las solicitudes quedó pendiente en su primera evaluación en el FNR mientras que en el año 2009 quedó pendiente el 24%. La mayor parte de los rechazos de ingreso a la normativa y de retraso en la autorización se debió a estudio de anatomía patológica incompleto, especialmente a falta de diagnóstico inmunohistoquímico adecuado; en un análisis publicado en el año 2009 el 47% de los rechazos se debían a esta causa(41). Las exigencias del FNR uniformizaron los diagnósticos a la clasificación de la OMS y generalizaron el uso de la inmuno-histoquímica en todo el país, determinando además un estándar de evaluación, tratamiento y seguimiento de los linfomas.
En el año 2005 el 64,2% de los pacientes autorizados para el uso de rituximab procedía de Montevideo y el 35,8% lo hacía del interior del país, en los años siguientes crecieron porcentualmente las autorizaciones para pacientes del interior lográndose un equilibrio en el año 2007. Al final del período de análisis, 51,7% fue para pacientes de Montevideo y el 48,3% para pacientes del interior. Aún resta crecer el número de casos procedente del interior para lograr un estimado de entre 50 y 60% de acuerdo al último Censo del Instituto Nacional de Estadística. Parte de esto puede ser explicado por un número de pacientes derivados a Montevideo para su tratamiento.
Este crecimiento de autorizaciones para pacientes del interior hasta llegar a un nivel próximo a lo esperado para la distribución demográfica del país, expresa la actualización de los centros de asistencia del interior impulsados por las exigencias de las normativas del FNR y por cursos y seminarios de actualización referidos al tema llevados adelante por la Sociedad de Hematología del Uruguay y por la Cátedra de Hematología de la Facultad de Medicina de la Universidad de la República.
Hubo un desbalance en lo referido al origen de los pacientes según provinieran de la asistencia pública o privada. Porcentualmente el mismo se mantuvo estable en el período de análisis con 24,4% de los pacientes procedentes del sector público. Es difícil evaluar los motivos de esta diferencia, los mismos pueden ser, un nivel socio-cultural del paciente que determine una consulta tardía, dificultad de acceso a especialistas en algunos centros de asistencia pública, o falta de infraestructura en los mismos que permita un correcto estudio de los pacientes.
Es de destacar que si bien la proporción de pacientes autorizados del sector público se mantuvo estable y por debajo de lo esperado en los años analizados, el porcentaje de pacientes que están bajo la cobertura del FNR provenientes de la asistencia pública ha descendido con la implementación del Sistema Nacional Integrado de Salud, por este motivo se puede inferir que ha mejorado el porcentaje de pacientes en este sector que accede al beneficio del rituximab. Actualmente entre el 25 y 30% de los pacientes bajo cobertura del FNR es del sector público. No se puede ser más preciso en la evaluación de la distribución sector público contra sector privado ya que no se tienen datos completos referidos al tipo de cobertura que tiene el país.
El análisis de la población de 591 pacientes autorizados muestra un predominio del sexo masculino, 53,6% contra 46,4%, esto está de acuerdo con los datos internacionales y nacionales de predominio de esta patología en el sexo masculino.
En lo que se refiere al diagnóstico de tipo de linfoma predominan los LDGCB que constituyeron el 60,9% del total, este predominio era esperado ya que es más frecuente este linfoma que el LF, además porque este último no siempre requiere de rituximab para su tratamiento. La procedencia de los diagnósticos anátomo-patológicos desde distintos centros generó una dificultad en la diferenciación entre LDGCB y LF grado III, esto, a los efectos del análisis de los resultados del tratamiento tiene un importancia menor ya que estas dos entidades fueron agrupadas como linfomas agresivos.
De los 591 pacientes autorizados, 468 (79,2%) eran debut de la enfermedad y 123 (20,8%) estaban en situación de recaída, progresión o refractarios al tratamiento instituido. Para el estudio de los resultados obtenidos bajo la cobertura del rituximab se analizaron los pacientes en debut de enfermedad ya que el grupo de los pacientes bajo otra situación clínica era muy heterogéneo.
Discusión sobre los resultados en linfomas agresivos con la cobertura financiera de rituximab:
La discusión de los resultados obtenidos con el rituximab asociado a CHOP en el FNR obliga a tener publicaciones de referencia. El estudio GELA fue el estudio que determinó el uso de rituximab en los LDGCB, este ensayo clínico y los del US Intergroup, Ricover y Hovon-Nordic sólo incluyeron pacientes mayores de 60 o 65 años, a su vez el estudio MInT se realizó en pacientes menores de 60 años con escore IPI bajo, todos ellos solo incluyeron LDGCB al debut sin considerar foliculares grado III o transformados, estos dos últimos de aceptado peor pronóstico (13-18). La publicación hecha por la BCCA excluyó a los LDGCB transformados de un indolente y a los LF grado III pero incluyó a todas las edades, con una media de edad de 64 años (rango: 19-86).19 No es posible comparar los resultados del FNR con los trabajos mencionados, los cuatro primeros son protocolos de investigación con estrictos criterios de inclusión y exclusión que determinan poblaciones distintas a la analizada; a su vez el trabajo publicado por la agencia canadiense si bien es sobre práctica clínica evaluó solamente LDGCB. De todas maneras a los efectos de discutir si los resultados obtenidos con la normativa del FNR son aceptables estos trabajos deben considerarse la referencia.
Los 351 pacientes que se presentaron como debut tenían una edad media de 54.9 años, 163 (46,4%) eran mayores de 60 años y 188 (53,6%) eran de sexo masculino. En el grupo del FNR la edad media fue 10 años menor que en el trabajo de la BCCA(19).
La distribución por estadio de Ann Arbor mostró que el 60,7% de los pacientes se presentó al debut de la enfermedad con un estadio III o IV y el 40,1% se presentó con enfermedad bulky. En el trabajo canadiense el 64% se presentó en estadio III-IV y el 38% tenía enfermedad bulky. En lo referido al escore de riesgo IPI, en los tratados bajo la cobertura del FNR el 30,8% fueron de riesgo intermedio-alto o alto, mientras que en el estudio canadiense el 49% se presentó con un IPI de riesgo. Por lo tanto las características de los pacientes de Canadá indican que los LF grado III y los transformados no fueron incluidos y que tenían una media de edad 10 años mayor, una estadificación y presencia de enfermedad bulky similares pero un IPI de mayor riesgo(19).
Con una mediana de seguimiento de 38,6 meses, la supervivencia global de los 351 pacientes en debut con linfoma agresivo a los 24 meses es de 74,7% y a 36 meses es de 69,6%. En el trabajo de la BCCA, 152 pacientes con una media de seguimiento de 24 meses presentaron una supervivencia global estimada de 78%(19). Si bien no es válido hacer la comparación estadística, los resultados del en la población cubierta por el FNR parecen estar dentro de los parámetros esperados.
Las curvas de supervivencia de acuerdo a edad mayor o menor de 60 años o IPI reproducen las diferencias encontradas en trabajos internacionales referidos para los LDGCB. En la población del FNR los pacientes menores de 60 años tuvieron una supervivencia global que fue algo mejor que para los mayores de 60 años pero sin lograr diferencia estadísticamente significativa. La media de supervivencia global estimada es 57 meses para los menores de 60 años y de 50 meses para los mayores de 60 años. El análisis de supervivencia global de acuerdo a estratificación por IPI confirma la utilidad de este sistema pronóstico en la población uruguaya. Los pacientes con IPI de bajo riesgo (0, 1 y 2) o de alto riesgo (3 o mayor) tuvieron diferencias significativas en la sobreviva (59,3 meses contra 42,9 meses, respectivamente) (p = 0,0001). La estratificación de acuerdo al IPI permite al médico tratante brindar información certera al paciente y su familia de los resultados en nuestro país.
Discusión sobre los resultados en linfomas indolentes con la cobertura financiera de rituximab
El análisis de los resultados del FNR en linfomas foliculares grado I y II debe tener como referencia el trabajo de Marcus R et al, este estudio demostró por primera vez un impacto en supervivencia global en los linfomas foliculares indolentes si se asociaba el rituximab a la quimioterapia. Este trabajo analizó en 162 pacientes tratados con CVP asociado a rituximab y lo comparó con 159 pacientes que sólo recibieron CVP. El grupo que recibió la inmuno-quimioterapia tenía una mediana de edad de 52 años, el 70% de los pacientes tenía un estadio IV y un 28% estadio III. El 49% se presentó con un escore FLIPI 0-2 y el 44% con un escore 3-5. El 39% tenía enfermedad bulky.
La población autorizada del FNR para tratamiento con rituximab por un linfoma folicular grado I o II fue de 179 pacientes, de ellos 117 estaban en debut. El 59,8% eran de sexo masculino y el 40,2% de sexo femenino; esto es lo esperado estadísticamente de acuerdo a la incidencia de este linfoma según género. La edad media fue de 55,1 años similar a la del trabajo citado como referencia. El 64,4% estaba en estadio IV y el 27,3% en estadio III, con 23,9% de pacientes con masa bulky. El 54,7% de los autorizados tenía un FLIPI 0-2 y el 44,6% tenía un FLIPI de 3 o mayor. Estas dos poblaciones son entonces muy similares.
Los pacientes incluidos en la normativa del FNR asociaron al rituximab diferentes planes de quimioterapia, 94 recibieron CHOP, 12 planes con fludarabina y 11 fueron tratados con CVP. En el trabajo de Marcus R et al.(23) todos los pacientes recibieron CVP; no hay al momento actual ningún trabajo que muestre diferencias estadísticamente significativas entre los distintos planes de quimioterapia que se utilizan en los linfomas foliculares indolentes.
La población de 117 pacientes en debut tratados bajo cobertura del FNR tuvo una mediana de seguimiento de 34,7 meses y alcanzó una supervivencia global a 24 meses de 88,4% y a 36 meses de 80,3%, con una media de supervivencia global estimada de 56 meses. La población del trabajo mencionado como referencia tuvo a 30 meses una supervivencia global estimada de 89%(23). En una actualización de resultados publicada en el año 2008 con una mediana de seguimiento de 53 meses la supervivencia global a 4 años fue 83%(24). En el trabajo de Herold M et al en linfomas foliculares avanzados, en una actualización realizada en el año 2007, el grupo que recibió R-MCP e interferón como mantenimiento tuvo a 4 años una supervivencia global de 87%(25-44).
Las diferencias entre los trabajos que fueron citados como evidencia científica para incorporar el rituximab en el tratamiento de los linfomas foliculares del FNR y la población que se autorizó para la cobertura del rituximab son múltiples. Los trabajos mencionados son ensayos clínicos bajo estricto protocolo con criterios de inclusión y exclusión para portadores de linfoma folicular a ser tratados en centros de referencia pertenecientes a grupos cooperativos. La población del FNR que fue tratada con inmuno-quimioterapia tenía como única exigencia estar en condiciones de recibir a dosis plenas de un tratamiento avalado por la normativa. En estas condiciones consideramos que la supervivencia global obtenida de 88,4% y 80,3% a 24 y 36 meses está dentro de los parámetros esperados.
Estratificando los pacientes por FLIPI hay una diferencia en la supervivencia entre los distintos niveles de riesgo que es significativa. Agrupados los pacientes en FLIPI 0-2 y 3 o más como lo hace el trabajo de Marcus R et al. la mediana de supervivencia es de 60 y 49 meses, respectivamente. Al ser una entidad de evolución indolente seguramente se podrán apreciar mayores diferencias en supervivencia global en análisis a realizar de futuro con seguimientos más prolongados.
Como en todo linfoma indolente que tiene una expectativa de vida media prolongada el ideal sería poder contar con la supervivencia libre de eventos, los resultados fueron analizados pero carecen de la confiabilidad necesaria para su publicación.
En forma global los resultados obtenidos bajo la cobertura de tratamiento del FNR en los pacientes tratados con rituximab tanto en linfomas agresivos como en los indolentes son los esperados teniendo en cuenta la bibliografía de referencia utilizada en el desarrollo de la normativa.
Discusión sobre los resultados de la población autorizada para cobertura financiera de imatinib
En el período de enero de 2005 a julio de 2010 se autorizó el tratamiento para 285 pacientes con LMC, la procedencia de los mismos mostró que, 174 (61,1%) pacientes eran usuarios del sector privado del sistema de salud y 111 (38,9%) del sector público, de Montevideo provenían 119 (41,8%) pacientes y del interior 166 (58,2%). No tenemos datos nacionales de incidencia de la LMC. Según datos del Instituto Nacional del Cáncer de los Estados Unidos de Norte-América (EUA) la incidencia es de 2,1/100.000 para el sexo masculino por año y de 1,2/100.000 para el sexo femenino, con una incidencia ajustada por edad de 1,6/100.000 hombres y mujeres por año. La mediana de edad reportada es de 64 años. De acuerdo a estos datos se podría estimar en el Uruguay unos 40-50 casos por año. En los 6 años analizados se autorizaron 285 tratamientos, 180 fueron catalogados como debut de enfermedad, esto es debido a que 105 casos de los autorizados eran LMC evolucionadas que se acogieron a la cobertura del FNR en el momento de su implementación. La autorización de 180 pacientes en 6 años arroja un promedio de 30 pacientes por año, algo por debajo de lo esperado si Uruguay tuviera una incidencia de LMC similar a la reportada en EUA.
El diagnóstico de LMC a través de la confirmación citogenética está disponible en el Uruguay desde hace largo tiempo, esto determinó una fácil integración de pacientes a la normativa, esto se refleja en que los porcentajes de pacientes del sector público y privado de la asistencia, así como la distribución entre Montevideo e interior fueron las esperadas. De cualquier manera también hubo una mejoría en el proceso y en a forma que llegaron las solicitudes al FNR que permitió acortar significativamente los tiempos de espera para la autorización.
Hubo un predomino de sexo masculino debido a una mayor incidencia de esta patología en este género, de los 285 pacientes autorizados, 152 fueron de sexo masculino (53,3%). La media de edad de 51,2 años con una mediana de 52 años fue menor a lo esperado ya que la mediana de esta enfermedad al diagnóstico es de 64 años. Esto puede sugerir que a algunos pacientes de edad avanzada no estarían llegando a la posibilidad de tratamiento con imatinib, a pesar de la existencia de estudios que muestran el beneficio de los inhibidores de tirosino quinasa independientemente de la edad.
Discusión sobre los resultados en leucemia mieloide crónica con la cobertura financiera de imatinib:
De los 276 pacientes tratados, se recabó información de la supervivencia en 274 (99,3%) durante un tiempo de seguimiento de 50,2 meses (mediana). Los resultados de supervivencia global y respuesta citogenética completa del total de esta población presentados son difíciles de comparar con los trabajos de referencia debido a lo heterogéneo del grupo. De todas maneras se destaca que la supervivencia global a 2 años es de 92,7% y que en 228 pacientes (82,6%) se logró un seguimiento citogenético adecuado con 80,1% de respuesta completa a 3 años.
Se realizó un análisis de los 152 pacientes que a la solicitud se encontraban en debut de la enfermedad, con un tiempo de evolución desde el diagnóstico menor a 6 meses y sin haber recibido tratamientos previos con excepción de hidroxiurea. Se mostraron los resultados de los 147 pacientes en debut de la enfermedad que recibieron tratamiento.
La edad media de estos 147 pacientes fue de 50,9 años con una mediana de 52 años, 83 pacientes eran de sexo masculino (53,9%). La edad media fue similar al trabajo IRIS, tomado como referencia, en esta publicación la misma fue de 50 años, con 61% de los enrolados de sexo masculino.35
Noventa y cinco por ciento de los pacientes estaban en fase crónica, 3 en fase acelerada (2%) y 4 en fase blástica (2,6%). El 12,9% se presentó con un Índice Sokal de bajo riesgo, el 38,1% con un Índice Sokal de riesgo moderado y el 49% con un Índice Sokal de riesgo alto, La mediana desde el tiempo del diagnóstico fue de 1.2 meses. En el estudio IRIS el 48,2% de la población se presentó con un índice Sokal de bajo riesgo, el 29,7 lo hizo con un índice Sokal de riesgo moderado y el 22,1% con un índice Sokal de riesgo alto(35).Con una mediana del tiempo de seguimiento de 42,4 meses la supervivencia global a 2 años fue 96,6% y a 5 años fue 94,4%. Con una mediana de seguimiento de 60 meses la supervivencia global estimada a 5 años en el trabajo IRIS fue 89% (IC 95% 86-92)(37).
Con el seguimiento adecuado en 125 pacientes (85%) la incidencia acumulada de respuesta citogenética completa fue de 68,4% a 2 años y de 86,4% a 3 años del diagnóstico de la enfermedad. En el estudio IRIS, 69% de los pacientes lograron respuesta citogenética completa a los 12 meses de iniciado el imatinib, y a los 60 meses el 87%, la curva se estabilizó luego de los 2-3 años(37). Se observó un retraso respecto al trabajo IRIS en lograr la respuesta citogenética completa. El mismo se puede deber a la baja proporción de pacientes con información de los estudios citogenéticas a los 12 y 24 meses. Es de destacar, que a los tres años de seguimiento, con información adecuada, la tasa de respuesta citogenética completa es similar. La importancia de esto radica en su valor pronóstico, los pacientes que logran remisión citogenética completa tienen un riesgo de progresión de la enfermedad menor a 3%.
No es válido desde el punto de vista estadístico comparar los resultados del IRIS con los obtenidos en la población del FNR, pero si los primeros son tomados como referencia los datos del análisis de la población del FNR parecen adecuados.
Incorporación de nuevos medicamentos a la cobertura del FNR
La eficiencia mostrada por el modelo, su impacto en la calidad de la asistencia y los buenos resultados mostrados en evaluaciones anteriores realizadas en el año 2008, estimularon a reproducir el modelo con otros MAC. Prueba de ello es la gran variedad que se han ido incorporando a la cobertura, como se mostró en los resultados. La cobertura se inicia luego que la normativa está redactada, discutida y aprobada. Las normativas de todos los medicamentos cubiertos están en el sitio web del FNR, así como los formularios y los otros documentos que deben ser presentados. En el año 2011 se autorizaron más 1.500 tratamientos con MAC bajo la cobertura del FNR, y el impacto presupuestal de los medicamentos superó el 30% del presupuesto anual del FNR. Los resultados de los pacientes tratados con la mayoría de dichos tratamientos ya han sido evaluados, se han realizado correcciones en el proceso cuando correspondió y los resultados han sido presentados en diferentes eventos científicos nacionales e internacionales.
Conclusiones
El FNR otorga financiamiento a prestaciones médicas altamente especializadas, en el año 2004 decidió incorporar a su función la cobertura financiera de MAC. La premisa, al igual que para las prestaciones médicas, fue que tuvieran demostrada efectividad y que las mismas estuvieran disponibles con equidad para toda la población del país. Además debía asegurarse la calidad de la prestación y su sustentabilidad económica y financiera.
Las normativas para imatinib y rituximab se basan en evidencia científica de trabajos fase III con impacto en calidad de vida y supervivencia global.
A través de estas normativas la financiación de estos MAC está disponible para toda la población en forma equitativa. Si bien inicialmente hubo una asimetría en su utilización con una aparente subutilización por parte de los pacientes del interior del país y de la asistencia pública la misma se ha corregido para la población del interior y ha mejorado para los pacientes del sector público de la asistencia. Las instituciones de asistencia del interior y los centros de asistencia pública se adecuaron a las normativas mejorando la calidad de su prestación asistencial, esto determinó un aumento progresivo en el número anual de pacientes que accedieron a los tratamientos.
Las normativas a través de sus exigencias de diagnóstico, evaluación, tratamiento y seguimiento han mejorado la calidad de la asistencia hematológica del país. Se han igualado estos parámetros en todos los centros asistenciales del país, independientemente que los mismos sean públicos o privados, del interior o de Montevideo.
La normativa del rituximab uniformizó el diagnóstico de los linfomas a la clasificación de la OMS y generalizó el uso de la inmuno-histoquímica en el país. Permitió homogeneizar los tratamientos de los linfomas e incluir el rituximab en los mismos, de forma que los protocolos utilizados son de eficacia y eficiencia demostrada en trabajos científicos válidos, con impacto en la supervivencia. Pautó un programa de seguimiento a 5 años para todos los pacientes. En 66 meses se beneficiaron del rituximab 591 pacientes cuándo antes de la normativa lo recibían unos 20 pacientes por año.
La normativa del imatinib permitió el tratamiento de 285 pacientes con LMC, además determinó que hoy todos los pacientes tengan un diagnóstico citogenético y molecular, que se haga un seguimiento citogenético pautado y que se haya incorporado al país la cuantificación molecular del re-arreglo BCR-ABL, patrón de seguimiento estándar en la medicina del más alto nivel. En forma secundaria y a través de las exigencias para drogas de uso en resistencia o intolerancia al imatinib se impuso el estudio de mutaciones del gen BCR-ABL para estos pacientes. Hoy los pacientes con LMC del país son diagnosticados, tratados y evaluados en su respuesta de acuerdo a criterios internacionales.
Analizados los resultados de estas dos normativas los mismos reflejan un trabajo de alta calidad en diagnóstico, evaluación, tratamiento y seguimiento. Los resultados de supervivencia global y de respuesta al tratamiento son los esperados de acuerdo a los trabajos de referencia utilizados en el diseño de las normativas.
La implementación de estas normativas ha mejorado la asistencia hematológica del país, esto se debe no sólo a la mejora de la asistencia de las patologías bajo cobertura, sino al impulso brindado por la incorporación de tecnología en el diagnóstico que ha impactado en el estudio de otras enfermedades de la especialidad.
En suma las normativas de cobertura de rituximab e imatinib, brindaron la posibilidad del uso universal y equitativo de estas drogas y mejoraron la calidad de asistencia de las patologías contempladas, esto se refleja en la obtención de resultados comparables con estándares internacionales. Además sirvieron como modelo operativo para la implementación de otras normativas de cobertura de MAC.
Declaración de conflictos de intereses
Dr. Pablo Muxí, recibió honorarios del laboratorio Roche por una conferencia en Córdoba, República Argentina en octubre de 2010. Concurrió a congresos organizados por la Sociedad Europea de Hematología y por la Sociedad Americana de Hematología con financiamiento del Laboratorio Roche. Concurrió al Congreso de Controversias en Hematología y Trasplante de Médula Ósea de los años 2010 y 2011 con financiación del Laboratorio Novartis.
Dr. Fernando Correa, declara no tener conflicto de intereses con la industria farmacéutica.
Dr. Henry Albornoz, declara no tener conflicto de intereses con la industria farmacéutica.
Dr. Lem Pedro Martinez, concurrió a los Congresos de la Sociedad Americana de Hematología y de la Sociedad Europea de Hematología con financiamiento del Laboratorio Roche.
Dr. Abayubá Perna, realizó un estudio financiado por el laboratorio Clausen y concurrió al Congreso Mundial de Neuroepidemiología del año 2009 con financiamiento del mismo.
Agradecimientos
Esta publicación no hubiera sido posible sin el apoyo institucional del Fondo Nacional de Recursos y sus funcionarios y sin el aporte de las instituciones de asistencia médica del país que junto a sus hematólogos y oncólogos acogieron a sus enfermos a la normativa de cobertura.
Bibliografía
2. Fondo Nacional de Recursos. Texto ordenado de normas regulatorias del Fondo Nacional de Recursos. Acceso abril 2012.
Disponible en: http://www.fnr.gub.uy/sites/default/files/texto_ord.pdf
3. Rodríguez Alarico, Fernández Graciela, Haretche Álvaro†. Gestión de la utilización de procedimientos de alta especialización médica en Uruguay. Cuadernos del CES N° 4, Diciembre 2008: 41 – 65. Disponible en:
http://www.smu.org.uy/elsmu/organismos/ces/cuadernos/cuadernos4/art8.pdf
4. Fondo Nacional de Recursos. Política y gestión de la cobertura de medicamentos de alto costo. Relevamiento de la experiencia
internacional y respuesta del Fondo Nacional de Recursos. Publicación Técnica Nº 13. Montevideo: FNR, 2010. Disponible en:
http://www.fnr.gub.uy/sites/default/files/Publicacion%20TECNICA%2013_PDF.pdf
5. Maloney D, Grillo-López G, White C, Bodkin D, Schilder R, Neidhart J, Janakiraman N, et al. IDEC-C2B8 (Rituximab) Anti-CD20 Monoclonal
Antibody Therapy in patients with Relapsed Low-Grade Non-Hodgkin’s Lymphoma. Blood 1997;90: 2188-2195.
6. Mauro M, Druker B. STI 571: Targeting BCR-ABL as therapy for CML. The Oncologist 2001;6:233-238.
7. Gualco G, Ardao G, Costa V, Martínez L. Reclasificación de linfomas. Arch Med Int 2005; 27(1): 12-21.
8. The International Non-Hodgkin’s Lymphoma Prognostic Factors Project. A predictive model for aggressive non-Hodgkin’s Lymphoma.N Eng J Med 1993;329; 987-94.
9. Rosenwald A, Wright G, Chan WC, Connors JM, Campo E, Fisher RI, Gascoyne RD, et al. The use of molecular profiling to predict survival
after chemotherapy for diffuse large Bcell lymphoma. N Eng J Med. 2002; 346: 1937-1947.
10. Solal-Celigny P, Roy P, Colombat P, White J, Armitage JO, Arranz-Saenz R, Au WY, et al. Follicular Lymphoma International Prognostic
Index. Blood 2004; 104:1258-1265.
follicular lymphoma (FL) registered in the F2 study and treated upfront with immunochemotherapy. J Clin Oncol 2007 ASCO Annual
Meeting Proceedings. Vol 25, N 18S
ProMACE-CytaBOM vs. MACOP-B in patients with intermediate- or high-grade non-Hodgkin’s lymphoma: results of SWOG-8516
(Intergroup 0067), the National High-Priority Lymphoma Study. Ann Oncol. 1994;5 Suppl 2:91-5.
13. Coiffier B, Lepage E, Briere J, Herbretch R, Tilly H, Bouabdallah R, Morel P, et al. CHOP Chemotherapy plus Rituximab Compared with CHOP
Alone in Elderly Patients with Diffuse Large-B-Cell Lymphoma. N Eng J Med 2002; 346:235-242.
14. Coiffier B, Feugier P, Sebban C, Bouabdallah R, Delwail V, Tilly H, Gisselbrecht C, et al. Blood. ASH meeting, Nov 2004; 104: 1383.
15. Habermann TM, Weller EA, Morrison VA, et al. Phase III trial of rituximab-CHOP vs. CHOP with a second randomization to maintenance
rituximab or observation in patients 60 years of age and older with diffuse large B cell lymphoma. Blood. 2003;102:6a
16. Pfreundschuh M, Truemper L, Gill D, Osterborg A, Pettengell R, Trneny M, Imrie K, et al. First Analysis of the Completed Mabthera
International (Mint) Trial in Young Patients with Low-Risk Diffuse Large B-Cell Lymphoma (DLBCL): Addition of Rituximab to a CHOP-Like
Regimen Significantly Improves Outcome of All Patients with the Identification of a Very Favorable Subgroup with IPI=O and No Bulky
Disease. Blood (ASH Annual Meeting Abstracts), Nov 2004; 104: 157.
17. Pfreundschuh M, Kloess M, Zeynalova S, Lengfelder E, Franke A, Reiser M, Steinhauer H, et al.. Six vs. Eight Cycles of Bi-Weekly
CHOP-14 with or without Rituximab for Elderly Patients with Diffuse Large B-Cell Lymphoma (DLBCL): Results of the Completed
RICOVER-60 Trial of the German High-Grade Non-Hodgkin Lymphoma Study Group (DSHNHL). Blood (ASH Annual Meeting Abstracts), Nov
2006; 108: 205.
18. Sonneveld P, van Putten W, Biesma D, Holte H, van Marwijk Kooij M, Kramer MH, Wijermans PW, et al. Phase III Trial of 2-Weekly CHOP
with Rituximab for Aggressive B-Cell Non-Hodgkin’s Lymphoma in Elderly Patients. Blood (ASH Annual Meeting Abstracts), Nov 2006; 108:210.
19. Sehn LH, Donaldson J, Chhanabhai M, Fitzgerald C, Gill K, Klasa R, MacPherson N, et al. Introduction of combined CHOP plus rituximab
therapy dramatically improved outcome of diffuse large B-cell lymphoma in British Columbia. J Clin Oncol. 2005; 23:5027-5033.
20. Trneny M, Belada D, Vasova I, Pytlik R, Kozak T, Sykorova A, Kubackova K, et al. Rituximab Combination with Anthracyclin Based
Chemothrapy Significantly Improved the Outcome of Young Patients with Diffuse Large B-Cell Lymphoma in Low as Well in High Risk
Subgroups. Blood (ASH Annual Meeting Abstracts), Nov 2005; 106: 2444.
21. Philip T, Guglielmi C, Hagenbeek A, Somers R, Van Der Lelie H, Bron D, Sonneveld P, et al. Autologous Bone Marrow Transplantation as
Compared with Salvage Chemotherapy in Relapses of Chemotherapy-Sensitive Non-Hodgkin’s Lymphoma. N Engl J Med 1995;333:1540-1545.
22. Hiddemann W, Forstpointer R, Kneba M, Schmitz N, Schmitz R, Metzner B, Reiser M, et al. The addition of rituximab to combination
chemotherapy with CHOP has a long lasting impact on subsequent treatment in remission in follicular lymphoma but not in mantle cell
lymphoma: Results of two prospective randomized studies of The German Low Grade Lymphoma Study Group (GLSG). Sassion type: Oral.
Blood 2004. 104: 50a (abstract 161).
23. Marcus R, Imrie K, Belch A, Cunningham D, Flores E, Catalano J, Solal-Celigny P, et al. CVP chemotherapy plus rituximab compared with
CVP as first-line treatment for advanced follicular lymphoma. Blood 2005;105:4 1417-1423.
24. Marcus R, Imrie K, Solal-Celigny P, Catalano J, Dmoszynska A, Raposo J, Offner F, et al. Phase III Study of R-CVP compared with
Cyclophosphamide, Vincristine, and Prednisone Alone in Patients With Previously Untreated Advanced Follicular Lymphoma. JCO 2008;26:4579-458.
24. Herold M, Pasold R, Srock S, Neser S, Niederwieser D, Neubauer A, Dolken G, et al. Results of a prospective randomised open label phase
III study comparing rituximab plus mitoxantrone, chlorambucile, prednisolone chemotherapy (R-MCP) versus MCP alone in untreated
advanced indolent non-Hodgkin‘s lymphoma (NHL) and mantle-cell-lymphoma (MCL). Blood (2004) (ASH Annual Meeting Abstracts), 104.
[11 (Supp 1)]:169 (abstract 584).
25. Salles G, Foussard C, Nicolas M. Rituximab added to alpha INF + CHVP improves the outcome of follicular lymphoma patients with high
tumor burden: first analysis of the GELA-GOELAMS FL-2000. Randomized Trial in 359 patients. Blood 2004; (ASH Annual Meeting
Abstracts), 104: 160a (abstract).
26. Schulz H, F. Bohlius J, Trelle S, Skoetz N, Reiser M, Kober T, Schwarzer G, et al. Immunochemotherapy with Rituximab and Overall
Survival in Patients with Indolent or Mantle Cell Lymphoma: A Systematic Review and Meta-analysis. JNCI Journal of the National Cancer
Institute 2007 99(9):706-714.
27. Forstpointner R, Dreyling M, Repp R, Hermann S, Hänel A, Metzner B, Pott C, Hartmann F, Rothmann F, Rohrberg R, Böck HP, Wandt H, Unterhalt M, Hiddemann W; German Low-Grade Lymphoma Study Group. The addition of rituximab to a combination of fludarabine, cyclophosphamide, mitoxantrone (FCM) significantly increases the response rate and prolongs survival as compared with FCM alone in patients with relapsed and refractory follicular and mantle cell lymphomas: results of a prospective randomized study of the German Low-Grade Lymphoma Study Group. Blood. 2004;104: 3064-71.
28. Vardiman JW, Melo JV, Baccarini M, Thiele J. Chronic myelogenous leukemia, BCR-ABL 1 positive. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. 4th Edition. Edited by SH Swerdlow, E Campo, NL Harris, ES Jaffe, SA Pileri, H Stein, J Thiele, JW Vardiman. 2008; 32-38.
29. Baccarani M., Saglio G., Goldman J, Hochhaus A, Simonsson B, Appelbaum F, Apperley J, et al. Evolving concepts in the management of chronic myeloid leukemia: recommendations from an expert panel on behalf of the European Leukemia Net. Blood 2006; 108: 1809-1820.
30. Strebhardt K, Ullrich A. Another Look at Imatinib Mesylate. Strebhardt K. and Ullrich A. N Engl J Med 2006; 355: 2481-2.
31. Goldman J, Melo J. Chronic Myeloid Leukemia – Advances in biology and new approaches treatment. N Eng J Med 2003. 349: 1451 – 1464.
32. Druker B, Tamura S, Buchdunger E, Ohno S, Bagby G, Lydon N. Preclinical evaluation of a selective inhibitor of the ABL tyrosine kinase as a therapeutic agent for chronic myelogenous leukemia. Blood (1995) (ASH Annual Meeting Abstracts), 601a (abstract 2392).
33. Kantarjian H; Sawyers C; Hochhaus A, Guilhot F, Schiffer C, Gambacorti-Passerini C, Niederwieser D, et al. Hematologic and cytogenetic responses to Imatinib Mesylate in Chronic Myelogenous Leukemia. For The International STI571 CML. study group. N Eng J Med 2002;346:645– 654.
34. O´Brien S, Guilhot F, Larson RA, Gathmann I, Baccarani M, Cervantes F, Cornelissen JJ, et al. Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase Chronic Myeloid Leukemia. N Eng J Med 2003; 348: 994 – 1004.
35. Hughes TP, Kaeda J, Branford S, Rudzki Z, Hochhaus A, Hensley ML, Gathmann I, et al. Frequency of major molecular responses to Imatinib or Interferon Alfa plus Cytarabine in newly diagnosed Chronic Myeloid Leukemia. N Eng J Med 2003. 349: 1423-1432.
36. Druker BJ, Guilhot F, O’Brien SG, Gathmann I, Kantarjian H, Gattermann N, Deininger MW, et al. Five-year follow-up of patients receiving imatinib for chronic myeloid leukemia. N Engl J Med. 2006;355:2408-17.
37. Talpaz M, Silver RT, Druker BJ, Goldman JM, Gambacorti-Passerini C, Guilhot F, Schiffer CA, et al. Imatinib induces durable hematologic and cytogenetic responses in patients with accelerated phase chronic myeloid leukemia: results of a phase 2 study. Blood. 2002;99 :1928-37.
38. Sawyers CL, Hochhaus A, Feldman E, Goldman JM, Miller CB, Ottmann OG, Schiffer CA, et al. Imatinib induces hematologic and cytogenetic responses in patients with chronic myelogenous leukemia in myeloid blast crisis: results of a phase II study. Blood. 2002;99 :3530-9.
39. Sokal J, Cox E, Baccarani M, et al. Prognostic discrimation in good-risk chronic granulocytic leukemia. Blood 1984;63:789-99.
40. Muxí P, Martínez L. Correa F. Tratamientos de Linfomas no Hodgkin con Rituximab con cobertura financiera del Fondo Nacional de Recursos. Arch Med Interna 2008; 30:248.9.1.
41. Buckley BC, Roylance D, Mitchell MP, Patel SM, Cannon HE, Dunn JD. Description of the outcomes of prior authorization of palivizumab for prevention of respiratory syncytial virus infection in a managed care organization. J Manag Care Pharm. 2010; 16(1):15-22.
42. Curtiss FR, Fairman KA. Utilization management opportunities for palivizumab for prophylaxis of respiratory syncytial virus complications in infants. J Manag Care Pharm. 2010; 16(1):59-66.
43.Herold M, Antje H, Srock S, Neser S, Haifa Al-Ali K, Neubauer A, Dölken G, et al. Rituximab added to first-line mitoxantrone, chlorambucil,
and prednisolone chemotherapy followed by interferon maintenance prolongs survival in patients with advanced follicular lymphoma: An East German Study Group Hematology and Oncology Study. J Clin Oncol
25:1986-1992, 2007.