Introducción
A lo largo de la historia el uso medicinal de la planta de cannabis ha despertado especial interés debido a sus beneficios analgésicos, antieméticos y antiepilépticos (AE)1. Si bien el cannabis como especie vegetal estuvo comprendida desde 1961 en la Lista Única de Estupefacientes de las Naciones Unidas, en los últimos años su regulación tuvo algunas modificaciones2. Estas flexibilizaciones, la identificación del sistema endocannabinoide y el interés de los propios pacientes, favorecieron su uso medicinal, principalmente en los casos de preparaciones en base al fitocannabinoide cannabidiol (CBD)3.
Hasta la fecha se han publicado cinco ensayos clínicos controlados aleatorizados doble ciego multicéntricos que incluyen a niños, niñas y adolescentes (NNA) con epilepsia refractaria (ER) tratados con CBD, evaluando sus beneficios y seguridad4-8. Estos estudios incluyeron principalmente poblaciones de NNA con características comunes, portadores de ER sindromáticas, como el síndrome de Dravet (SD), síndrome de Lennox-Gastaut (SLG) y la epilepsia asociada al complejo de esclerosis tuberosa (CET), reportando una reducción significativa de la frecuencia de crisis epilépticas (CE), de los NNA que recibieron CBD versus placebo, a pesar de identificar eventos adversos (EA), siendo los más frecuentes considerados leves a moderados. Para otros tipos de ER, no se dispone de estudios con este nivel de evidencia9-11.
En Uruguay, el uso de derivados del cannabis medicinal (DCM) se ha reglamentado a nivel normativo desde el año 2013, como quedó establecido en las leyes 19.172/2013 y 19.847/2019 y sus respectivos decretos. Estas leyes abarcan desde la regulación y el control de la producción hasta los usos terapéuticos y no terapéuticos del cannabis y los DCM 12-15.
Actualmente existen diversas marcas de DCM registrados en Uruguay, en variadas presentaciones de administración enteral16. Todos los productos de calidad farmacéutica disponibles están compuestos por el fitocannabinoide CBD en diferentes concentraciones, se dispensan bajo receta profesional y están aprobados para tratar las CE en mayores de 2 años con diagnóstico de ER15. Previamente al registro nacional de DCM, se accedía a ellos por uso compasivo, también regulado por el Ministerio de Salud Pública (MSP). Además de productos industrializados, se dispone de DCM producidos artesanalmente de composición cuali-cuantitativa no estandarizada1,17,18.
A nivel nacional la indicación de CBD para el tratamiento de la ER es definida en conjunto entre el neuropediatra y el pediatra tratante, quienes cuentan con el conocimiento integral del NNA y su familia. Para la prescripción es importante que el paciente cumpla con los criterios diagnósticos de ER, conocer el tipo/síndrome epiléptico y que se haya valorado la pertinencia o posibilidad de realizar dieta cetogénica o cirugía, y se hayan descartado o hayan fracasado estas opciones terapéuticas10,17.
A pesar de este contexto regulatorio favorable a nivel nacional, existe limitada información sobre el uso de los DCM en NNA con ER1,17. Por lo tanto, es necesario continuar profundizando sobre la farmacoterapia con DCM utilizados en pediatría, en este uso como AE así como en otros usos1,17,19. Además, en los tratamientos crónicos como los de la epilepsia, es fundamental conocer aspectos de beneficios terapéuticos en términos de la evolución clínica de los pacientes, analizar la adherencia y los efectos adversos a largo plazo que pueden asociarse a su uso. El estudio de los beneficios clínicos en pacientes de la vida real comprende una forma cada vez más frecuente de analizar la efectividad de los medicamentos, entendida como la utilidad del medicamento en grupos diferentes a los de los ensayos clínicos controlados, generalmente más heterogéneos. Se determina, por lo tanto, mediante estudios epidemiológicos, o sea, en la fase IV de los estudios clínicos y permite ampliar el conocimiento del uso de DCM en la vida real, hecho fundamental para adecuar las prácticas prescriptivas en caso que sea necesario20. La estrecha monitorización de estos pacientes es clave en la optimización de los tratamientos y en lograr la mejor relación beneficio-riesgo21.
Objetivos
Describir el perfil de uso, beneficios y riesgos de los DCM en el tratamiento de NNA con ER, asistidos en el Hospital Pediátrico del Centro Hospitalario Pereira Rossell (HP-CHPR), entre julio de 2021 y febrero de 2024.
Metodología
Se realizó un estudio descriptivo, observacional, longitudinal, retrospectivo. Se incluyeron todos los NNA menores de 19 años, usuarios del HP-CHPR, con diagnóstico de ER bajo tratamiento con DCM durante el período de estudio, cuyos familiares o cuidadores otorgaron el consentimiento a participar.
El contacto con los participantes fue proporcionado por el Departamento de Farmacia del HP-CHPR. Fueron eliminados del estudio los NNA fallecidos y los que no estaban recibiendo DCM al momento de iniciar el trabajo.
Se realizó la revisión de historias clínicas y entrevistas telefónicas a familiares o cuidadores en dos momentos (t1: julio 2022 y t2: febrero 2024). Se utilizó una ficha recolectora de datos elaborada para esta investigación.
Respecto a la población incluida se analizaron las siguientes variables: edad (años), sexo, procedencia, comorbilidades/enfermedad o condición de salud, cantidad, frecuencia y fenotipo de las CE.
Las variables relevadas respecto a los DCM y su prescripción fueron: indicación, tipo de DCM (industrial o artesanal), nombre comercial (preparados industriales), posología-dosis (mg/kg/día), intervalo interdosis, inicio y duración del tratamiento (meses, años), medio de obtención de DCM (farmacia comunitaria, farmacia hospitalaria, otros), accesibilidad a DCM, necesidad de ajuste de dosis en los últimos tres meses (aumento, disminución), necesidad de cambio de tipo de DCM o de presentación.
El beneficio del tratamiento con DCM se analizó en base a la frecuencia (número de crisis/día); duración de crisis (minutos, segundos) antes del inicio del tratamiento con DCM (t0), en la primera y en la segunda entrevista (t1 y t2, respectivamente). Para cuantificar el efecto se establecieron las siguientes definiciones operativas: a) línea de base de CE: frecuencia y duración de crisis tres meses previos al inicio del DCM; b) evolución: porcentaje de reducción de CE, cantidad de casos en que se redujeron en al menos 50% las CE respecto de la línea de base y número de casos libres de crisis al t1 y mantenimiento del efecto en t2. Para el análisis cuantitativo del beneficio se consideraron únicamente los NNA que utilizaron DCM industrial a lo largo del todo el estudio.
Los NNA usuarios de DCM de origen artesanal fueron incluidos únicamente para la descripción del perfil de uso de DCM.
Se registraron otros factores que podrían alterar el beneficio de DCM: tratamientos concomitantes (anticonvulsivantes, analgésicos, antiespásticos, antieméticos, psicofármacos y otros), enfermedades, ingesta con alimentos y momento del día en el que se administra.
Respecto a los riesgos asociados al uso de DCM se analizó la aparición y tipo de EA y se cotejaron con la ficha técnica del medicamento.
Para el análisis de datos se utilizó el software estadístico Statistical Package for Social Sciences (SPSS) versión 25. Las variables cualitativas fueron resumidas con frecuencias absolutas y frecuencias relativas. Para evaluar si existían asociaciones entre las variables cualitativas se utilizó test de chi cuadrado.
Se evaluó la normalidad de las variables cuantitativas mediante test de Kolmogorov-Smirnov. Al no presentar distribución normal, las variables cuantitativas fueron resumidas con mediana y rango intercuartílico (RIC). Para evaluar si existían diferencias entre la frecuencia de CE, según los distintos tiempos relevados, se utilizó la prueba de Wilcoxon para muestras relacionadas. Para evaluar diferencias entre la frecuencia de CE según las variables cualitativas relevadas (formulación del DCM, uso de clobazam concomitante) se utilizó la prueba de U de Mann-Whitney y la prueba de Kruskal-Wallis, según se compararan dos o más de dos grupos respectivamente. Se evaluó si existía asociación lineal entre la frecuencia (número de CE/día) según la dosis de DCM utilizado a través del coeficiente de correlación de Spearman. Se utilizó un nivel de significación de 0,05.
Aspectos éticos
Se resguardó el anonimato y la confidencialidad de la información en todas las etapas de la investigación. Se solicitó consentimiento informado a padres o cuidadores y a los adolescentes su asentimiento. El protocolo de investigación fue aprobado por la Dirección del HP-CHPR y por el Comité de Ética de Investigación del CHPR.
Resultados
Características demográficas de la población
Al inicio del estudio, a partir de 21 NNA elegibles (pacientes con diagnóstico de ER que utilizaban DCM según registros de farmacia hospitalaria), se analizaron 15 NNA que efectivamente recibían DCM. De los 6 excluidos, 5 dejaron de usar DCM antes de julio de 2021 (inicio del estudio), no siendo indagados los motivos de abandono del tratamiento y uno había fallecido (la causa de muerte no fue atribuida al uso de DCM).
La mediana de edad al momento de la inclusión fue de 8,13 años (rango intercuartílico 2; 19 años), 9/15 eran de sexo masculino y 11/15 procedentes del interior del país. La ER se presentó en NNA con parálisis cerebral o encefalopatías crónicas no progresivas severas en 13/15 casos, siendo 11/13 de causas pre o perinatales. Las características de la población estudiada se presentan en la (Tabla 1).
Tabla 1 Características de las niñas, niños y adoles centes con epilepsia refractaria en tratamiento con DCM. Hospital Pediátrico, Centro Hospitalario Pereira Rossell, Uruguay 2021-2024 (N=15).

Perfil de uso de los DCM
En todos los casos, los DCM fueron administrados por vía enteral. El tipo más frecuente de DCM utilizado fue el industrializado en 12/15 (t1) y 10/15 (t2). La mediana de dosis de DCM industrial fue 0,5 mg/kg/día (rango 0,2-1,2 mg/kg/día) al inicio del tratamiento; 3,5 mg/kg/día (rango 0,4-12,1 mg/kg/día) en t1, y 3,7 mg/kg/día (rango 1,3-6,4 mg/kg/día) en t2. No fue posible estimar la dosis (mg/kg/día de CBD) en los NNA que recibían preparados artesanales en ningún momento del estudio.
Los aspectos vinculados a la prescripción de DCM se presentan en la (Tabla 2).
Tabla 2 Tratamiento con DCM y posología. Hospital Pediátrico, Centro Hospitalario Pereira Rossell, Uruguay 2021-2024 (N=15).
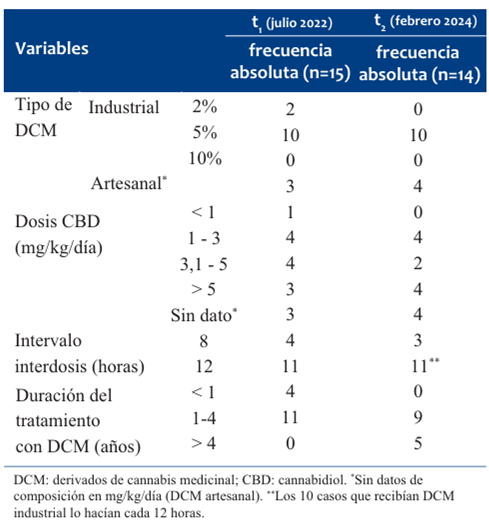
Dentro de la población estudiada, 11/15 de los NNA requirieron cambios en el tratamiento con DCM en algún momento: cambios en la concentración o marca comercial del DCM industrial 7/11, cambios de formulación industrial a preparado artesanal 4/11. Los casos en que ocurrió cambio de concentración en la formulación del DCM fueron motivados por la necesidad de aumentar la dosis buscando mayor control de las CE. La razón del cambio a preparados artesanales fue motivada por problemas de accesibilidad a la formulación industrial en todos los casos y en uno de ellos por falta de respuesta terapéutica (considerada por su cuidador).
Respecto a la necesidad de ajuste de la dosis, todos requirieron algún ajuste con aumento de dosis a lo largo del tratamiento y en dos casos requirieron descenso de dosis por probables efectos adversos (incremento de la irritabilidad). Durante el seguimiento telefónico en t2 se constató que un paciente abandonó el tratamiento con DCM, continuando el tratamiento con otros fármacos AE. El motivo del abandono fueron problemas de accesibilidad al DCM en farmacia hospitalaria y dificultades en la adherencia a los tratamientos.
Tratamientos asociados a DCM
Previo al comienzo de la terapia con DCM 8/15 de los pacientes recibieron dieta cetogénica (DC) como tratamiento coadyuvante para la ER, de los cuales 6 utilizaron fórmulas industriales y 2 artesanales. La mediana de tiempo de tratamiento con DC fue 12 meses (rango 8 - 15 meses). Al t2 continuaban recibiendo DC en forma concomitante al uso de DCM 2 casos. Los motivos de suspensión de la DC fueron pobre adherencia al tratamiento en 3, efectos adversos como hematuria, dislipemia, vómitos 3, desnutrición 1 caso.
Los fármacos AE que recibían los pacientes en t1 y t2 se describen en la (Tabla 3).
Tabla 3 Otros fármacos antiepilépticos utilizados. Hospital Pediátrico-Centro Hospitalario Pereira Rossell, Uruguay 2021-2024 (N=15).
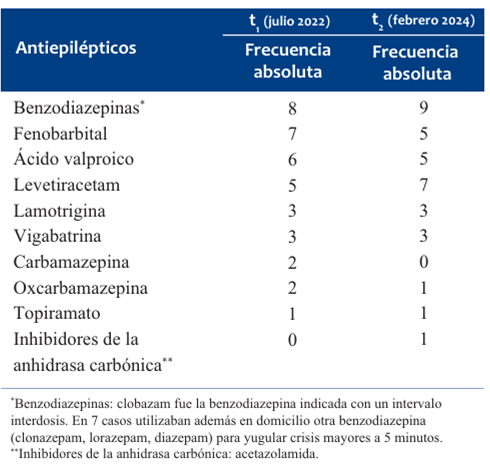
Al momento de la segunda entrevista (t2) 11/15 de los NNA utilizaban en forma crónica otros medicamentos además de AE, entre ellos: agonistas de receptores de melatonina 9/15, relajantes musculares (baclofeno, tizanidina) 6, coadyuvantes para el dolor crónico (gabapentinoides) 6, antipsicóticos 5, protectores gástricos (inhibidores de la bomba de protones y antagonistas de los receptores H2) 5, L-carnitina 4, leucosamida y proquinéticos 1 caso respectivamente.
Beneficio clínico del tratamiento con DCM
De las entrevistas realizadas a familiares/cuidadores, 13/15 reportaron que los NNA tuvieron mejoría clínica de las CE luego del inicio del tratamiento con DCM.
Para el análisis del beneficio respecto a reducción de frecuencia y duración de las CE se incluyeron únicamente los casos que recibirán DCM industrial en t1 y/o en t2 (Tabla 4). Al indagar sobre la historia de la ER y la presentación de las CE de cada paciente en t2, todos refirieron una reducción de más de 50% en la frecuencia de las CE. Al evaluar si existían diferencias entre la frecuencia de CE observadas en t0 respecto a t1, se observó disminución significativa en la frecuencia de CE en t1 (p= 0,005); asimismo, en t2 respecto a las observadas en t0 (p= 0,005). No se encontraron diferencias significativas en la frecuencia de CE observadas en t1 respecto a las observadas en t2 (p = 0,324), indicando un mantenimiento del efecto AE producido por los DCM.
Tabla 4 Reducción de frecuencia y duración de crisis epilépticas reportadas por los cuidadores respecto al uso de DCM industrial (N=12).
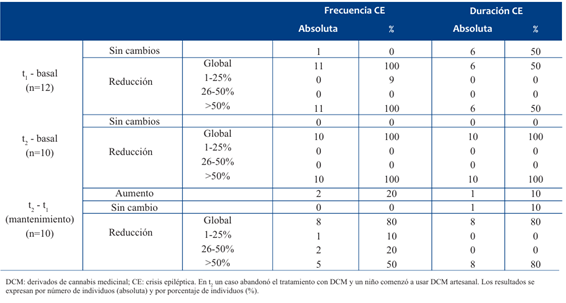
La mitad de los cuidadores reportó reducción de la duración de las CE. Al evaluar si existían diferencias entre la duración de las CE observadas en t0 respecto a t1, se observó una disminución significativa en la duración de CE en t1 (p= 0,042); asimismo, en t2 respecto a las observadas en t0 (p= 0,005). Para la duración de las CE también se encontraron diferencias significativas entre t1 respecto a t2 (p= 0,004), indicando una intensificación del efecto AE producido por DCM en esta variable.
Por otro lado, en t2 se observó disminución en el número de AE utilizados previamente en dos casos, recibiendo un único fármaco como tratamiento concomitante al uso de DCM.
Al analizar de manera individual la evolución de la respuesta al tratamiento con los DCM de cada NNA, pudo observarse una tendencia en la reducción en la frecuencia (CE/día) en la gran mayoría de los pacientes, la cual se representa en la (Figura 1).
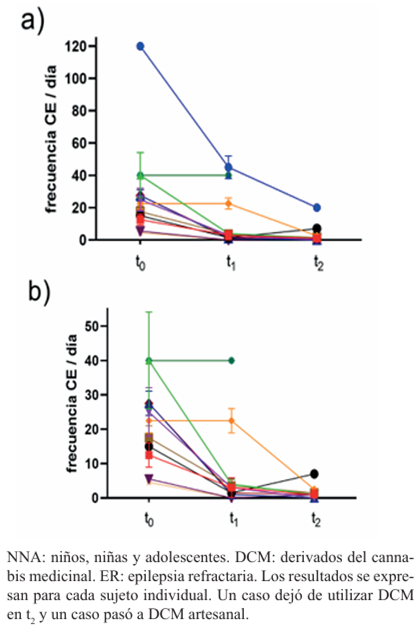
Figura 1 Evolución de la frecuencia (CE/día) de crisis epilépticas en los NNA que utilizaban DCM industrial como coadyuvante del tratamiento de la ER (N=12).
En la (Figura 2) se muestra la variación individual en la duración de las CE en los NNA que utilizaban DCM industrial.
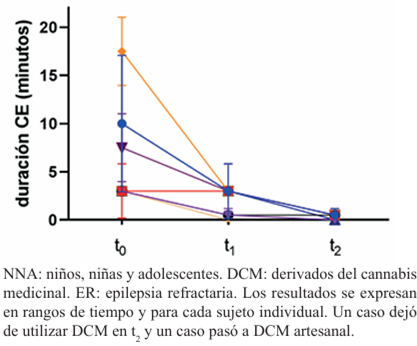
Figura 2 Evolución de la duración de las crisis epilépticas en NNA que utilizaba DCM industrial como coadyuvante del tratamiento de la ER (N=12).
Además del efecto descripto sobre las CE, los familiares/cuidadores entrevistados mencionaron haber observado otros beneficios. Entre ellos, mejoría en la conexión con el entorno y mayor reactividad en 11/12 respectivamente, mejora en la calidad del sueño 7/12 y menor irritabilidad en 5/12. En algunos NNA se constató más de un beneficio en forma simultánea.
Riesgos del tratamiento
Para este análisis se incluyeron únicamente los casos que recibían DCM industrial (12/15 casos). De éstos, en 8 se reportaron aparición de EA, en su mayoría leves. Entre estos, somnolencia transitoria 5/8, boca seca 2/8, y cambios de apetito, diarrea, mareos e irritabilidad en un paciente para cada evento. Cuatro pacientes presentaron más de un EA. Dos casos reportaron que al cambiar de marca comercial (Epixann® por Bidiol® y Epifractan® por Convupidiol®, en todos los casos al 5%), se observaron complicaciones: en el primer caso depresión neuropsíquica de 48 horas de evolución y en el segundo aumento de las CE. En ambas situaciones se suspendió el uso de DCM por 72 horas, reinstalando la misma marca de DCM que recibían previamente. Ambos casos fueron notificados como probables EA al Sistema Nacional de Farmacovigilancia del MSP. Luego de la reintroducción del DCM que utilizaban, ambos niños lograron el control de la frecuencia de las CE que presentaban previo al evento.
No se encontraron asociaciones significativas entre la frecuencia de CE y la formulación de DCM utilizada en t1 (p= 0,727) y en t2 (p= 0,351), ni con la dosis de CBD utilizada en t1 (p= 0,223) y en t2 (p= 0,426), tampoco con el uso concomitante de clobazam en t1 (p= 0,412) ni en t2 (p= 0,841).
No se encontró asociación significativa entre la presencia de somnolencia y la formulación de DCM utilizada en t2 (p= 0,521), la dosis de CBD en t2 (p= 0,833), ni el uso concomitante de clobazam en t2 (p= 0,490).
Accesibilidad a DCM
Respecto a la forma de acceder a DCM, el medio de obtención más habitual fue la farmacia hospitalaria. Considerando las respuestas de los pacientes entrevistados en t2 (febrero 2024), 10/15 lo hacían por farmacia hospitalaria, 4 mediante productor artesanal y 1 caso había abandonado el tratamiento con DCM industrial, reportando como motivo dificultades económicas para concurrir a retirar el fármaco en farmacia.
Durante el tratamiento con DCM, 13/15 expresaron que en algún momento no pudieron acceder al mismo por diversos motivos. Los principales fueron la discontinuidad de DCM en farmacia hospitalaria en 9/13 o problemas burocráticos en el proceso de solicitud, aprobación y repetición de la indicación médica de DCM 3/13, y un caso manifestó dificultades económicas que imposibilitaron concurrir a retirar el fármaco. Dentro de los 13 que refirieron tener problemas de accesibilidad, 10 objetivaron peoría clínica de las CE en el período sin tratamiento con DCM, y un paciente no mejoró ni empeoró sus crisis en ese período.
Discusión
Este es el primer estudio nacional longitudinal que describe el uso terapéutico de DCM en el tratamiento de la ER. Dentro de la población estudiada se encontró predominio de NNA en edad escolar, este hallazgo concuerda con lo reportado en la literatura22-25. Esto puede deberse a diversos motivos. En primera instancia, el rango de edad para el que se encuentra aprobado el uso de DCM en ER y en segundo lugar es que a esta población particular de NNA suelen ofrecerse otras opciones terapéuticas como el cambio y titulación de dosis de diversos AE y el uso de la DC, previo al inicio del tratamiento con DCM10,17,22.
La mayoría de los estudios publicados sobre uso de DCM en ER incluyen a NNA con SD, SLG y el complejo Esclerosis tuberosa4-11. En los últimos años se han incluido otras condiciones que asocian ER como los síndromes de Doose, Struger Weber, Aicardi, Cyclin-dependent kinase-like 5 (CDKL5), síndrome de duplicación del cromosoma 15q11.2-q13.1 (Dup 15q), otros espasmos infantiles, crisis parciales migratorias malignas de la infancia, encefalopatía hipóxica isquémica, ausencias infantiles y el síndrome epiléptico asociado a infección febril22,25. En esta serie, la mayoría de los NNA incluidos eran portadores de encefalopatías crónicas no evolutivas de causa pre o perinatal en su mayoría sin un síndrome epiléptico identificado, seguido en frecuencia por el SLG.
De los DCM disponibles en Uruguay, los más empleados fueron los preparados industriales en presentación para uso por vía enteral al 5%. En los últimos años se han incorporado en el mercado una gran diversidad de presentaciones, conteniendo desde 2% a 10% de CBD. En este centro y a lo largo del estudio, se encontró diversidad en la oferta de DCM conteniendo CBD dispensado en la farmacia hospitalaria. Si bien no se exploraron los motivos de estos cambios, los mismos podrían deberse a la mayor oferta de marcas y presentaciones en el mercado y aspectos administrativos de las compras del prestador público de salud. Esto difiere de lo reportado por Álvarez y colaboradores en el mismo centro, donde predominaba el uso de Epifractán® al 2% y 5%17. Resulta importante destacar que ningún NNA utilizaba preparados con CBD al 2% en t2, sugiriendo que se trata de una formulación obsoleta dada su escasa conveniencia para los pacientes.
La vía de administración de DCM fue enteral en todos los casos. La mayoría de las presentaciones industriales disponibles en Uruguay sugieren su administración sublingual. Sin embargo, se desconoce si los prescriptores indicaron el uso por esta vía o si los NNA efectivamente utilizaron la vía sublingual. El volumen en gotas utilizado y las dificultades de deglución presentes en la mayoría de estos pacientes, son barreras para el uso de la vía sublingual. Si bien la utilización por vía sublingual podría favorecer la efectividad de CBD, ya que evita el metabolismo de primer paso, mejora su biodisponibilidad y permite un rápido inicio de acción, debe administrarse un volumen reducido y evitar su ingestión26.
En cuanto a la posología, la literatura refiere una dosis de inicio de CBD variable (0,018 - 5 mg/kg/día)25-29. En el trabajo publicado por Devinsky y colaboradores en 2017, que incluyó 120 sujetos entre 2-18 años con SD, la dosis de inicio de CBD (Epidiolex 10%®) fue 5 mg/kg/día titulando luego a 20 mg/kg/día4. Caraballo y colaboradores, en Argentina, utilizaron CBD (Rideau®, Aphria, Canadá) a una dosis de inicio de 2 mg/kg/día, administrado dos veces al día en menores de 45 kg, y 5 mg/kg/día en NNA mayores de 45 kg, titulando a un máximo de 25 mg/kg/día22. En esta cohorte se utilizaron dosis de inicio dentro de los rangos sugeridos por la literatura, realizando una posterior titulación hasta obtener una mediana de dosis de mantenimiento de 3,7 mg/kg/día, inferior a las dosis de mantenimiento reportadas por otros autores. En la metodología de este trabajo no se incluyó como variable de estudio los motivos por los cuales los clínicos realizaban o no las titulaciones.
Las variables utilizadas habitualmente para medir la eficacia de fármacos AE suelen incluir la reducción de la frecuencia de la CE o su remisión, así como la reducción de dosis y número de fármacos AE, con períodos de seguimiento mayoritariamente menores a un año en los ensayos clínicos controlados (ECA) doble ciego4-8. Estos criterios son los que utilizan las agencias europea y estadounidense (European Medicines Agency (EMA) y Food and Drug Administration (FDA), respectivamente) para la aprobación de nuevos AE30. En cuanto a la frecuencia de las CE, está establecida una significancia clínica mediante la reducción de más de 50% de las crisis31,32. En esta serie, las diferencias en frecuencia de CE antes y después de administrar DCM resultaron estadísticamente significativas. En particular, se observó que todos los NNA que utilizaron DCM industrial redujeron la cantidad de CE en más de 50% entre el primer y el cuarto año de tratamiento (t1), y que la magnitud del efecto se mantuvo incluso luego de cuatro años de tratamiento (t2). De forma similar a lo reportado por otros autores33,34, se observó que el uso de DCM industrial mantuvo su efecto más allá del primer año de uso. Como efecto adicional, dos NNA disminuyeron la cantidad de AE utilizados para el tratamiento de la ER, minimizando la posibilidad de interacciones farmacológicas y efectos adversos. Resultados similares se observaron respecto de la duración de las CE. En ningún NNA hubo aumento de la duración de las CE tras el uso de DCM y la magnitud de este efecto se intensificó entre t1 y t2. Sin embargo, no se encontró correlación entre la magnitud del efecto de reducción en la duración ni en el número de CE con las dosis de CBD utilizadas, a diferencia de otros trabajos publicados en la literatura. El escaso número de pacientes incluidos puede ser un factor que impida establecer este tipo de correlaciones.
Cabe destacar que los resultados obtenidos en este estudio, en cuanto a la reducción en la frecuencia de CE producida por CBD, muestran una intensidad de efecto mayor que la reportada para CBD en el contexto de ECA publicados por Devinsky, Thiele y Miller4-8. La intensidad de efecto en dichos trabajos fue entre 37,2% a 48,7% versus un rango de 13,3% a 26,9% con placebo, mientras que en este estudio se obtuvo una reducción promedio de frecuencia de CE de 70% y 89% versus basal, en t1 y t2 respectivamente. Devinsky y colaboradores (2018) estudiaron el efecto de CBD durante 14 semanas en 225 sujetos, de edades comprendidas entre 2 - 55 años, con diagnóstico de SLG, observando una reducción de frecuencia de CE de 41,9% y 37,2% (20 y 10 mg/kg/día CBD, respectivamente) versus 17,2% en rama placebo5. Thiele y colaboradores (2018) estudiaron el efecto de CBD durante 14 semanas sobre 171 pacientes con SLG, de entre 2- 55 años, obteniendo reducción de CE de 43,9% y 44,4% (10 y 20 mg/kg/día, respectivamente) versus 21,8% con placebo6. Devinsky y colaboradores (2017) compararon el efecto de CBD (20 mg/kg/día) durante 14 semanas en 120 pacientes, de entre 2 -18 años con SD, identificando reducción de CE de 38,9% versus 13,3% con placebo4. Miller y colaboradores (2020) incluyeron 190 sujetos con SD, con edades comprendidas entre 2 - 18 años, reportando una reducción de CE de 48,7% y 45,7% (CBD 10 y 20 mg/kg/día, respectivamente) versus 26,9% con placebo7. Thiele y colaboradores (2021) realizaron un ECA, siguiendo durante 16 semanas a 224 sujetos con ER asociada al CET, de 1 - 57 años, tratados con CBD, observando una reducción de CE de 48,6% y 47,5% con CBD a 25 y 50 mg/kg/día versus 26,5% con placebo (ECA)8. Es importante mencionar que una amplia cantidad de variables podría limitar la comparabilidad de los resultados obtenidos con dichos trabajos. En primer lugar, los tipos de estudios desde el punto de vista metodológico difieren en el diseño experimental, el cegamiento, la aleatorización de participantes, el uso de comparadores y los tiempos de seguimiento con este trabajo. Las poblaciones de dichas investigaciones son más numerosas, más homogéneas en cuanto a las características de la ER y síndromes epilépticos, aunque más diversas en rango etario. Los productos evaluados y sobre todo la cantidad y variedad de dosis utilizadas también difieren con la variedad de productos estudiados aquí.
Por otro lado, si bien en la literatura se describe el efecto sinérgico entre CBD y clobazam y la mayoría de los NNA de este estudio utilizaban este AE, no se encontró correlación entre la intensidad de efecto en reducción de frecuencia de CE por DCM y el uso concomitante de clobazam4.
Es importante destacar que en aquellas situaciones que los NNA dejaron de utilizar DCM por algún motivo (problemas de disponibilidad, de adherencia, de tolerancia o falta de beneficio clínico) sus cuidadores manifestaron un aumento en la cantidad de CE. La accesibilidad determina la adherencia y es una limitante para poder evaluar la efectividad34,35.
Considerando que los distintos tipos de epilepsia, y particularmente la ER, constituyen síndromes complejos que afectan la salud psicológica y emocional, la independencia, la interacción social y la calidad de vida de los pacientes, otras variables pueden ser usadas para medir estos efectos36. En este caso, la mayoría de los cuidadores de NNA reportaron mejoría en la conexión con el entorno y la reactividad, y en menor proporción mejor calidad del sueño y reducción de la irritabilidad asociados al uso de DCM.
En cuanto a los posibles riesgos del tratamiento con DCM, se observó variabilidad en el porcentaje de EA reportados en los estudios internacionales con rangos que van de 5% a 92% de los sujetos incluidos que recibieron CBD, siendo en su mayoría catalogados como EA leves a moderados4-8,22-34. Entre 4%-17% de los sujetos incluidos abandonaron los estudios por EA4-8,34. Este hallazgo podría estar vinculado a la variabilidad en la dosis de inicio y mantenimiento alcanzada en dichos estudios. En esta serie se identificaron EA similares a los reportados en otros trabajos, siendo los más referidos la somnolencia, disminución del apetito, diarrea, vómitos y pirexia4-8,22,23,34. La somnolencia fue el EA más frecuente y podría estar asociado no solo con el uso de DCM, sino con la administración concomitante de clobazam y otras benzodiacepinas, ampliamente utilizadas en esta población. Sin embargo, esta correlación no fue identificada en la muestra de este estudio. Se destaca además que si bien hubo baja incidencia de EA graves y estos fueron notificados a la autoridad sanitaria, no se realizó un análisis de imputabilidad que atribuya a DCM la aparición de los mismos. Sin embargo, los EA desaparecieron al discontinuar el medicamento. En este sentido, es importante destacar que los diferentes DCM disponibles, al igual que otros AE, no son equivalentes farmacéuticos ni terapéuticos, por lo tanto, no son intercambiables entre sí. Más allá de la notificación espontánea de eventos adversos, en Uruguay los DCM están sujetos a farmacovigilancia adicional13.
El acceso a DCM en esta población estuvo concentrado en dos vías: a través de la farmacia hospitalaria cuando se trataba de productos industrializados, y por medios propios si eran productos artesanales. Es probable que por cuestiones económicas para esta población el acceso a través de su prestador de salud sea efectivamente la principal vía. A pesar de que los DCM no son medicamentos incluidos en el Formulario Terapéutico de Medicamentos (FTM), se logra que se dispense como medicamentos fuera de los listados mínimos nacionales a los NNA usuarios del subsector público de salud, e incluso la dispensación se mantiene siguiendo las vías de acceso de otros medicamentos crónicos.
A pesar de que el acceso a los productos industrializados fue mediante la farmacia hospitalaria, un alto porcentaje refirió que en algún momento presentó dificultad para acceder a éstos. Esto interpela desde el punto de vista administrativo burocrático la calidad de la atención, que además tuvo repercusión en la evolución clínica, pues el control de la enfermedad fue afectado. Esta falta de control de los síntomas es otra forma de medir efectividad (o falta de ella) no por el producto en sí, sino por este aspecto vinculado a la adherencia al tratamiento por falta de acceso.
Limitaciones
La comparación de los resultados clínicos obtenidos es una limitante que transversaliza a los trabajos realizados con DCM, dado que en su mayoría se evalúan extractos vegetales con diferente composición cuali-cuantitativa de fitocannabinoides y compuestos como terpenos y flavonoides, que pueden afectar el efecto terapéutico. A nivel mundial se encuentran registrados diferentes productos, que no son equivalentes farmacéuticos ni terapéuticos entre ellos. Por otro lado, la población incluida en los estudios tampoco suele ser comparable, dificultando la extrapolación de los resultados. El análisis y la comparación de los resultados con productos artesanales es otra limitación, dado que al no estar homogeneizada su composición dificulta su estudio e interpretación de su beneficio.
En cuanto a los sujetos estudiados, se trata de una población reducida proveniente de un único prestador de salud, que no representa a la totalidad de NNA uruguayos con ER, existiendo un sesgo en la selección de los participantes al no incluir a usuarios del subsector privado de salud y aquellos que habían abandonado el uso de CBD previo al inicio del estudio. Por otro lado, la metodología de investigación puede estar sujeta a otros tipos de sesgo, relacionados principalmente con el recuerdo y la subjetividad de los cuidadores, asociada a la percepción de mejoría. Otra limitante detectada, propia de los trabajos de tipo retrospectivo, fue la calidad de los registros médicos respecto a la evolución cronológica del fenotipo de las CE síndromes epilépticos y la gran diversidad de nomenclatura clínica utilizada, dificultando el análisis de los datos. El escaso número de NNA incluidos no permitió comparar los beneficios y riesgos observados según el tipo de CE, síndrome epiléptico y etiología.
Conclusiones
La mayoría de cuidadores reportaron que los NNA incluidos en este estudio presentaron buena respuesta al tratamiento con DCM, con reducción de más de 50% de la frecuencia de las crisis y en la mitad de los casos reducción en la duración. Este efecto se mantuvo a lo largo del período de seguimiento.
El perfil de seguridad en esta muestra de NNA fue adecuado, identificándose efectos adversos en su mayoría leves.
En la mayoría se detectaron problemas de acceso a DCM, generando en algunos casos aumento en frecuencia de crisis al tener que suspender el tratamiento.
Se requiere de estudios prospectivos que incluyan un mayor número de pacientes para evaluar la efectividad y seguridad a largo plazo e incluir aspectos vinculados a la adherencia, fundamental en este tipo de usos sostenidos. Es necesario indagar sobre posibles cambios en la efectividad con la administración de estos medicamentos por vía oral versus la sublingual. Se requiere también profundizar en las formas de acceso y el tipo de preparados industriales y sus concentraciones de CBD para facilitar la conveniencia para los pacientes.















