Introducción
En los últimos años, el uso de cannabis medicinal ha sido propuesto como una opción terapéutica para algunos problemas refractarios a los tratamientos farmacológicos habituales1-4.
En el año 2013, en Uruguay se promulga la Ley 19.172 que regula y controla la importación, producción, adquisición, almacenamiento, comercialización y distribución del cannabis y sus derivados. El artículo quinto autoriza la industrialización y uso farmacéutico, regulado por decreto del Poder Ejecutivo desde el año 2015. La normativa vigente establece que la dispensación de las distintas especialidades para uso medicinal (vegetales o farmacéuticas) podrá ser realizada únicamente por farmacias de primera y segunda categoría habilitadas por el Ministerio de Salud (MS) y contra presentación exclusiva de receta oficial realizada por un médico5,6.
En esta ley se define cannabis psicoactivo y no psicoactivo. “Se entiende por cannabis psicoactivo: las sumidades floridas, con o sin fruto, de la planta hembra del cannabis, exceptuando las semillas y las hojas separadas del tallo, cuyo contenido de tetrahidrocannabinol (THC) natural, sea igual o superior al 1% (uno por ciento) en su peso”. Por cannabis no psicoactivo, “a las plantas o piezas de la planta de los géneros cannabis, las hojas y las puntas floridas, que no contengan más de 1% de THC en su peso, incluyendo los derivados de tales plantas y piezas de las plantas”. Se entiende por especialidad farmacéutica “a todo medicamento simple o compuesto a base de cannabis (psicoactivo y no psicoactivo) con nombre registrado en el MSP, de fórmula cuali-cuantitativa declarada, fabricada industrialmente y con propiedades terapéuticas comprobables, que se comercializa en determinadas unidades de venta”. Por especialidad vegetal: “a la hierba de cannabis o mezcla de hierbas cannabis (psicoactivo y no psicoactivo) utilizado con fines medicinales”5,6.
En diciembre de 2017 el Instituto de Regulación y Control del Cannabis (IRCCA) y el MSP otorgaron los permisos necesarios para fraccionar y comercializar una primera presentación de cannabis medicinal, efectivizando su disponibilidad en farmacias habilitadas.
Cannabinoides: tipos y relación estructura-actividad
Existen tres subespecies principales de esta planta, conocidas como cannabis sativa, indica y ruderalis, las cuales difieren en la concentración de sustancias psicoactivas. En el año 1964 se descubrió el 9- tetrahidrocannabinol (9-THC) y luego se identificaron otras moléculas a las cuales se les denominó cannabinoides. Hasta la fecha se han descrito más de 60 cannabinoides, de un total de 400 compuestos químicos presentes en las plantas de cannabis. Además de 9-THC los principales cannabinoides son: 8 - tetrahidrocannabinol (8-THC), cannabidiol (CBD) y cannabinol (CBN). El 9-THC tiene diez veces mayor potencia psicoactiva que CBN1-3,7,8.
Luego del descubrimiento de los receptores donde actúan estas sustancias (CB1 y CB2) se identificaron tres familias de endocannabinoides o cannabinoides endógenos que actúan en los mismos receptores que los exógenos (sistema endocannabinoide). Estos son anandamida, 2-araquinodil glicerol y el éter 2 araquinodil-gliceril1-4,9.
La acción de los cannabinoides es mediada a través de receptores CB1 presentes principalmente en el sistema nervioso central y de receptores CB2 en tracto gastrointestinal, sistema nervioso periférico, bazo y células del sistema inmune.
THC actúa principalmente como agonista parcial de los receptores CB1 y CB2 y se le describen efectos antiinflamatorios, antieméticos, relajante muscular, analgésico y psicogénico1-3,9.
CBD puede actuar a través de una variedad de mecanismos, incluyendo agonismo parcial y antagonismo de los receptores cannabinoides, lo que probablemente explica su acción ansiolítica. Se le atribuyen efectos antiinflamatorios, neuromoduladores, antipsicóticos y antiepilépticos1,8,9.
Propiedades farmacocinéticas
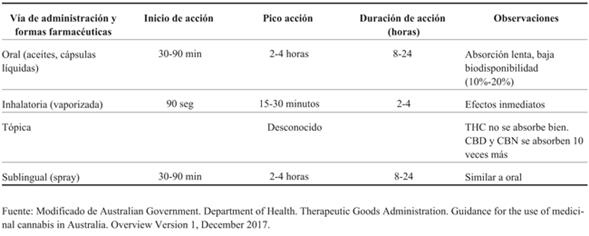
Los derivados cannábicos medicinales se pueden administrar por varias vías y en diferentes formas farmacéuticas, con variable biodisponibilidad.
Los que se administran por vía oral presentan elevada liposolubilidad y absorción lenta y errática. Las máximas concentraciones en plasma se alcanzan a los 60-120 minutos luego de la ingestión. La biodisponibilidad es baja (6%) debido a que sufren metabolismo hepático a través del sistema citocromo P450 (CYP), predominantemente CYP3A y CYP2C. Entre las formas farmacéuticas para uso por vía oral la de mejor biodisponibilidad es el aceite10,11.
La elevada liposolubilidad favorece la rápida distribución hacia el cerebro y tejido graso. En este último se acumula y libera lentamente. No está claro si sucede lo mismo en el cerebro. Como consecuencia, presentan considerable volumen de distribución.
El metabolismo de los cannabinoides se lleva a cabo por vía hepática, mediante citocromos P-450 (CYP), y se eliminan principalmente por las heces y por la orina en usuarios crónicos. THC se puede detectar en la orina varios días después de suspendida su administración. La vida media de eliminación de una dosis única en usuarios crónicos es 18-96 horas1,10-13.
En la (Tabla 1) se describen las propiedades farmacocinéticas de los derivados cannábicos de uso medicinal según las vías de administración y formas farmacéuticas.
Uso medicinal de derivados cannábicos en pediatría
La evidencia para el uso de derivados de cannabis medicinal en pediatría es escasa y de calidad variable.
La más reciente revisión sistemática, publicada en agosto de 2017, analiza 22 ensayos clínicos que en totalidad incluyen 795 niños. Solo cinco son ensayos clínicos controlados9. La mayor evidencia es para su uso como antiemético, analgésico y antiepiléptico. Faltan estudios a largo plazo, prospectivos, controlados, con mayor número de niños para establecer el rol potencial de estos productos en los diferentes tratamientos.
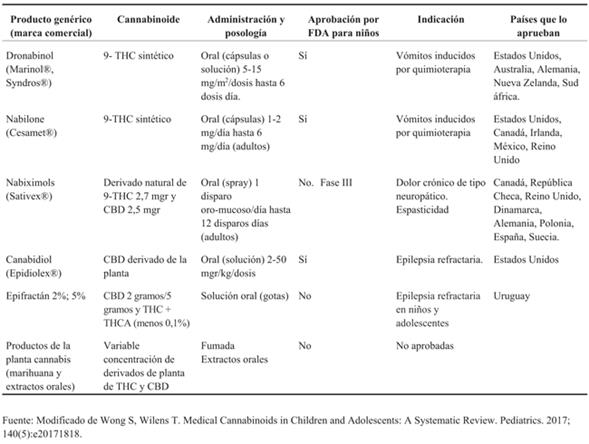
Actualmente solo dos productos sintéticos derivados del cannabis (dronabinol y nabilona) cuentan con la aprobación de la Food Drug Administration (FDA) de Estados Unidos para el tratamiento de náuseas y vómitos en pacientes oncológicos y anorexia asociada a pacientes con síndrome de inmuno deficiencia adquirida (SIDA), ambos contienen como principal cannabinoide 9-THC14,15.
Existen otras especialidades aún no aprobadas por la FDA que están en fases clínicas avanzadas de investigación (nabiximols, CBD) para el tratamiento del dolor neuropático, esclerosis múltiple, espasticidad y epilepsia9.
Hasta la fecha, en Uruguay la única especialidad farmacéutica aprobada y registrada por el MS es Epifractán® en dos presentaciones 2% y 5%, en solución oral (gotas), que contienen 2 gramos o 5 gramos de CBD respectivamente y menos de 0,1% de THC y ácido tetra hidrocanbinólico (THCA) cada 100 mL. Se encuentra registrado únicamente para el tratamiento de la epilepsia refractaria en niños y adolescentes.
Es importante señalar que existen especialidades vegetales y productos naturales derivados del cannabis. Estos productos naturales presentan diferentes y desconocidas concentraciones de cannabinoides (CBD y THC), variables según la planta y formulación9. Por lo tanto, el uso de productos sintéticos y naturales no es intercambiable. No es aconsejable el uso de productos naturales con fines medicinales en niños.
En la (Tabla 2) se muestran los productos derivados de cannabis naturales y sintéticos y sus usos aprobados por diferentes entes reguladores.
Tratamiento de la epilepsia refractaria
Este es el uso con mayor evidencia científica disponible. En las últimas décadas se han realizado diversas investigaciones sobre el uso de cannabis en el tratamiento de la epilepsia refractaria en niños, en especial en síndromes epilépticos como síndrome de Dravet (SD), Doose y Lennoux Gastaut (LGS)16. La epilepsia refractaria representa 20%-30% de las epilepsias, ocurre cuando las crisis no se controlan tras el tratamiento con dos o más fármacos antiepilépticos, adecuadamente seleccionados según el tipo de crisis y síndrome epiléptico, a dosis máxima17.
Las investigaciones clínicas presentan limitaciones metodológicas relacionadas con el escaso número de niños incluidos, el corto período de seguimiento y el diseño metodológico (series de casos, encuestas a padres). Los padres o cuidadores han reportado una reducción entre 57% a 84% en la frecuencia de crisis epilépticas, con mayor impacto en SD y LGS.
En el año 2017, Devinsky y colaboradores realizan el primer ensayo clínico controlado (ECC) en el que incluyen a 120 niños y adultos jóvenes con SD. Se comparó la eficacia de administración de CBD oral a 20 mg/kg versus placebo, sin suspender los fármacos antiepilépticos clásicos que venía recibiendo el paciente. Se observó una reducción estadísticamente significativa en el porcentaje de crisis mensuales en el grupo tratado con CBD18.
En dos ECC que incluyeron 291 pacientes con epilepsia refractaria (edad media 25,9 años, rango 10-45 años), CDB mostró reducción de convulsiones superior a 50% en comparación con placebo (riesgo relativo RR 1,74, IC95%: 1,24-2,43). El número necesario a tratar (NNT) para que un individuo logre una reducción de 50% de la epilepsia fue 7 en niños y 8 en adultos jóvenes (IC95%: 6-17). Las estimaciones no difieren según el tipo de epilepsia o edad18-21.
Tratamiento de los vómitos inducidos por quimioterapia (VIQ)
Algunos estudios han demostrado que nabilona y dronabinol disminuyen la gravedad de las náuseas y la frecuencia de vómitos en comparación con domperidona, proclorperazina o metoclopramida. La limitante continúa siendo el bajo número de niños incluidos y el breve período de seguimiento9,22-24.
Ondansetrón es uno de los fármacos más frecuentemente incluidos y utilizados en los protocolos para la prevención y el tratamiento de las náuseas y VIQ. A la fecha, no existen estudios que comparen la eficacia de CBD con ondansetrón.
De acuerdo a la evidencia científica, en niños con náuseas o vómitos inducidos por quimioterapia el uso de cannabinoides solo debería considerarse una vez que todas las estrategias farmacológicas y no farmacológicas sugeridas por los protocolos internacionales han sido utilizadas sin resultado.
Ananth y colaboradores refieren que “el paradigma cambia cuando se está frente a pacientes gravemente enfermos”. En una encuesta a profesionales que asisten niños con cáncer, se observó que los profesionales son más permisivos para indicar cannabis medicinal en niños con cáncer avanzado o en el final de sus vidas que en etapas tempranas, lo cual había sido previamente también admitido por la Academia Americana de Pediatría25.
Tratamiento del dolor crónico neuropático
Hasta el momento hay escasa evidencia que avale el uso de cannabinoides para el tratamiento del dolor crónico neuropático en niños. Se han comunicado dos casos de adolescentes con dolor neuropático refractario en el que el tratamiento con dronabinol mostró mejoría sintomática leve-moderada9,26,27.
Su uso podría basarse en datos reportados de investigaciones realizadas en adultos, aunque estas presentan importantes limitaciones28. En su mayoría, incluyen escaso número de pacientes, el período de seguimiento es corto (un año o menos). Se reportan altas tasas de abandono por intolerancia (efectos gastrointestinales, somnolencia) en especial en pacientes no consumidores previos de marihuana. El efecto analgésico de los cannabinoides en el dolor crónico neuropático que se observa con todas las formas farmacéuticas utilizadas es leve a moderado y dependiente de la dosis28-33.
Por lo tanto, los cannabinoides constituyen una alternativa terapéutica a considerar junto a otros tratamientos cuando todas las estrategias farmacológicas y no farmacológicas propuestas en los protocolos internacionales no han dado resultado29,31.
Interacciones potenciales de los cannabinoides con medicamentos
Es importante recordar que debido a su metabolización en el sistema citocromo P450 hepático es posible que presenten interacciones con otros medicamentos y productos naturales que inhiben o inducen dicho complejo enzimático.
CBD puede ser un potente inhibidor de isoenzimas de CYP, pudiendo modificar los niveles plasmáticos de varios de los antiepilépticos como ácido valproico, clobazam, topiramato, carbamazepina y fenitoína. Se han registrado aumentos de los niveles plasmáticos de topiramato y disminución de clobazam durante el uso concomitante con CBD10.
Son también esperables interacciones con inductores potentes de las enzima CYP como carbamazepina, fenobarbital, difenilhidantoína, rifampicina y con inhibidores potentes como ácido valproico, oxcarbamazepina, claritromicina, sulfadiazina, sulfametoxazol, ketoconazol, fluconazol, voriconazol, metronidazol, lopinavir, ritonavir, efavirenz, verapamilo, fluoxetina, omeprazol y esomeprazol10.
Otras interacciones farmacológicas posibles son de tipo farmacodinámico: con fármacos depresores del sistema nervioso central (antiepilépticos, opioides, alcohol), anticolinérgicos y estimulantes del sistema nervioso central10.
Efectos adversos
Los efectos adversos a corto plazo derivan principalmente de estudios en población adulta, siendo frecuentes, dosis dependientes y posibles con todas las vías de administración30. Los más frecuentes son: sedación, somnolencia, mareo, debilidad, fatiga, síntomas gastrointestinales y ganancia o pérdida de peso. Generalmente son leves a moderados. Menos frecuentemente se describen: ideación suicida, alucinaciones, confusión, convulsiones, cambios de comportamiento1,2,10,18,30-33.
Si bien es conocido el impacto en la función cerebral y pulmonar con el uso no medicinal del cannabis, hasta la fecha no se conoce el impacto a largo plazo del uso medicinal25. Los efectos a largo plazo sobre la función pulmonar y neurocognitiva no se han determinado. Los estudios disponibles presentan períodos de seguimiento máximos de un año. Se requieren estudios de farmacovigilancia activa para caracterizar los problemas de seguridad entre los nuevos usuarios de derivados de cannabis medicinales incluyendo niños y adolescentes32,34.
Las precauciones para su uso son las enfermedades cardiovasculares severas (arritmias, hipertensión no controlada, falla cardíaca severa), esquizofrenia y otras enfermedades psicóticas, el embarazo y la lactancia (10,34).
Consideraciones sobre la posología
Un problema importante para el uso de derivados de cannabis medicinal en niños y adolescentes es la inexistencia de protocolos, internacionalmente probados, de dosis de administración según edad, peso e indicación específica. Las pautas posológicas no están completamente establecidas para todos los usos ni todos los grupos etarios. Es por ello que se debe tener especial precaución con posibles errores de medicación al momento de la administración y riesgo de sobredosis. Es importante seguir las pautas de dosificación establecidas por el médico. Se debe comenzar con dosis bajas e ir aumentando gradualmente según tolerancia, hasta lograr el efecto buscado con la menor cantidad de efectos adversos posible. En los pacientes que nunca han consumido cannabis, se debe comenzar con la mitad de la dosis inicial. En los pacientes que ya han consumido cannabis se debe considerar la tolerancia y acumulación de THC en las reservas de grasa10.
Recomendaciones para su uso responsable e informado
Antes de iniciar el uso de cannabis medicinal se debe identificar y reconocer el producto que se utilizará, elaborar y acordar un plan de tratamiento que incluya objetivos claros, pautas de dosificación y monitorización.
Se debe informar al niño o adolescente y su familia sobre los beneficios, efectos adversos potenciales a corto y largo plazo y las limitaciones de la evidencia disponible hasta el momento.
Los pacientes y sus familias deben conocer que muchas de las indicaciones se hacen “fuera de prospecto” (“off label”) y por lo tanto entender lo que ello implica para el tratamiento. En todos los casos se debe contar con el consentimiento informado del padre, madre o tutor y el asentimiento del niño cuando corresponda (según edad y competencia del paciente). Podría ser de utilidad contar con formularios de consentimiento informado con tal finalidad sin que esto sustituya la información imprescindible para que las personas puedan decidir.
El uso de cannabis medicinal requiere monitorización clínica estricta y por lo tanto supervisión del médico tratante. Es importante que los médicos notifiquen la aparición de efectos adversos o tóxicos por las vías correspondientes.
La notificación de la sospecha de efectos adversos se realiza a través del Sistema Nacional de Farmacovigilancia del MSP en: http://www.msp.gub.uy/noticia/notificaci%C3%B3n-de-sospecha-de-reacci%C3%B3n-adversa-de-medicamentos.
Para consultas por intoxicaciones dirigirse al Centro de Información y Asesoramiento Toxicológico (CIAT) del Departamento de Toxicología de la Facultad de Medicina de la Universidad de la República, teléfono: 1722.
Comentarios finales
Según la evidencia científica disponible, los Comités de Farmacología y Terapéutica y de Cuidados Paliativos de la Sociedad Uruguaya de Pediatría y la Cátedra de Neuropediatría de la Facultad de Medicina consideran que la principal indicación de cannabinoides medicinal en niños y adolescentes es el tratamiento de la epilepsia refractaria. Para otras indicaciones como dolor neuropático refractario o náuseas y vómitos inducidos por quimioterapia, la evidencia disponible sobre eficacia y seguridad es escasa, por lo que su indicación se debería reservar para situaciones en los que las estrategias farmacológicas y no farmacológicas debidamente aplicadas han sido inefectivas.
En caso de epilepsia refractaria es importante tener claro: el tipo/síndrome epiléptico en cuestión, la etiología del mismo, confirmar que realmente cumpla con los criterios diagnósticos para “epilepsia refractaria” y que se haya valorado la pertinencia o posibilidad de realizar dieta cetogénica o cirugía y se hayan descartado o hayan fracasado las mismas. En estos casos, la prescripción de cannabinoides en niños debería ser realizada en conjunto entre el neuropediatra y el pediatra tratante debido a que son los profesionales que cuentan con el conocimiento integral del niño y la experticia en el manejo del resto de los fármacos en esta población.
Para las otras indicaciones, antes de considerar el uso de derivados de cannabis, es necesario que el pediatra en conjunto con los otros subespecialidades tratantes (oncología, cuidados paliativos, etcétera) analicen si se indicaron todas las opciones farmacológicas y no farmacológicas posibles y disponibles en forma adecuada. En caso de decidir el uso de cannabinoides, la prescripción debería ser realizada por pediatras o subespecialistas pediátricos con experiencia y formación en la temática.
En todos los casos es importante que los médicos que prescriben derivados cannábicos, y los que realizan el seguimiento se encuentren informados, y realicen una farmacovigilancia activa mediante el registro responsable de los beneficios encontrados y los efectos adversos permitiendo conocer más el perfil de seguridad de estos productos.
Es necesario promover la investigación clínica básica sobre el uso de cannabinoides medicinal en niños y adolescentes con el objetivo de generar bases para una prescripción racional basada en evidencias.